Похожие презентации:
Углеводы. Моносахариды и их производные. (Лекция 5)
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТКАФЕДРА ХИМИИ
БИООРГАНИЧЕСКАЯ ХИМИЯ
Лекция 5
Углеводы. Моносахариды и их
производные
Лектор: Ирина Петровна Степанова, доктор биологических наук,
профессор, зав. кафедрой химии
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о строении,
номенклатуре и реакционной способности
моносахаридов.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний, развить
логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию
у обучающихся устойчивого интереса к изучению
дисциплины.
3.
ПЛАН ЛЕКЦИИ•Классификация
•Моносахариды, строение
•Химические свойства моносахаридов
•Производные моносахаридов, строение
4.
Медико-биологическоезначение темы
Зерна крахмала в
клетках картофеля:
амилопласты
Углеводы входят в
состав клеток и тканей
всех растительных и
животных организмов,
где соответственно
составляют 80% и 2% от
массы сухого остатка.
5. Биологические функции углеводов
1. Энергетическая. Углеводы –главный вид клеточного топлива.
При сгорании 1 моль глюкозы
выделяется 3060 Дж энергии,
которая расходуется в
эндотермических биологических
процессах и частично
аккумулируется в АТФ.
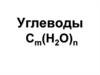
6. Биологические функции углеводов
2. Пластическая.Гепарансульфат
Хондроитинсульфат
Снаружи
Внутри
Углеводы являются обязательным компонентом
внутриклеточных структур и мембран
растительного и животного происхождения.
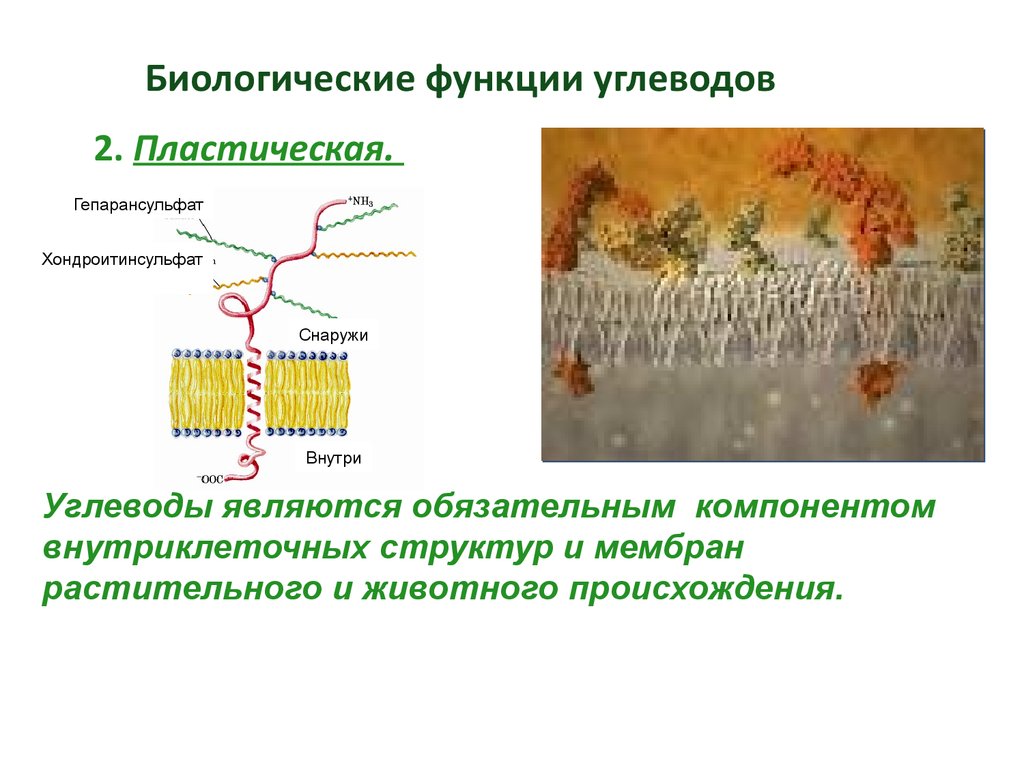
7.
Биологические функции углеводовГиалуроновая
кислота
Основную
субстанцию
межклеточного
матрикса
соединительной
ткани
составляют
протеогликаны –
углеводобелковые
компоненты.
Кератансульфат
Хондроитинсульфат
Связующие белки
Сердцевидный
белок
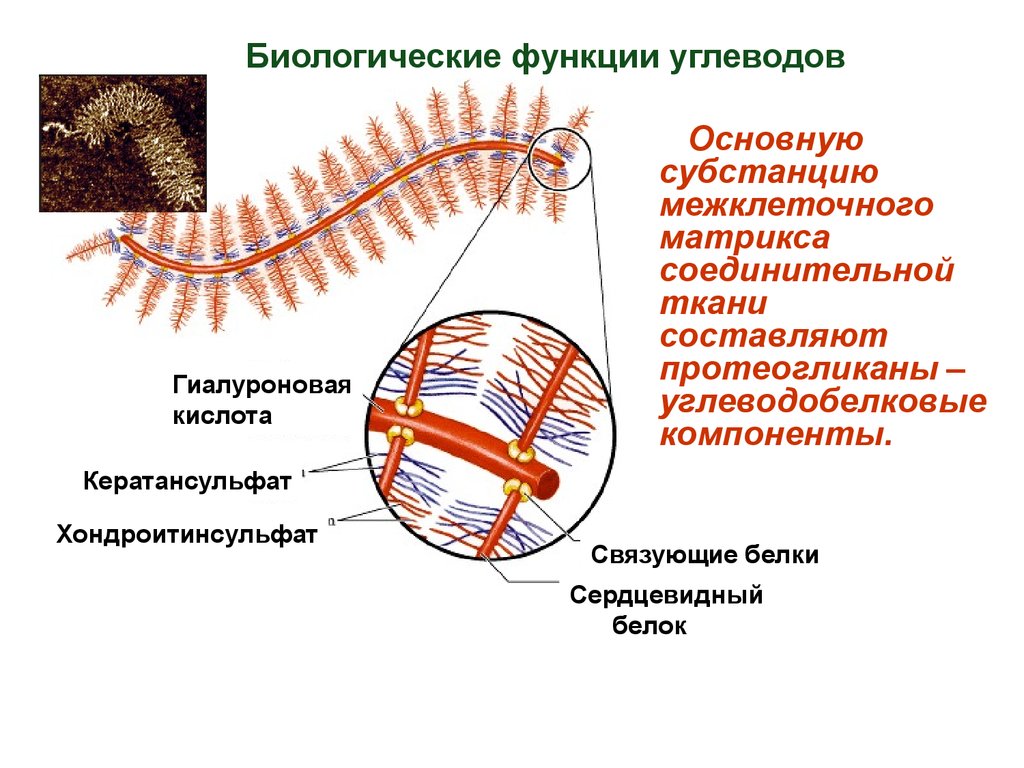
8.
Биологические функции углеводовАктиновые
филаменты
Интегрины
В состав внеклеточного
матрикса также входят
гликопротеины и
гиалуроновая кислота.
Протеогликаны
и гиалуроновая кислота
Фибронектин
Коллаген
Плазменная мембрана
9.
Биологические функции углеводовПолисахарид хитин (C8H13NO5)n
(от греч. χιτών: хитон —
одежда, кожа, оболочка) —
основной компонент кутикулы
членистоногих и ряда других
беспозвоночных, входит в
состав клеточной стенки
грибов и бактерий.
10. Биологические функции углеводов
3. Синтетическая.Углеводы участвуют в
синтезе нуклеиновых
кислот, входят в состав
коферментов,
гликолипидов,
гликопротеинов.
β2-Гликопротеин I
11. Биологические функции углеводов
4. Защитная. Углеводыучаствуют в поддержании
иммунитета организма.
Например, тиреотропный
гормон, контролирующий
функцию и развитие
щитовидной железы,
является гликопротеином.
Тиреотропный гормон
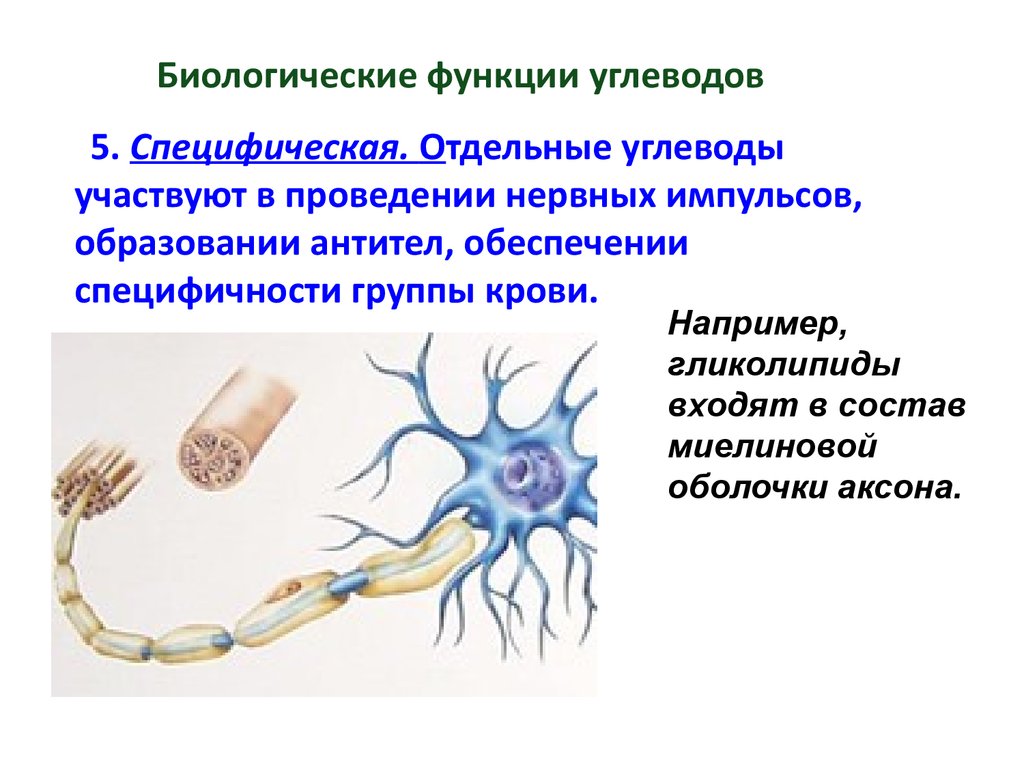
12. Биологические функции углеводов
5. Специфическая. Отдельные углеводыучаствуют в проведении нервных импульсов,
образовании антител, обеспечении
специфичности группы крови.
Например,
гликолипиды
входят в состав
миелиновой
оболочки аксона.
13. Биологические функции углеводов
6. Регуляторная. Растительная пища содержитполисахарид - целлюлозу, которая улучшает
работу кишечника и повышает секрецию в
желудке.
14. Биологические функции углеводов
Для оптимального обеспеченияорганизма человека углеводами в
среднем необходимо 450 г. в сутки.
Высокоуглеводный рацион
питания может привести к
ожирению.
15.
Биологические функции углеводовПрием легкоферментируемых углеводов
(кондитерские изделия, белый хлеб, картофель)
приводит к развитию кариеса и пародонтоза.
16. Биологические функции углеводов
Хорошо, что появиласьнизкоуглеводная диета.
Сейчас никто не хочет есть
меня, потому что думают,
что я сделаю их толстыми.
17.
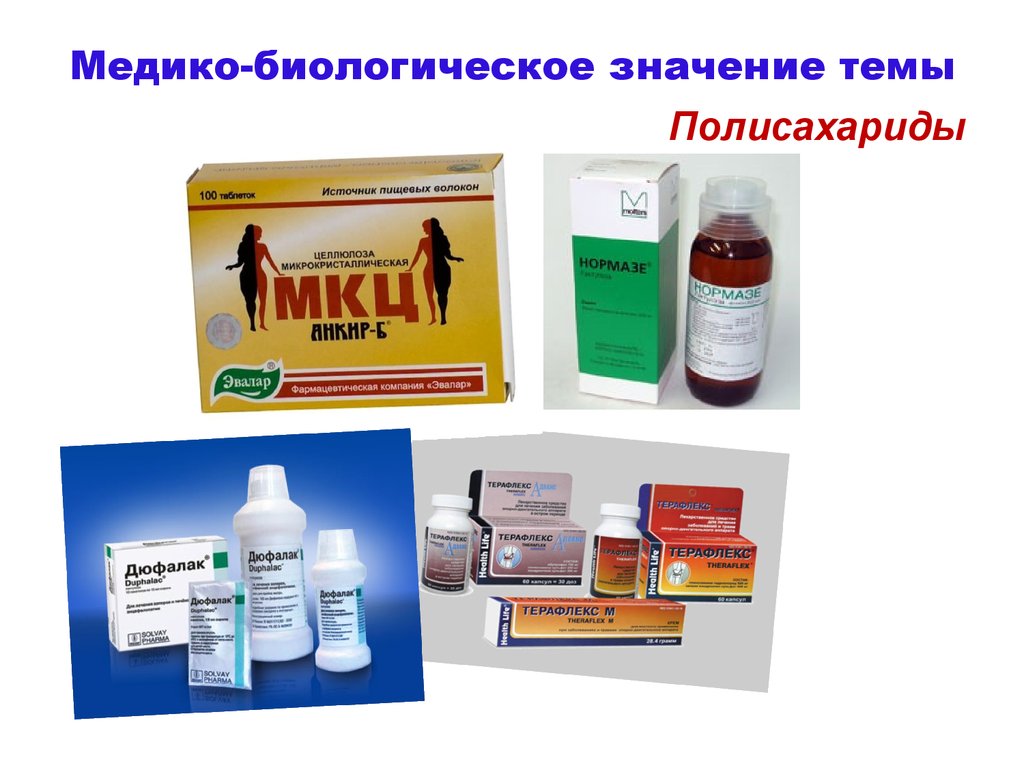
Медико-биологическое значение темыУглеводы входят
в состав фарм.
препаратов.
Моносахариды
18.
Медико-биологическое значение темыПолисахариды
19.
Медико-биологическое значение темыНаходит применение бактериальная
целлюлоза.
Чайный гриб – симбиоз
дрожжеподобного
гриба Saccharomycodes ludwigii
и бактерий Acetobacter xylinum
20. Образование углеводов
1. Углеводыобразуются в
процессе фотосинтеза в
хлоропластах клеток
растений (от греч. Φωτο свет и σύνθεσις - синтез,
совмещение, помещение
вместе) из углекислого газа и
воды на свету при участии
Хлоропласты в клетках листа фотосинтетических
пигментов.
6CO2 + 6H2O → C6H12O6 + 6O2
21.
Образование углеводовElysia chlorotica — вид морских
слизней, относящийся к морским
брюхоногим моллюскам, способным
к осуществлению фотосинтеза.
Elysia chlorotica
Моллюск использует
хлоропласты
морской водоросли
Vaucheria litorea,
которую
употребляет в пищу.
Геном молюска кодирует некоторые белки,
необходимые хлоропластам для
фотосинтеза.
22. 2. Углеводы образуются в результате гидролиза дисахаридов, олигосахаридов и полисахаридов в присутствии кислот или ферментов.
Получение углеводов2. Углеводы образуются в результате гидролиза
дисахаридов, олигосахаридов и полисахаридов в
CH2OH
CH2OH
CH2OH
присутствии
кислот
или ферментов.
H
HO
O
H
OH H
H
H
OH
H
O
O H
H
OH H
H
Мальтоза
H
+
OH
OH
H2O
2
HO
O H
H
OH H
H
OH
OH
D-глюкоза
23. Моносахариды
УглеводыМоносахариды
Углеводы - гетерофункциональные
соединения полигидроксикарбонильного
ряда и их производные.
Общая формула простых моносахаридов:
Cn(H2O)m
Ранее сахара считали гидратированными
формами углерода, что объясняет этимологию
слова “углевод”.
Англ. Carbohydrate происходит от carbon
(углерод) и гидрат (от греч. – вода).
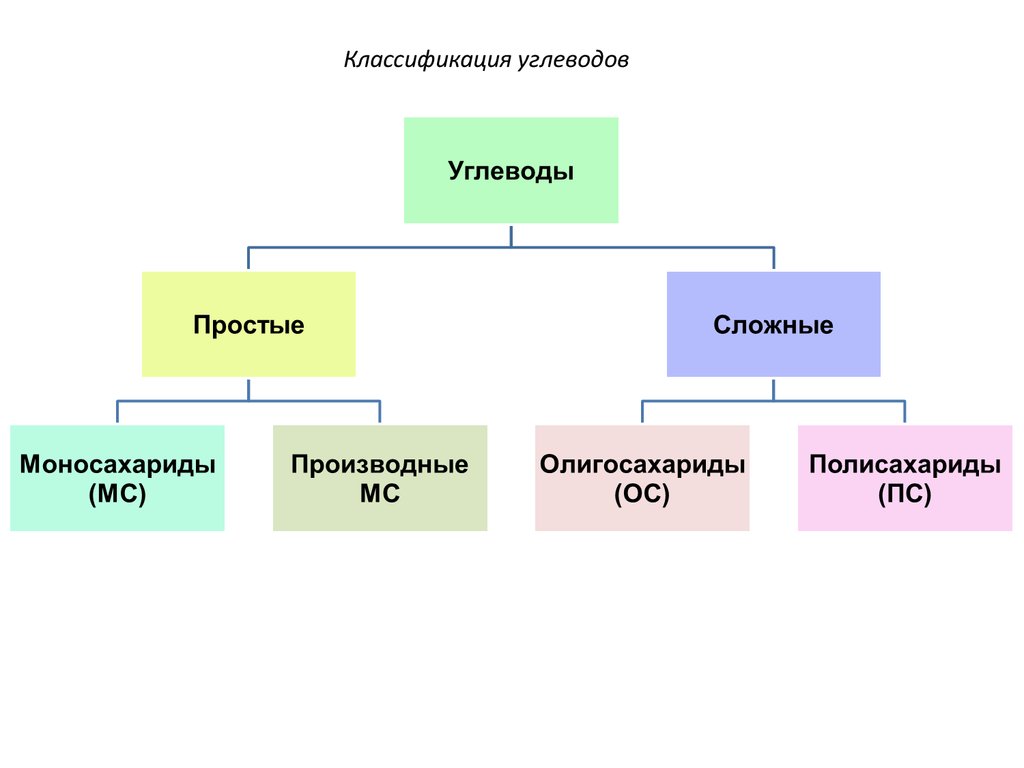
24. Классификация углеводов
По способности к гидролизу углеводыделятся на 2 класса:
1. Простые (греч. mono – один)
– не подвергаются гидролизу;
2. сложные - гидролизуются с образованием
простых углеводов.
25. Классификация углеводов
26. Классификация углеводов
Олигосахариды содержат от 2 до 10 остатковмоносахаридов, а полисахариды – несколько
десятков тысяч. И те, и другие являются продуктами
поликонденсации моносахаридов.
Полисахариды подразделяются на:
- гомополисахариды - однородные по составу
сложные углеводы;
- гетерополисахариды - сложные углеводы,
включающие остатки разных моносахаридов.
27. Моносахариды
Моносахариды относятся к полигидроксикарбонильнымсоединениям.
Классификация моносахаридов:
Моносахариды делят по функциональной
принадлежности на:
1. альдозы – полигидроксиальдегиды;
2. кетозы – полигидроксикетоны.
По числу атомов углерода в цепи различают:
1. триозы;
2. тетрозы;
3. пентозы;
4. гексозы;
5. высшие сахара.
28.
НоменклатураH
C O
H C OH
HO C H
H C OH
H C OH
CH2OH
D-глюкоза
D-Glucosa
В основном применяется
тривиальная номенклатура.
Название D-глюкозы по номенклатуре IUPAC:
(2R, 3S, 4R, 5R) – 2,3,4,5,6-пентагидроксигексаналь.
29.
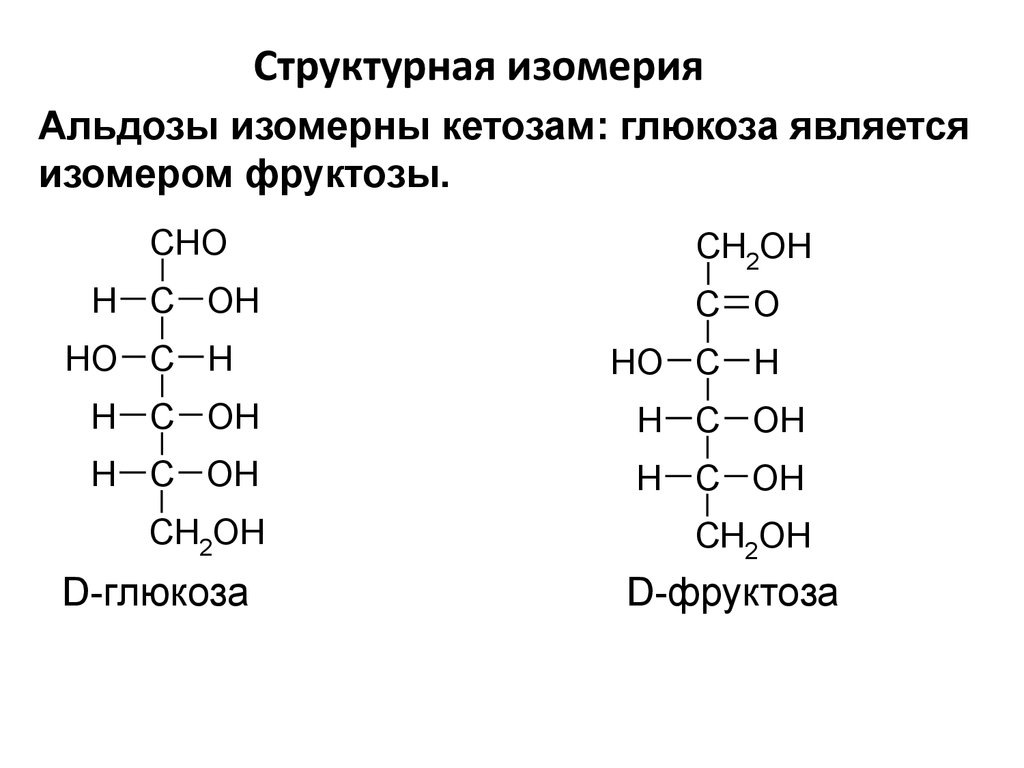
Структурная изомерияАльдозы изомерны кетозам: глюкоза является
изомером фруктозы.
CHO
H C OH
HO C H
CH2OH
C O
HO C H
H C OH
H C OH
H C OH
H C OH
CH2OH
CH2OH
D-глюкоза
D-фруктоза
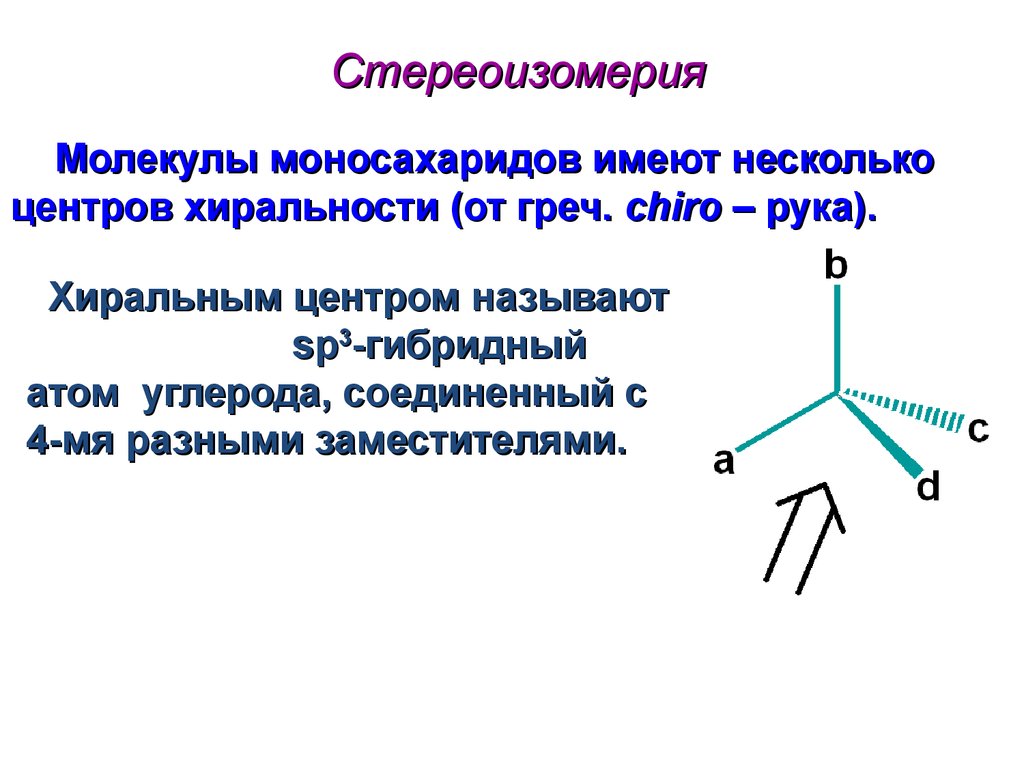
30. Стереоизомерия
Молекулы моносахаридов имеют несколькоцентров хиральности (от греч. сhiro – рука).
Хиральным центром называют
sp3-гибридный
атом углерода, соединенный с
4-мя разными заместителями.
31.
a4
2
Энантиомеры
1
1
3
3
Энантиомеры – это изомеры,
которые относятся друг к
1
другу как предмет и
несовместимое с ним в
пространстве зеркальное
отражение.
3
2
b
2
4
4
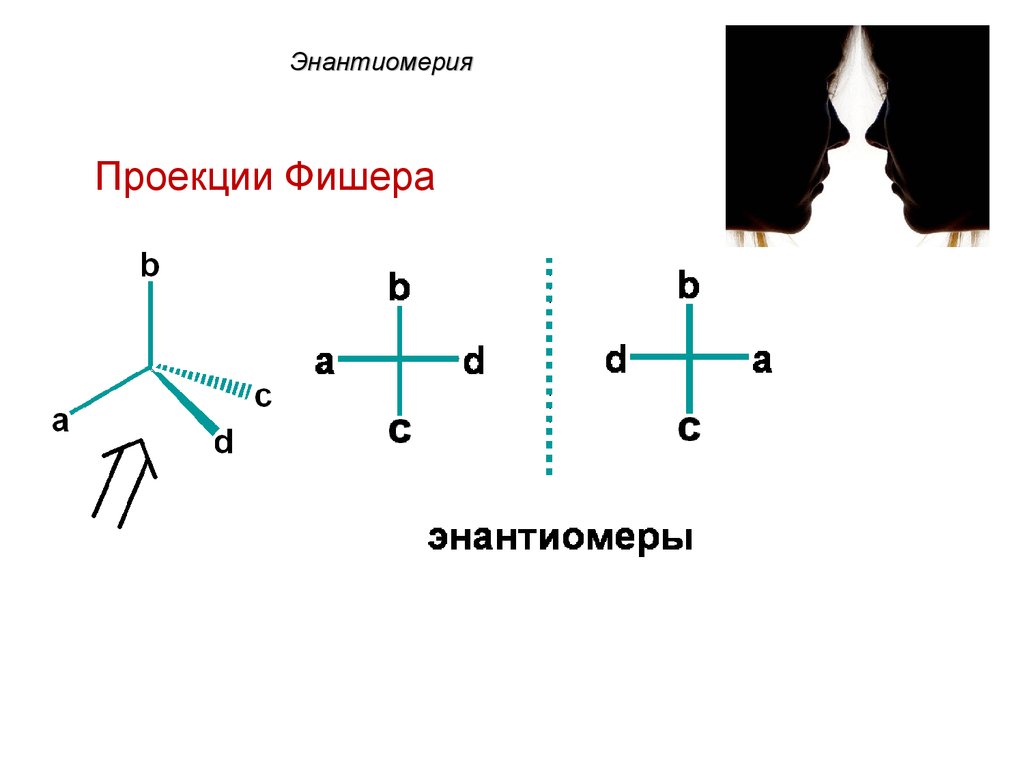
32. Энантиомерия
Проекции Фишера33. Энантиомерия
В зависимости от конфигурации хиральногоцентра различают D- и L- конфигурации
(формы).
В D-форме гидроксильная (-ОН)
функциональная группа хирального центра
располагается справа от углеродной цепи;
В L-форме – функциональная
гидроксильная (-ОН) группа хирального центра
располагается слева от углеродной цепи.
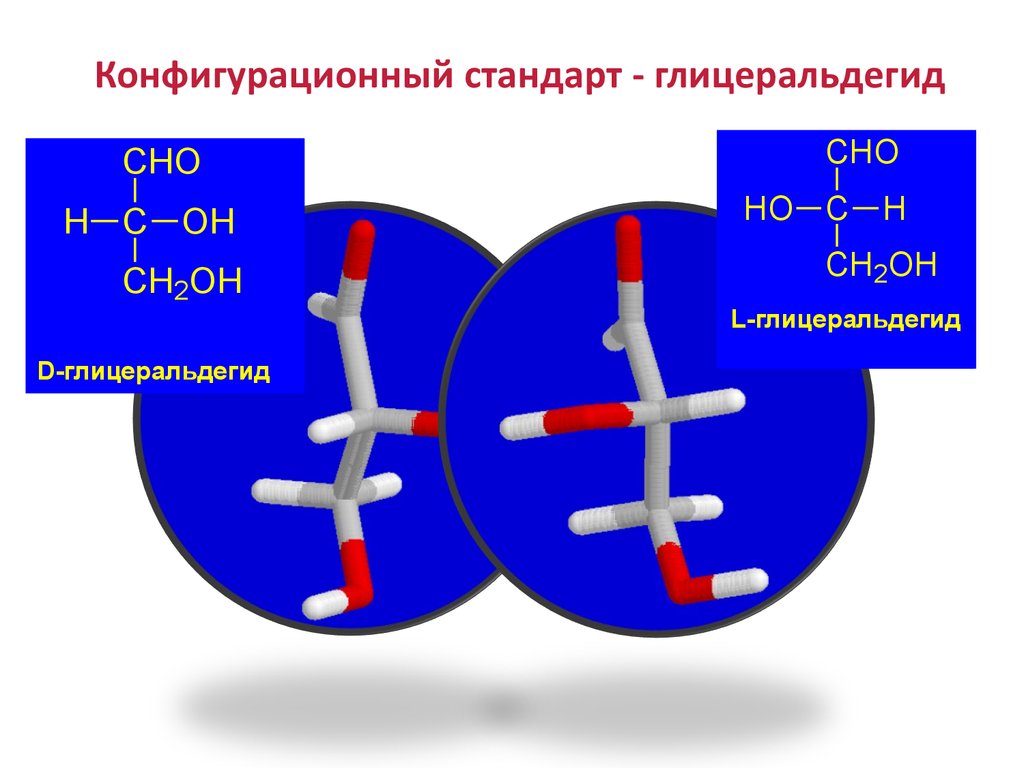
34. Конфигурационный стандарт - глицеральдегид
CHOH C OH
CH2OH
D-Gliceraldehido
D-глицеральдегид
CHO
HO C H
CH2OH
L-глицеральдегид
L-Gliceraldehido
35.
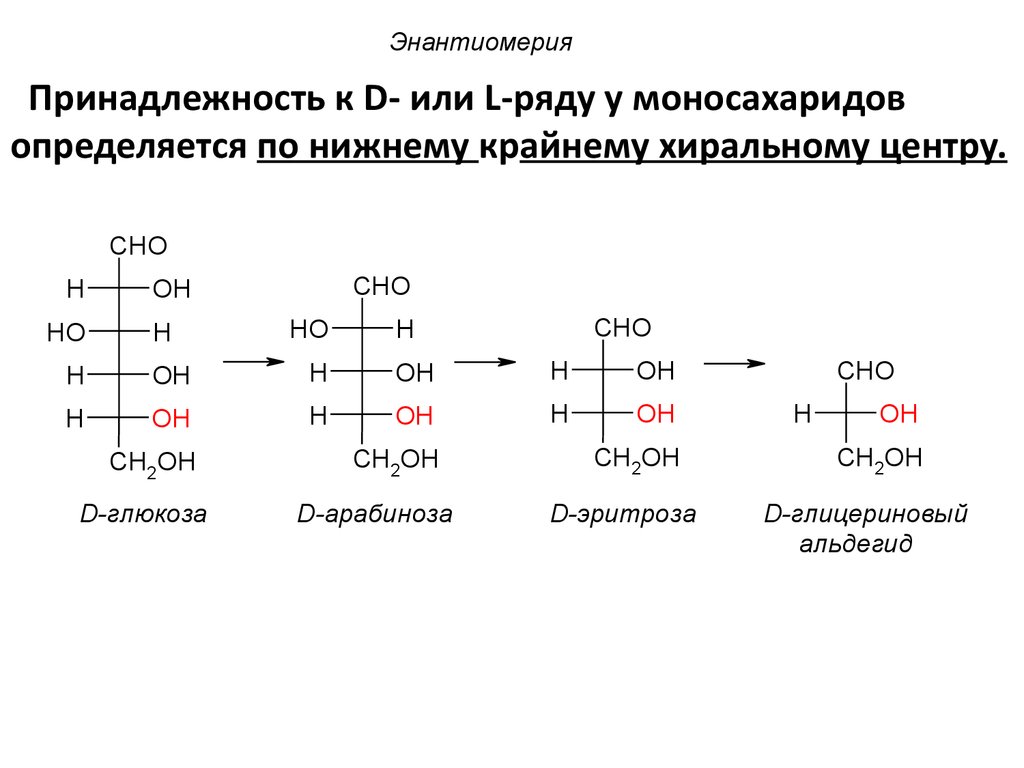
ЭнантиомерияПринадлежность к D- или L-ряду у моносахаридов
определяется по нижнему крайнему хиральному центру.
CHO
H
HO
CHO
OH
H
HO
CHO
H
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
CH2OH
D-глюкоза
CH2OH
D-арабиноза
CH2OH
D-эритроза
CHO
H
OH
CH2OH
D-глицериновый
альдегид
36. Энантиомерия
Энантиомерам D-ряда углеводовсоответствует энантиомер L-ряда с
противоположной конфигурацией всех
центров хиральности.
Большинство природных моносахаридов
принадлежат D-ряду.
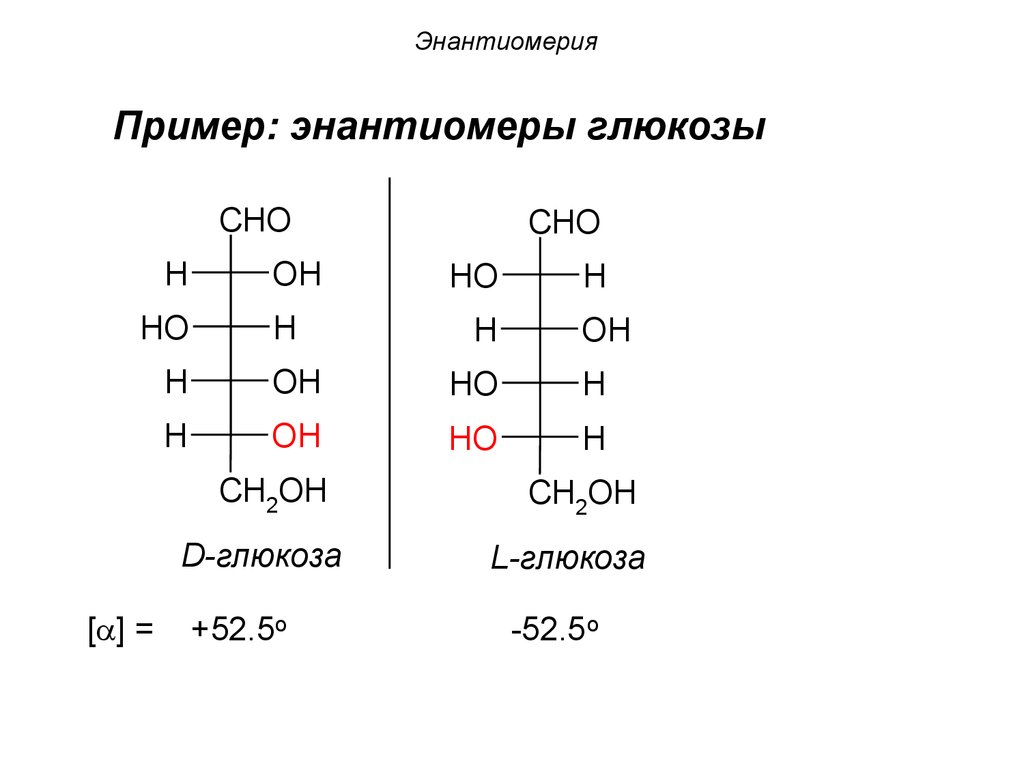
37. Энантиомерия
Пример: энантиомеры глюкозыCHO
H
HO
OH
H
HO
H
H
OH
H
OH
HO
H
H
OH
HO
H
CH2OH
D-глюкоза
[ ] =
CHO
+52.5o
CH2OH
L-глюкоза
-52.5 o
38. Энантиомерия
Энантиомеры обладают одинаковымифизическими и химическими свойствами,
но являются оптическими антиподами и
имеют различную физиологическую
активность.
39.
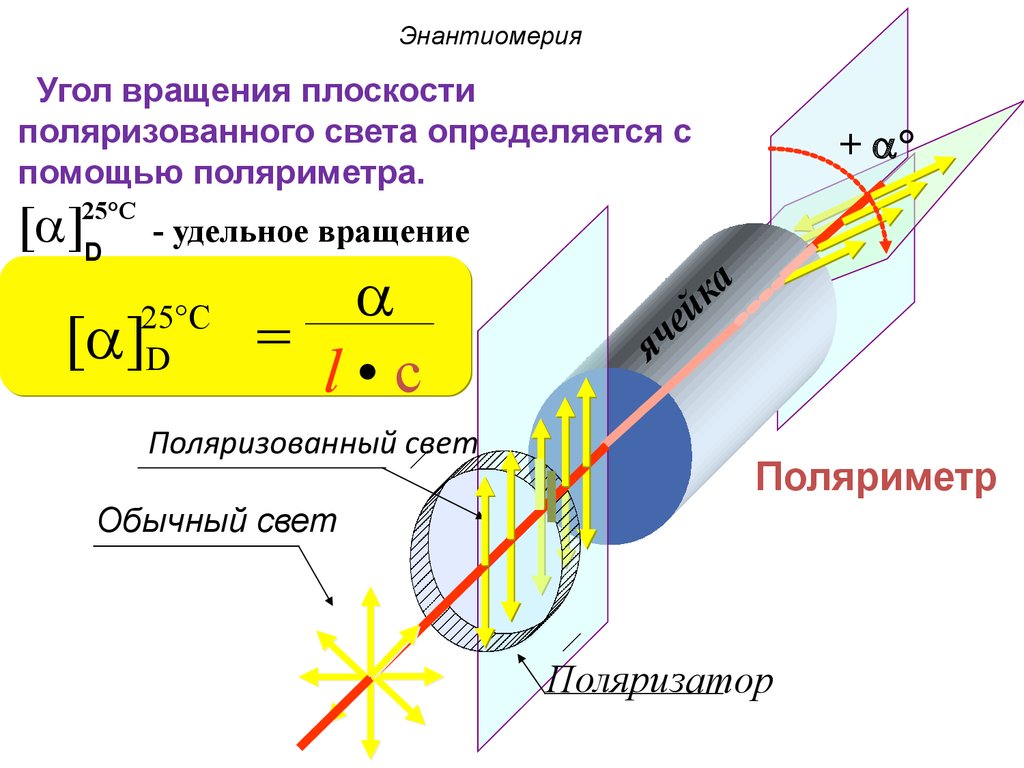
ЭнантиомерияУгол вращения плоскости
поляризованного света определяется с
помощью поляриметра.
[ ]D
25°C
+ °
- удельное вращение
25°C
D
[ ]
=
l•c
Поляризованный свет
а
к
й
е
яч
Поляриметр
Обычный свет
Поляризатор
40.
σ - Диастереомерияσ-Диастереомерия возникает в молекулах с 2 и более центрами
хиральности.
σ- Диастереомеры – оптические изомеры, не являющиеся зеркальным изображением
друг друга.
41.
σ - ДиастереомерияЧисло стереоизомеров рассчитывают
по формуле Фишера: Z =2n ,
где n-число центров хиральности.
σ– Диастереомеры имеют разные
физические и химические свойства и
физиологическое действие.
42.
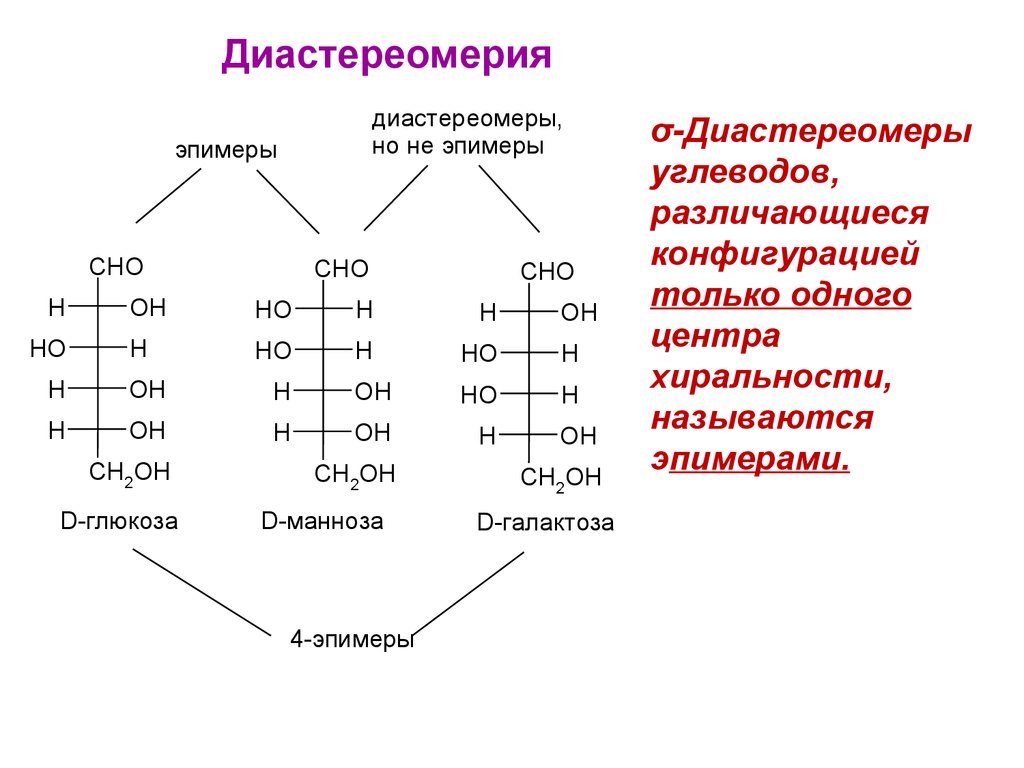
Диастереомериядиастереомеры,
но не эпимеры
эпимеры
CHO
H
HO
CHO
CHO
OH
HO
H
H
H
HO
H
HO
H
H
H
OH
H
OH
HO
H
OH
H
OH
H
CH2OH
D-глюкоза
CH2OH
D-манноза
4-эпимеры
OH
OH
CH2OH
D-галактоза
σ-Диастереомеры
углеводов,
различающиеся
конфигурацией
только одного
центра
хиральности,
называются
эпимерами.
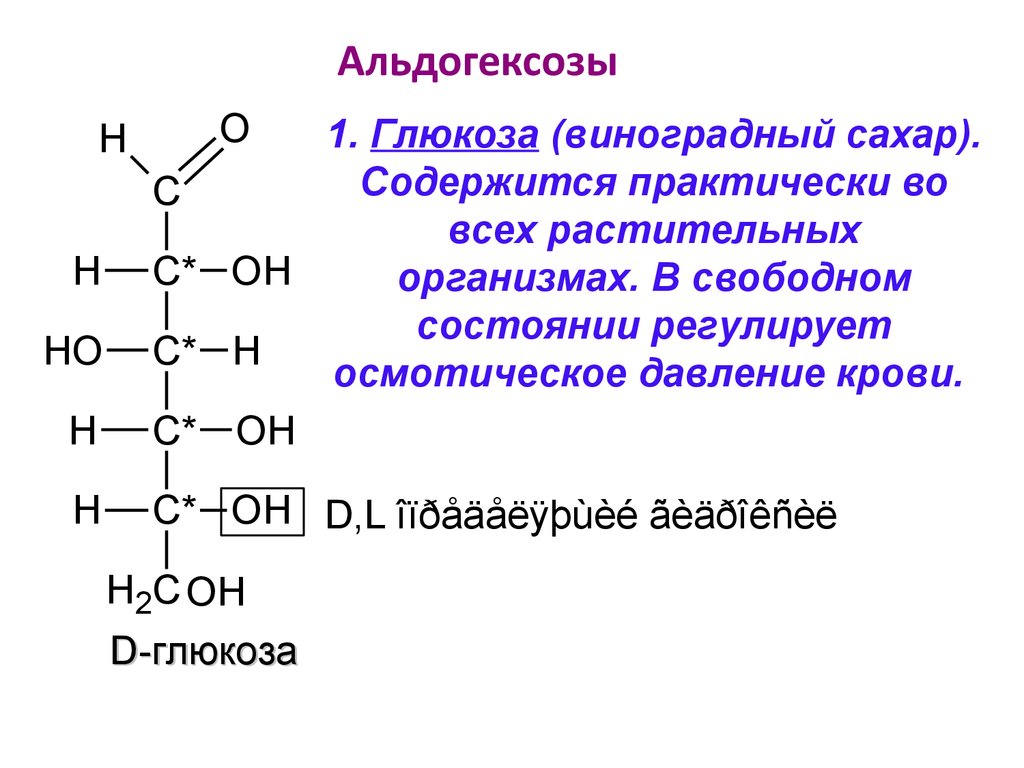
43. Альдогексозы
OH
1. Глюкоза (виноградный сахар).
Содержится практически во
C
всех растительных
C* OH
организмах. В свободном
состоянии регулирует
C* H
осмотическое давление крови.
C* OH
H
C* OH D,L îïðåäåëÿþùèé ãèäðîêñèë
H
H
HO
H2C OH
D-глюкоза
44. Альдогексозы
ГлюкозаМеждународное наименование:
Декстроза (Dextrose)
5% Раствор глюкозы оказывает
дезинтоксикационное,
метаболическое действие,
является источником энергии.
Гипертонические растворы (10%, 20%, 40%)
повышают осмотическое давление крови,
улучшают обмен веществ; повышают
сократимость миокарда; улучшают
антитоксическую функцию печени,
расширяют сосуды, увеличивают диурез.
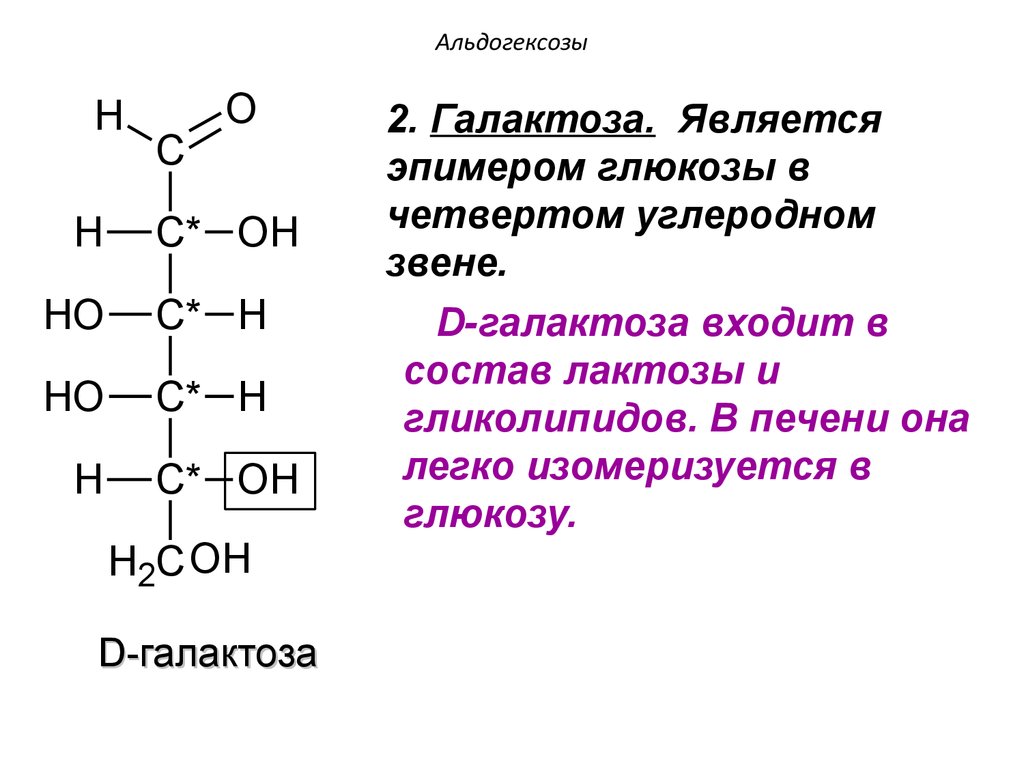
45. Альдогексозы
HH
C
O
C* OH
HO
C* H
HO
C* H
H
C* OH
H2C OH
D-галактоза
2. Галактоза. Является
эпимером глюкозы в
четвертом углеродном
звене.
D-галактоза входит в
состав лактозы и
гликолипидов. В печени она
легко изомеризуется в
глюкозу.
46. Альдогексозы
Галактоза(Galactose) –
ультразвуковое
контрастнодиагностическое
средство.
47. Альдогексозы
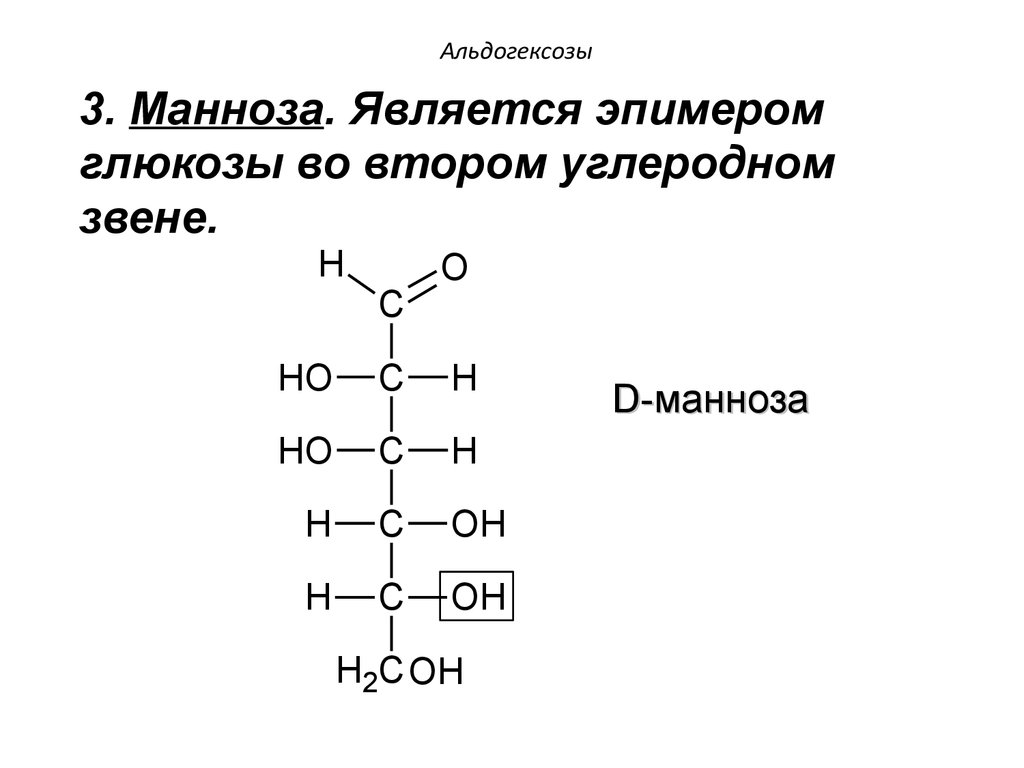
3. Манноза. Является эпимеромглюкозы во втором углеродном
звене.
H
C
O
HO
C
H
HO
C
H
H
C
OH
H
C
OH
H2C OH
D-манноза
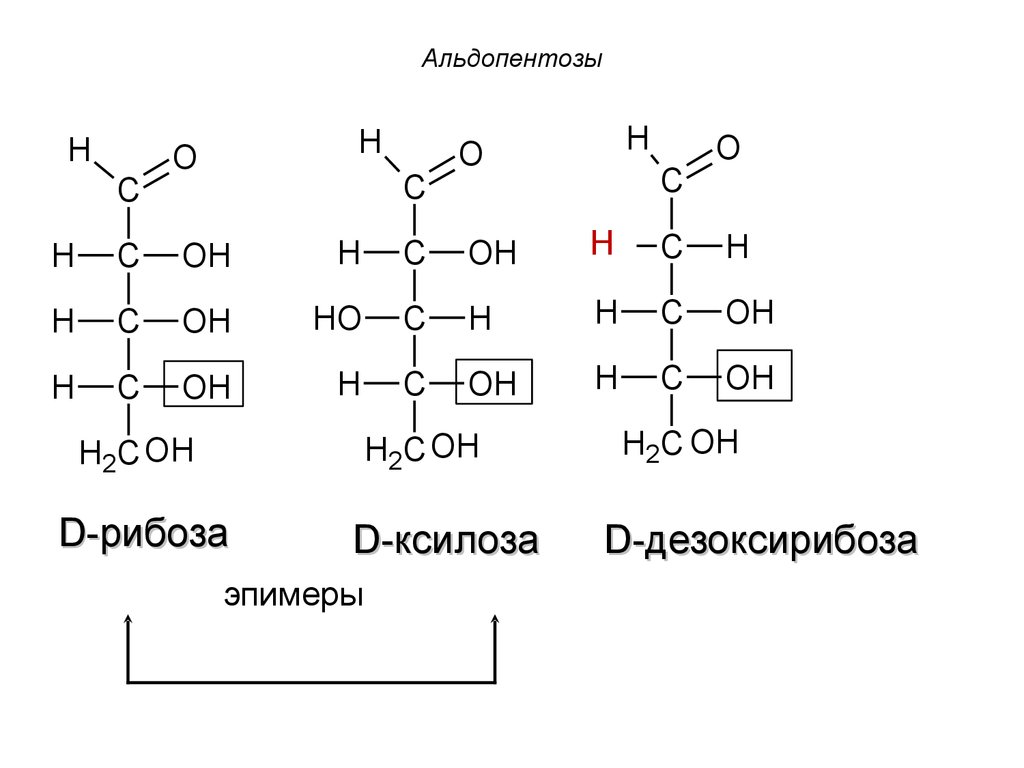
48. Альдопентозы
1. D-рибоза. Входит в состав нуклеотидовРНК.
2. D-ксилоза – эпимер рибозы в третьем
углеродном звене.
3. Производным рибозы является
дезоксисахар –2-дезокси-D-рибоза
(дезоксирибоза) - входит в состав ДНК.
49.
АльдопентозыH
C
H
O
C
C
H
H
H
C
OH
OH
H
C
OH
C
OH
H
C
OH
H
C
OH
HO
C
H
C
OH
H
C
H2C OH
D-рибоза
D-ксилоза
эпимеры
C
O
HH
O
H
H2C OH
H
O
H2C OH
D-дезоксирибоза
50. Кетогексозы
H2COHC
O
HO
C
H
H
C
OH
H
C
OH
H2C OH
D-фруктоза
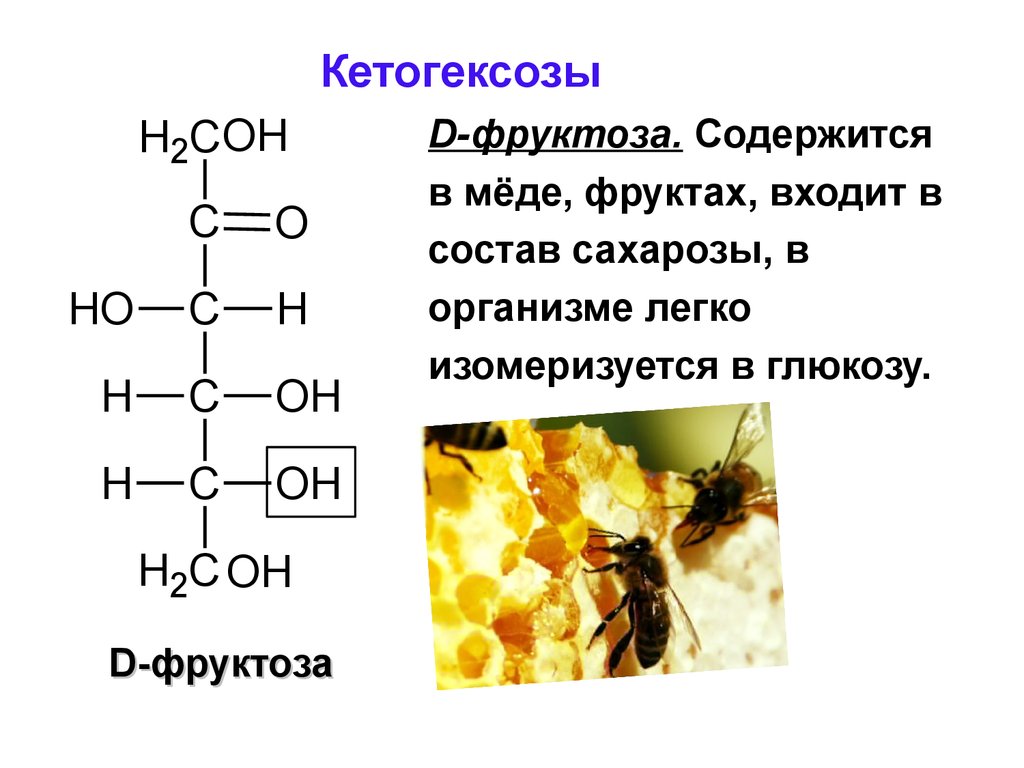
D-фруктоза. Содержится
в мёде, фруктах, входит в
состав сахарозы, в
организме легко
изомеризуется в глюкозу.
51.
КетогексозыФруктоза парентеральное
средство для
регидратации и
дезинтоксикации.
52.
«Открытие меда» - Пьееро ди Коезимо (1462).(Вустерский «Музей искусств»)
53. Циклические формы моносахаридов
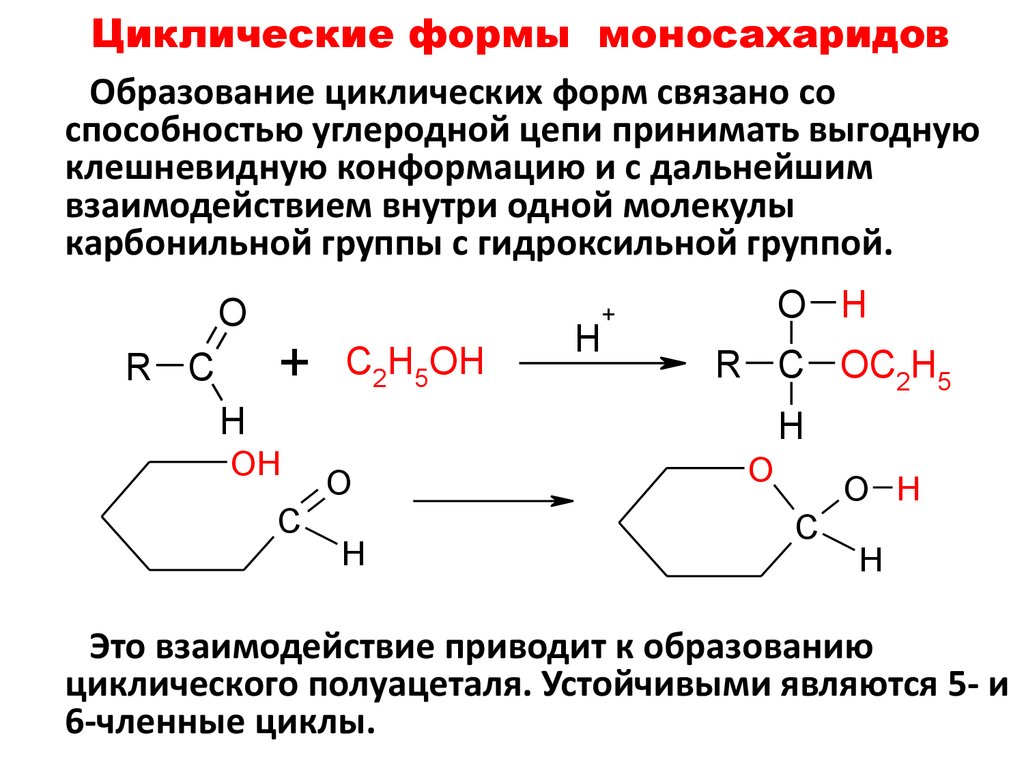
Образование циклических форм связано соспособностью углеродной цепи принимать выгодную
клешневидную конформацию и с дальнейшим
взаимодействием внутри одной молекулы
карбонильной группы с гидроксильной группой.
O
R C
+
C2H5OH
H
O H
+
R C OC2H5
H
OH
C
H
O
H
O
O H
C
H
Это взаимодействие приводит к образованию
циклического полуацеталя. Устойчивыми являются 5- и
6-членные циклы.
54.
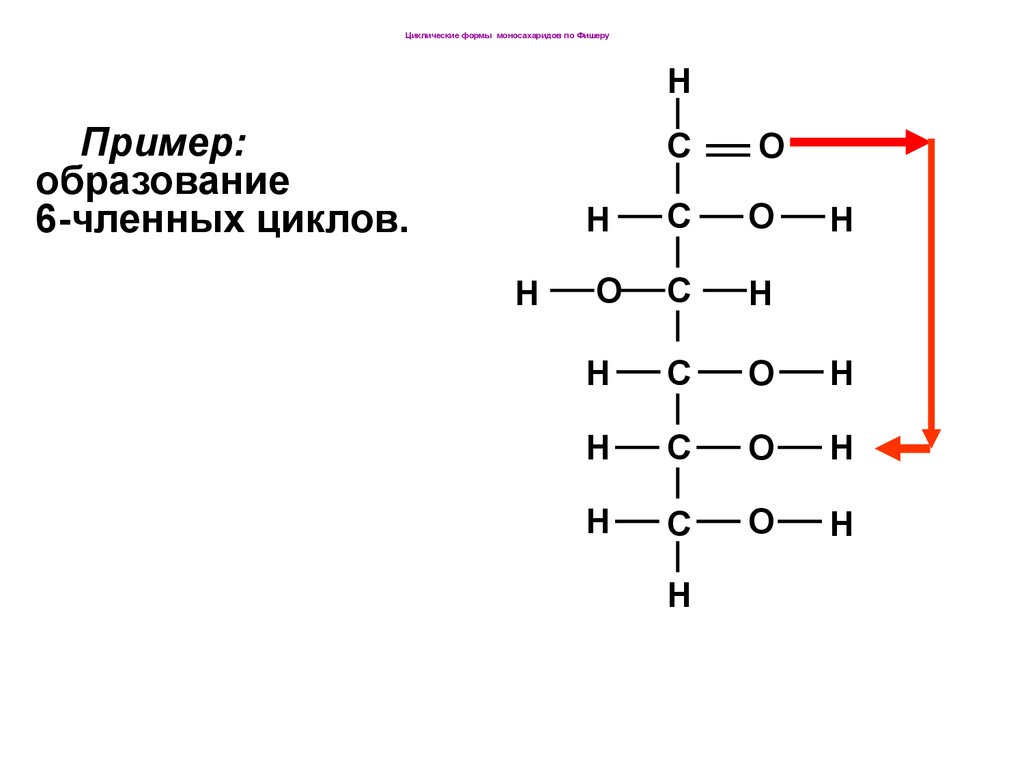
Циклические формы моносахаридов по ФишеруH
Пример:
образование
6-членных циклов.
H
C
O
H
C
O
O
C
H
H
C
O
H
H
C
O
H
H
C
O
H
H
H
55.
Циклические формы моносахаридовH
H
C
O
H
C
O
O
C
H
H
C
O
H
H
C
O
H
H
C
O
H
H
H
56.
Циклические формы моносахаридовH
H
O
C
H
C
O
O
C
H
H
C
O
H
H
C
O
H
H
C
O
H
H
H
57.
Циклические формы моносахаридовH
O
H
H
C
H
C
O
O
C
H
H
C
O
H
C
O
H
C
O
H
H
H
H
58.
Циклические формы моносахаридовH
O
H
H
C
O
H
C
O
O
C
H
H
C
O
H
H
C
H
C
O
H
H
H
59.
Циклические формы моносахаридовH
H
H
C
O
H
C
O
O
C
H
H
H
H-O
C
H
C
O
O
C
H
H
O
H
C
O
H
H
C
H
C
O
H
H
C
H
C
O
H
H
C
H
H
O
H
O
H
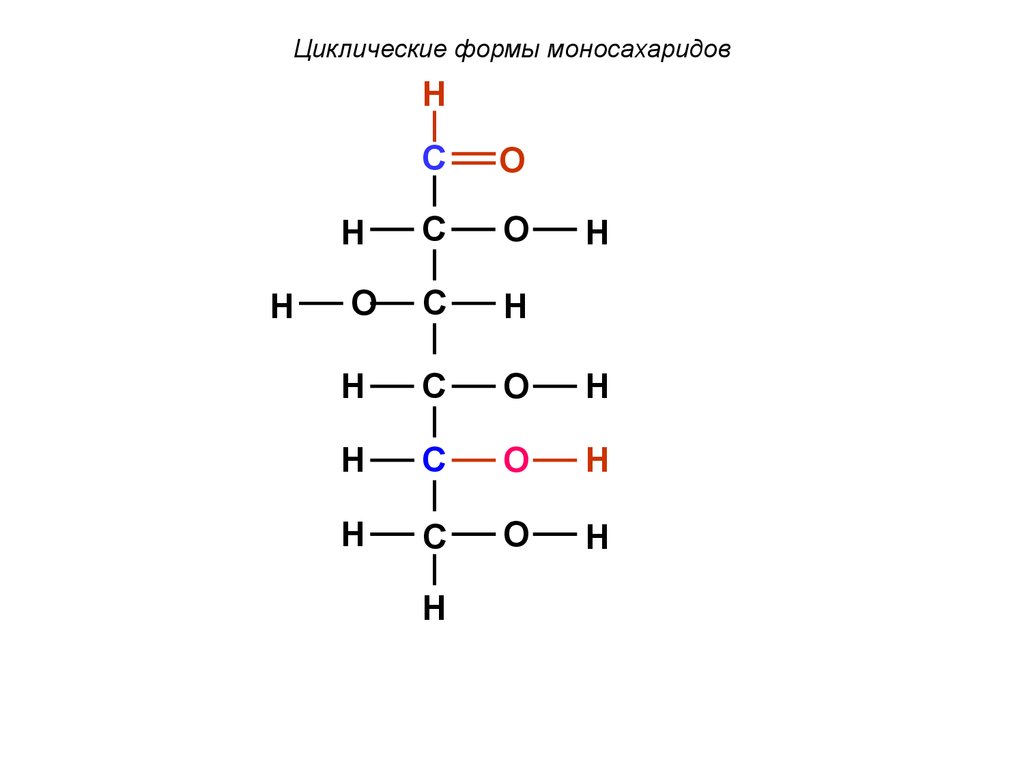
60. Циклические формы моносахаридов
В случае образования циклическогополуацеталя появляется дополнительный
центр хиральности, который называется
аномерным атомом углерода.
Два образующихся σ-диастереомера
называются аномерами.
61.
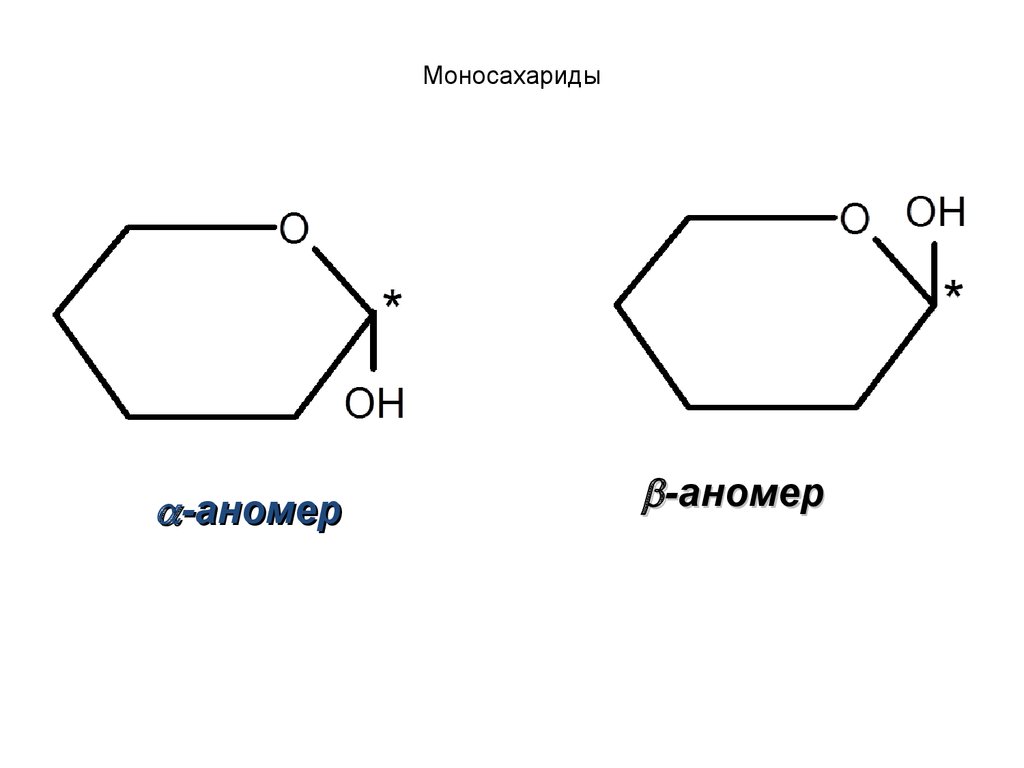
Циклические формы моносахаридовЕсли у циклической формы конфигурация
аномерного центра такая же, как у концевого
хирального центра, то это α-аномер, если
противоположная, то β-аномер.
H
HO C
H
HO
C
H
OH
H
H
HO
O
OH
H
H
C OH
H
OH
HO
H
H
OH
H
OH
H
OH
H
O
H
OH
H
O
CH2OH
-аномер
CH2OH
открытая цепь
CH2OH
-аномер
Образующаяся полуацетальная OH-группа
называется гликозидной гидроксигруппой.
62.
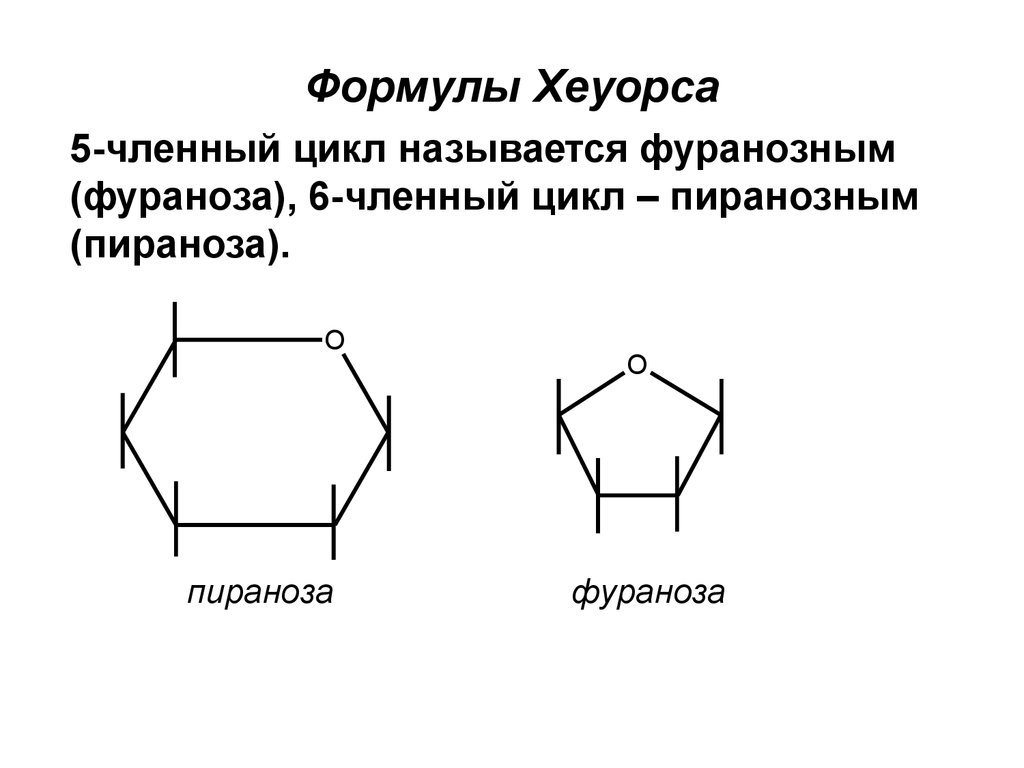
Формулы Хеуорса5-членный цикл называется фуранозным
(фураноза), 6-членный цикл – пиранозным
(пираноза).
O
пираноза
O
фураноза
63.
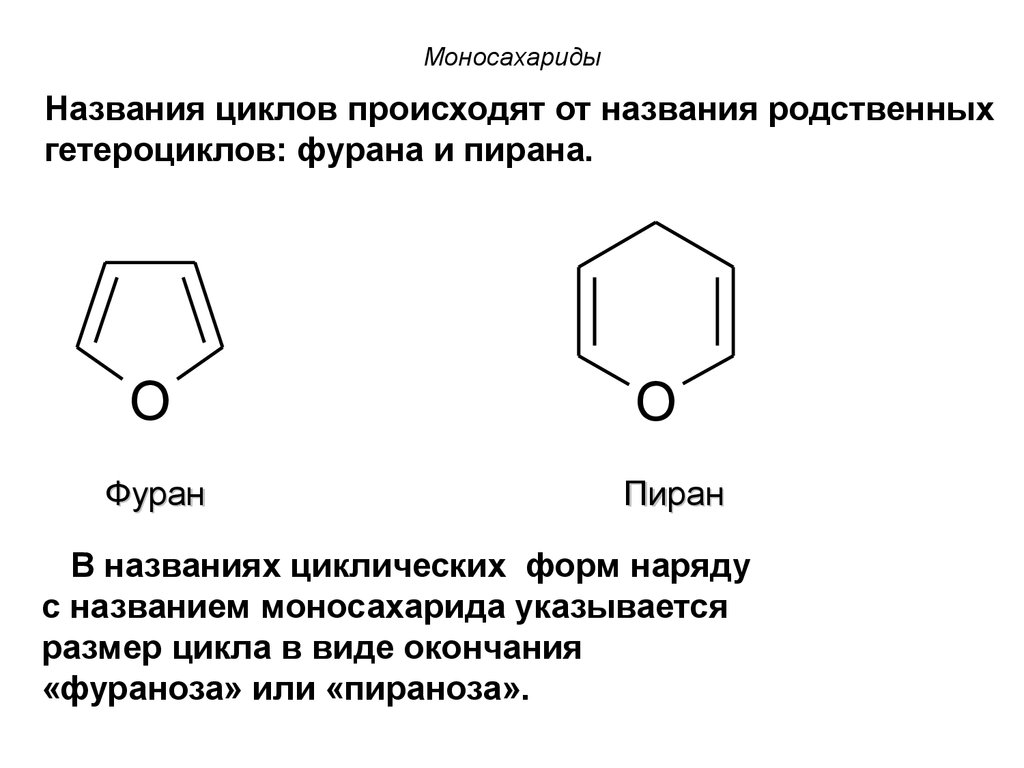
МоносахаридыНазвания циклов происходят от названия родственных
гетероциклов: фурана и пирана.
O
Фуран
O
Пиран
В названиях циклических форм наряду
с названием моносахарида указывается
размер цикла в виде окончания
«фураноза» или «пираноза».
64. Моносахариды
Нумерацию цепи в формулах Хеуорса ведут открайнего правого положения по часовой стрелке.
Последнее звено -СН2ОН выносят над плоскостью
цикла, что является дополнительным Dпризнаком по Хеуорсу.
Если полуацетальный гидроксил расположен
под плоскостью цикла, то имеем -аномер.
Если полуацетальный гидроксил расположен
над плоскостью цикла -аномер.
65.
Моносахариды-аномер
-аномер
66.
CHOH
OH
HO
Переход линейной формы в циклическую
H
H
H
OH
H
OH
H
OH H
HOCH2
CHO
OH OH H
OH
1. Поворот структуры на
90o направо.
CH2OH
2.Поворот на 90o
группы,
содержащей
гидроксигруппу,
образующую
полуацеталь.
CH2OH
H
H
OH H
HOCH2
H
CHO
OH OH H
OH H
CHO
HO
OH
H
OH H
OH
3. Образование полуацеталя.
H
OH H
H
CHO
HO
H
CH2OH
CH2OH
CH2OH
OH H
OH
HO
OH
H
OH
H
H
OH
H
CHO
HO
O
H
OH
OH
H
H
H
OH
67.
HO
H
H
Циклические формы
C
O
H
C
O
O
C
H
H
C
O
H
C
H
C
O
CH2OH
H
C
O
H
OH
H
C
C
H
H
OH
OH
H
C
C
H
OH
H
H
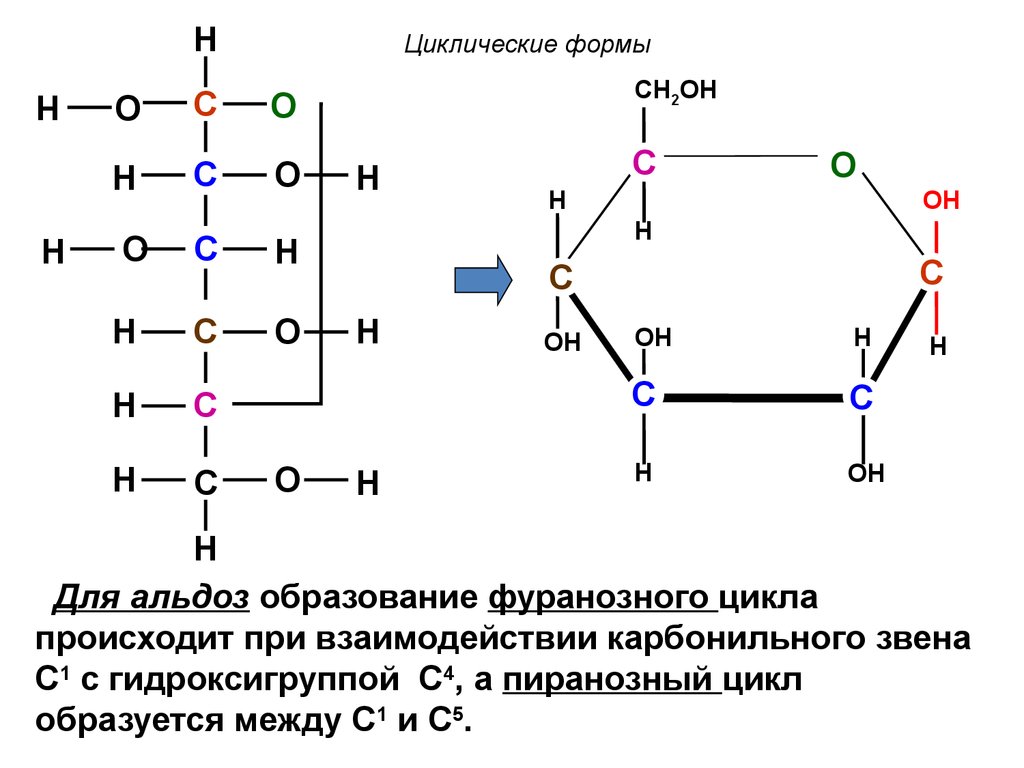
Для альдоз образование фуранозного цикла
происходит при взаимодействии карбонильного звена
С1 с гидроксигруппой С4, а пиранозный цикл
образуется между С1 и С5.
68.
HЦиклические формы
O
C
H
H
C
O
H
C
H
C
H
O
O
CH2OH
CH2OH
C
C
H
H
H
C
C
OH
O
H
H
O
C
H
H
OH
H
O
C
OH
H
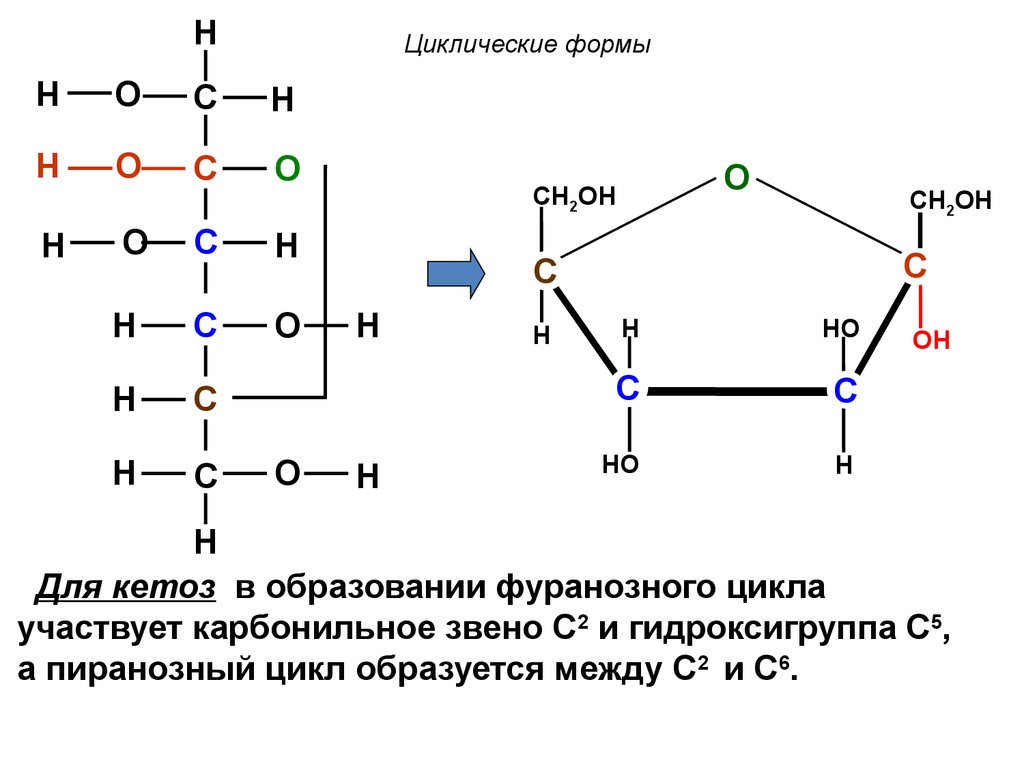
Для кетоз в образовании фуранозного цикла
участвует карбонильное звено С2 и гидроксигруппа С5,
а пиранозный цикл образуется между С2 и С6.
69.
Циклическиеформы
Энантиомерия
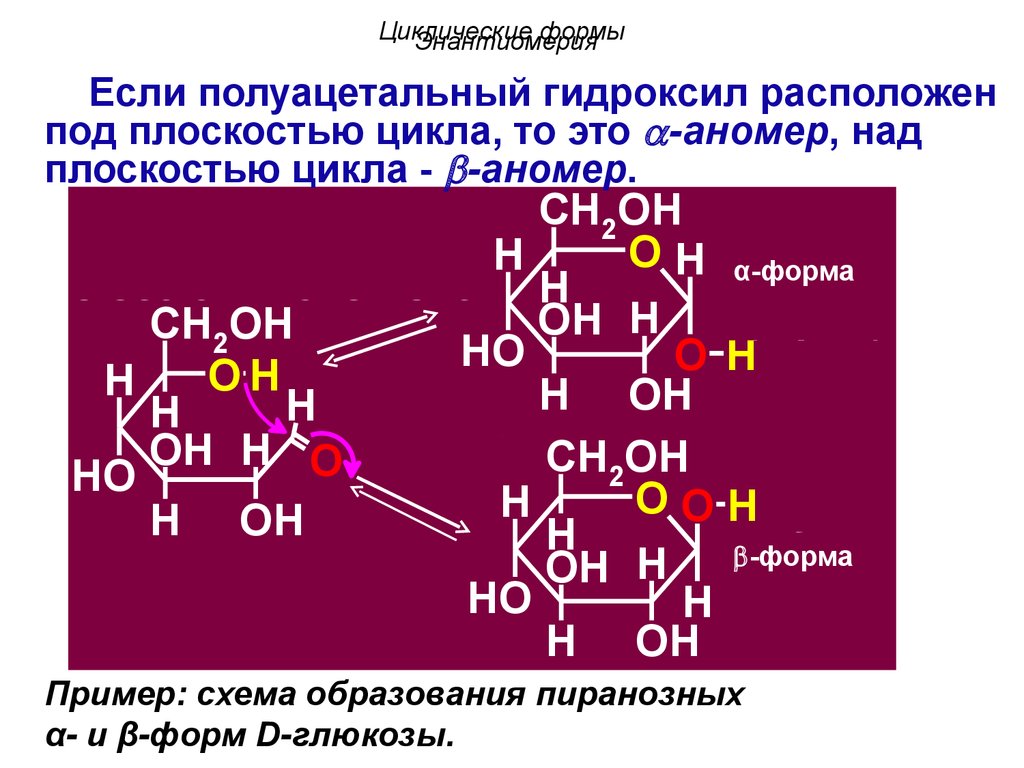
Если полуацетальный гидроксил расположен
под плоскостью цикла, то это -аномер, над
плоскостью цикла - -аномер.
CH2OH
arrows show
O H α-форма
H
form
electron movement
H
(alpha)
OH H
CH2OH
HO
O H
O
H
H
H
OH
H
H
OH H O
CH
OH
2
HO
O
H
OH
H OH
H
form
OH H -форма
HO
H (beta)
H OH
Пример: схема образования пиранозных
α- и β-форм D-глюкозы.
70.
Циклические формыarrows show
electron movement
CH2OH
O H
H
H
OH
H
H
O
OH
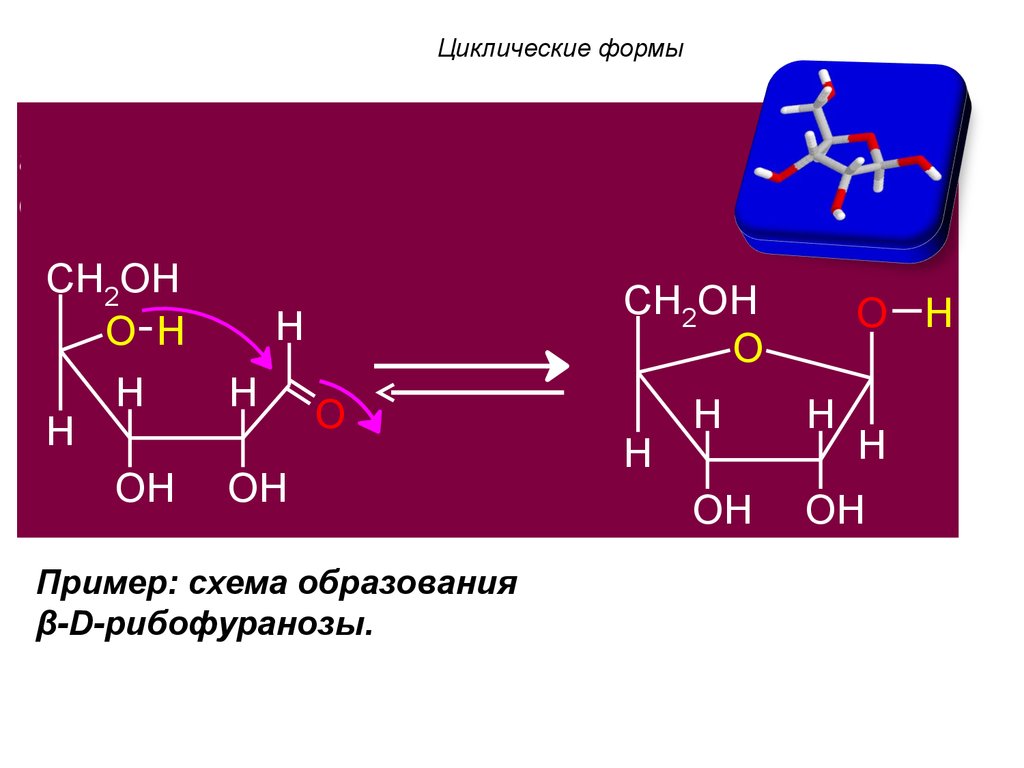
Пример: схема образования
β-D-рибофуранозы.
D-ribose
D-ribofuranose
(furanose ring form)
CH2OH
O H
O
H
H
H
OH
OH
H
71. Моносахариды
В растворе моносахариды присутствуют воткрытых и циклических формах, способных
свободно переходить друг в друга. Такой вид
изомерии называется цикло-оксо-таутомерией
(кольчато-цепной таутомерией).
Изомеры, взаимно переходящие друг в друга
и находящиеся в состоянии динамического
равновесия, называются таутомерами.
72.
Кольчато-цепная таутомерияCH2OH
CH2OH
H
32%
HO
H
OH
OH
CH2OH
68%
HO
HO
OH
H
H
OH
H
OH
CH2OH
O OH
H
H
H
CHO
H
-D-глюкопираноза
OH
-D-глюкопираноза
H
O
OH
H
OH
H
H
H
H
HO
O H
H
OH
H
OH
H
OH
-D-глюкофураноза
CH2OH
HO
H
OH
O
0,02%
H
OH
H
H
H
OH
-D-глюкофураноза
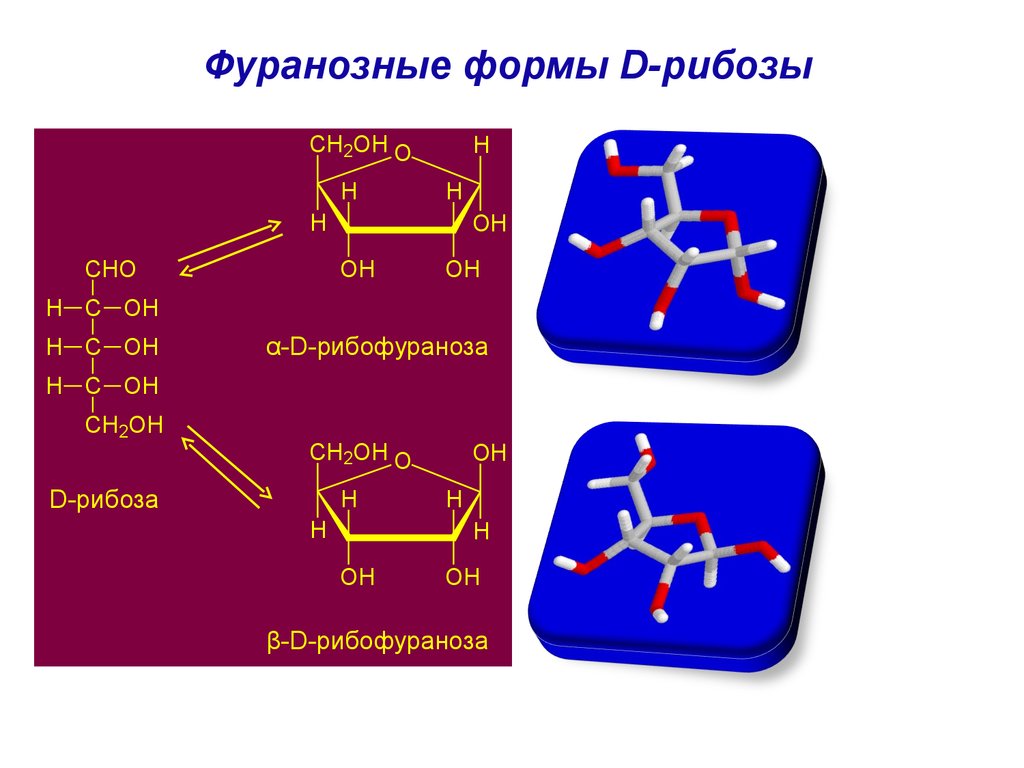
73. Фуранозные формы D-рибозы
CH2OH OH
H
H
H
CHO
OH
OH
OH
H C OH
H C OH
-D-Ribofuranosa
α-D-рибофураноза
H C OH
CH2OH
D-рибоза
D-Ribosa
(forma abierta)
CH2OH O
H
H
OH
H
H
OH
OH
β-D-рибофураноза
-D-Ribofuranosa
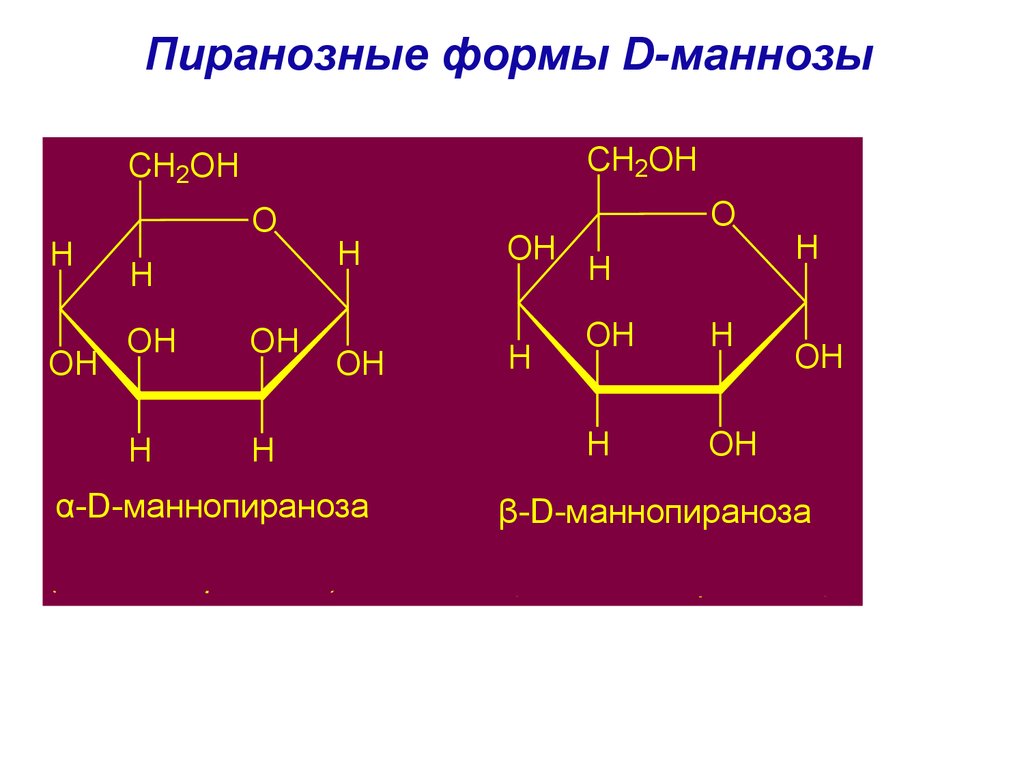
74. Пиранозные формы D-маннозы
CH2OHCH2OH
H
OH
O
H
OH
OH
H
H
H
OH
α-D-маннопираноза
D-Manosa
( -D-Manopiranosa)
OH
H
O
H
OH
H
H
OH
H
OH
β-D-маннопираноза
D-Galactosa
( -D-Galactopiranosa)
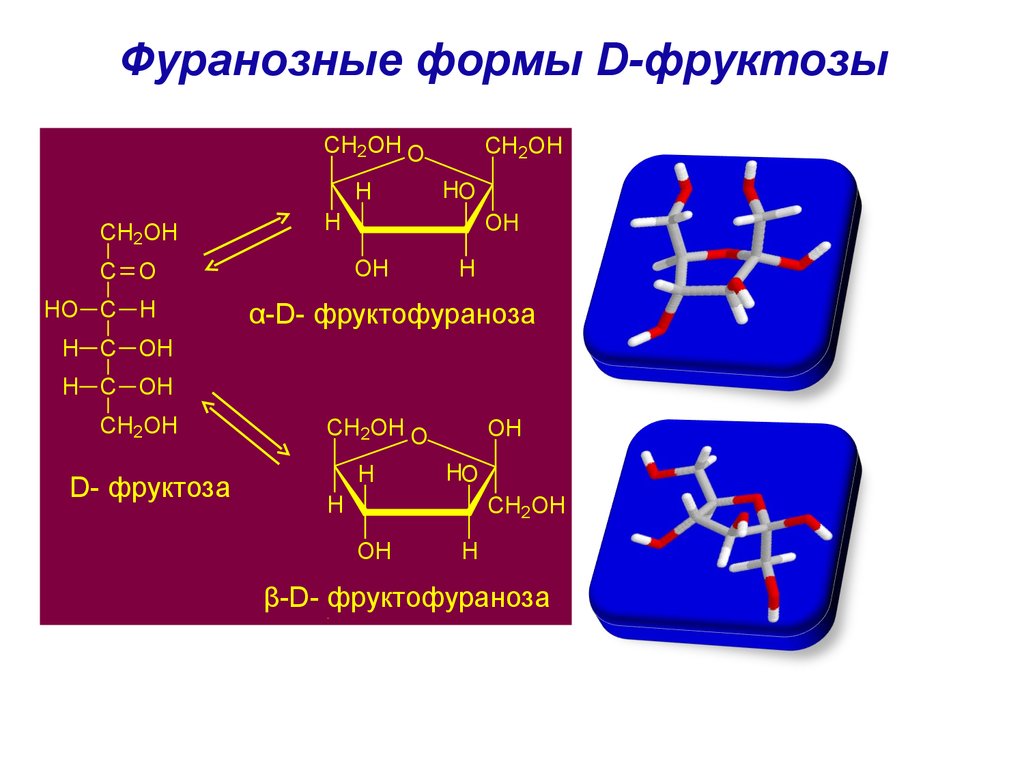
75. Фуранозные формы D-фруктозы
CH2OH OH
CH2OH
HO
H
OH
OH
C O
HO C H
CH2OH
H
α-D- -D-Fructofuranosa
фруктофураноза
H C OH
H C OH
CH2OH
D-Fructosa
Dфруктоза
CH2OH O
H
OH
HO
H
CH2OH
OH
H
β-D- -D-Fructofuranosa
фруктофураноза
76.
ТаутомерияКольчато-цепная таутомерия сопровождается
закономерным явлением – мутаротацией.
Мутаротация (от лат. mutare – изменять, rotatio –
вращение) в данном случае - это изменение вращения
плоскости поляризации света свежеприготовленными
растворами разных аномеров.
Например, a-D-глюкопираноза имеет удельное
вращение [a] = +112o, а b-D-глюкопираноза имеет
[a] = +19o. При стоянии свежеприготовленных
растворов каждого из аномеров удельное вращение
изменяется и достигает значения +52,5o,
соответствующего равновесию.
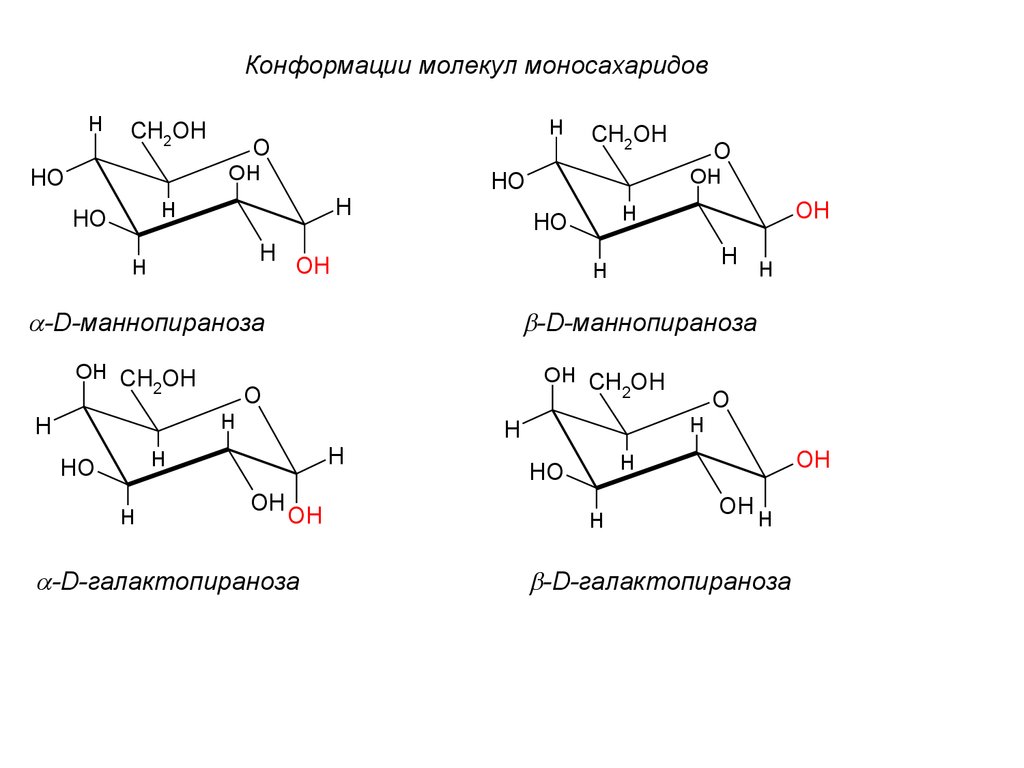
77. Конформации молекул моносахаридов
В реальности пиранозные формы принимаютконформацию кресло – наиболее энергетически
выгодную в случае шестичленных циклов.
78.
Конформации молекул моносахаридовВ случае β-аномера все объемные заместители
занимают экваториальные положения, что
энергетически выгодно.
H
CH2OH
H
HO
O H
H
OH
OH
H
HO
O OH
H
H
H
OH
D-маннопираноза
OH
-D-глюкопираноза
CH2OH
H
OH
OH
H
-D-глюкопираноза
H
H
H
HO
OH
O
H
HO
H
H
CH2OH
CH2OH
O
H
HO
OH
H
HO
H
OH
H
-D-глюкопираноза
79.
Конформации молекул моносахаридовH
CH2OH
H
O
OH
HO
H
H
H
OH
OH CH OH
2
O
H
H
OH
H
OH
-D-галактопираноза
O
H
H
H
HO
H
H
-D-маннопираноза
H
H
OH
H
HO
-D-маннопираноза
OH CH OH
2
O
OH
HO
H
HO
CH2OH
OH
H
HO
H
OH
H
-D-галактопираноза
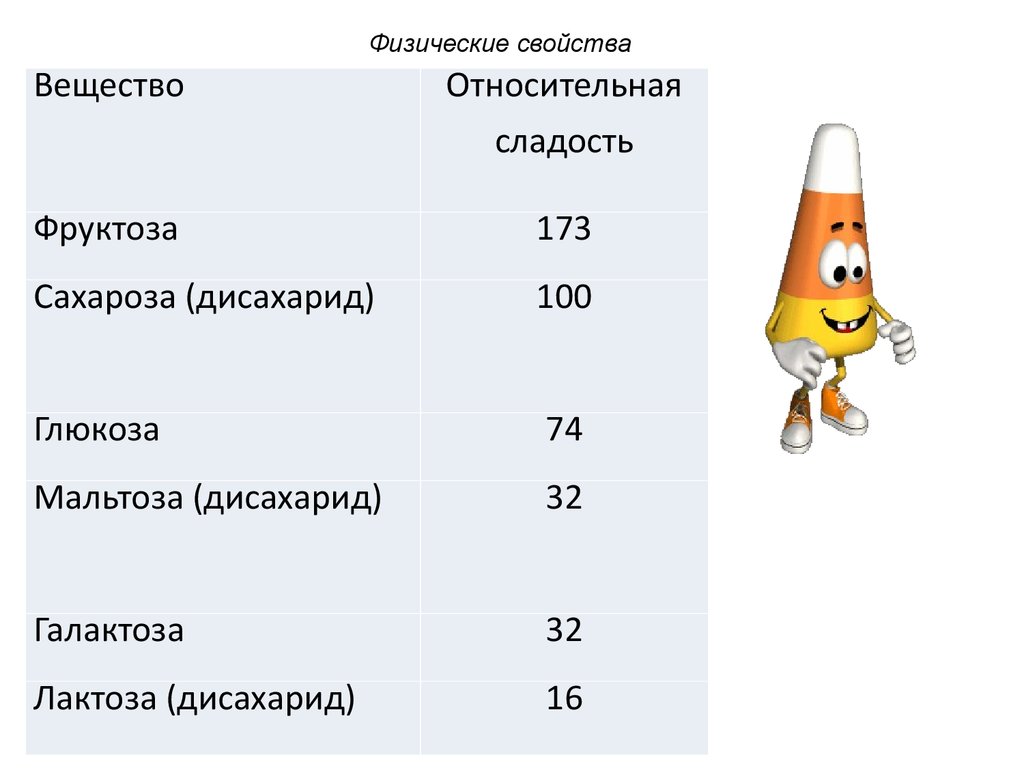
80. Физические свойства
Моносахариды представляют собой бесцветныекристаллические
вещества
очень
хорошо
растворимые в воде. Моносахариды трудно
растворяются в спирте, очень плохо в гидрофобных
растворителях.
Концентрированные растворы сахаров в воде
называются сиропами.
81.
Физические свойстваВещество
Относительная
сладость
Фруктоза
173
Сахароза (дисахарид)
100
Глюкоза
74
Мальтоза (дисахарид)
32
Галактоза
32
Лактоза (дисахарид)
16
82.
Физические свойстваO
C
NH
S
O
Сахарин (E954), 500 раз
O
Этоксифенилмочевина (дульцин), 200 раз
Ацесульфам (E950), 200 раз
Аспартам (метиловый эфир L-аспартил-Lфенилаланина, E951), 200 раз
Метилфенхиловый эфир L-аспартиламиномалоновой
кислоты, 33000 раз
Сукроновая кислота, 200000 раз.
83.
Физические свойстваБелок монеллин из
тропического растения
Dioscoreophyllum cumminsii
в 3000 раз слаще
сахарозы.
84.
Физические свойстваБелок тауматин (E957)
из тропического
растения Thaumacoccus
daniellii слаще сахарозы в
750-1000 раз, а его
комплекс с ионами
алюминия – талин – уже
в 35000 раз.
Thaumacoccus daniellii
85.
Физические свойстваБелок миракулин из
Synsepalum dulcificum имеет
уникальное свойство
воздействовать на вкусовые
рецепторы, отключая на
время восприятие кислого и
горького вкусов, при этом
все остальные вкусовые
ощущения остаются.
Synsepalum dulcificum
86.
Физические свойстваФрукт Synsepalum
dulcificum сам по себе не
сладкий, но может
использоваться как
натуральный
подсластитель.
87.
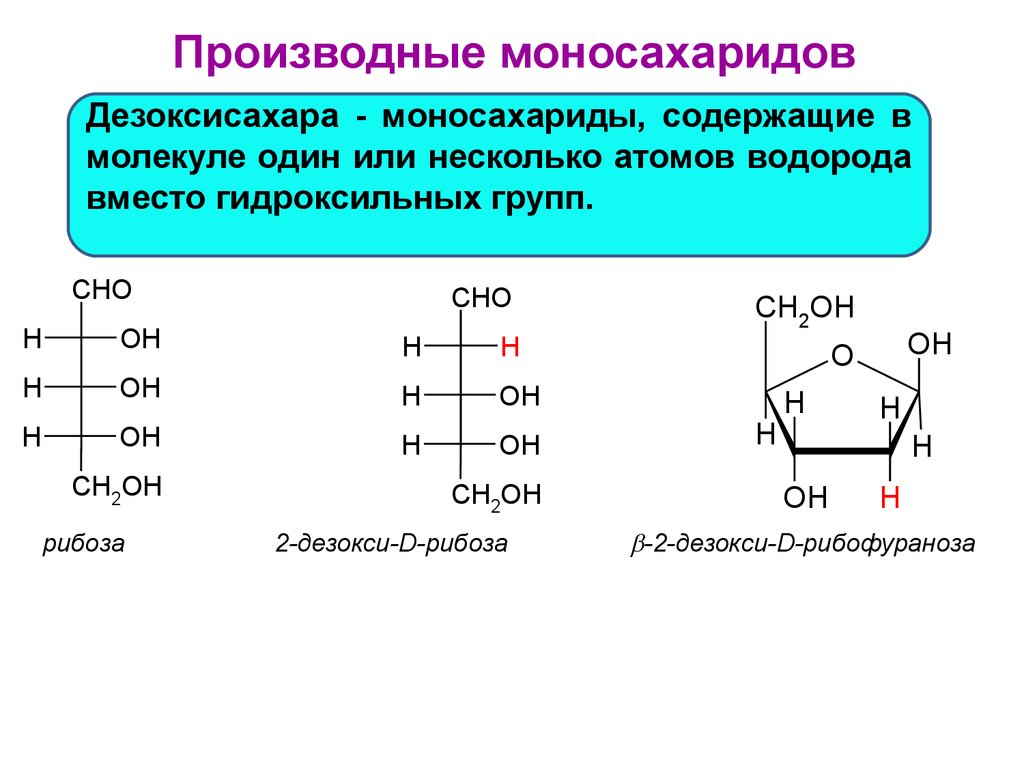
Производные моносахаридовДезоксисахара - моносахариды, содержащие в
молекуле один или несколько атомов водорода
вместо гидроксильных групп.
CHO
CHO
H
OH
H
H
H
OH
H
OH
H
OH
H
OH
CH2OH
рибоза
CH2OH
2-дезокси-D-рибоза
CH2OH
OH
O
H
H
H
H
OH
H
-2-дезокси-D-рибофураноза
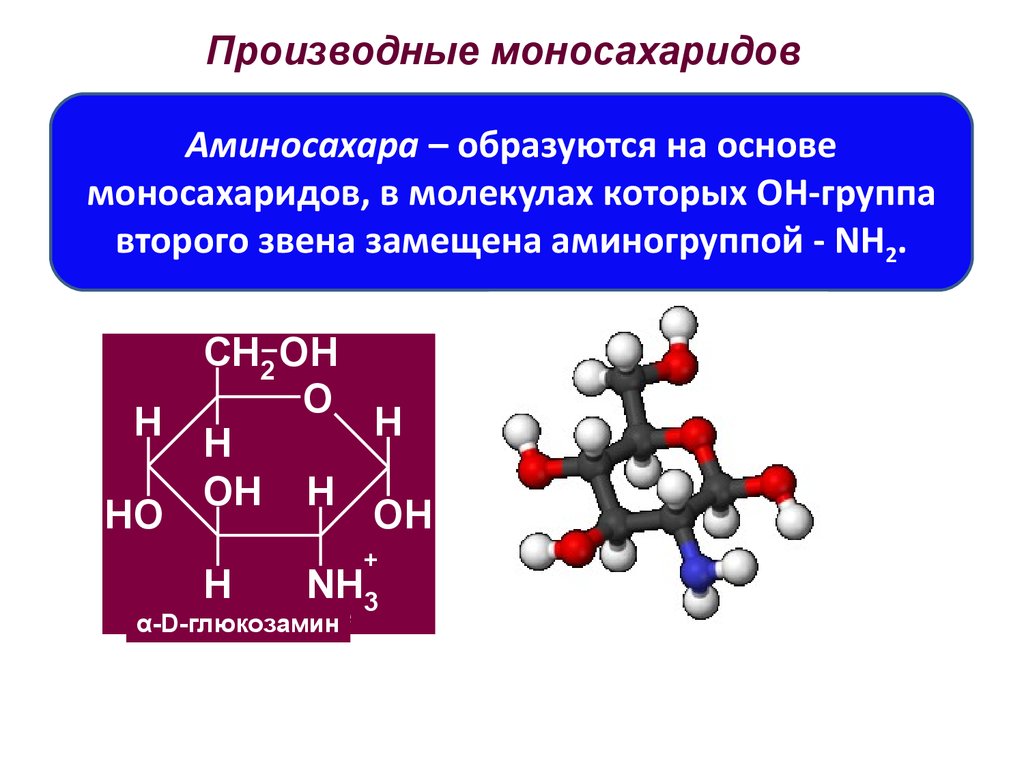
88. Производные моносахаридов
Аминосахара – образуются на основемоносахаридов, в молекулах которых OH-группа
второго звена замещена аминогруппой - NH2.
CH2 OH
O
H
H
H
OH H
HO
OH
H
+
NH3
-D-glucosamine
α-D-глюкозамин
89.
АминосахараCHO
H
NH2
HO
H
H2N
H
H
HO
H
HO
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
O OH
HO
H
H
H
CH2OH
CH2OH
CH2OH
HO
NH2
H
CH2OH
H
CHO
CHO
NH2
D-глюкозамин
(2-амино-2-дезоксиD-глюкопираноза)
H
H
OH
O OH
H
H
H
NH2
D-галактозамин
H
HO
O OH
H
OH H2N
H
H
H
D-маннозамин
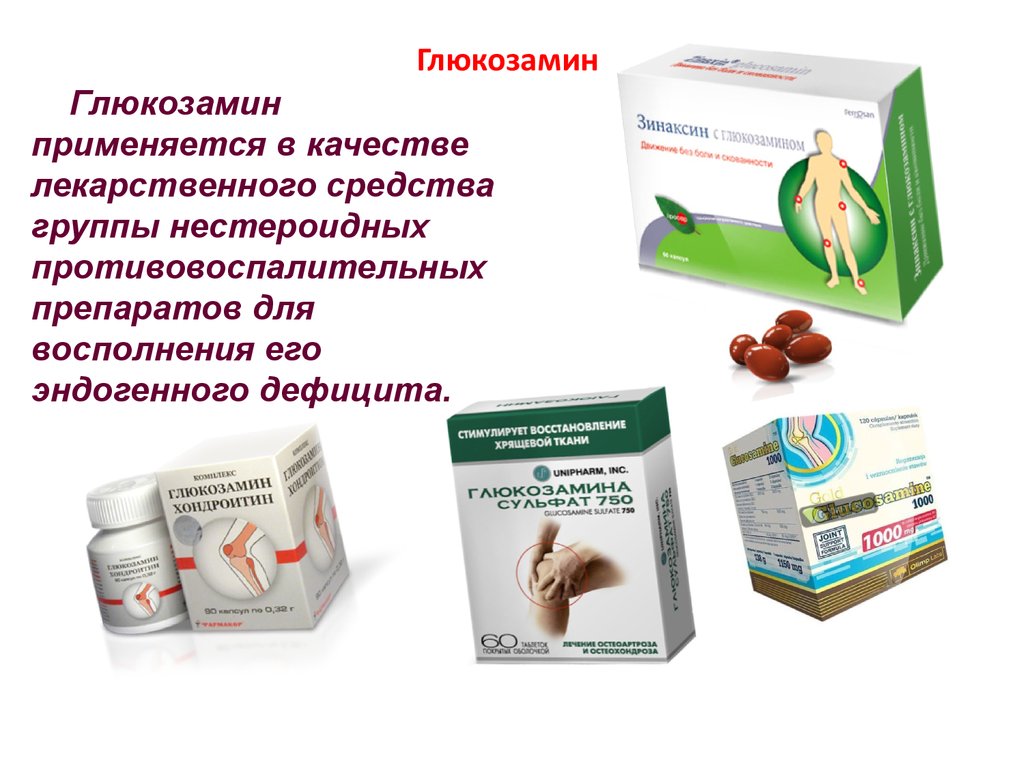
90. Глюкозамин
Глюкозаминприменяется в качестве
лекарственного средства
группы нестероидных
противовоспалительных
препаратов для
восполнения его
эндогенного дефицита.
91.
АминосахараCH2 OH
O
H
H
H
OH H
HO
OH
H
NH
CH3C O
N-acetyl- -D-glucosamine
N-ацетил-α-D-глюкозамин
2-ацетамидо-2-дезоксиα-D-глюкопираноза
Аминогруппа часто
ацилирована остатком
уксусной кислоты, при
этом образуется
амидная группировка:
-NH-CO-.
92.
АминосахараАминосахара входят в
состав групповых веществ
крови, определяя их
специфичность и
являются компонентами
структурных
полисахаридов.
N-ацетил-D-галактозамин
2-ацетамидо-2-дезоксиD-галактопираноза
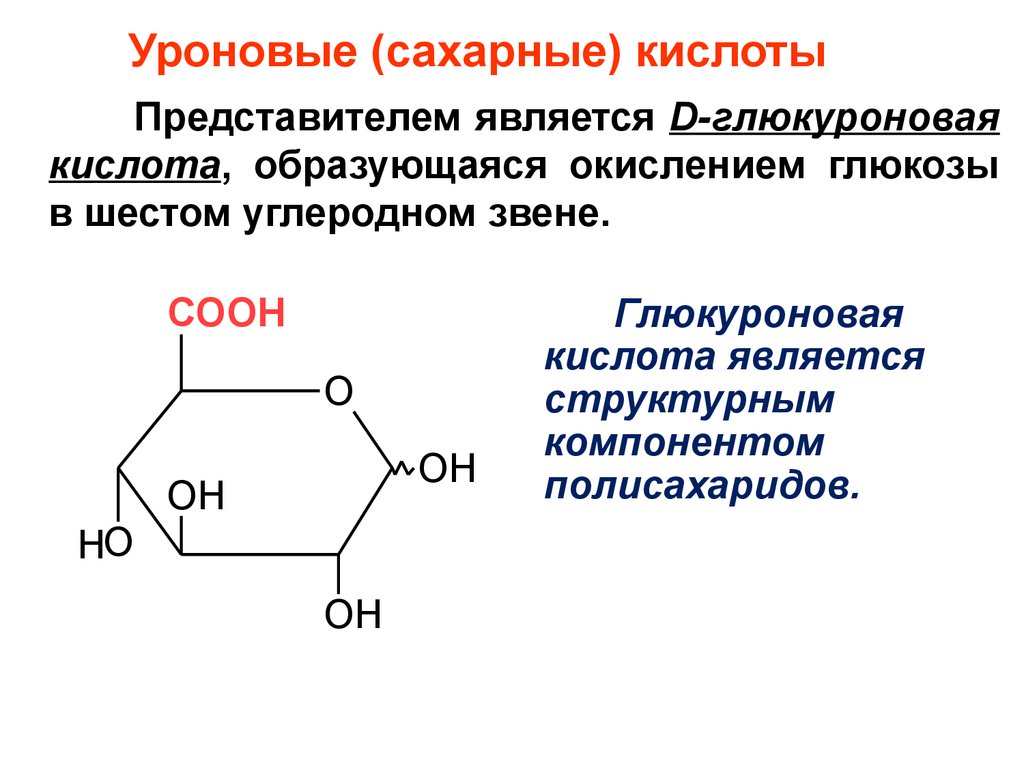
93. Уроновые (сахарные) кислоты
Представителем является D-глюкуроноваякислота, образующаяся окислением глюкозы
в шестом углеродном звене.
COOH
O
OH
OH
HO
OH
Глюкуроновая
кислота является
структурным
компонентом
полисахаридов.
94.
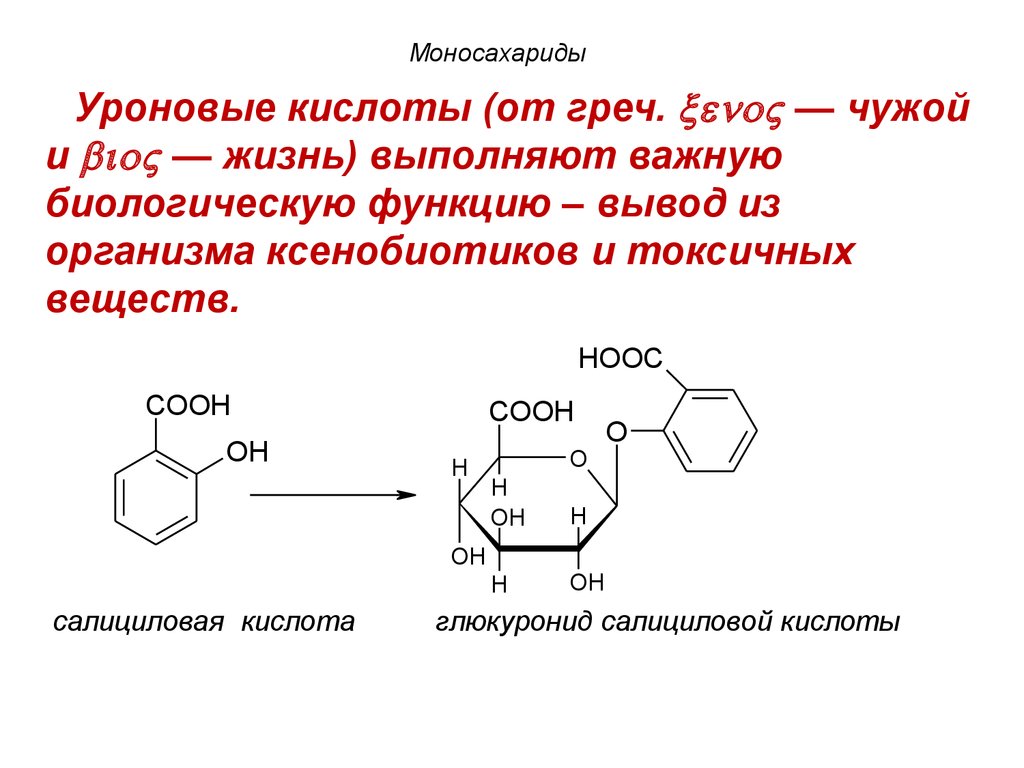
МоносахаридыУроновые кислоты (от греч. — чужой
и — жизнь) выполняют важную
биологическую функцию – вывод из
организма ксенобиотиков и токсичных
веществ.
HOOC
COOH
OH
COOH
H
O
H
OH
H
H
OH
OH
салициловая кислота
O
глюкуронид салициловой кислоты
95.
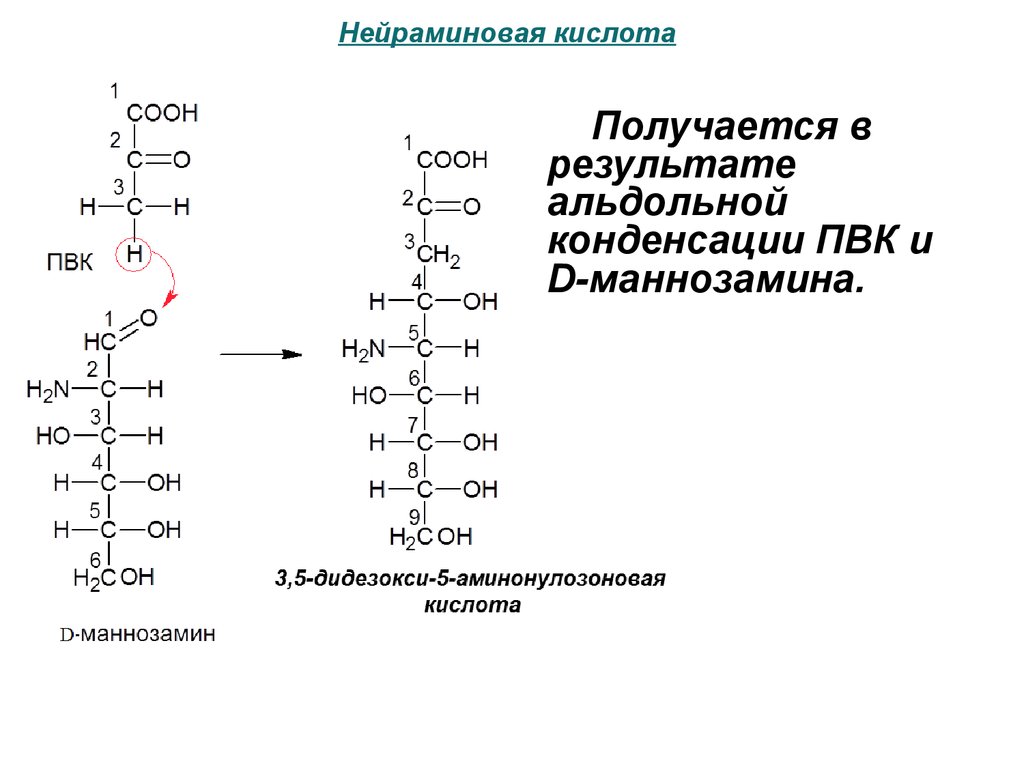
Нейраминовая кислотаПолучается в
результате
альдольной
конденсации ПВК и
D-маннозамина.
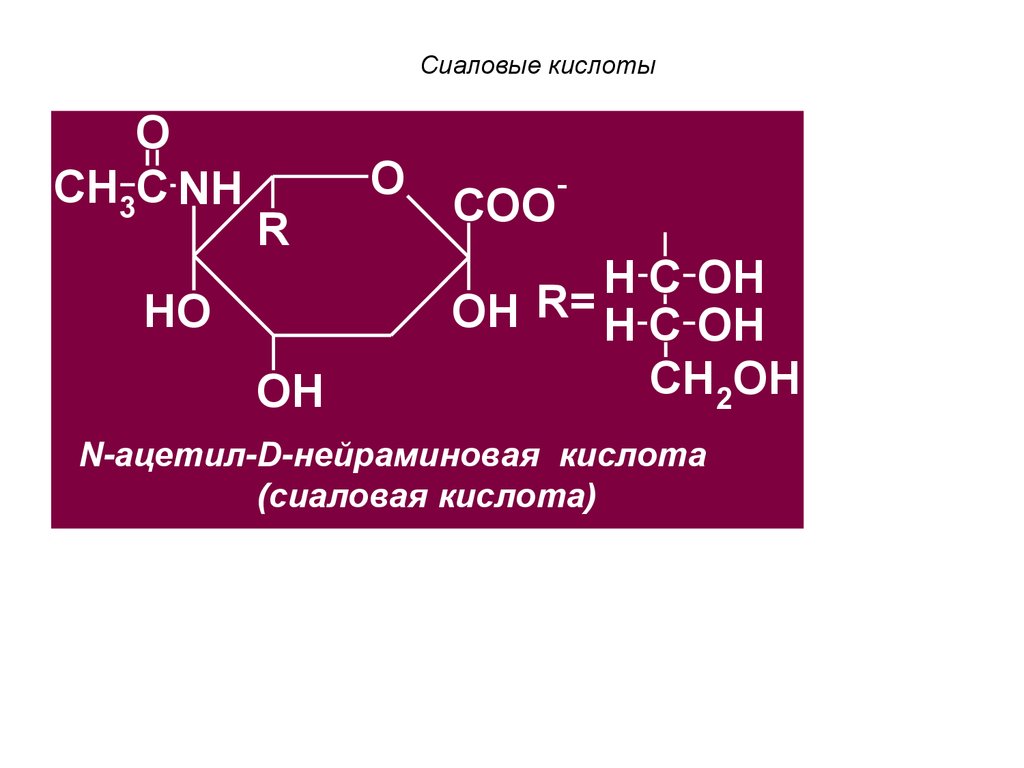
96. Сиаловые кислоты
1Сиаловые кислоты
COOH
2C
O
3
CH2
4
HC
H3C
C
O
5
NH C
HO
H
H
6
C
7
C
8
C
9
H2C
OH
H
H
OH
Сиаловые кислоты N-ацетильными
производными
нейраминовой кислоты.
Ацилирование
происходит ацетильным
или гидроксиацетильным
остатком.
OH
OH
N-ацетил-D-нейраминовая
кислота
(сиаловая кислота)
97.
Сиаловые кислотыO
CH3C NH
HO
R
O
COO
-
H C OH
OH R= H C OH
CH2OH
OH
N-acetylnuraminic
acid
N-ацетил-D-нейраминовая
кислота
(сиаловая
sialic кислота)
acid
98. Моносахариды
Нейраминовые и сиаловые кислоты в свободномсостоянии содержатся в спиномозговой
жидкости. Сиаловая кислота является
компонентом специфических веществ крови,
входит в состав ганглиозидов мозга и участвует
в проведении нервных импульсов.
Сиаловые кислота
Галактоза
Нейраминидаза
99. Химические свойства моносахаридов
Исходя из функционального состава,моносахариды
проявляют
свойства
многоатомных
спиртов,
карбонильных
соединений, полуацеталей и специфические
свойства.
100.
Химические свойстваI. Свойства многоатомных спиртов.
1)
Качественная реакция с гидроксидом меди(II) Сu(OH)2. В реакцию вступает -диольный
фрагмент молекулы моносахарида:
HC
2
2
O
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H2C OH
C
+
Cu(OH)2
+
2OH
O
O
Cu
-
-4H2O
C
O
C
2+
O
ôðàãìåíò õåëàòà
В результате происходит образование
растворимого хелатного комплекса яркосинего цвета.
C
-
101.
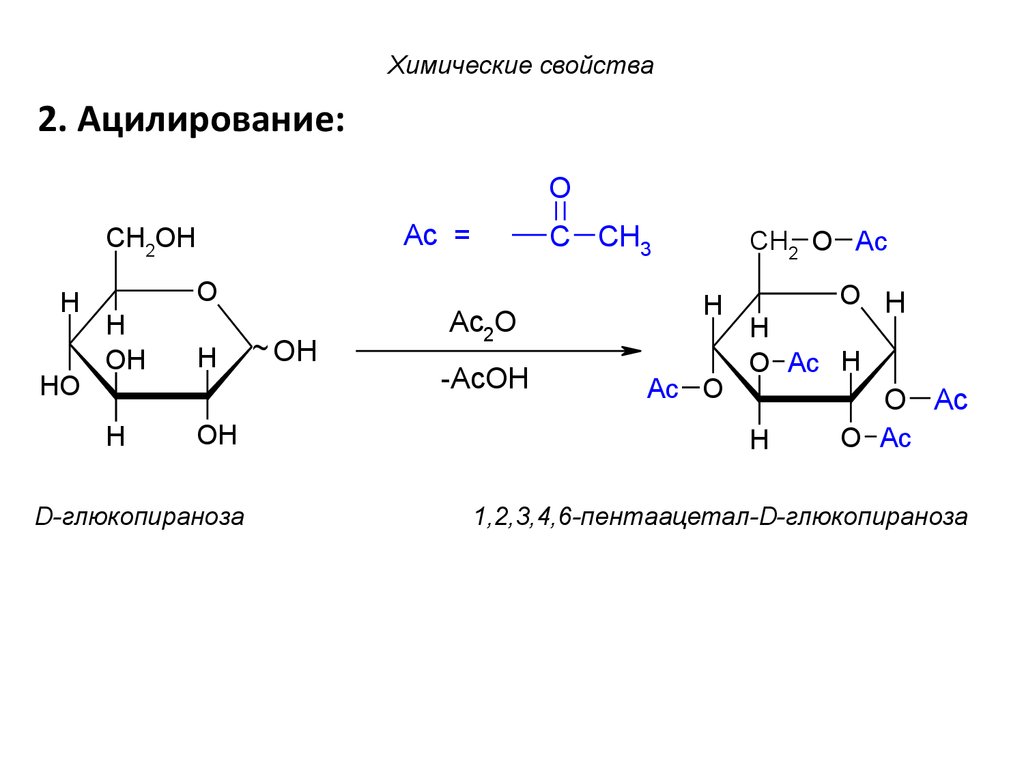
Химические свойства2. Ацилирование:
O
Ac =
CH2OH
H
HO
O
H
OH
H
H
OH
D-глюкопираноза
~ OH
C CH3
Ac2O
-AcOH
CH2 O Ac
H
Ac O
O H
H
O Ac H
O Ac
H
O Ac
1,2,3,4,6-пентаацетал-D-глюкопираноза
102. Химические свойства
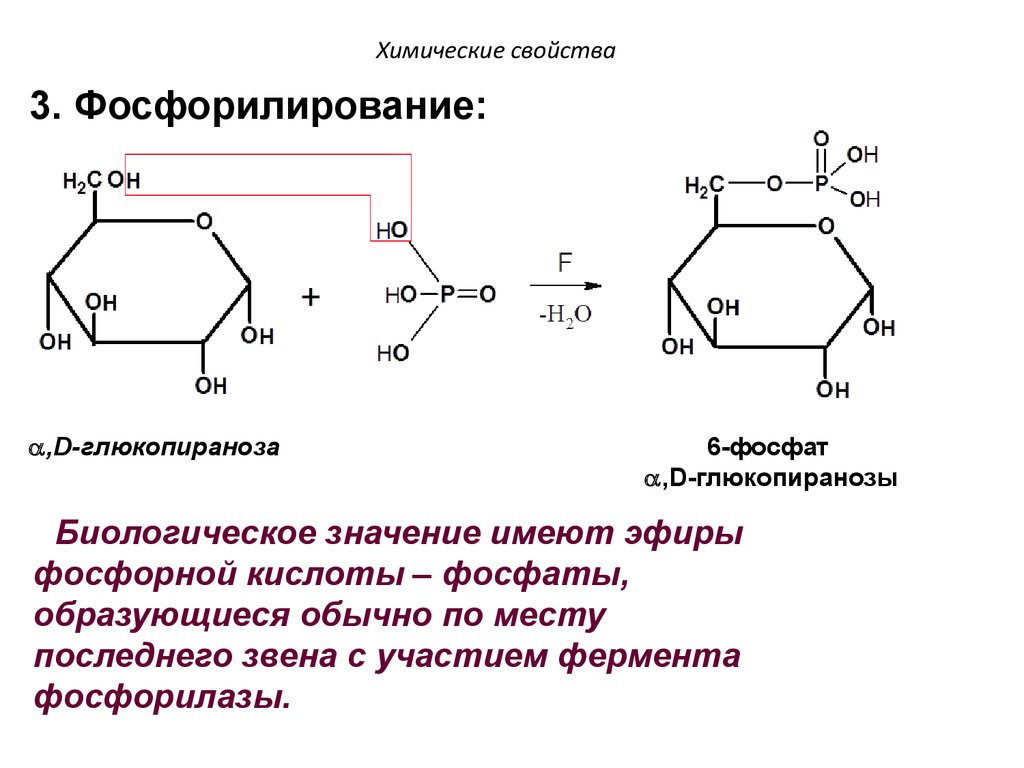
3. Фосфорилирование:,D-глюкопираноза
6-фосфат
,D-глюкопиранозы
Биологическое значение имеют эфиры
фосфорной кислоты – фосфаты,
образующиеся обычно по месту
последнего звена с участием фермента
фосфорилазы.
103.
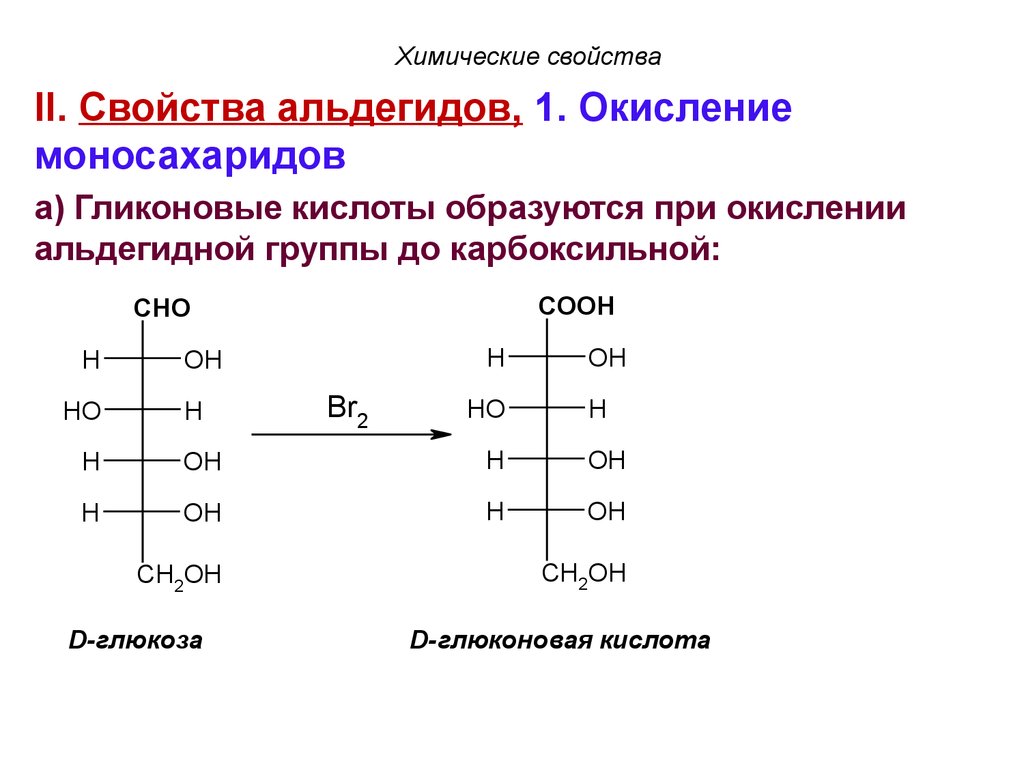
Химические свойстваII. Свойства альдегидов, 1. Окисление
моносахаридов
а) Гликоновые кислоты образуются при окислении
альдегидной группы до карбоксильной:
COOH
CHO
H
HO
H
OH
H
Br2
HO
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-глюкоза
CH2OH
D-глюконовая кислота
104.
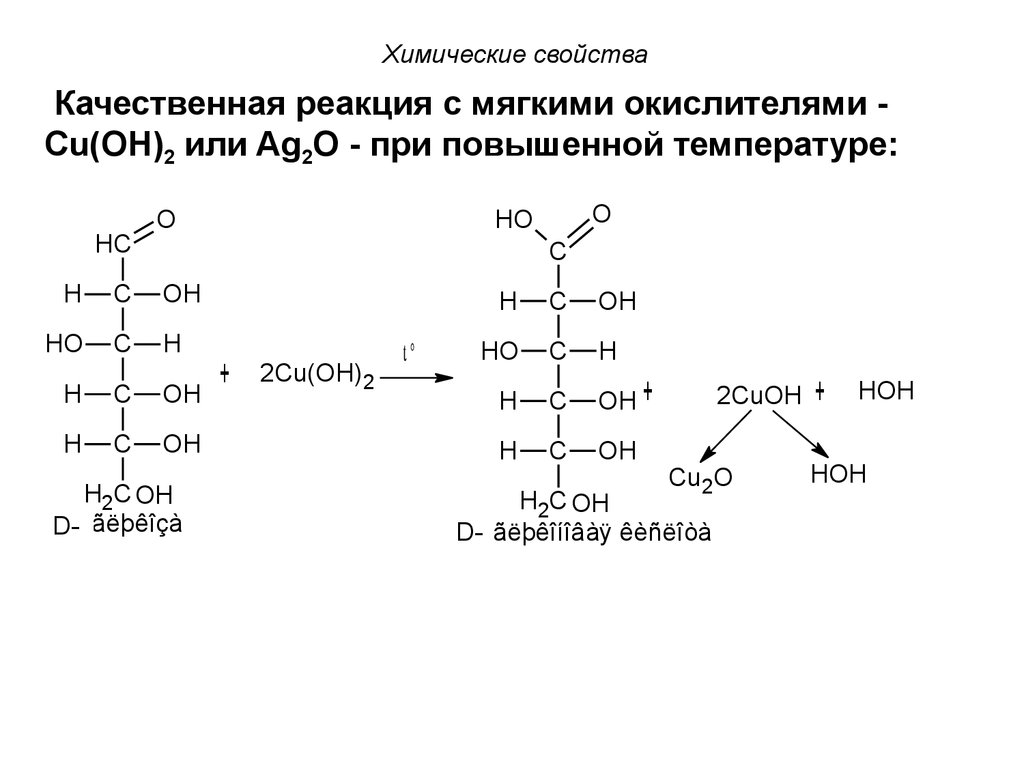
Химические свойстваКачественная реакция с мягкими окислителями Сu(OH)2 или Ag2O - при повышенной температуре:
HC
O
O
HO
C
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H2C OH
Ä-ãëþêîçà
D-
+
2Cu(OH)2
t°
H
C
OH
HO
C
H
H
C
OH +
H
C
OH
2CuOH
Cu2O
H2C OH
DÄ-ãëþêîíîâàÿ êèñëîòà
+
HOH
HOH
105.
Химические свойстваРеакция с Cu(OH)2 называется пробой Троммера и
используется для обнаружения глюкозы в моче.
106.
Химические свойстваб) Гликаровые кислоты образуются при
жёстком окислении. При этом окисляется и
альдегидная и первичная спиртовая группы:
COOH
CHO
H
HO
H
HO
H
H
H
OH
OH
CH2OH
D-галактоза
HNO3
OH
HO
H
HO
H
H
OH
COOH
D-галактаровая кислота
107.
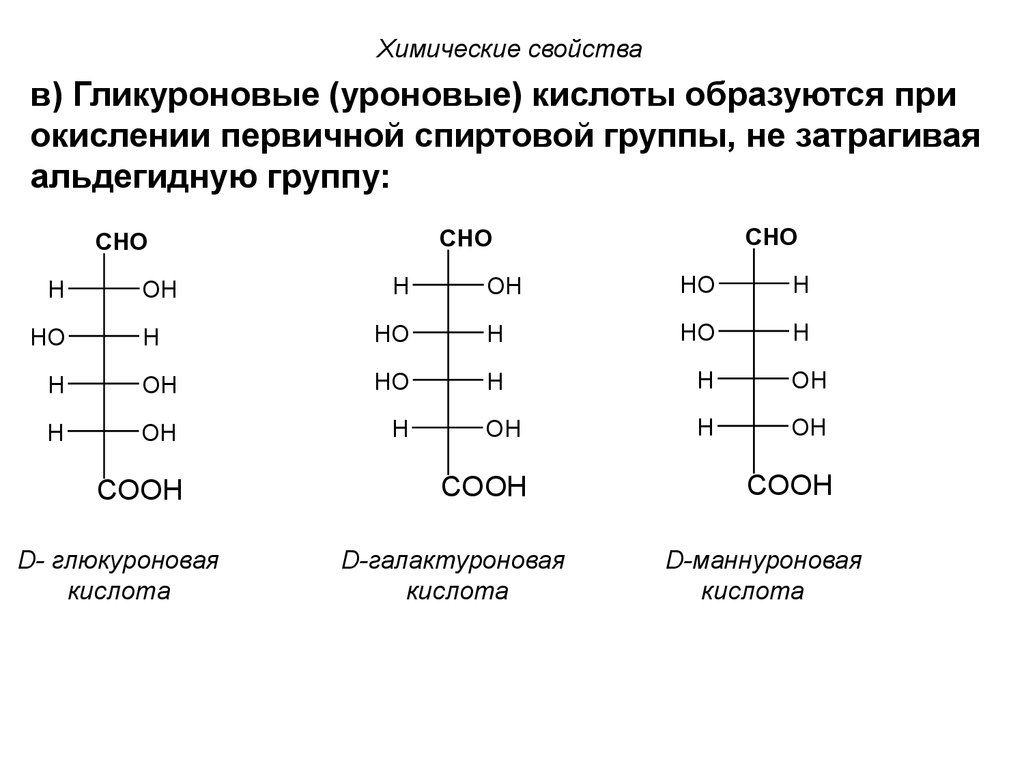
Химические свойствав) Гликуроновые (уроновые) кислоты образуются при
окислении первичной спиртовой группы, не затрагивая
альдегидную группу:
H
OH
CHO
CHO
CHO
H
OH
HO
H
H
H
HO
H
HO
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
HO
COOH
D- глюкуроновая
кислота
COOH
D-галактуроновая
кислота
COOH
D-маннуроновая
кислота
108.
Химические свойстваГликуроновые (уроновые) кислоты образуются при
окислении первичной спиртовой группы, не затрагивая
альдегидную группу:
H
OH
CHO
CHO
CHO
H
OH
HO
H
H
H
HO
H
HO
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
HO
COOH
глюкуроновая
кислота
COOH
галактуроновая
кислота
COOH
маннуроновая
кислота
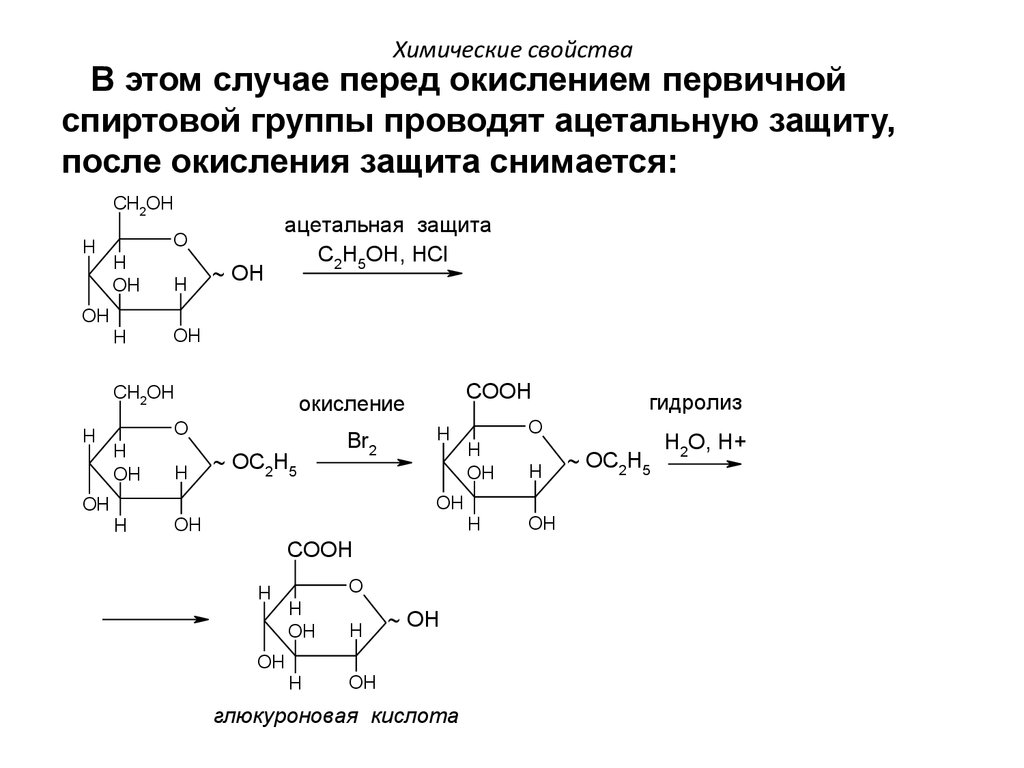
109. Химические свойства
В этом случае перед окислением первичнойспиртовой группы проводят ацетальную защиту,
после окисления защита снимается:
CH2OH
H
O
H
OH
H
H
OH
OH
~ OH
ацетальная защита
C2H5OH, HCl
CH2OH
H
O
H
OH
COOH
окисление
H
~ OC2H5
Br2
H
O
H
OH
H
H
OH
OH
OH
H
OH
COOH
H
O
H
OH
H
H
OH
OH
~ OH
глюкуроновая кислота
гидролиз
~ OC2H5
H2O, H+
110.
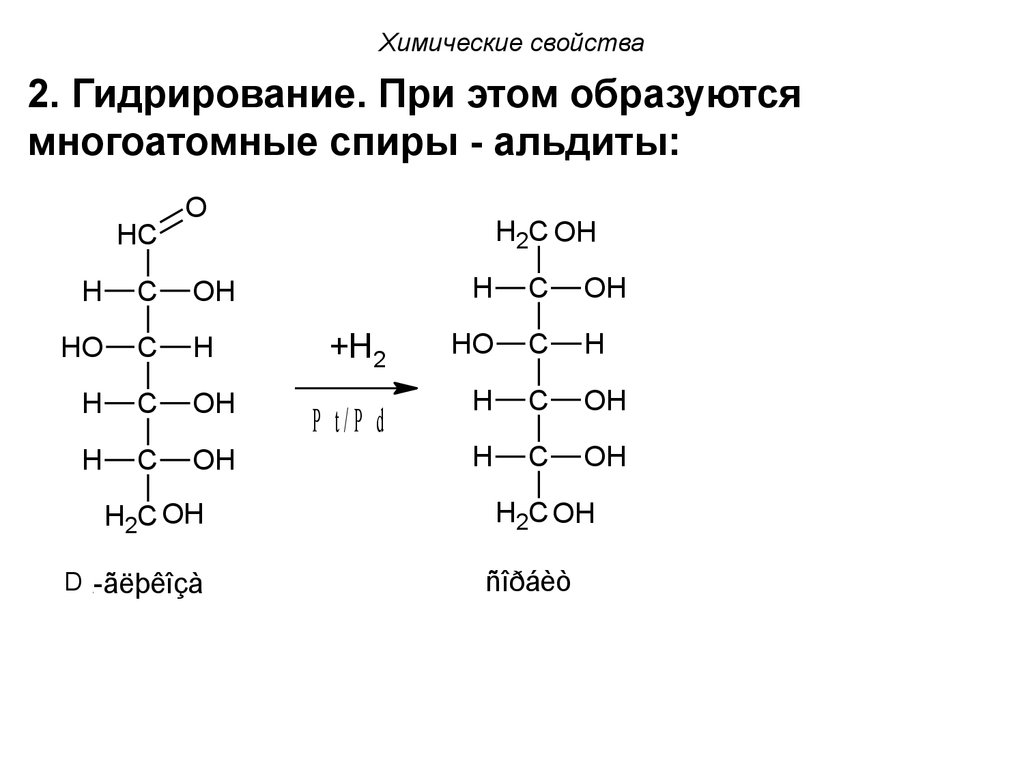
Химические свойства2. Гидрирование. При этом образуются
многоатомные спиры - альдиты:
HC
O
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H2C OH
DÄ-ãëþêîçà
H2C OH
+H2
P t/P d
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H2C OH
ñîðáèò
111.
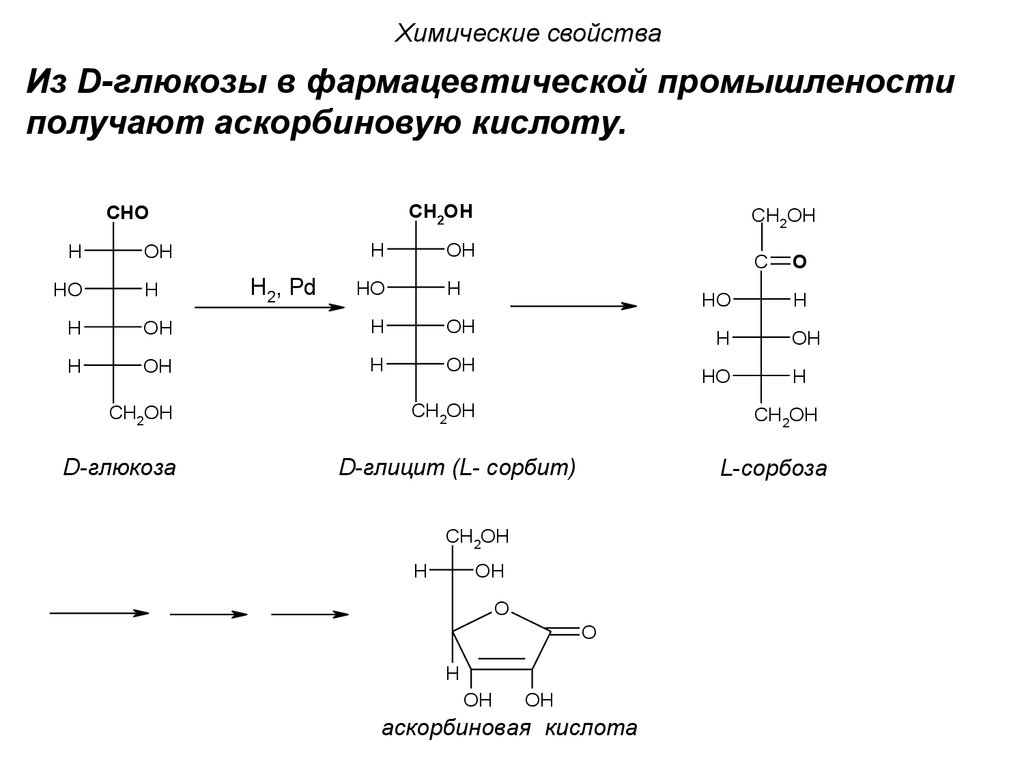
Химические свойстваD-глюкоза образует глицит (сорбит, E420),
D-манноза - маннит, D-ксилоза - ксилит
(E967), D-галактоза - дульцит.
112.
Химические свойстваИз D-глюкозы в фармацевтической промышлености
получают аскорбиновую кислоту.
CH2OH
CHO
H
HO
H
OH
H
H2, Pd
HO
H
H
OH
H
OH
H
OH
H
HO
CH2OH
H
OH
H
L-сорбоза
CH2OH
OH
O
O
H
OH
O
CH2OH
D-глицит (L- сорбит)
H
C
HO
OH
D-глюкоза
Acetobacter
suboxydans
OH
H
CH2OH
CH2OH
OH
аскорбиновая кислота
113.
Химические свойстваАскорбиновая кислота
(а – отрицающая
частица и scorbutus –
цинга) (витамин С) водорастворимый
витамин.
114.
Химические свойстваАскорбиновая кислота
также используется в
аналитической химии в
аскорбинометрии, которую
применяют для определения
Fe(III), Hg(II), Au(III), Pt(IV), Ag(I),
Ce(IV), Mo(VI), W(VI), I2, Br2,
хлоратов, броматов,
иодатов, ваданатов,
дихроматов, а также нитронитрозо-, азо- и иминогрупп в
органических соединениях.
115.
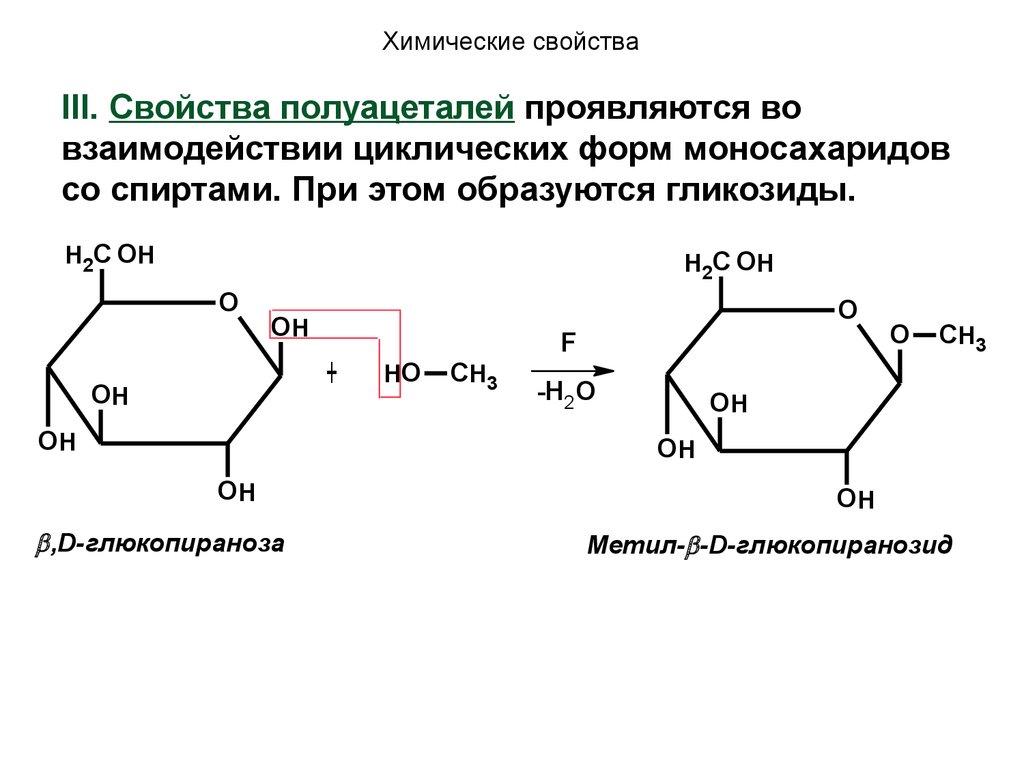
Химические свойстваIII. Свойства полуацеталей проявляются во
взаимодействии циклических форм моносахаридов
со спиртами. При этом образуются гликозиды.
H2C OH
H2C OH
O
O
OH
+
OH
OH
F
HO
CH3
-H2O
O
CH3
OH
OH
OH
,D-глюкопираноза
OH
Метил- -D-глюкопиранозид
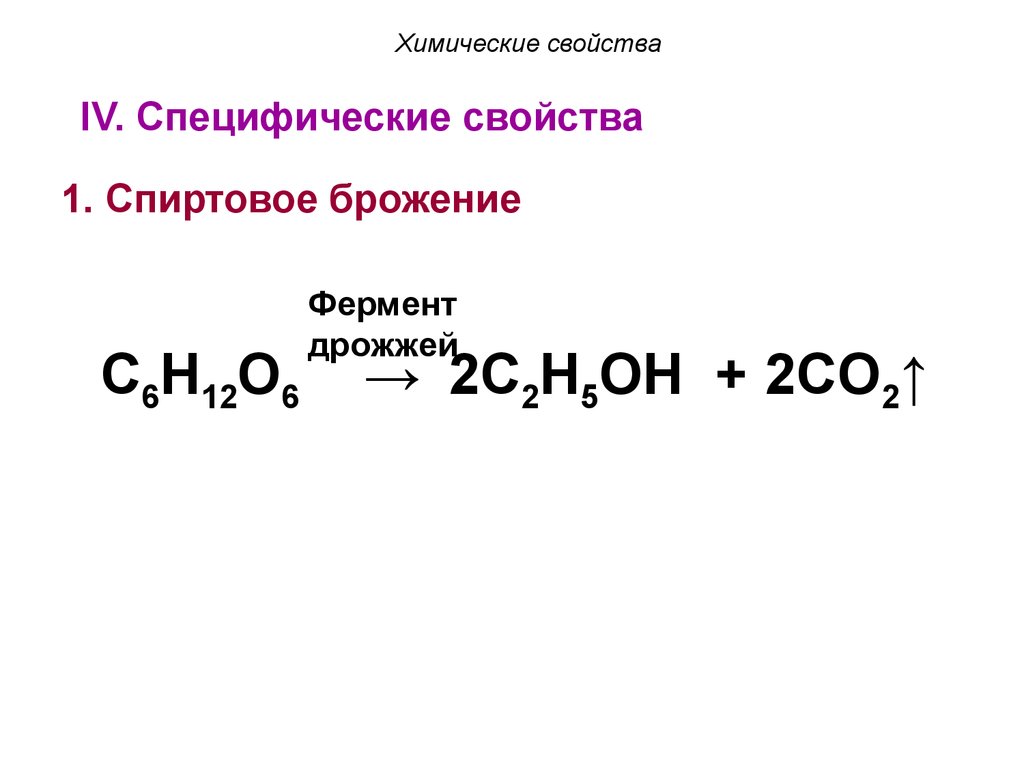
116. IV. Специфические свойства
Химические свойстваIV. Специфические свойства
1. Спиртовое брожение
C6H12O6
Фермент
дрожжей
→ 2C2H5OH + 2CO2↑
117.
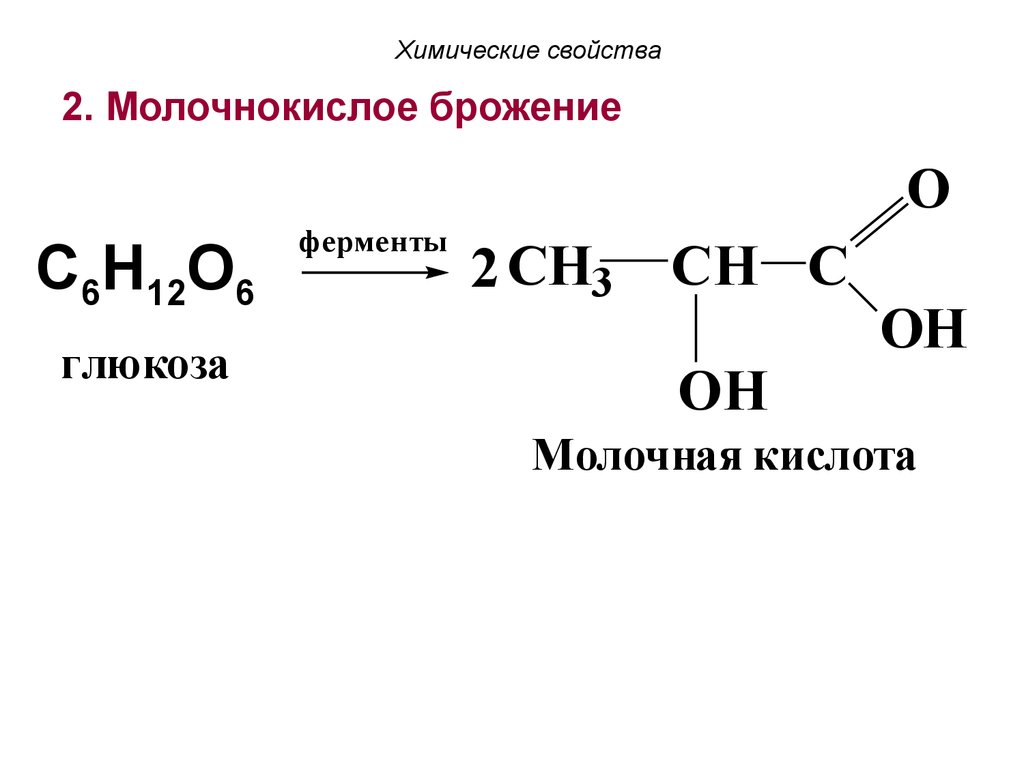
Химические свойства2. Молочнокислое брожение
O
CC66HH122O66
глюкоза
ферменты
2 CH3
CH C
OH
OH
Молочная кислота
118. Вопросы для самоконтроля
1. Перечислите биологически важныеальдопентозы, альдогексозы и
кетогексозы.
2. Охарактеризуйте кольчато-цепную
таутомерию.
3. Какое явление называют
мутаротацией?
4. Охарактеризуйте химические
свойства моносахаридов.
5. Перечислите биологически важные
производные моносахаридов.
119.
СПАСИБОЗА ВАШЕ ВНИМАНИЕ!































































 Биология
Биология Химия
Химия