Похожие презентации:
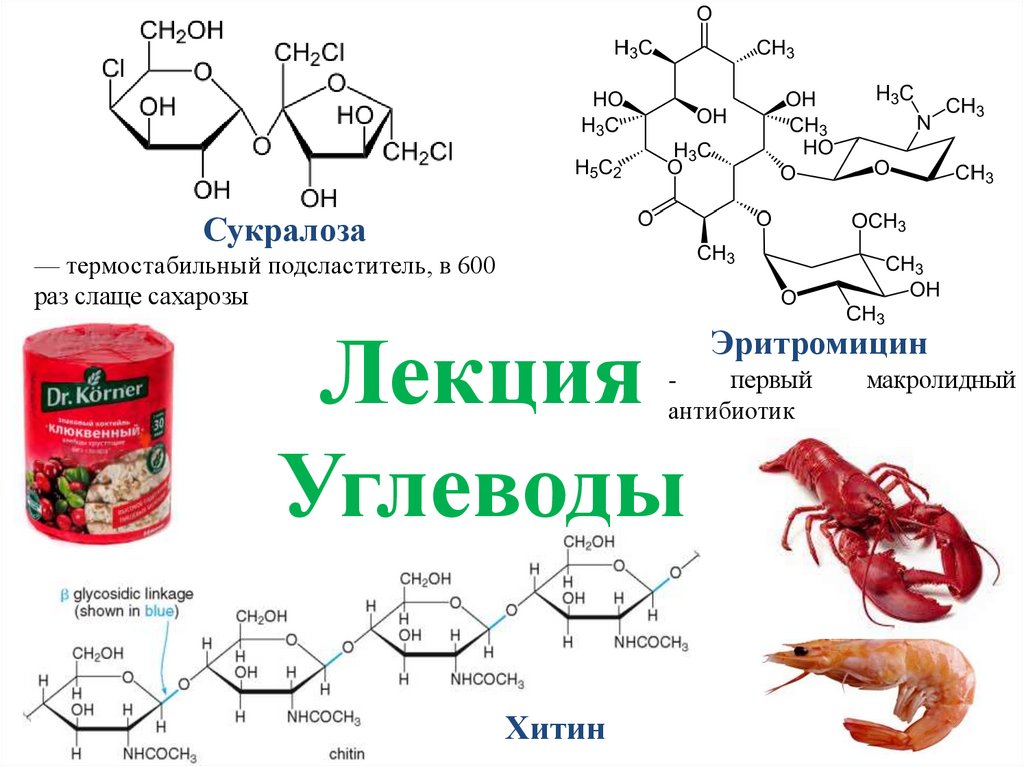
Углеводы. Сукралоза
1. Лекция Углеводы
Сукралоза— термостабильный подсластитель, в 600
раз слаще сахарозы
Лекция
Углеводы
Эритромицин
первый
антибиотик
Хитин
макролидный
2. Углеводы
• Углеводы - полигидроксиальдегиды илиполигидроксикетоны, или соединение, которое
при гидролизе дает одно из этих соединений.
• Моносахариды - углеводы, которые не могут быть
гидролизованы до более простого углевода.
• Имеют общую формулу CnH2nOn, где n варьируется
от 3 до 8.
• Не используется номенклатура ИЮПАК, называют
традиционными именами.
– Альдозы: моносахариды, содержащие альдегидную группу.
– Кетозы: моносахариды, содержащие кетонную группу.
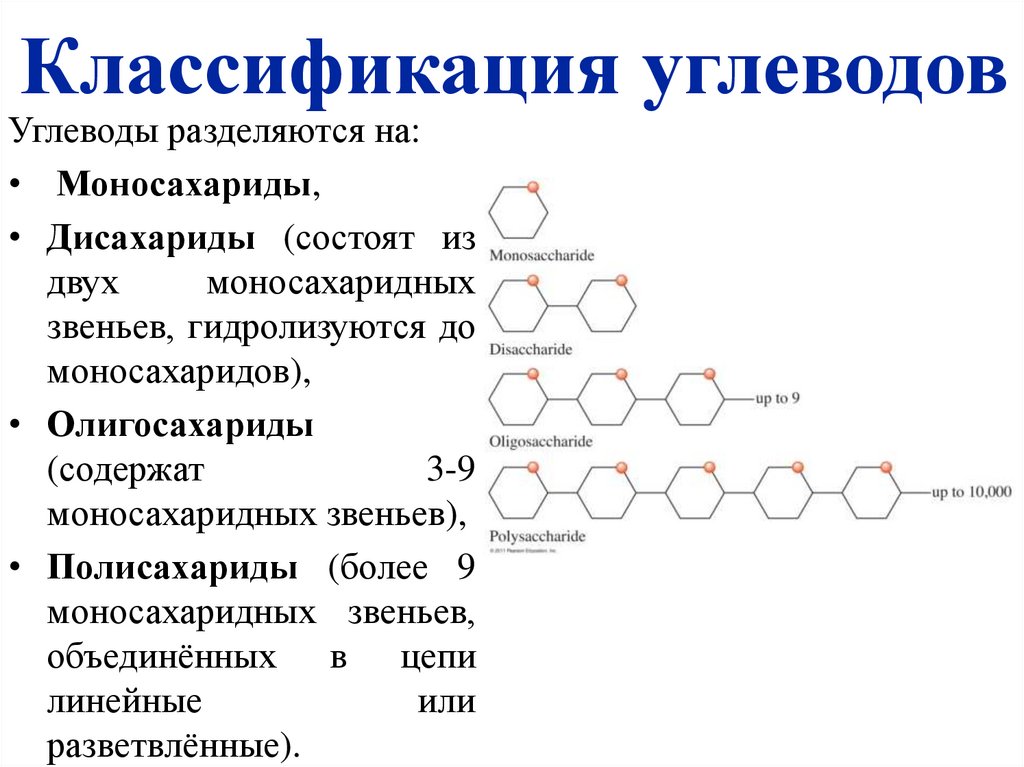
3. Классификация углеводов
Углеводы разделяются на:• Моносахариды,
• Дисахариды (состоят из
двух
моносахаридных
звеньев, гидролизуются до
моносахаридов),
• Олигосахариды
(содержат
3-9
моносахаридных звеньев),
• Полисахариды (более 9
моносахаридных звеньев,
объединённых в цепи
линейные
или
разветвлённые).
4.
Моносахариды• Моносахариды классифицируют по количеству
углеродных атомов в молекуле.
N ame
Trios e
Tetros e
Formula
C3 H6 O3
C4 H8 O4
Pen tos e
Hexose
C5 H1 0 O5
Heptose
Octose
C7 H1 4 O7
C8 H1 6 O8
C6 H1 2 O6
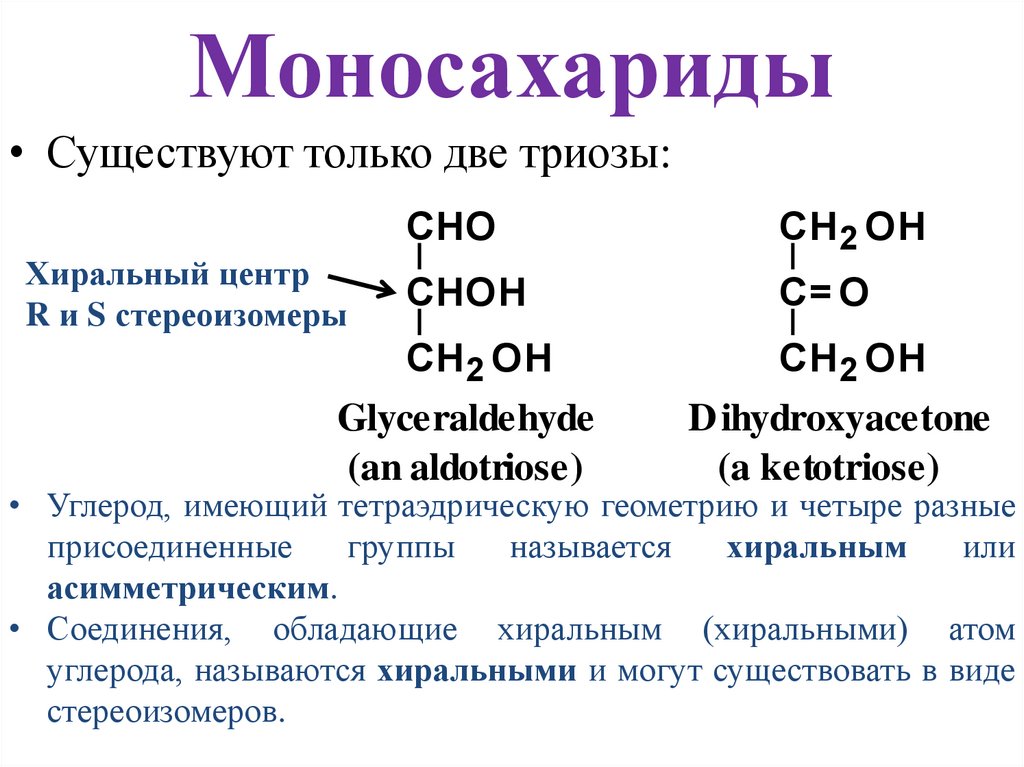
5. Моносахариды
• Существуют только две триозы:Хиральный центр
R и S стереоизомеры
CHO
CH2 OH
CHOH
C= O
CH2 OH
CH2 OH
Glyceraldehyde
(an aldotriose)
D ihydroxyacetone
(a ketotriose)
• Углерод, имеющий тетраэдрическую геометрию и четыре разные
присоединенные
группы
называется
хиральным
или
асимметрическим.
• Соединения, обладающие хиральным (хиральными) атом
углерода, называются хиральными и могут существовать в виде
стереоизомеров.
6.
Проекция Фишера• Проекция
Фишера:
двухмерное
представление
конфигурации углеводов.
• Горизонтальные
линии
представляют
углероды,
выступающие из плоскости листа вперёд.
• Вертикальные линии представляют собой углероды,
выступающие из плоскости листа назад.
• Наверху показан наиболее окисленный углерод.
CHO
H
C
OH
convert to a
Fisch er p rojection
CH2 OH
CHO
H
OH
CH2 OH
.
(R)-Glycerald ehyde
(three-dimensional
represen tation )
(R)-Glyceraldeh yd e
(Fis cher projection)
7. Проекция Фишера
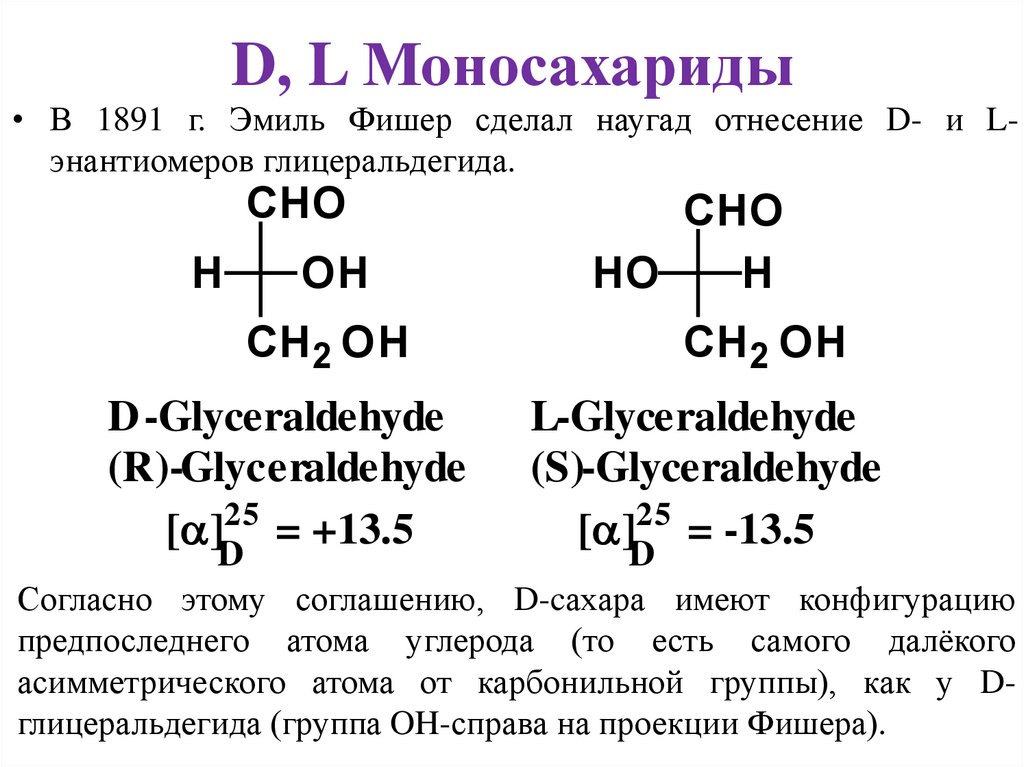
D, L Моносахариды• В 1891 г. Эмиль Фишер сделал наугад отнесение D- и Lэнантиомеров глицеральдегида.
CHO
H
OH
CHO
HO
H
CH2 OH
D -Glyceraldehyde
(R)-Glyceraldehyde
[ ]25 = +13.5
D
CH2 OH
L-Glyceraldehyde
(S)-Glyceraldehyde
[ ]25 = -13.5
D
Согласно этому соглашению, D-cахара имеют конфигурацию
предпоследнего атома углерода (то есть самого далёкого
асимметрического атома от карбонильной группы), как у Dглицеральдегида (группа OH-справа на проекции Фишера).
8.
Хиральность глицеральдегида• Глицеральдегид имеет асимметрический атом
углерода и может существовать в виде двух изомеров
(энантиомеров).
– D изомер имеет -OH группу при стереоцентре справа.
– L изомер имеет -OH группу при стереоцентре слева.
Хиральный
атом
углерода,
соединённый
с
четырьмя разными
заместителями
Плоскость зеркала
O
C
H
H C OH
CH2OH
the D isomer
O
C
H
HO C H
CH2OH
the L isomer
9. Хиральность глицеральдегида
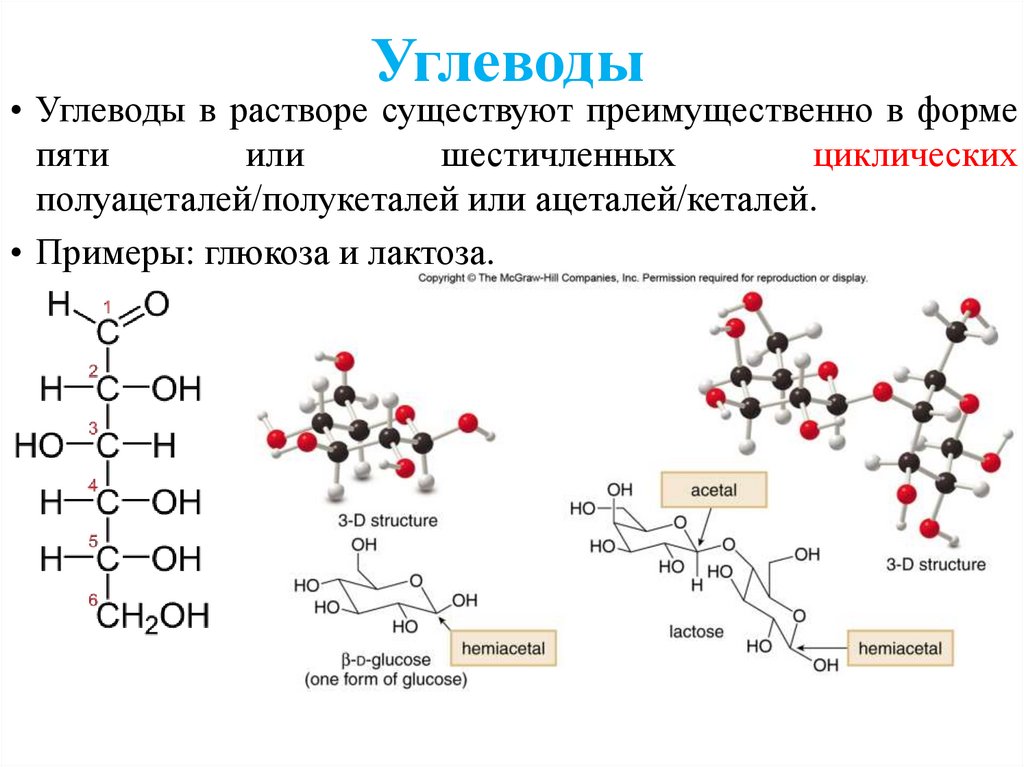
Углеводы• Углеводы в растворе существуют преимущественно в форме
пяти
или
шестичленных
циклических
полуацеталей/полукеталей или ацеталей/кеталей.
• Примеры: глюкоза и лактоза.
10.
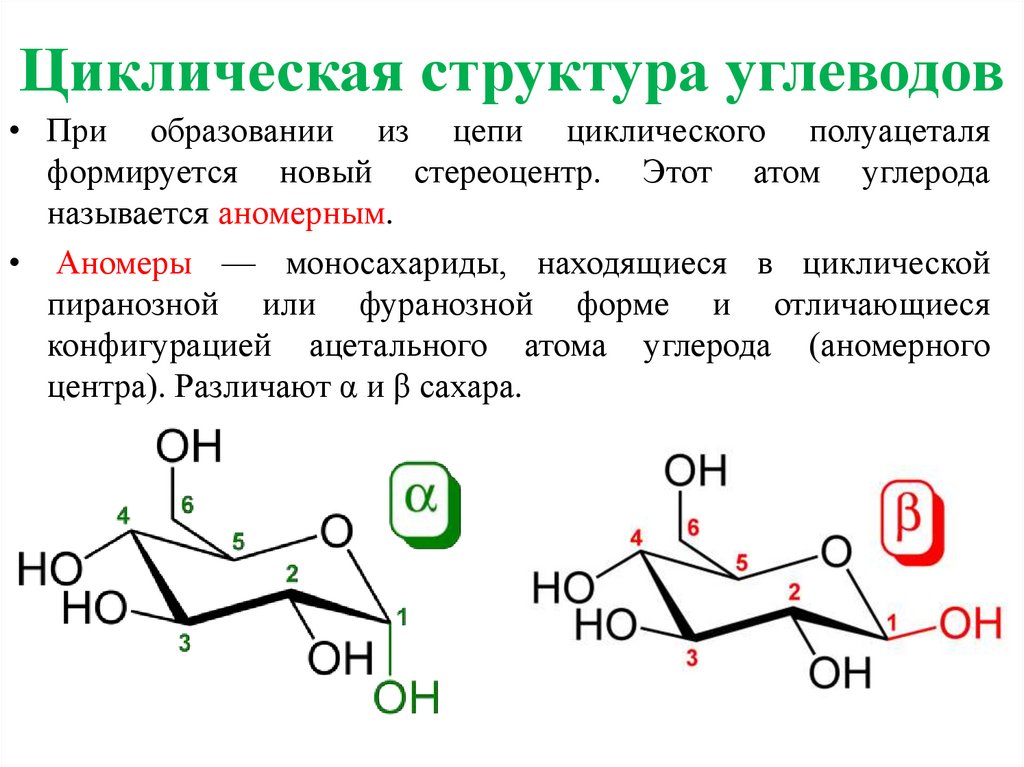
Циклическая структура углеводов• При образовании из цепи циклического полуацеталя
формируется новый стереоцентр. Этот атом углерода
называется аномерным.
• Аномеры — моносахариды, находящиеся в циклической
пиранозной или фуранозной форме и отличающиеся
конфигурацией ацетального атома углерода (аномерного
центра). Различают α и β сахара.
11. Циклическая структура углеводов
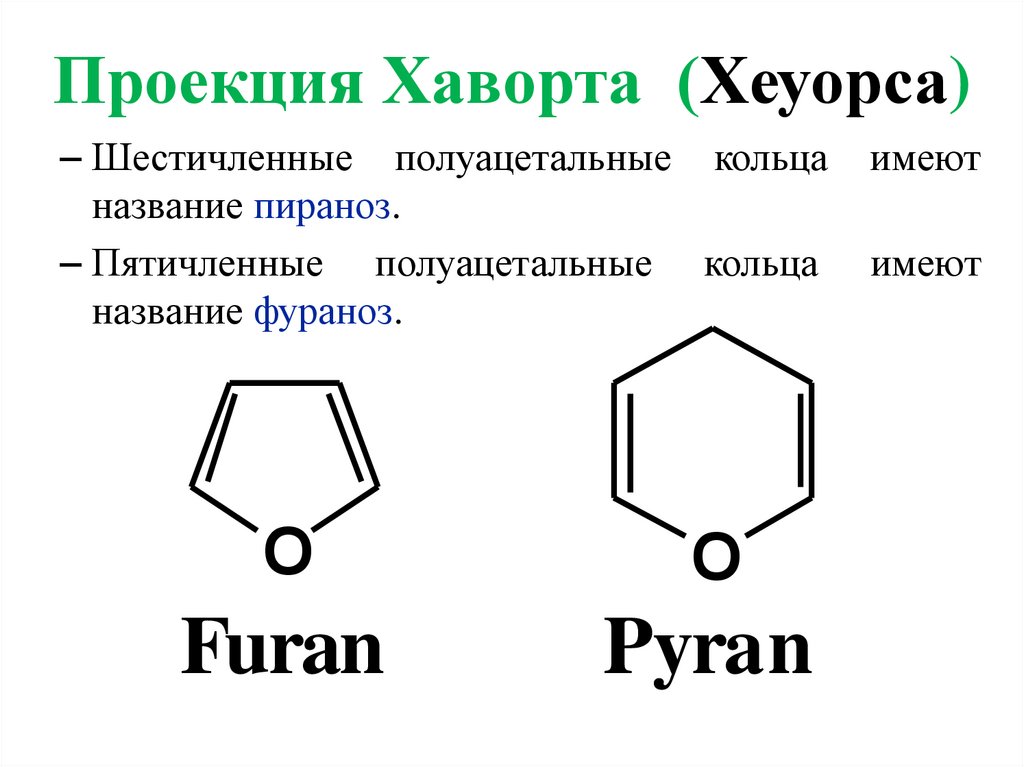
Проекция Хаворта (Хеуорса)– Шестичленные полуацетальные кольца
название пираноз.
– Пятичленные полуацетальные кольца
название фураноз.
O
O
Furan
Pyran
имеют
имеют
12.
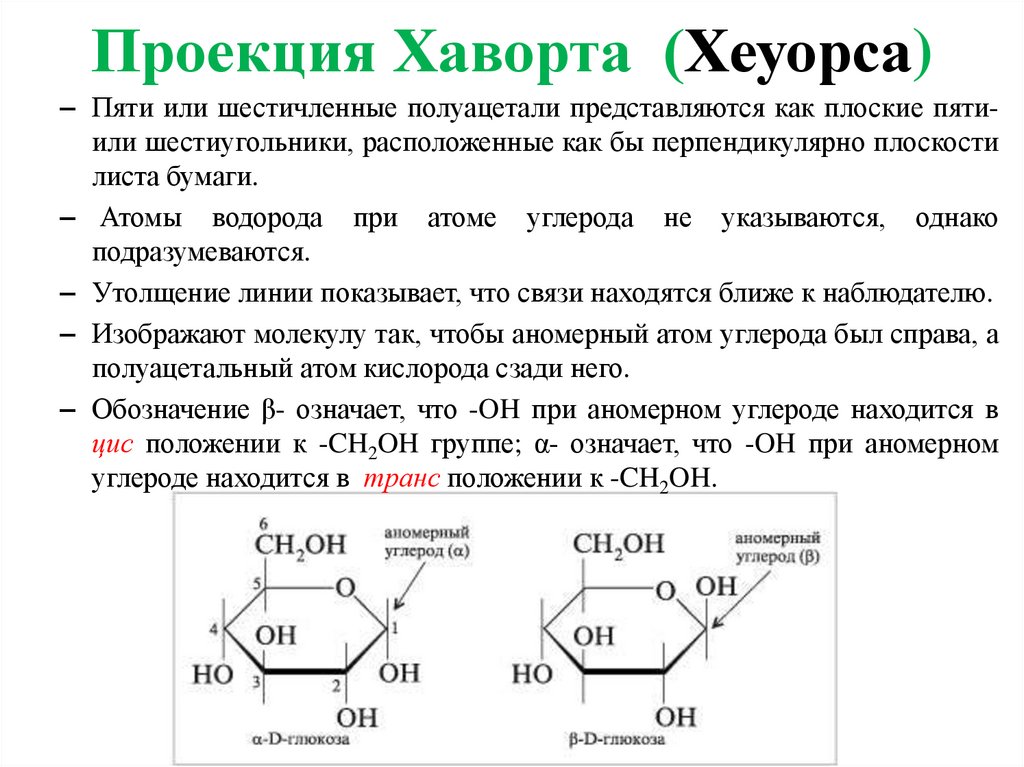
Проекция Хаворта (Хеуорса)– Пяти или шестичленные полуацетали представляются как плоские пятиили шестиугольники, расположенные как бы перпендикулярно плоскости
листа бумаги.
– Атомы водорода при атоме углерода не указываются, однако
подразумеваются.
– Утолщение линии показывает, что связи находятся ближе к наблюдателю.
– Изображают молекулу так, чтобы аномерный атом углерода был справа, а
полуацетальный атом кислорода сзади него.
– Обозначение β- означает, что -OH при аномерном углероде находится в
цис положении к -CH2OH группе; α- означает, что -OH при аномерном
углероде находится в транс положении к -CH2OH.
13. Проекция Хаворта (Хеуорса)
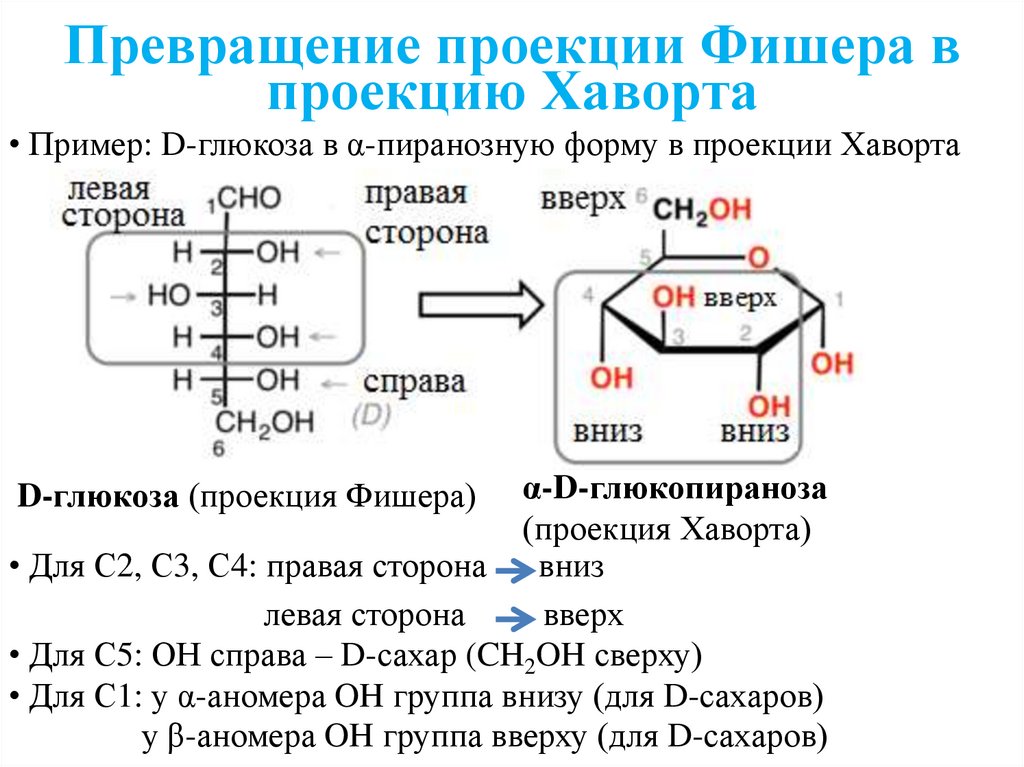
Превращение проекции Фишера впроекцию Хаворта
• Пример: D-глюкоза в α-пиранозную форму в проекции Хаворта
α-D-глюкопираноза
(проекция Хаворта)
• Для С2, С3, С4: правая сторона вниз
левая сторона
вверх
• Для С5: ОН справа – D-сахар (CH2OH сверху)
• Для С1: у α-аномера OH группа внизу (для D-сахаров)
у β-аномера OH группа вверху (для D-сахаров)
D-глюкоза (проекция Фишера)
14.
Химические реакции моносахаридов1. Мутаротация
2. Образование гликозидов
3. Восстановление
4. Окисление
5. Образование озазонов
6. Эпимеризация/изомеризация
7. Удлинение и укорочение углеродной
цепи
8. Дегидратация
9. Другие
15.
16.
Мутаротация• изменение величины оптического вращения растворов
оптически активных соединений вследствие взаимного
перехода аномеров вещества друг в друга.
[ ]
Mon os accharide
[ ] after
% Present at
Mutarotation Equ ilib riu m
-D -glu cose
-D -glucos e
+112.0
+18.7
+52.7
+52.7
36
-D -galactos e
-D -galactose
+150.7
+52.8
+80.2
28
72
HO
HO
CH2 OH
O
OH
-D -Glu cop yranose
25
[ ] D +18.7
OH ( )
64
+80.2
HO
HO
CH2 OH
O
HO
OH ( )
-D -Glucopyranose
25
[ ] D +112
17.
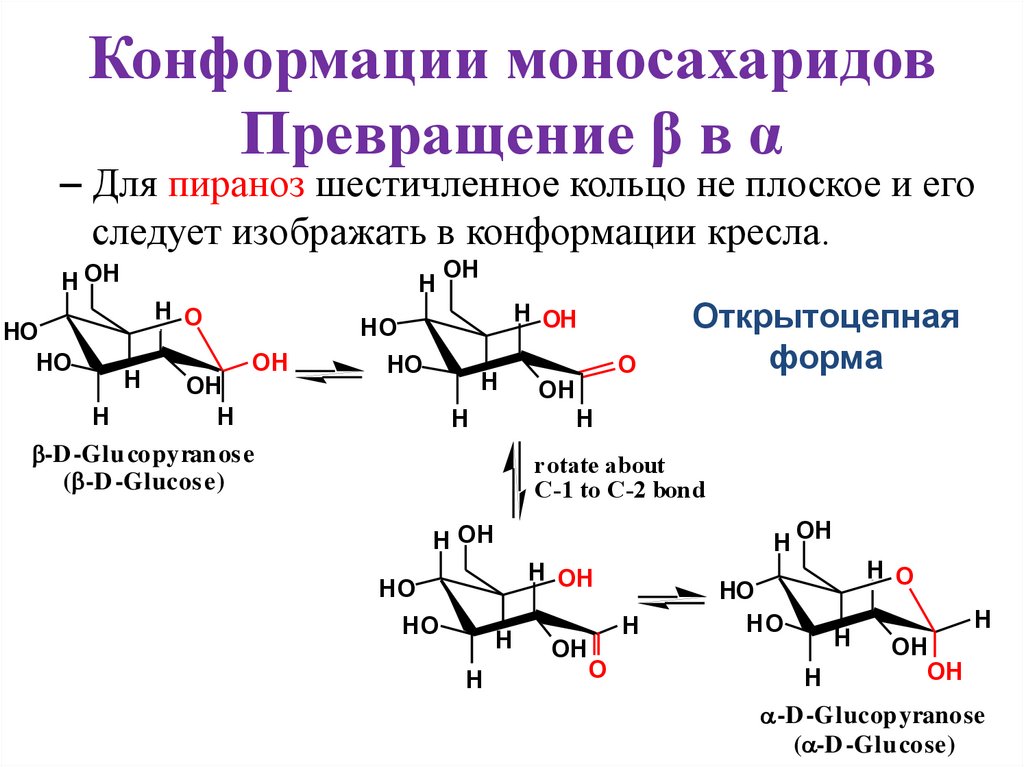
Конформации моносахаридовПревращение β в α
– Для пираноз шестичленное кольцо не плоское и его
следует изображать в конформации кресла.
H OH
H
H O
HO
HO
H
H
OH
H
OH
H OH
HO
OH
HO
H
H
O
Открытоцепная
форма
OH
H
-D -Glu copyran os e
( -D -Glucos e)
rotate about
C-1 to C-2 bond
H OH
H
H OH
HO
HO
H
H
OH
H
O
OH
H O
HO
HO
H
H
H
OH
OH
-D -Glucop yranose
( -D -Glu cose)
18. Мутаротация
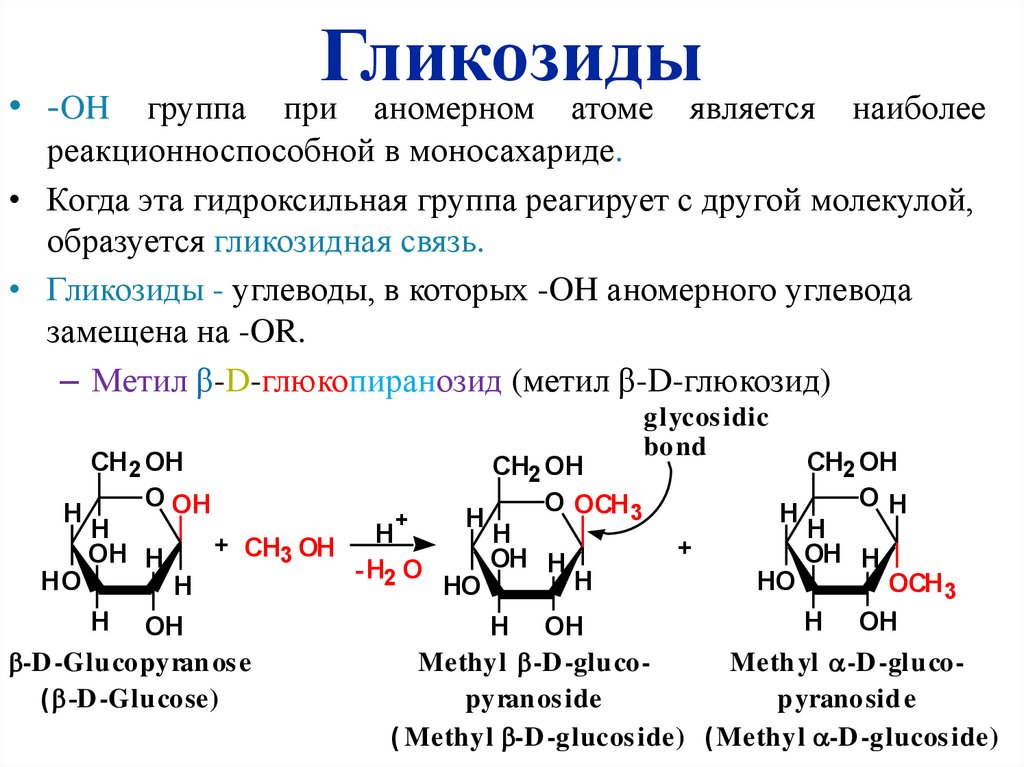
• -OH группаГликозиды
при аномерном атоме является
наиболее
реакционноспособной в моносахариде.
• Когда эта гидроксильная группа реагирует с другой молекулой,
образуется гликозидная связь.
• Гликозиды - углеводы, в которых -OH аномерного углевода
замещена на -OR.
– Метил β-D-глюкопиранозид (метил β-D-глюкозид)
glycos idic
bond
CH 2 OH
CH2 OH
CH2 OH
O OH
OH
O OCH 3
H
H
+
H
H
H
H
H
+
CH
OH
+
OH H
3
OH H
OH H
-H
O
2
HO
H
HO
OCH 3
H
HO
H OH
H OH
H OH
-D -Glu copyran os e
Methyl -D -glu coMeth yl -D -glu co( -D -Glu cose)
pyran os ide
p yranosid e
( Methyl -D -glucos ide) (Methyl -D -glucos ide)
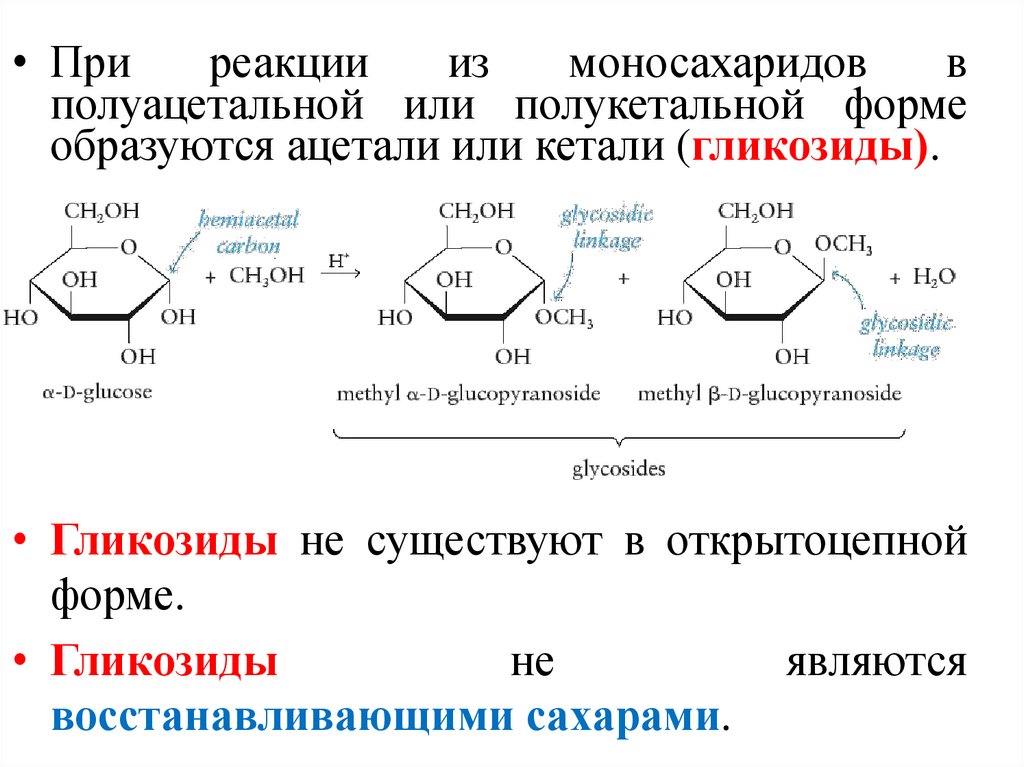
19. Конформации моносахаридов Превращение β в α
• Приреакции
из
моносахаридов
в
полуацетальной или полукетальной форме
образуются ацетали или кетали (гликозиды).
• Гликозиды не существуют в открытоцепной
форме.
• Гликозиды
не
являются
восстанавливающими сахарами.
20. Гликозиды
• Гликозидная связь: связь аномерного атомауглерода гликозида с -OR группой.
• Гликозиды называют, указывая алкильный или
арильный заместитель, связанный с кислородом,
далее название углевода заменяя -оза на -озид.
– Метил α-D-глюкопиранозид
– Метил β-D-рибофуранозид
21.
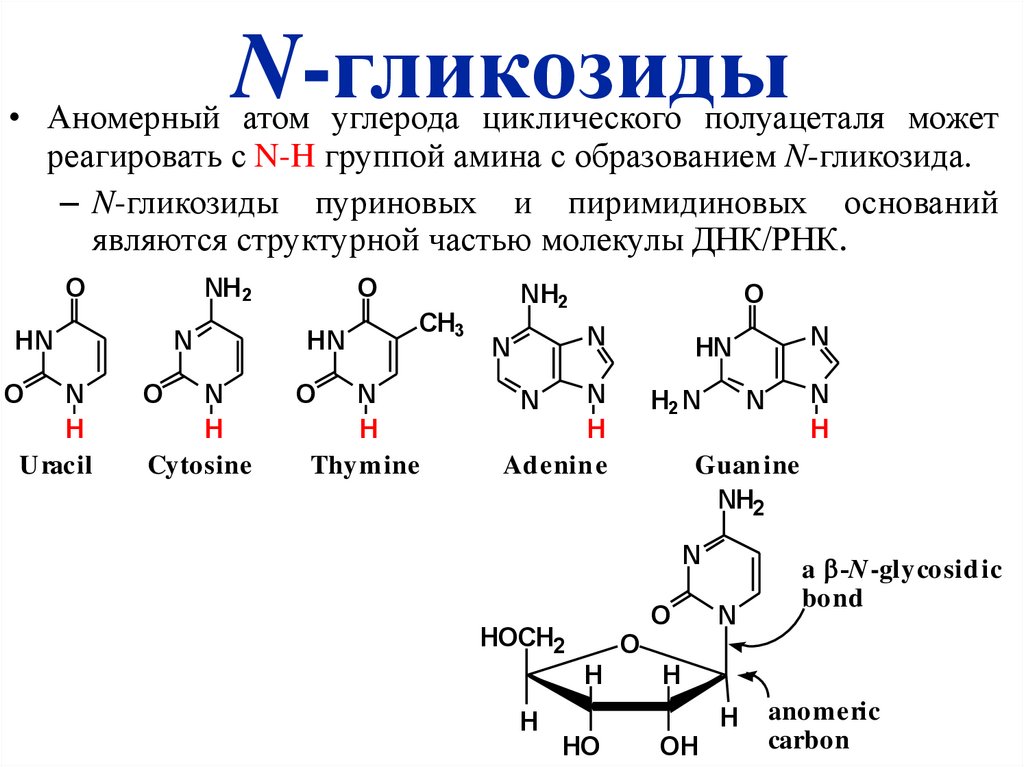
N-гликозиды• Аномерный атом углерода циклического полуацеталя может
реагировать с N-H группой амина с образованием N-гликозида.
– N-гликозиды пуриновых и пиримидиновых оснований
являются структурной частью молекулы ДНК/РНК.
O
NH2
HN
O
N
H
U racil
N
O
N
H
Cytosine
O
HN
O
NH2
CH3
N
H
Thymine
O
N
N
N
H
Ad enin e
N
H2 N
Guan ine
NH2
O
N
a -N -glycosid ic
bond
O
H
H
N
H
N
N
HOCH2
N
HN
H
H
HO
OH
anomeric
carbon
22.
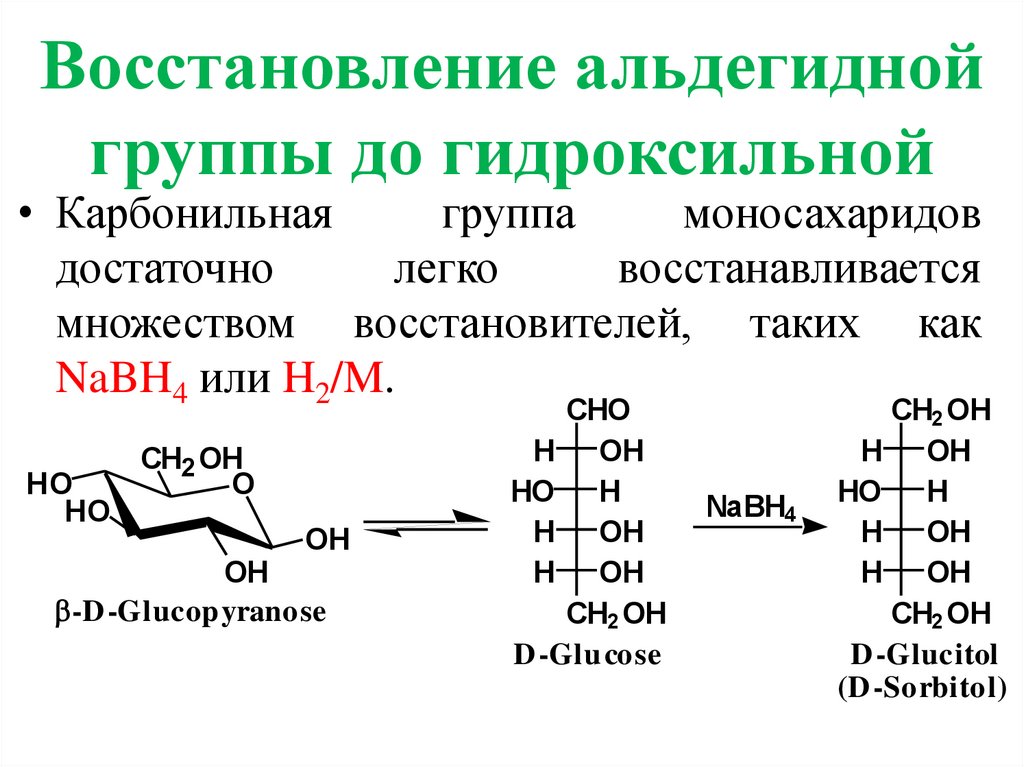
Восстановление альдегиднойгруппы до гидроксильной
• Карбонильная
группа
моносахаридов
достаточно
легко
восстанавливается
множеством восстановителей, таких как
NaBH4 или H2/M.
HO
HO
CH2 OH
O
OH
OH
-D -Glucop yranose
CHO
H OH
HO H
H OH
H OH
CH2 OH
D -Glu cose
NaBH4
CH2 OH
H OH
HO H
H OH
H OH
CH2 OH
D -Glucitol
(D -Sorbitol)
23.
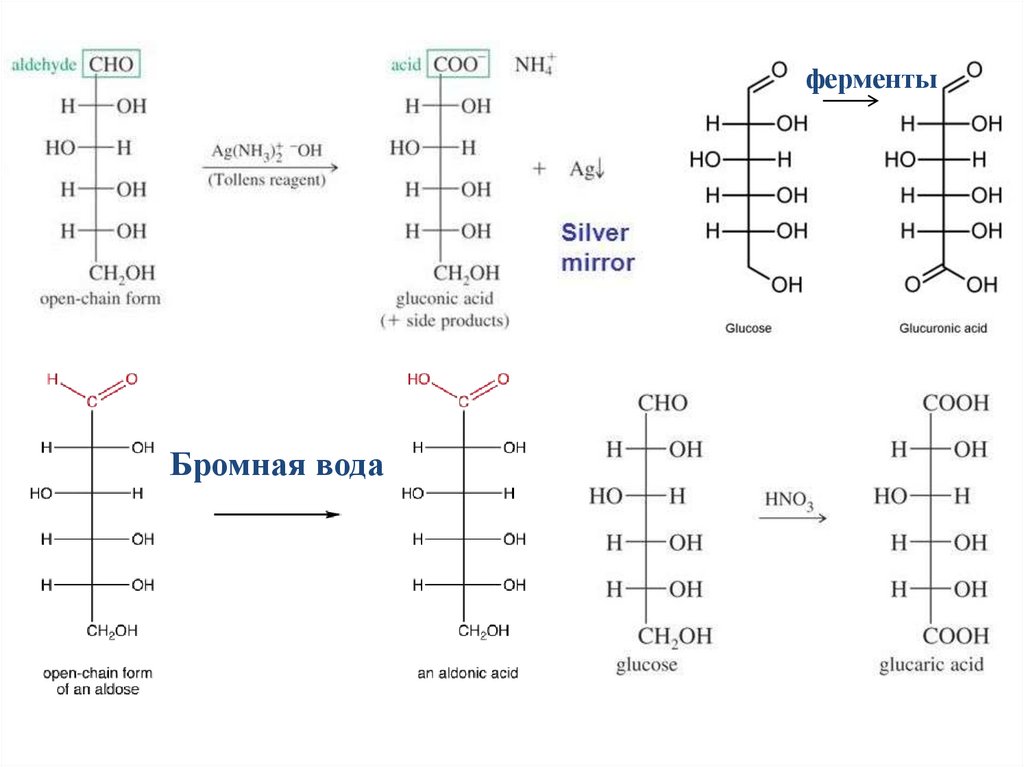
ОкислениеРезультат зависит от используемого окислителя:
Реагент Толленса (аммиачный раствор оксида серебра)
или реактив Фелинга (Cu2+ тартратный комплекс)
окисляет до соли монокарбоновых кислот (альдоновые
кислоты).
Бромная вода окисляет альдозы (не кетозы) до
монокарбоновых кислот (альдоновые кислоты).
Азотная кислота окисляет альдозы до дикарбоновых
кислот (альдариновые кислоты).
Ферменты катализируют окисление терминальной OH
до монокарбоновых кислот (уроновые кислоты).
Иодная кислота разрушает C-C связи.
24. Восстановление альдегидной группы до гидроксильной
ферментыБромная вода
25. Окисление
Восстанавливающие сахара• Сахара с альдегидной (кетонной) группой в растворе.
Группа может быть окислена с помощью реактива
Толленса или Фелинга.
• 2-кетозы также окисляются реактивом Толленса
благодаря конверсии в альдегиды.
CH2 OH
(1)
C= O
( CHOH ) n
CH2 OH
A 2-ketose
CHOH
C-OH
(2)
( CHOH ) n
CH2 OH
An enediol
Кето-енольный таутомеризм
CHO
CHOH
(3)
( CHOH ) n
CH2 OH
An aldos e
COOH
CHOH
( CHOH ) n
CH2 OH
An aldonic acid
Окисление
Восстанавливающий сахар
26.
Окисление иодной кислотой HIO4 или H5IO6• Иодная кислота разрывает C-C связи в гликолях.
OH
O - 2 H2 O
+
I
OH
C OH HO
OH
C OH
A 1,2 -diol
HO
Periodic acid
OH
O
I
OH
C O
OH
C O
A cyclic periodic
ester
* E. Brandon Strong et
al. How To Shrink
Paper
Money:
A
Macroscopic
Demonstration of the
Malaprade Reaction // J.
Chem. Educ. 2019, 96,
6, 1199-1204.
C O
+
C O
• Периодатом
натрия
можно купюру сделать в 4
раза меньше начального
размера*.
Периодат
частично разрушает связи
в целлюлозе, окисляя её.
H 3 IO 4
Iodic acid
27.
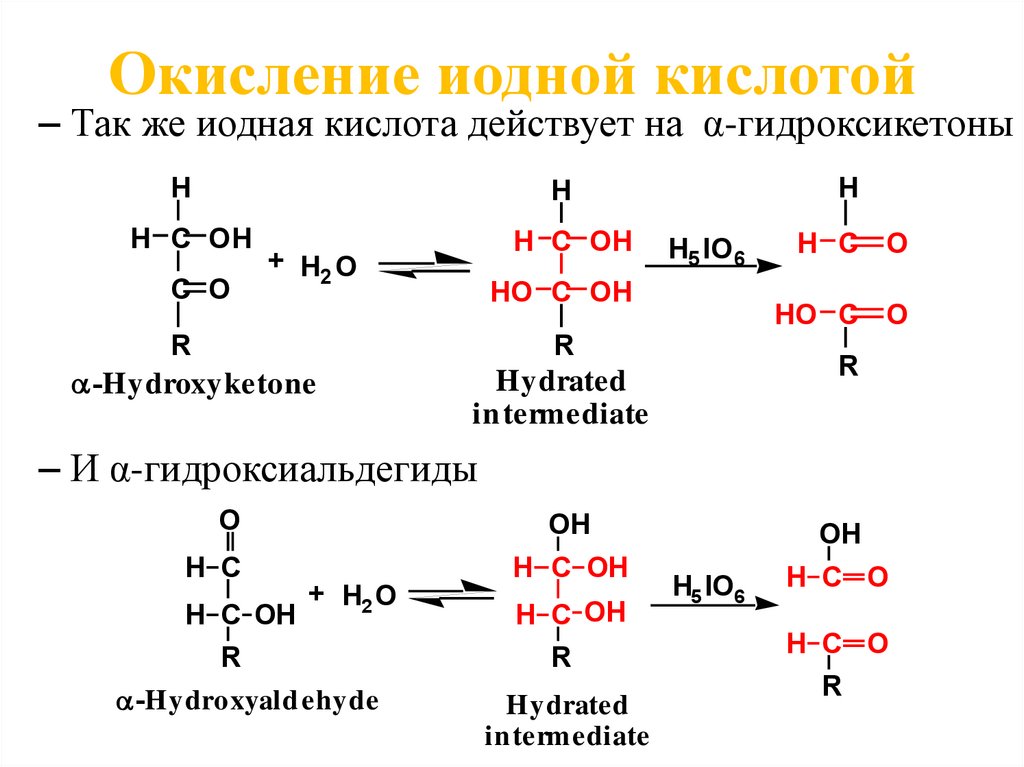
Окисление иодной кислотой– Так же иодная кислота действует на α-гидроксикетоны
H
H
H
H C OH
C O
H C OH
+ H2 O
H5 IO 6
HO C OH
R
HO C O
R
-Hydroxyketone
H C O
R
Hydrated
in termediate
– И α-гидроксиальдегиды
O
H C
H C OH
OH
+ H2 O
R
-Hydroxyald ehyde
H C OH
H C OH
R
Hydrated
in termediate
OH
H5 IO6
H C O
H C O
R
28. Восстанавливающие сахара
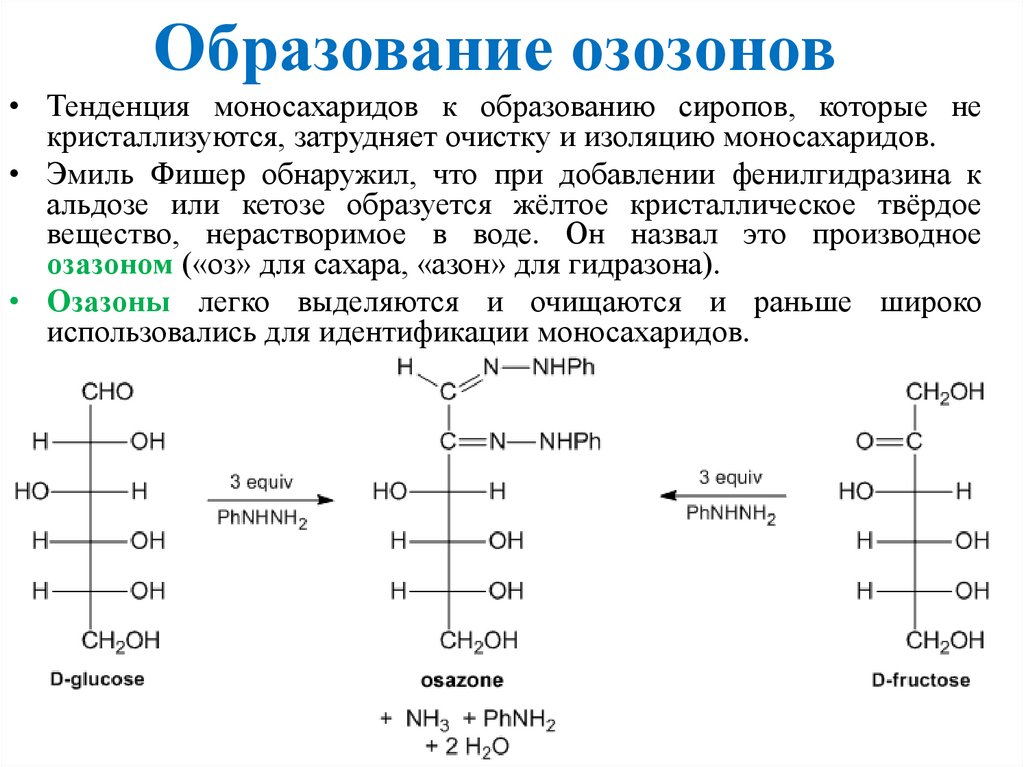
Образование озозонов• Тенденция моносахаридов к образованию сиропов, которые не
кристаллизуются, затрудняет очистку и изоляцию моносахаридов.
• Эмиль Фишер обнаружил, что при добавлении фенилгидразина к
альдозе или кетозе образуется жёлтое кристаллическое твёрдое
вещество, нерастворимое в воде. Он назвал это производное
озазоном («оз» для сахара, «азон» для гидразона).
• Озазоны легко выделяются и очищаются и раньше широко
использовались для идентификации моносахаридов.
29. Окисление иодной кислотой HIO4 или H5IO6
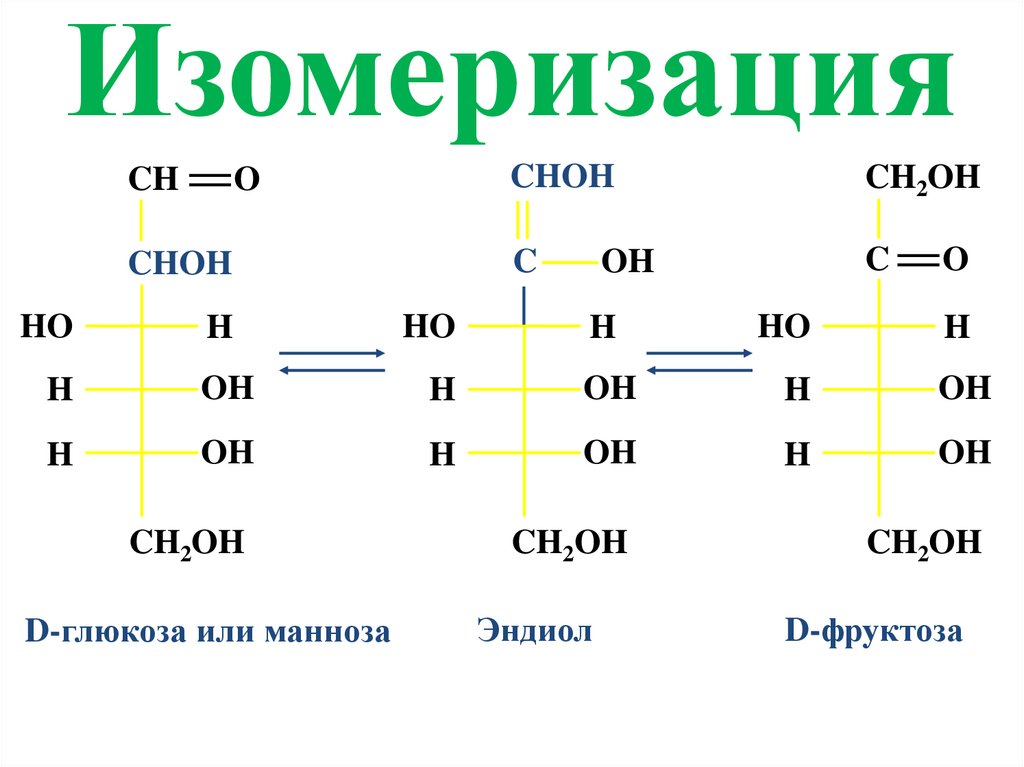
ИзомеризацияCH
O
CHOH
HO
H
HO
CHOH
CH2OH
C
C
OH
H
HO
O
H
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
CH2OH
D-глюкоза или манноза
CH2OH
Эндиол
CH2OH
D-фруктоза
30. Окисление иодной кислотой
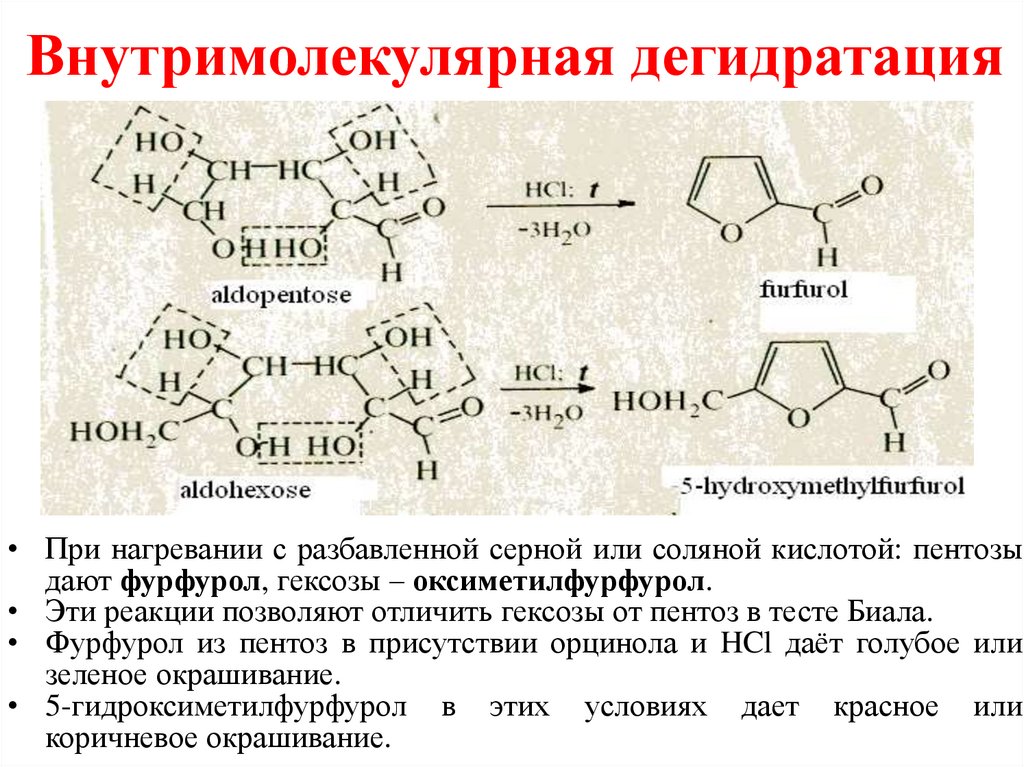
Внутримолекулярная дегидратация• При нагревании с разбавленной серной или соляной кислотой: пентозы
дают фурфурол, гексозы – оксиметилфурфурол.
• Эти реакции позволяют отличить гексозы от пентоз в тесте Биала.
• Фурфурол из пентоз в присутствии орцинола и HCl даёт голубое или
зеленое окрашивание.
• 5-гидроксиметилфурфурол в этих условиях дает красное или
коричневое окрашивание.
31.
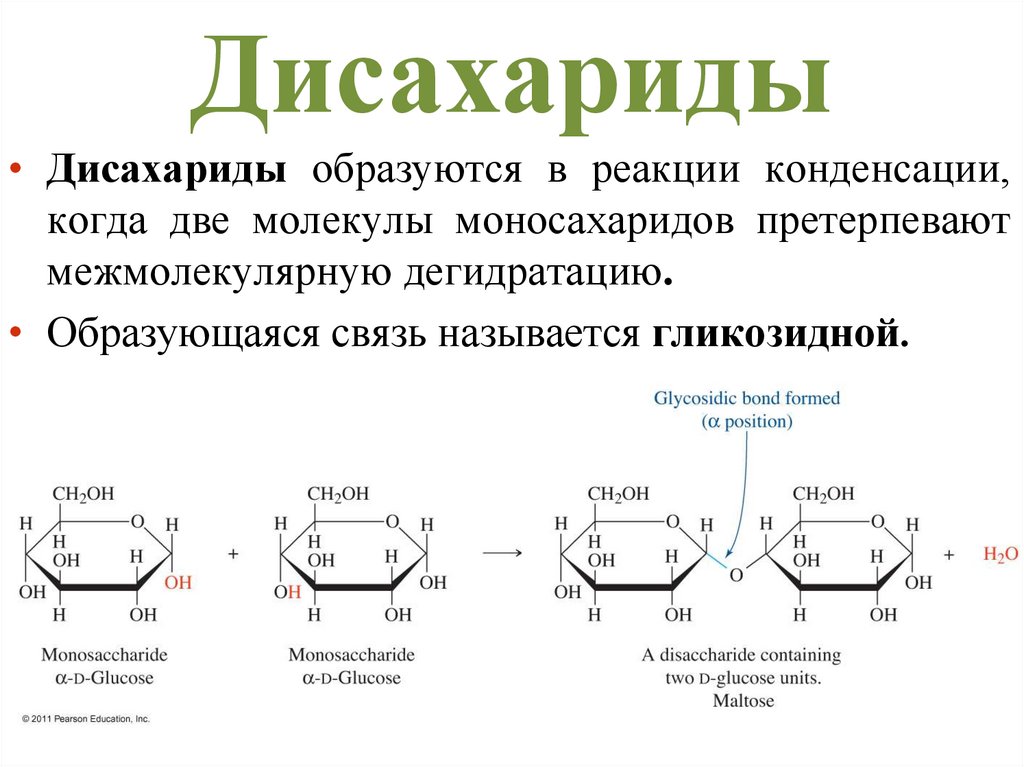
Дисахариды• Дисахариды образуются в реакции конденсации,
когда две молекулы моносахаридов претерпевают
межмолекулярную дегидратацию.
• Образующаяся связь называется гликозидной.
32. Использование озазонов в определении структуры моносахаридов
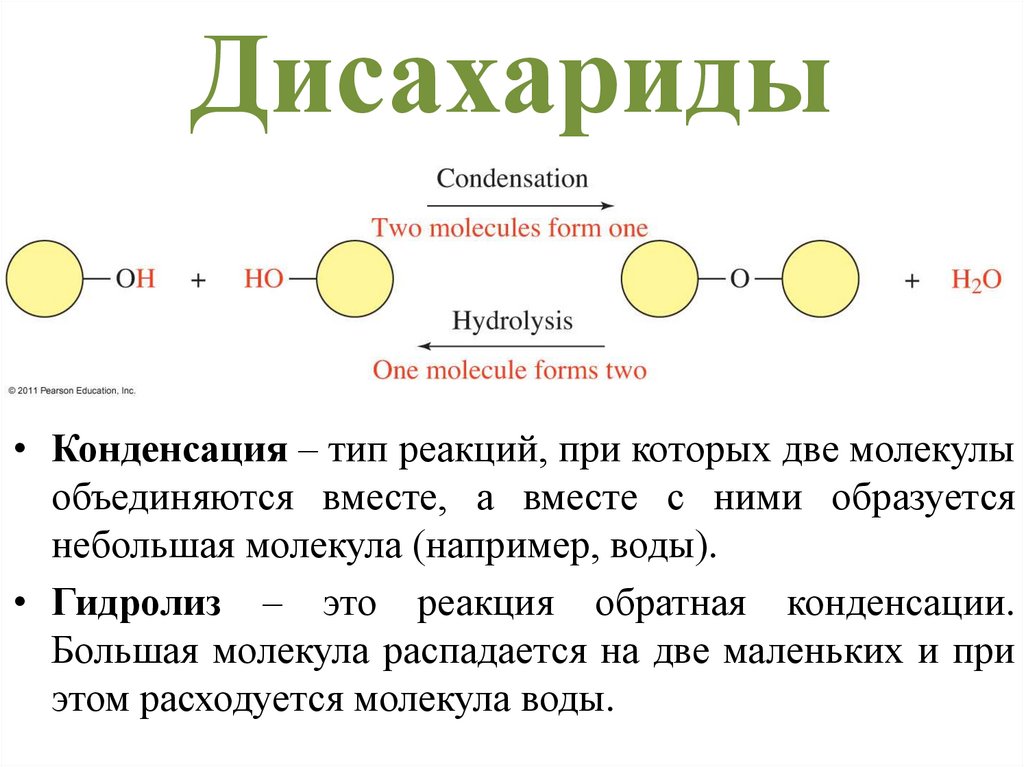
Дисахариды• Конденсация – тип реакций, при которых две молекулы
объединяются вместе, а вместе с ними образуется
небольшая молекула (например, воды).
• Гидролиз – это реакция обратная конденсации.
Большая молекула распадается на две маленьких и при
этом расходуется молекула воды.
33. Эпимеризация
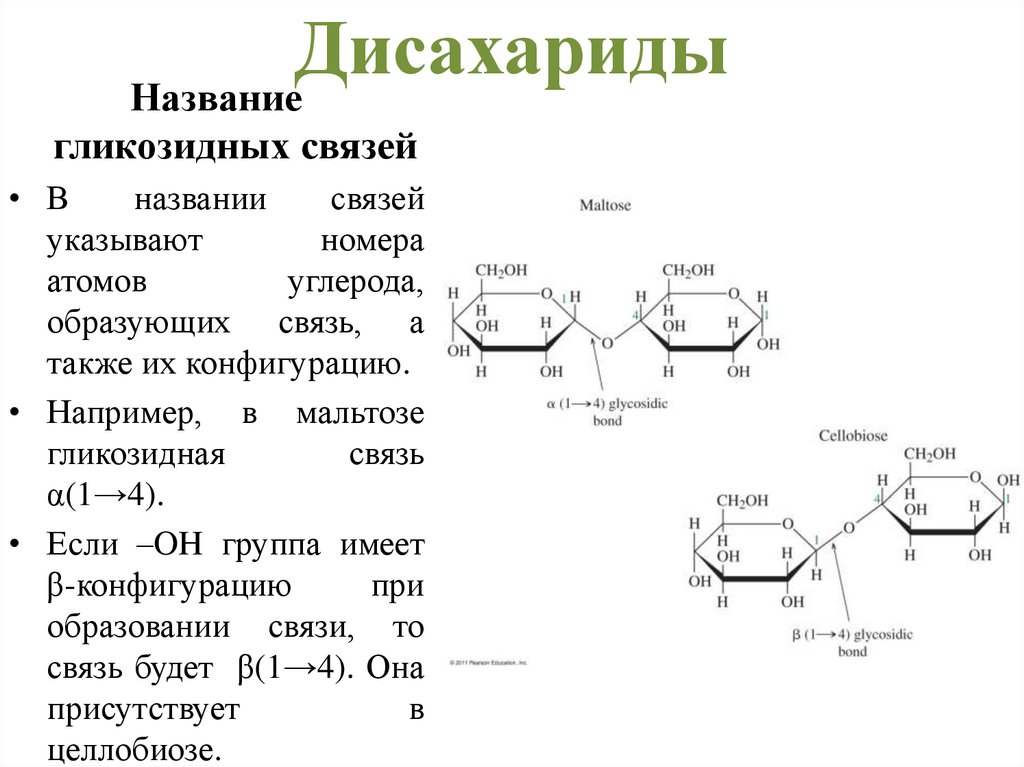
ДисахаридыНазвание
гликозидных связей
• В
названии
связей
указывают
номера
атомов
углерода,
образующих связь, а
также их конфигурацию.
• Например, в мальтозе
гликозидная
связь
α(1→4).
• Если –OH группа имеет
β-конфигурацию
при
образовании связи, то
связь будет β(1→4). Она
присутствует
в
целлобиозе.
34. Изомеризация
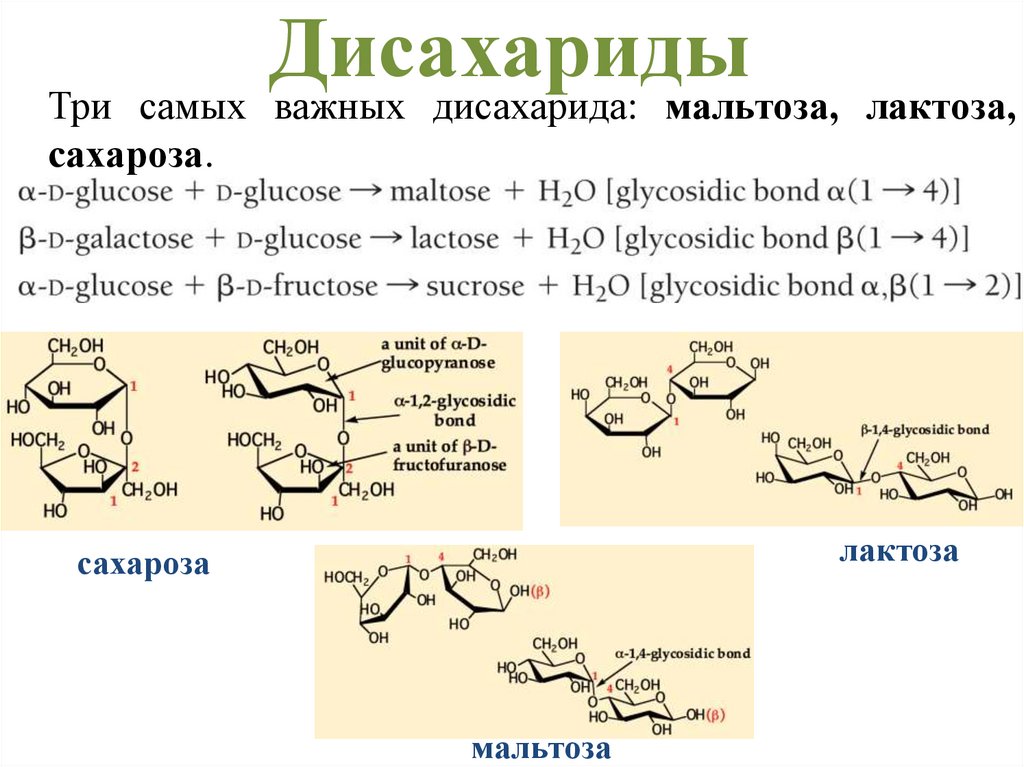
Дисахаридысамых важных дисахарида: мальтоза,
Три
сахароза.
лактоза,
лактоза
сахароза
мальтоза
35. Удлинение углеродной цепи (Реакция Килиани-Фишера)
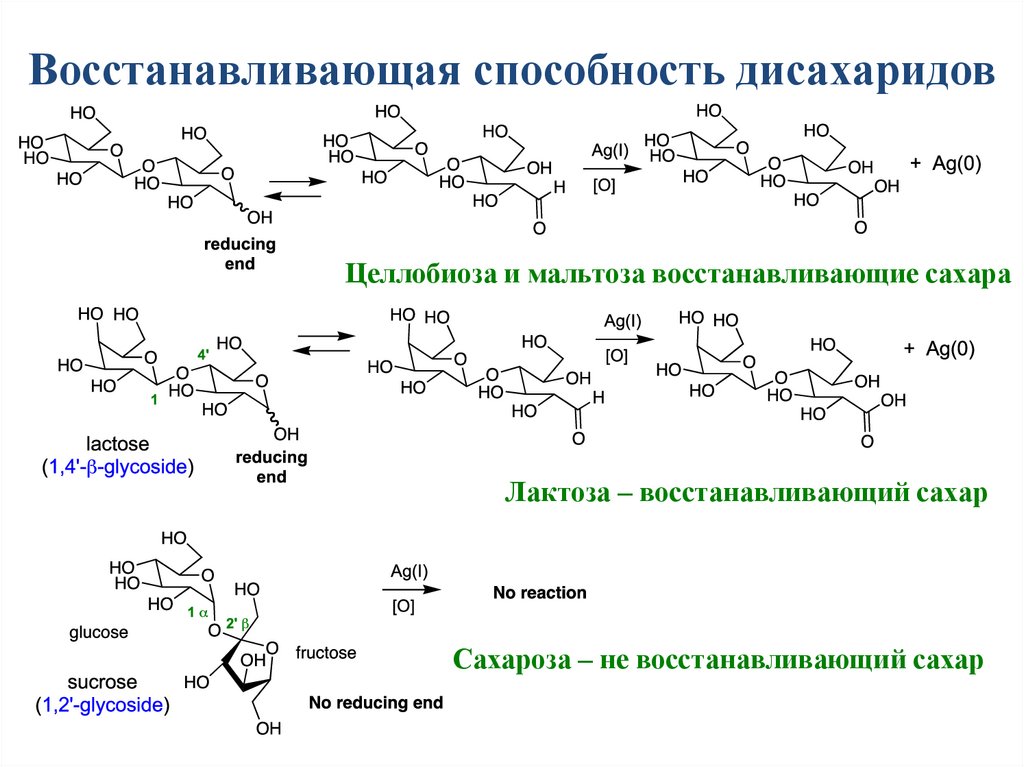
Восстанавливающая способность дисахаридовЦеллобиоза и мальтоза восстанавливающие сахара
Лактоза – восстанавливающий сахар
Сахароза – не восстанавливающий сахар
36. Укорочение углеродной цепи Деградация по Руфу
ПолисахаридыПолисахариды
это
макромолекулы,
построенные из моносахаридов, связанных
между собой через аномерные углероды.
Существуют
два
основных
типа
полисахаридов по функциям:
1. Запасающие
полисахариды
фрагменты α-глюкозы. К ним
крахмал, гликоген.
содержат
относятся
2. Структурные
полисахариды
фрагменты -глюкозы. К ним
целлюлоза и хитин.
содержат
относятся
37. Внутримолекулярная дегидратация
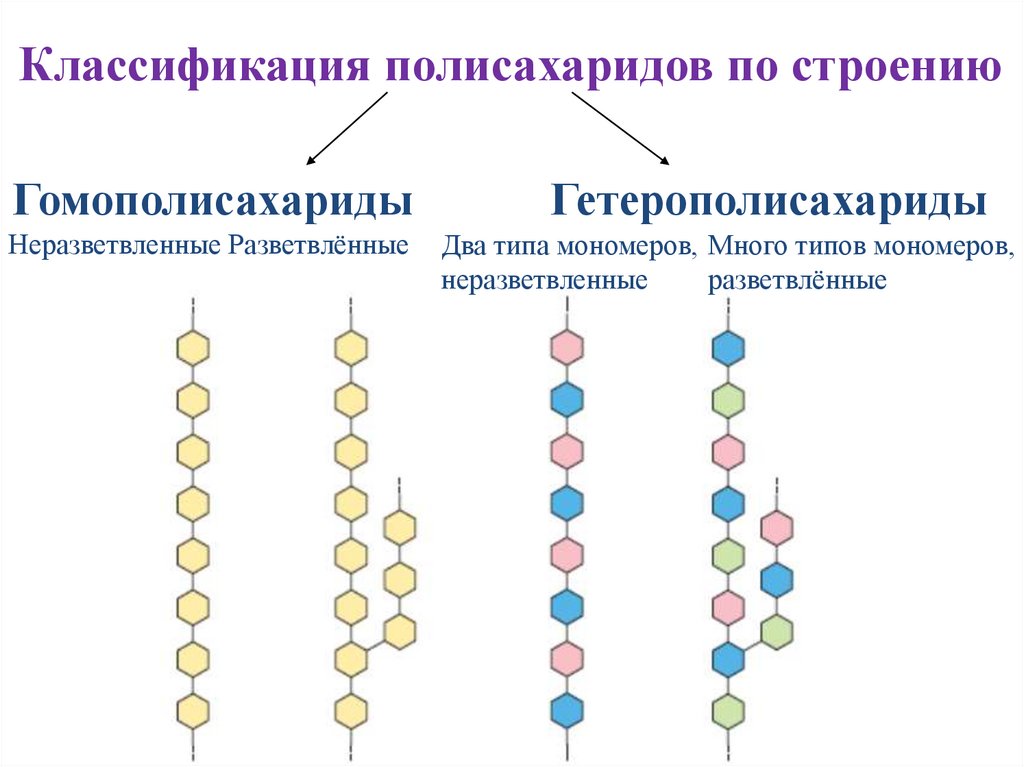
Классификация полисахаридов по строениюГомополисахариды
Неразветвленные Разветвлённые
Гетерополисахариды
Два типа мономеров, Много типов мономеров,
неразветвленные
разветвлённые
38. Дисахариды
Химические свойства полисахаридов• После
кипячения
(в
кислой
среде)
полисахариды дают качественную реакцию на
альдегидную группу.
• Причина:
полисахариды
подвергаются
гидролизу с образованием моносахаридов.
(С6Н10О5)n + nН2О
Н+ t
(С6Н10О5)n + nН2О
Н+ t
Крахмал
Целлюлоза
nС6Н12О6
α-глюкоза
nС6Н12О6
β-глюкоза
39. Дисахариды
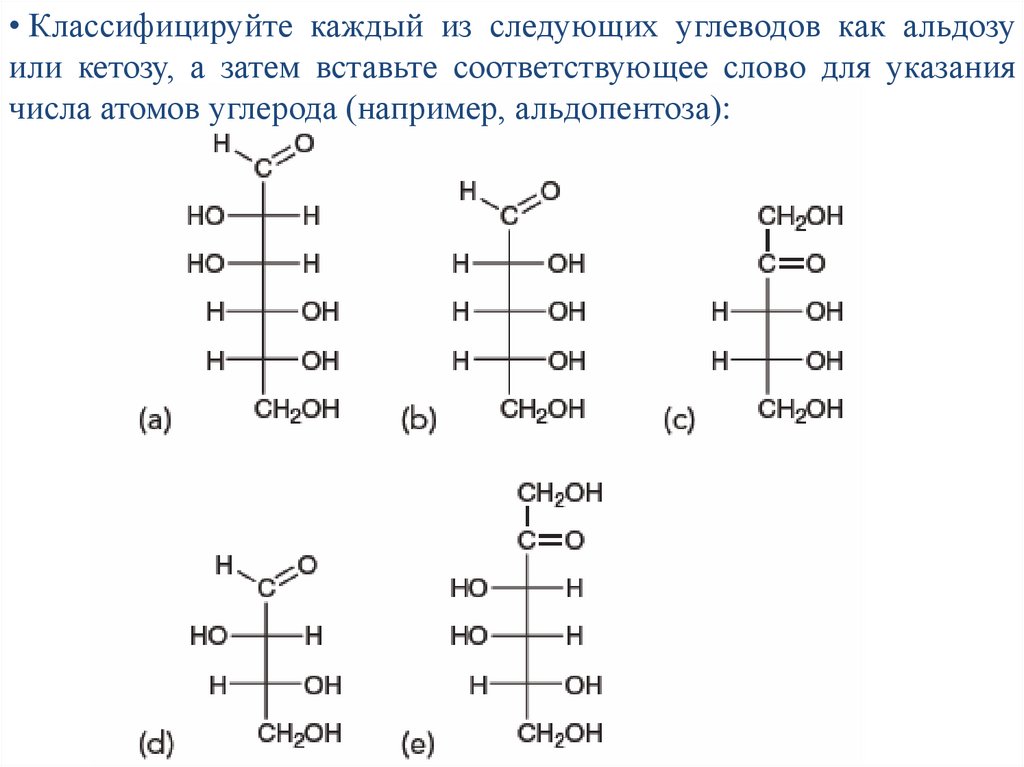
• Классифицируйте каждый из следующих углеводов как альдозуили кетозу, а затем вставьте соответствующее слово для указания
числа атомов углерода (например, альдопентоза):
40. Дисахариды
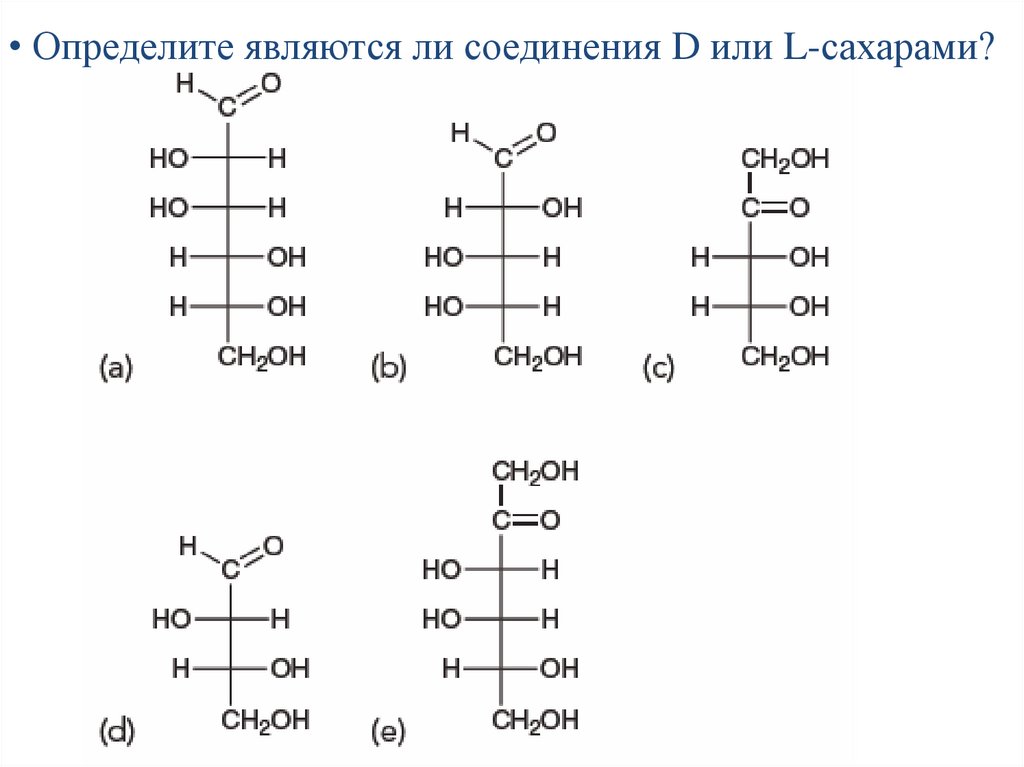
• Определите являются ли соединения D или L-сахарами?41.
• Для каждой из следующих пар соединений определите, являютсяли они энантиомерами, диастереомерами или идентичными
соединениями:
42.
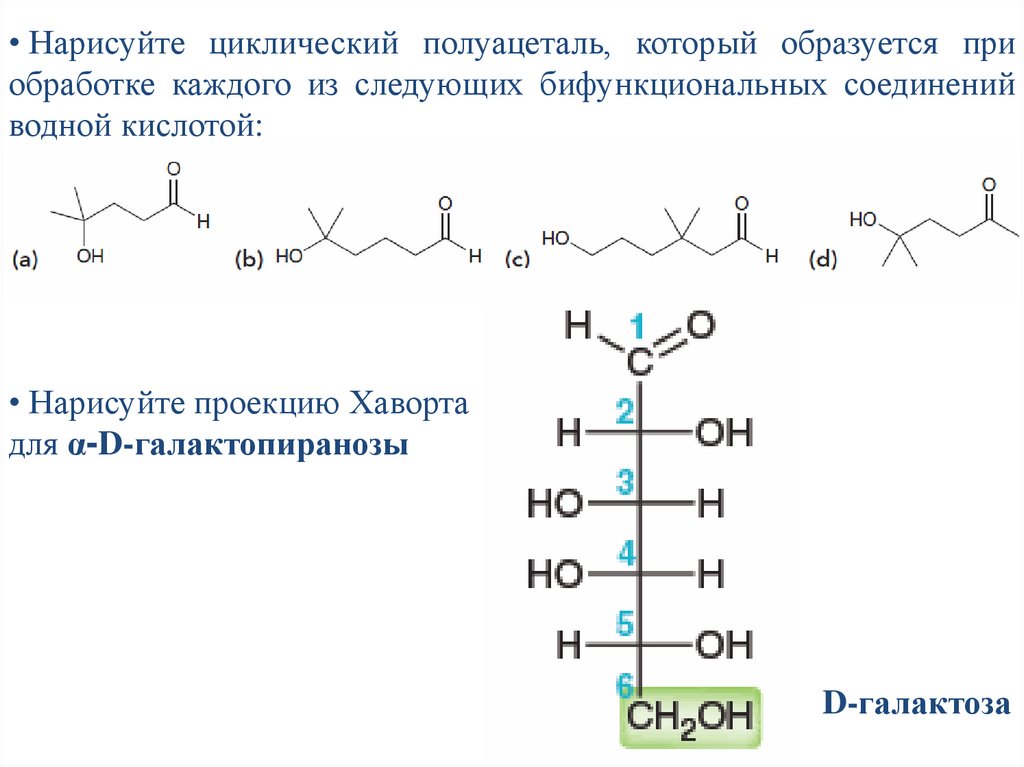
• Нарисуйте циклический полуацеталь, который образуется приобработке каждого из следующих бифункциональных соединений
водной кислотой:
• Нарисуйте проекцию Хаворта
для α-D-галактопиранозы
D-галактоза
43. Полисахариды
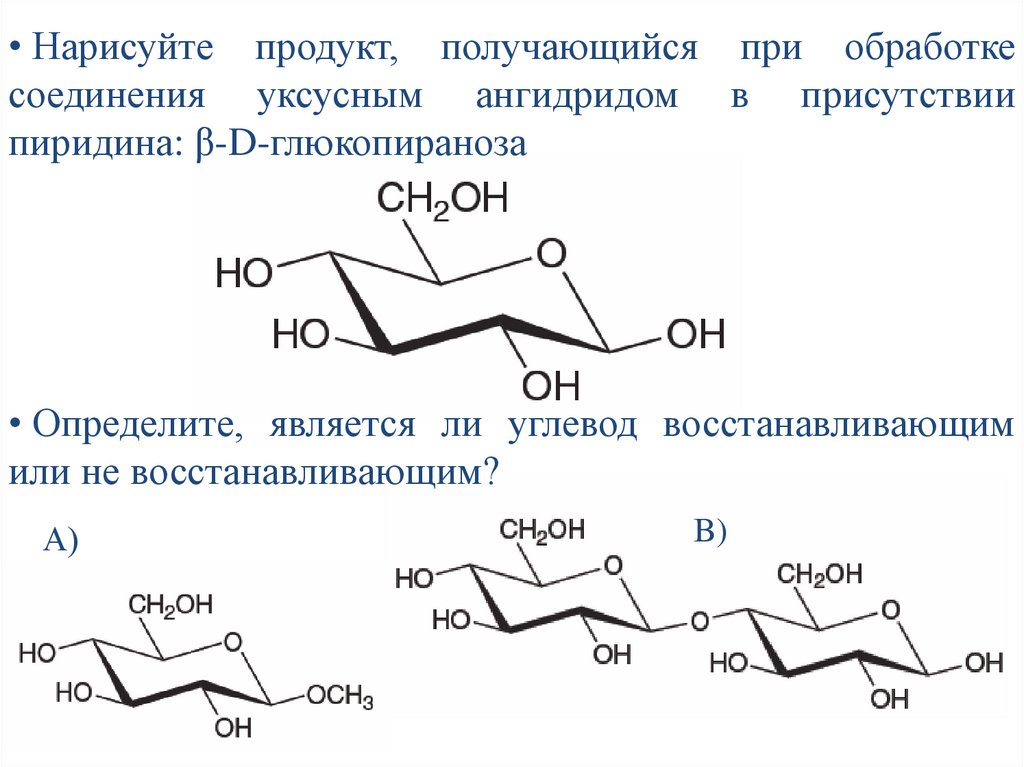
• Нарисуйте продукт, получающийся при обработкесоединения уксусным ангидридом в присутствии
пиридина: β-D-глюкопираноза
• Определите, является ли углевод восстанавливающим
или не восстанавливающим?
А)
B)
44. Классификация полисахаридов по строению
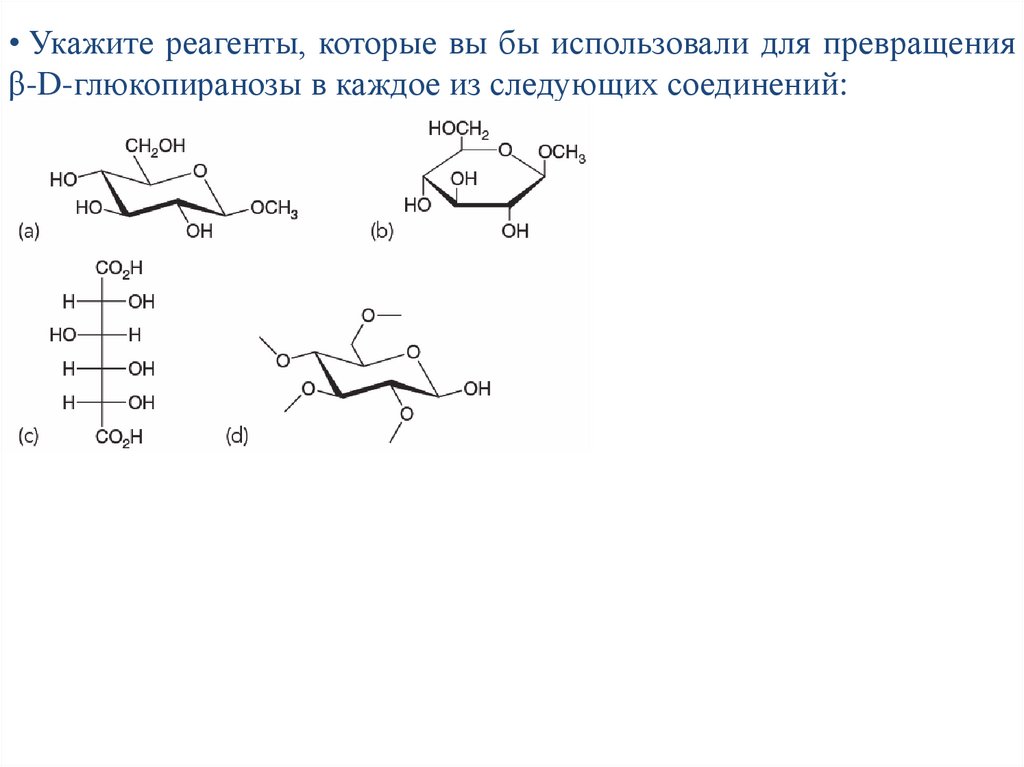
• Укажите реагенты, которые вы бы использовали для превращенияβ-D-глюкопиранозы в каждое из следующих соединений:
45. Химические свойства полисахаридов
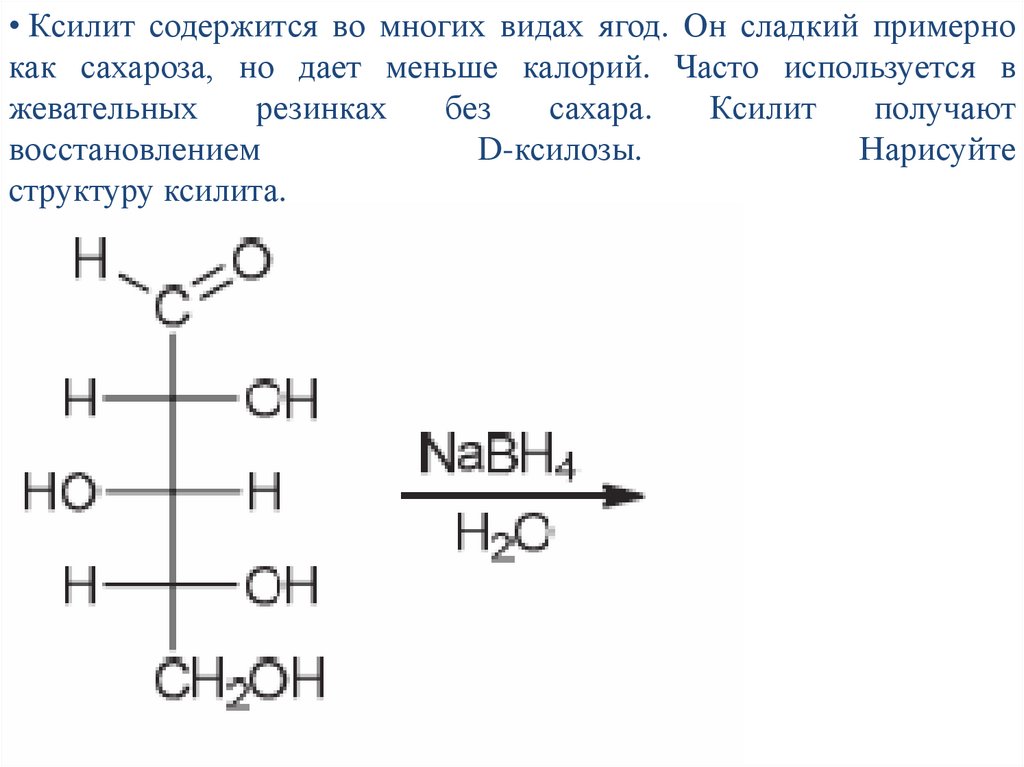
• Ксилит содержится во многих видах ягод. Он сладкий примернокак сахароза, но дает меньше калорий. Часто используется в
жевательных
резинках
без
сахара.
Ксилит
получают
восстановлением
D-ксилозы.
Нарисуйте
структуру ксилита.
46.
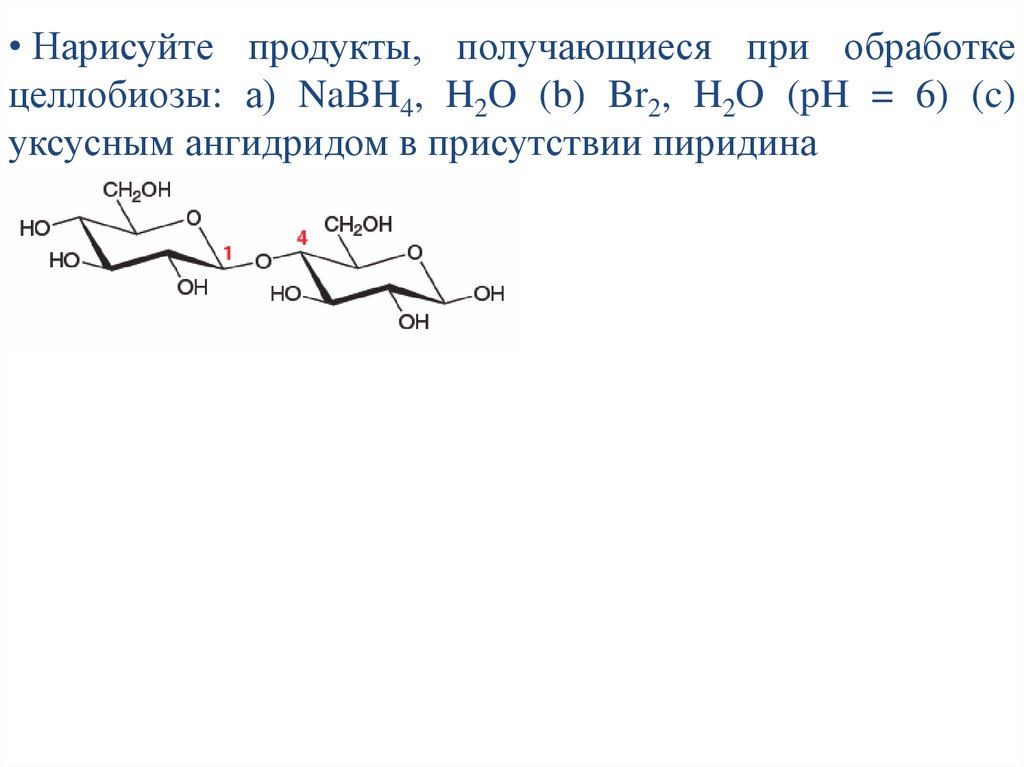
• Нарисуйте продукты, получающиеся при обработкецеллобиозы: а) NaBH4, H2O (b) Br2, H2O (pH = 6) (c)
уксусным ангидридом в присутствии пиридина














 Химия
Химия








