Похожие презентации:
Строение электронных оболочек атомов химических элементов
1.
Запомните!• Электроны, расположенные на
последней электронной оболочке,
называются внешними
• Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
2.
3.
Цель урока:• научиться составлять электронные
формулы атомов элементов первых
трех периодов ПСХЭ;
• объяснять зависимость и закономерные изменения свойств химических
элементов от электронного строения
их атомов.
4.
Электронная оболочка• Совокупность всех электронов в атоме,
окружающих ядро
• Каждый электрон имеет свою траекторию
движения и запас энергии
• Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его труднее
вырвать из электронной оболочки
• По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
5.
Форма электронныхоблаков
(орбиталей)
Орбиталь – это область наиболее
вероят- ного местонахождения
электрона в прост- ранстве
6.
р – облакаS – облако
d - облака
7.
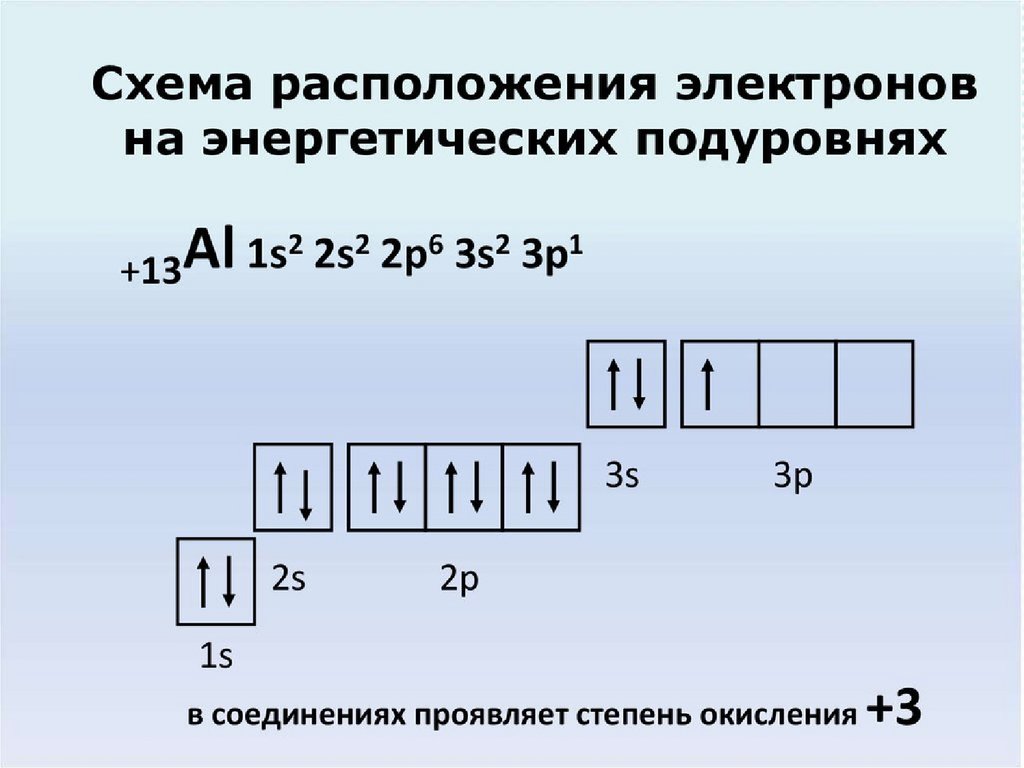
Алгоритм составленияэлектронных формул
•Записываем знак химического
элемента и
заряд ядра его атома – он равен
порядковому
номеру элемента.
•Определяем количество
энергетических
уровней (оно равно номеру периода) и
количество электронов на каждом уровне.
8.
9.
1 период1ē
Н+1
1
2ē
Нe + 2
2
10.
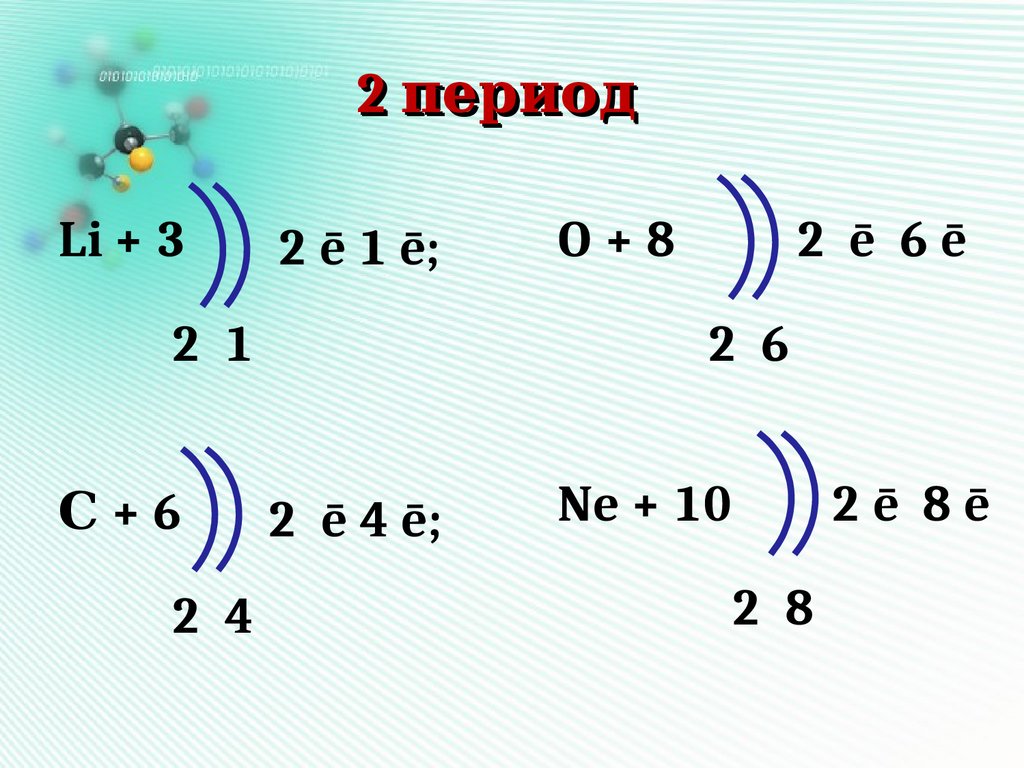
2 периодLi + 3
2 ē 1 ē;
2 1
С+6
2 4
O+8
2 ē 6ē
2 6
2 ē 4 ē;
Ne + 10
2 8
2ē 8ē
11.
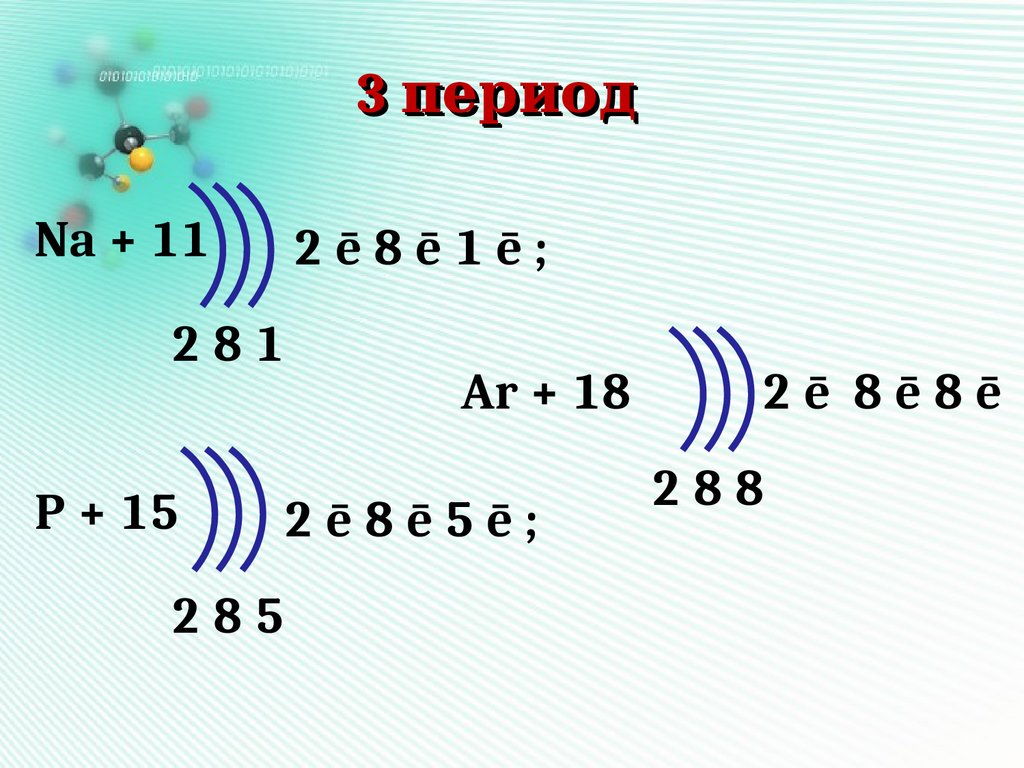
3 периодNa + 11
2ē8ē1ē;
281
P + 15
Ar + 18
2ē8ē5ē;
285
2ē 8ē8ē
288
12.
4 периодK + 19
2ē8ē8ē1ē
2881
Ca + 20
2ē8ē8ē2ē
2882
13.
14.
15.
16.
17.
Молодцы!Вы сегодня хорошо
потрудились.
Спасибо за урок!














 Химия
Химия








