Похожие презентации:
Строение электронных оболочек атомов химических элементов
1. «Строение электронных оболочек атомов химических элементов»
2. Запомните!
• Электроны, расположенные напоследней электронной оболочке,
называются внешними
• Число внешних электронов для
химических элементов главных
подгрупп равно номеру группы, в
которой находится элемент
3.
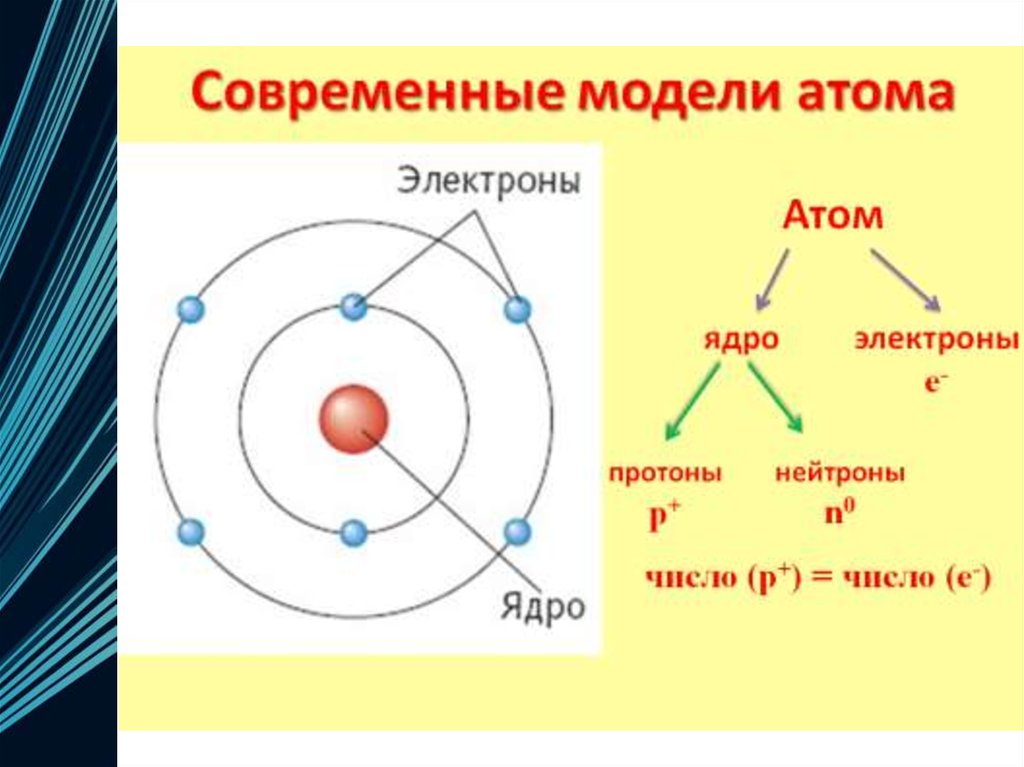
4. Электронная оболочка
• Совокупность всех электронов в атоме,окружающих ядро
Каждый электрон имеет свою траекторию
движения и запас энергии
Электроны расположены на различном
расстоянии от ядра: чем ближе электрон к
ядру, тем он прочнее с ним связан, его труднее
вырвать из электронной оболочки
По мере удаления от ядра запас энергии
электрона увеличивается, а связь с ядром
становится слабее
5. Форма электронных облаков (орбиталей)
Орбиталь – это область наиболее вероятного местонахождения электрона в пространстве6.
р – облакаS – облако
d - облака
7.
s-элементы – I - II A группыp-элементы – III – VIII А группы
d-элементы – I-VIII B группы
f-элементы – La и Ac
8. Алгоритм составления электронных формул
• Записываем знак химического элемента изаряд ядра его атома – он равен порядковому
номеру элемента.
• Определяем количество энергетических
уровней (оно равно номеру периода) и количество электронов на каждом уровне.
• Составляем электронную схему и формулу.
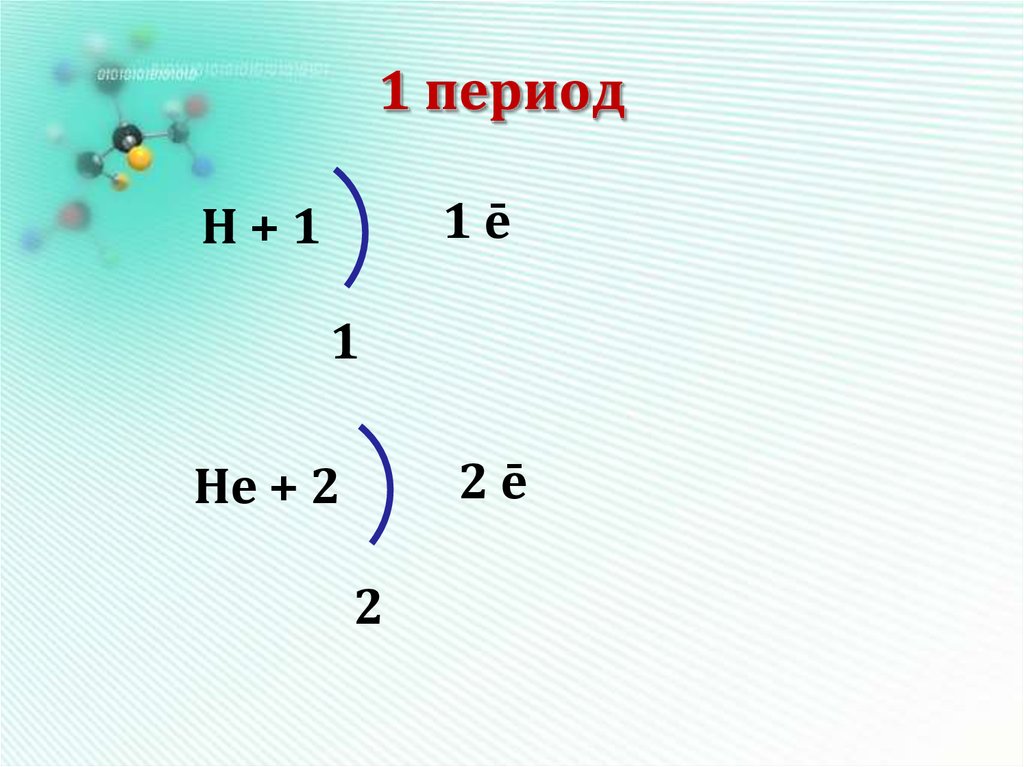
9. 1 период
1ēН+1
1
2ē
Нe + 2
2
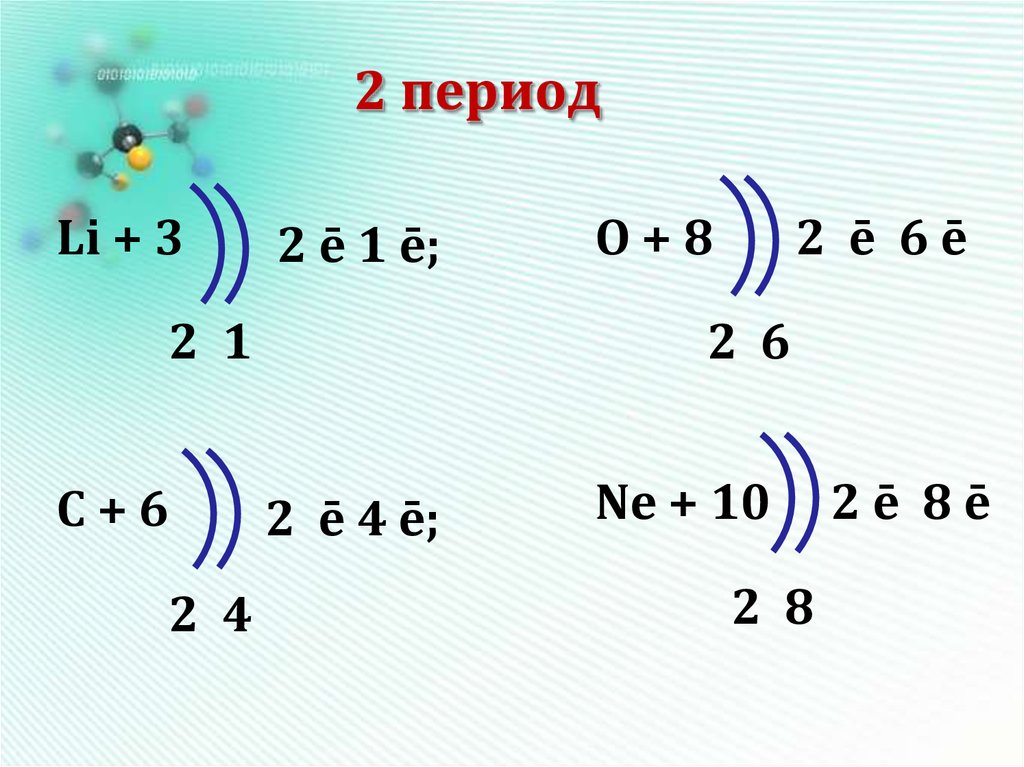
10. 2 период
Li + 32 ē 1 ē;
2 1
С+6
2 4
O+8
2 ē 6ē
2 6
2 ē 4 ē;
Ne + 10
2 8
2ē 8ē
11. 3 период
Na + 112ē8ē1ē;
281
P + 15
Ar + 18
2ē8ē5ē;
285
2ē 8ē8ē
288
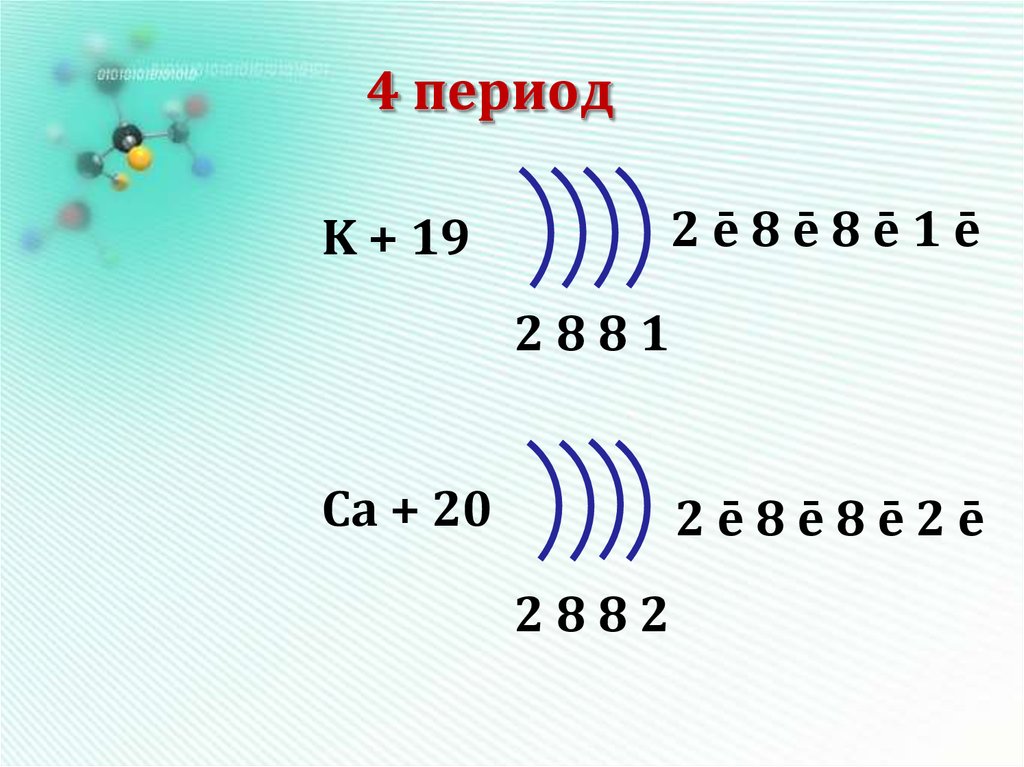
12. 4 период
2ē8ē8ē1ēK + 19
2881
Ca + 20
2ē8ē8ē2ē
2882
13. Игра «Крестики- нолики» выигрышный путь составляют :
а) элементы одного периода2ē2ē
2ē1ē
2ē8ē1ē
2ē4ē
2ē 8ē2ē
2ē6ē
2ē7ē
2ē 5ē
2ē
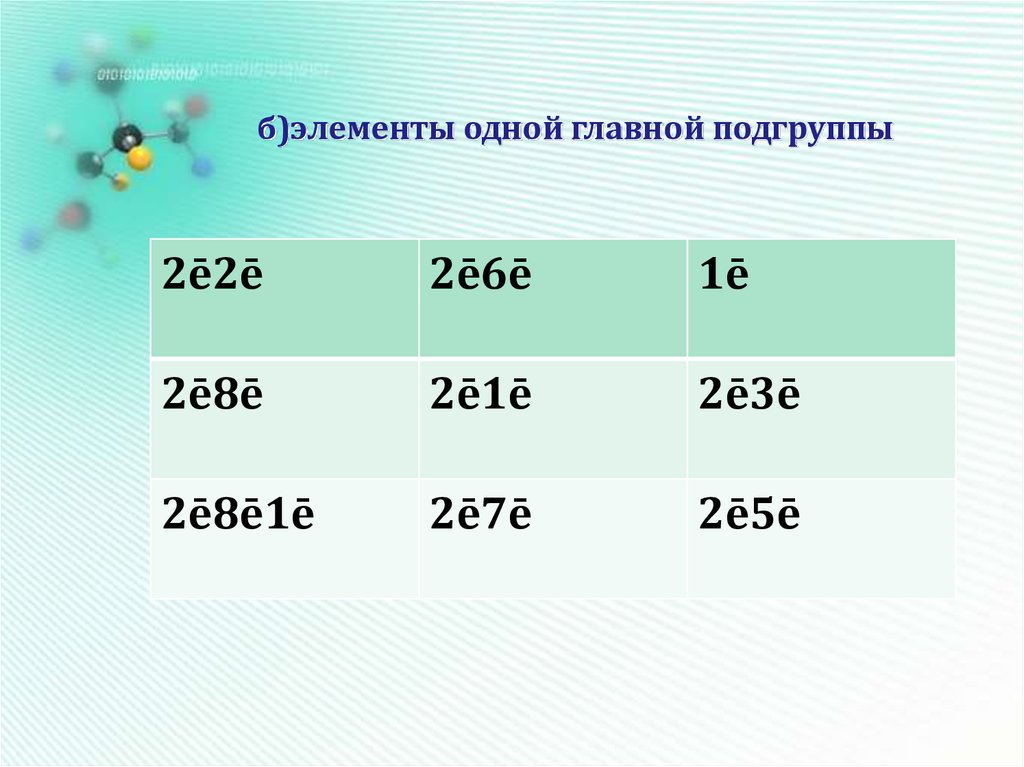
14. б)элементы одной главной подгруппы
2ē2ē2ē6ē
1ē
2ē8ē
2ē1ē
2ē3ē
2ē8ē1ē
2ē7ē
2ē5ē
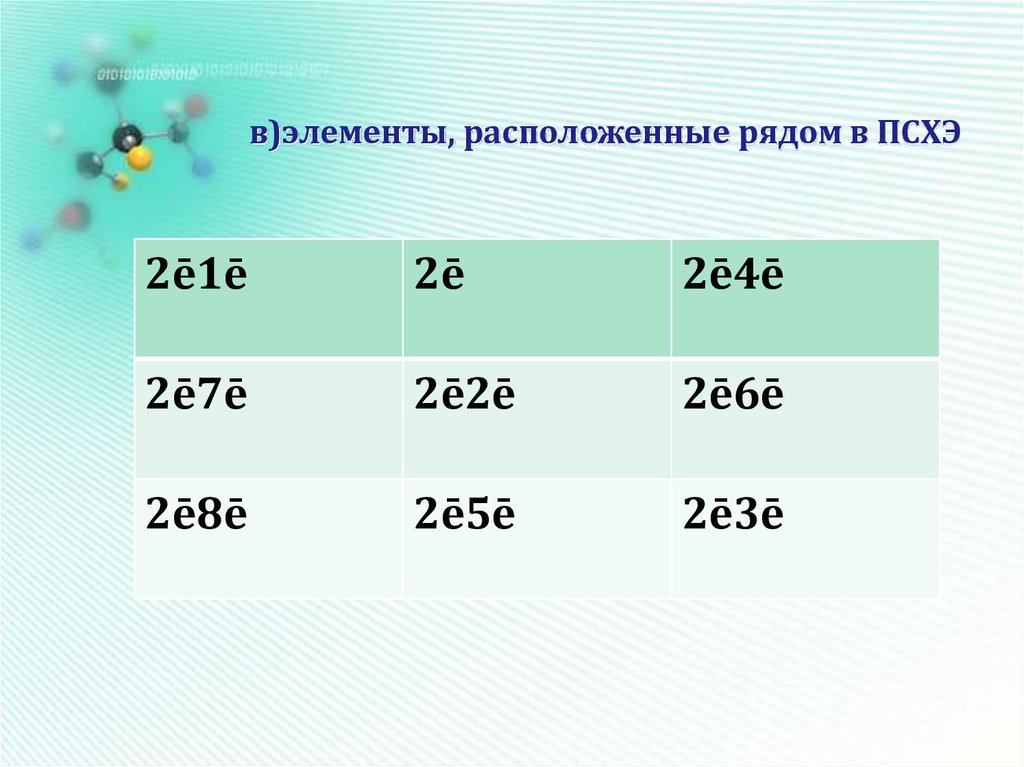
15. в)элементы, расположенные рядом в ПСХЭ
2ē1ē2ē
2ē4ē
2ē7ē
2ē2ē
2ē6ē
2ē8ē
2ē5ē
2ē3ē









 Химия
Химия








