Похожие презентации:
Элементы ядерной физики. Лекция16
1.
Лекция 16ЭЛЕМЕНТЫ
ЯДЕРНОЙ ФИЗИКИ
Вопросы:
1. Состав и основные характеристики атомного ядра. Изотопы.
2. Дефект массы и энергия связи.
Способы освобождения
внутриядерной энергии.
3. Закон радиоактивного распада.
2.
Атомные ядра, открытые Э.Резерфордом в 1911 г.,так же как и сами атомы, имеют внутреннюю структуру, т.е. не являются неделимыми.
Основой современной ядерной физики является протоннонейтронная модель строения атомного ядра (В.Гейзенберг,
Д.Иваненко, 1932 г.)
Атомные ядра химических элементов состоят из двух видов
частиц – протонов и нейтронов (имеющих обобщающее название нуклонов). Ядро атома водорода состоит из одного
протона.
Характерис- Протон (p) Нейтрон (n)
тики
нуклонов
Электрический заряд, Кл
1,6 ·10-19
0
Масса, а.е.м.
1,00728
1,00866
Вернер Гейзенберг
(1901 – 1976)
1 а.е.м. 1,66 10
27
кг.
Дмитрий Иваненко
(1904 – 1994)
3.
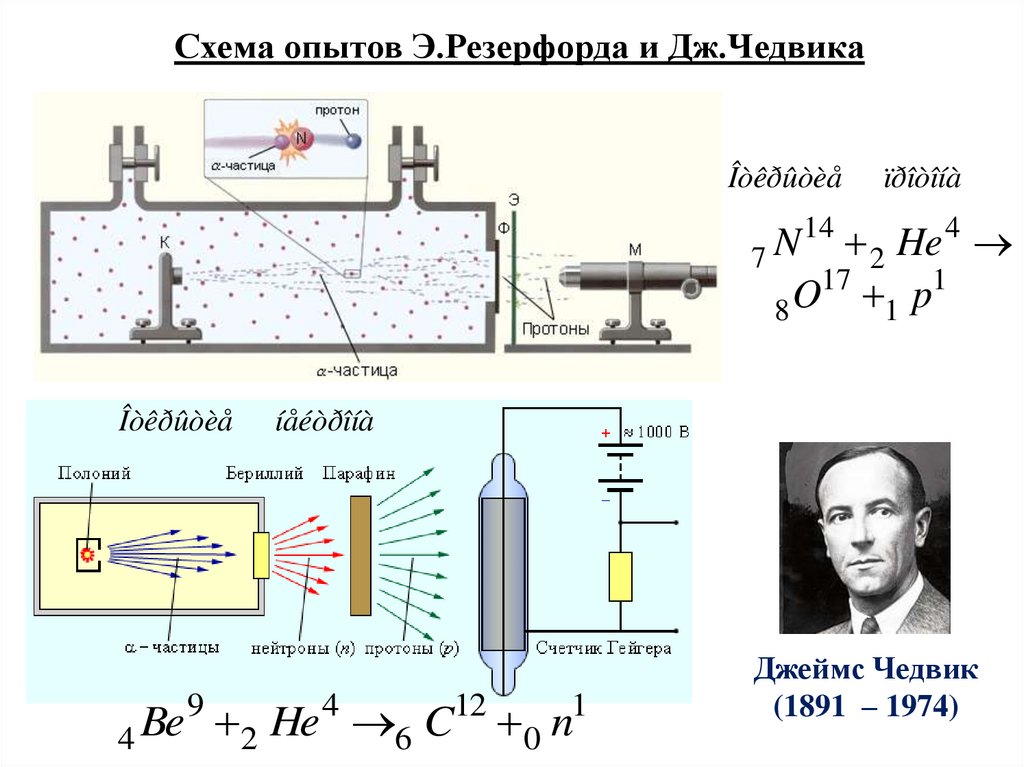
Схема опытов Э.Резерфорда и Дж.ЧедвикаÎòêðûòèå
ïðîòîíà
2 He
17
1
8 O 1 p
7N
Îòêðûòèå
4 Be
9
14
4
íåéòðîíà
2 He 6 C 0 n
4
12
1
Джеймс Чедвик
(1891 – 1974)
4.
zХ
A – условное обозначение атомного ядра
(химического элемента).
Массовое число А ядра равно общему числу нуклонов
(протонов и нейтронов) в данном ядре.
Заряд ядра (зарядовое число) z ядра равен числу протонов
в данном ядре, определяет порядковый номер химического
элемента в Периодической таблице и его химические свойства.
Следствия:
1. Разность А – z определяет число нейтронов в данном
атомном ядре.
2. В нейтральном (неионизированном) атоме химического
элемента в электронных оболочках содержится z электронов, т.к. суммарный электрический заряд атома
должен быть равен нулю.
5.
Основные характеристики атомного ядра1.
2.
3.
4.
Зарядовое число z.
Массовое число А.
Радиус ядра Rя.
Спин ядра тs.
15 3
Rя (1,3...1,5) 10 А, м
4
3
3
Rя ~ А
Vя Rя ~ А
3
Поскольку у протона и нейтрона тs = ½, то спин ядра, состоящего из четного числа нуклонов, является целым числом, а спин ядра, состоящего из нечетного числа нуклонов,
– полуцелым.
Изотопами называются ядра с одинаковым зарядовым
числом z (т.е. одинаковыми химическими свойствами),
но с разными массовыми числами А (т.е. различными
физическими свойствами).
Например: 1 Н (протий); 1 Н (дейтерий);1 Н (тритий).
1
2
3
6.
Дефект массы атомного ядраМасса любого ядра тя всегда меньше суммы масс входящих
в его состав отдельных нуклонов:
mя z m p A z mn
Это объясняется тем, что при объединении нуклонов в ядро
между ними начинают действовать короткодействующие
ядерные силы притяжения. Это означает уменьшение энергии и массы системы нуклонов.
Величина m z m p
называется дефектом массы.
Пример. Для ядра гелия
A z mn ] mя
: 2mp + 2mn = 4,03298 а.е.м.,
Не
2
4
mя = 4,00260 а.е.м., Δm = 0,03038 а.е.м.
7.
Энергия связи атомного ядраВеличина Eсв m с [z m p
называется энергией связи ядра.
2
A z mn - mя ] с 2
Физический смысл энергии связи ядра: это энергия, необходимая для расщепления ядра на отдельные нуклоны без сообщения им кинетической энергии. Энергия связи является
характеристикой прочности атомных ядер.
Преобразуем формулу для энергии связи:
Eсв [z m p A z mn - mя ] с
2
z m p z me ( A z) mn mя z тe c
2
z mH ( A z) mn mат с 2
Есв , МэВ 931,5 т, а.е.м.
8.
Свойства энергии связи1. Согласно закону сохранения энергии, при образовании
ядра из составляющих его нуклонов выделяется энергия,
равная энергии связи ядра.
Есв
Еуд
А
– удельная энергия связи ядра.
2. Если из одного ядра с меньшей
удельной энергией связи образуется другое ядро с большей удельной энергией связи, то такой процесс пойдет с выделением энергии.
Энрико Ферми
(1901 – 1953)
9.
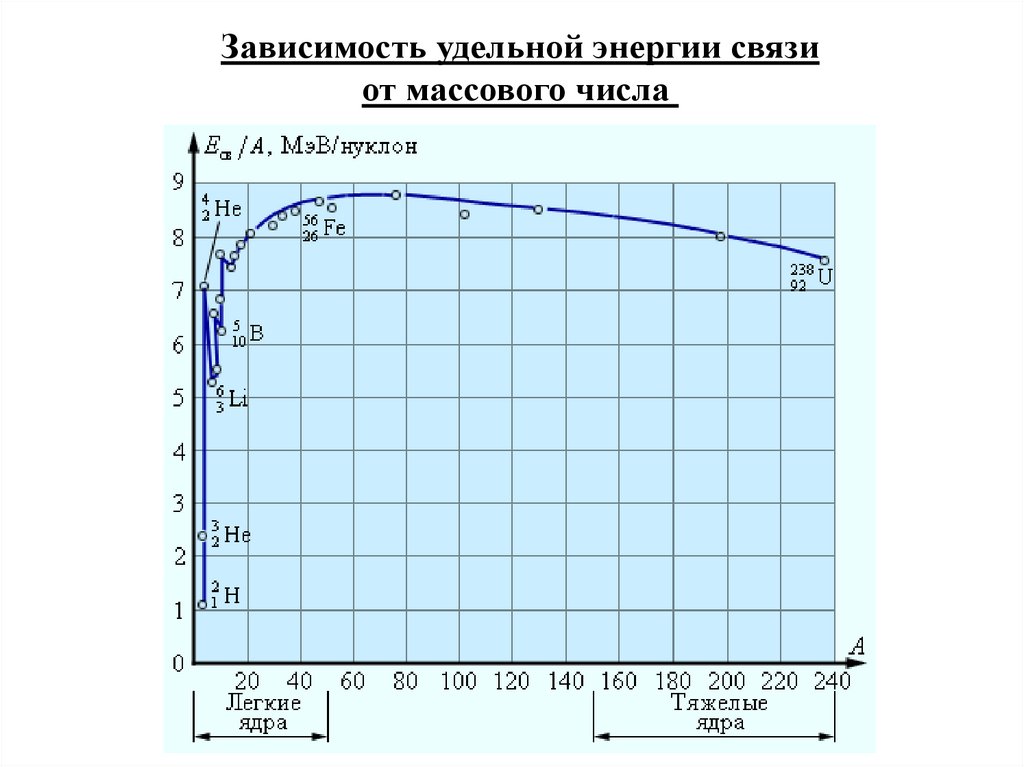
Зависимость удельной энергии связиот массового числа
10.
Из зависимости Еуд = Еуд(А) следует, что наиболее прочнымиявляются ядра химических элементов в средней части Периодической таблицы Д.Менделеева, а легкие и тяжелые ядра
являются менее прочными.
Такая зависимость делает энергетически возможными два
процесса:
• деление тяжелых ядер;
• синтез легких ядер.
Оба процесса сопровождаются
выделением большого количества
энергии.
0 n
94
1
36 Kr 30 n Q
92U
139
56 Âà
235
1
Отто Ган
(1879 – 1968)
Q (8,7 7,6)МэВ / нуклон 235 0,8 200 МэВ
11.
Термоядерная энергия синтеза легких ядерН 1 Н 2 Не 0 п Q
Q 28,3 МэВ (2,2 8,5) МэВ 17,6 МэВ
2
3
4
1
1
В пересчете на один нуклон энергетический эффект реакции
синтеза более чем в 4 раза превосходит эффект реакции деления (3,52 МэВ/нуклон против 0,85 МэВ/нуклон).
Если в реакции деления тяжелых ядер
кулоновские силы помогают ядру
делиться на несколько осколков, то в
реакции синтеза они препятствуют
сближению ядер. Поэтому реакции
синтеза изотопов водорода могут
протекать только при очень высоких
температурах (~ 10 млн. К) и получили
название термоядерных реакций.
Эдвард Теллер
(1908 – 2003)
12.
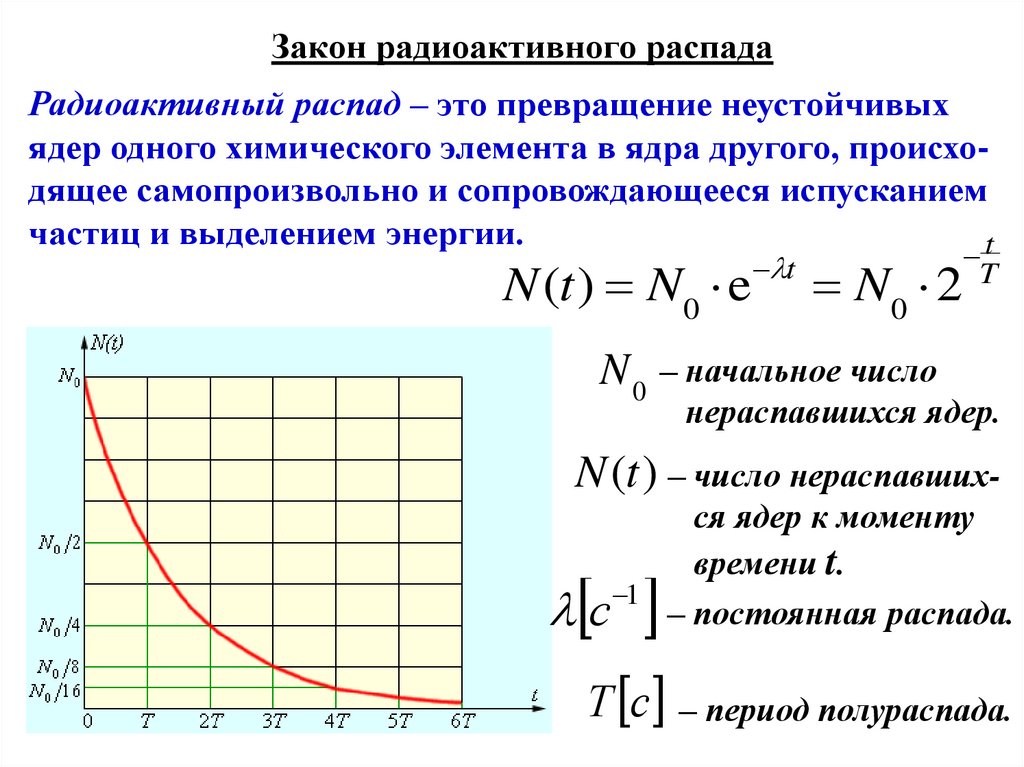
Закон радиоактивного распадаРадиоактивный распад – это превращение неустойчивых
ядер одного химического элемента в ядра другого, происходящее самопроизвольно и сопровождающееся испусканием
частиц и выделением энергии.
t
N (t ) N0 e
N0
t
N0 2
T
– начальное число
нераспавшихся ядер.
N (t ) – число нераспавшихся ядер к моменту
времени t.
с 1 – постоянная распада.
Т с – период полураспада.
13.
Физический смысл характеристик радиоактивного распада:• период полураспада Т – это время, за которое исходное число
радиоактивных ядер в среднем уменьшается вдвое;
• постоянная распада λ – это величина, обратная к которой
есть среднее время жизни радиоактивного ядра:
Связь между Т и λ:
N0
2
N0 e
T
e
T
1
ср
2
Т
ln 2
Периоды полураспада, Т
222
Rn
86
210
Po
84
90
Sr
38
226
Ra
88
238
U
92
3,82 сут. 138 сут.
28 лет
1590 лет
4,5 109
лет
0,693
14.
Активностью А радиоактивного изотопа (нуклида) называетсячисло распадов, происходящих с ядрами вещества за 1 с:
dN
A
N ; А Бк (Беккерель)
dt
1 Бк активность нуклида, при которой за 1 с распадается
одно ядро.
Широко применяются кратные единицы: кБк, МБк, ГБк.
A(t ) N N 0 e
t
A0 e
t
Закон изменения активности радиоактивного вещества имеет такой же вид,
как и закон радиоактивного распада.
Антуан
Беккерель
(1852 – 1908)











 Физика
Физика








