Похожие презентации:
Химический элемент алюминий
1. Алюминий
2. Строение:
23p1Al
3s
13
-
+3
3. Физические свойства:
1. серебристо белый2. легкий
3. t- плавления 6600С
4. пластичен
5. электропроводен
6. теплопроводен
7. образует сплавы
4. Химические свойства:
1. хорошо горит 4Al0+3O20=t=2Al2+3O3-22. взаимодействует с неметаллами
2Al0+3Br20=2Al+3Br3-1 бромид алюминия (Cr)
2Al0+3S0=t=Al2+3S3-2 сульфат
4Al0+3C0=t=Al4+3C3-4 карбид
3. взаимодействие с кислотами (с
концентрированными пассивирует)
2Al+3H2SO4=Al2(SO4)3+3H2↑
2Al+6HCl=2AlCl3+3H2↑
4. растворяется в водных растворах щелочей →соли
алюминия
2Al+2NaOH(конц)+6HOH(гор)=2Na[Al(OH)4]+3H2↑
5. восстанавливает М (Cr, Mn, V, Ti, Zr) из их оксидов –
алюмотермия
8Al+3Fe3O4=t=4Al2O3+9Fe
5. Получение:
1. электролиз 2Al2O3+20500C=2Al2+3O22. криолит Na3AlF6+Al2O3=10000C
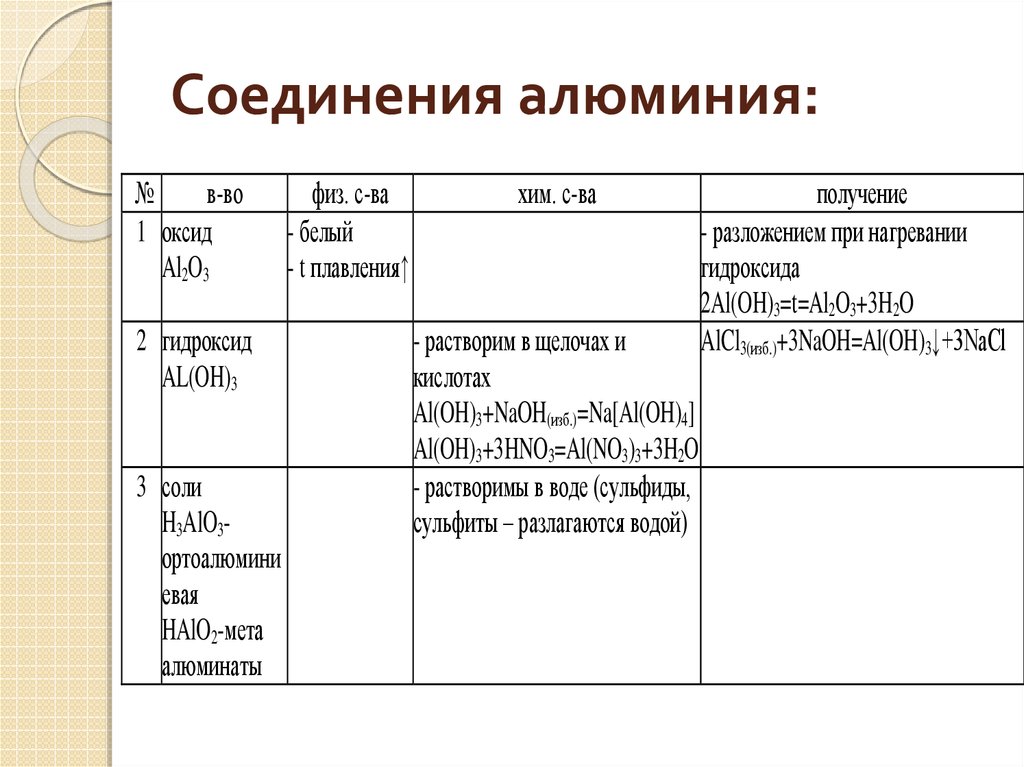
6. Соединения алюминия:
№в-во
1 оксид
Al2O3
2 гидроксид
AL(OH)3
3 соли
H3AlO3ортоалюмини
евая
HAlO2-мета
алюминаты
физ. с-ва
- белый
- t плавления↑
хим. с-ва
- растворим в щелочах и
кислотах
Al(OH)3+NaOH(изб.)=Na[Al(OH)4]
Al(OH)3+3HNO3=Al(NO3)3+3H2O
- растворимы в воде (сульфиды,
сульфиты – разлагаются водой)
получение
- разложением при нагревании
гидроксида
2Al(OH)3=t=Al2O3+3H2O
AlCl3(изб.)+3NaOH=Al(OH)3↓+3NaCl
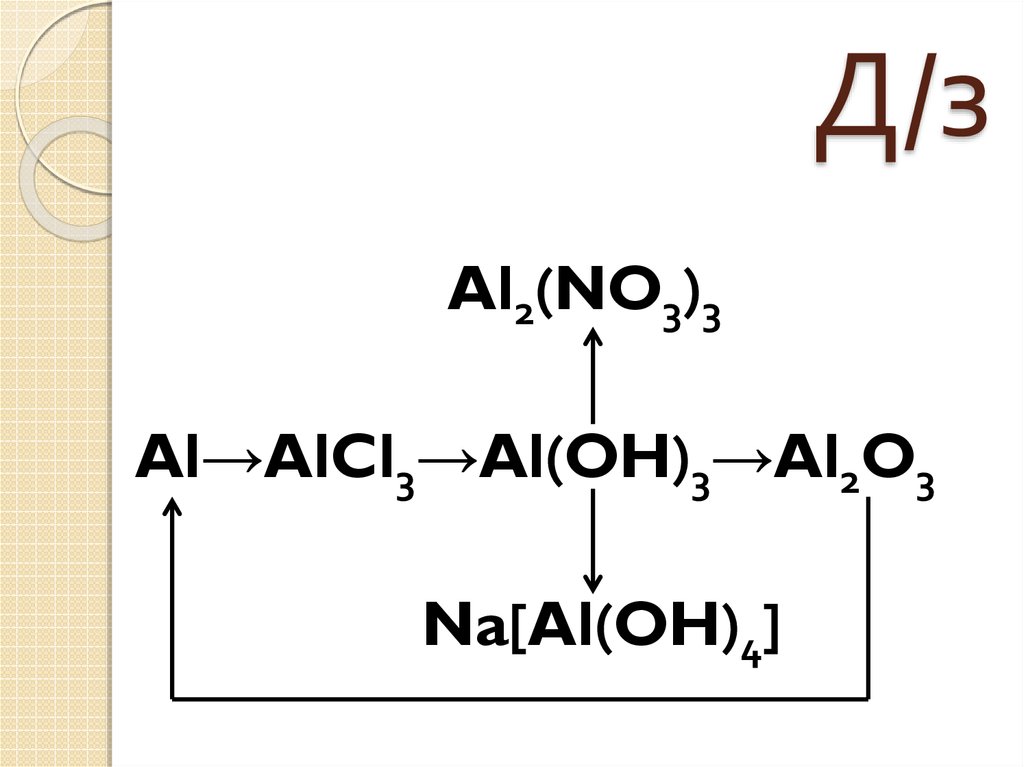
7. Д/з
Al2(NO3)3Al→AlCl3→Al(OH)3→Al2O3
Na[Al(OH)4]





 Химия
Химия








