Похожие презентации:
Карбоновые кислоты (часть 1)
1.
Карбоновые кислоты2.
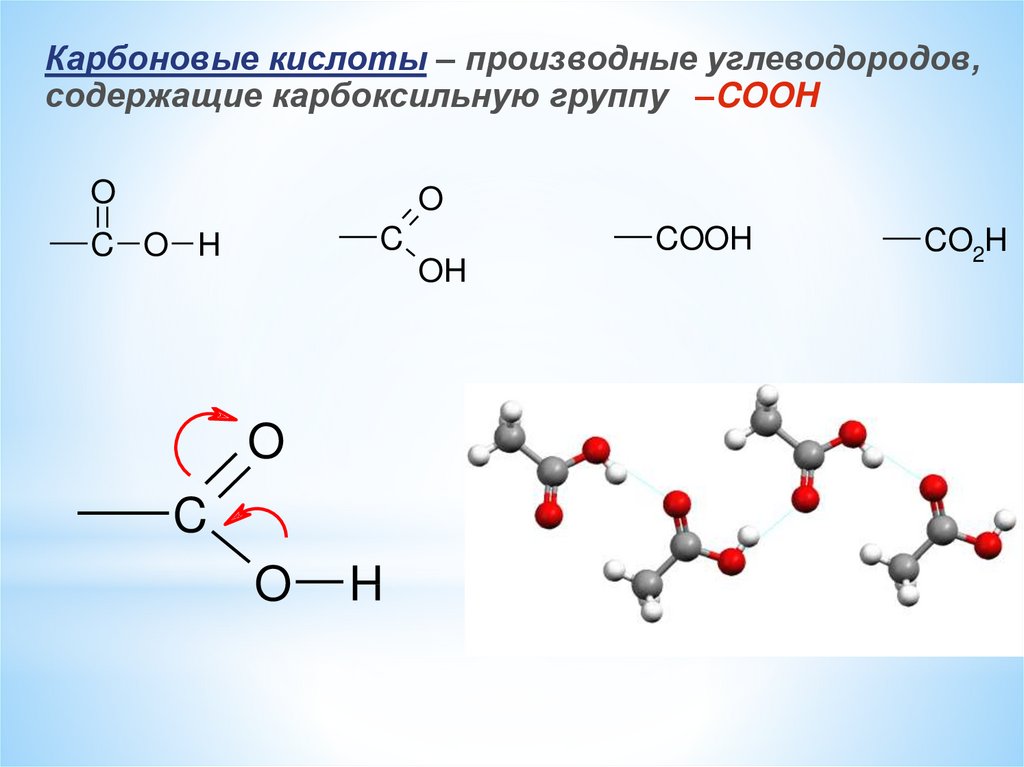
Карбоновые кислоты – производные углеводородов,содержащие карбоксильную группу –COOH
O
O
C
C O H
COOH
OH
O
C
O
H
CO2H
3.
I. Номенклатура кислоти кислотных остатков
Число
атомов
С
Название
кислоты
по ИЮПАК
Название
соли
по ИЮПАК
Тривиальное
название
кислоты
Тривиальное
название соли
1
Метановая
Метаноат
Муравьиная
Формиат
2
Этановая
Этаноат
Уксусная
Ацетат
3
Пропановая
Пропаноат
Пропионовая
Пропионат
4
Бутановая
Бутаноат
Масляная
Бутират
5
Пентановая
Пентаноат
Валерьяновая
Валерат
6
Гексановая
Гексаноат
Капроновая
Капронат
Карбоновые кислоты с числом атомов углерода выше шести называют
высшими (жирными) кислотами.
4.
C C C C C COOH6 5 4 3 2 1
CH3 CH2 CH COOH
CH3
-метилмасляная кислота
2-метилмасляная кислота
2-метилбутановая кислота
5.
Названия солям обычно дают, используятривиальные названия:
Пример:
*HCOONH4 – формиат аммония
*CH3COONa – ацетат натрия,
*(CH3CH2COO)2Ca - пропионат кальция,
*(CH3COO)3Fe - ацетат железа(III).
6.
Тривиальные названияароматических карбоновых кислот:
COOH
COOH
COOH
COOH
COOH
N
COOH
бензойная
кислота
фталевая
кислота
терефталевая
кислота
никотиновая
кислота
7.
II. Виды изомерииСтруктурная изомерия
1. Изомерия углеродного скелета
CH3 CH2 CH2 COOH
бутановая кислота
CH3 CH COOH
CH3
2-метилпропановая кислота
2. Межклассовая изомерия
O
CH3 CH2 C
O
CH3 CH C
OH
пропановая кислота
OH
H
2-гидроксипропаналь
8.
Пространственная изомерия1. Оптическая изомерия
COOH
H C* CH3
COOH
H3C C* H
CH2
CH2
CH3
CH3
(R)-2-метилмасляная кислота
(S)-2-метилмасляная кислота
2. Геометрическая изомерия
H
H
C
H3C
H
H3C
C
C
COOH
цис-бутеновая кислота
H
C
COOH
транс-бутеновая кислота
9.
III. Физические и биологическиесвойства карбоновых кислот
Низшие жирные кислоты представляют собой легкоподвижные
жидкости, средние члены ряда – масла, высшие – твёрдые
кристаллические вещества.
Первые челны гомологического ряда карбоновых кислот обладают
резким запахом, средние – прогорклым, неприятным, например,
масляная кислота пахнет потом, высшие карбоновые кислоты
вследствие нелетучести лишены запаха.
Карбоновые кислоты, как правило, не ядовиты, однако приём внутрь
концентрированных растворов (например, уксусной эссенции)
вызывает тяжёлые ожоги. Нежелательно попадание этих растворов
на кожу и тем более внутрь.
10.
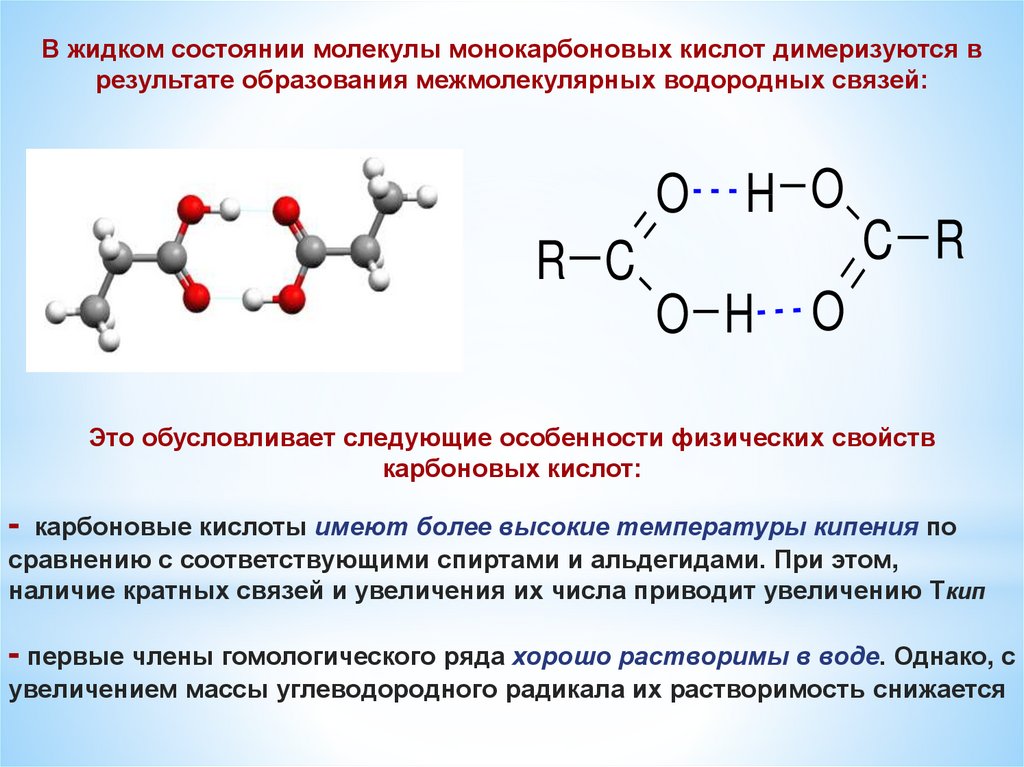
В жидком состоянии молекулы монокарбоновых кислот димеризуются врезультате образования межмолекулярных водородных связей:
O
H O
R C
O H
C R
O
Это обусловливает следующие особенности физических свойств
карбоновых кислот:
-
карбоновые кислоты имеют более высокие температуры кипения по
сравнению с соответствующими спиртами и альдегидами. При этом,
наличие кратных связей и увеличения их числа приводит увеличению Ткип
- первые члены гомологического ряда хорошо растворимы в воде. Однако, с
увеличением массы углеводородного радикала их растворимость снижается
11.
* Карбоксильная группа восстанавливается с большимтрудом. Для того чтобы восстановить карбоновую кислоту
до углеводорода требуется длительное кипячение с HI в
присутствии фосфора.
* Прямое восстановление карбоновых кислот до спиртов
водородом достигается при использовании высоких
давлений и катализаторов (Cu, Ni, Co, Zn-Cr-Cu-Cd, Шраут,
Норманн).
12.
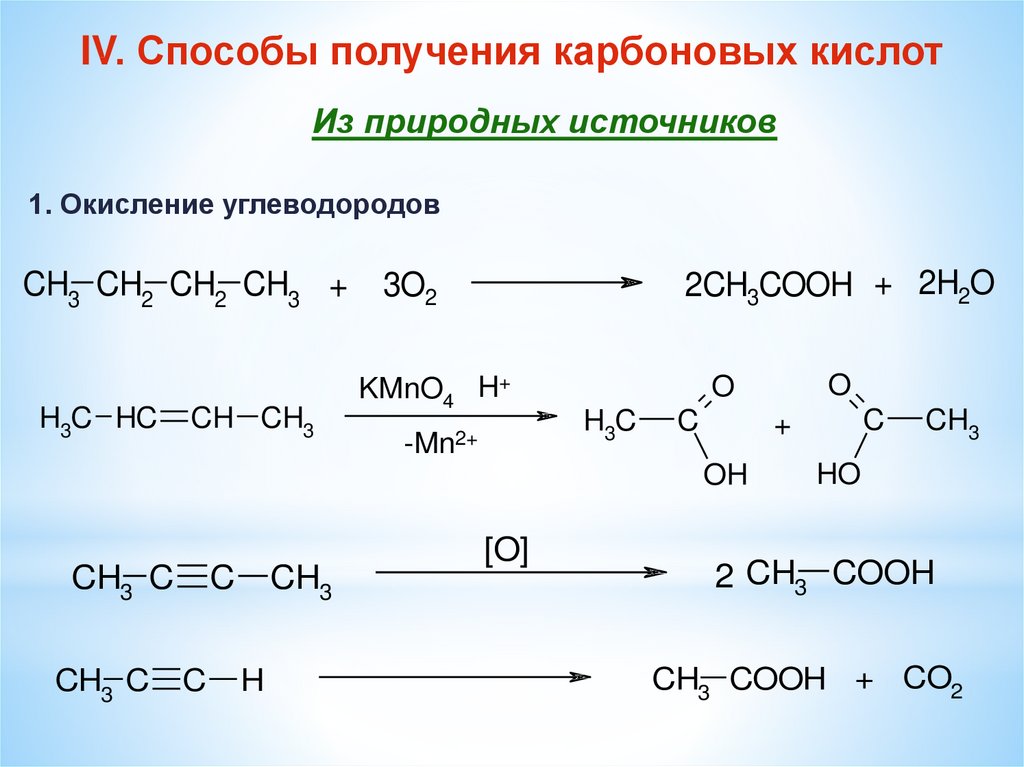
IV. Способы получения карбоновых кислотИз природных источников
1. Окисление углеводородов
CH3 CH2 CH2 CH3 +
H3C HC
CH CH3
2CH3COOH + 2H2O
3O2
KMnO4 H+
-Mn2+
H3C
C
CH3 C
CH3 C
C
C
CH3
H
C
+
OH
[O]
O
O
CH3
HO
2 CH3 COOH
CH3 COOH + CO2
13.
2. Гидролиз производных карбоновых кислотCH3 C
O
H2O
Cl
-HCl
хлорангидрид
O
CH3 C
O
H2O
-CH3COOH
CH3 C
O
ангидрид
O
CH3 C
O C2H5
H2O
-C2H5OH
сложный эфир
CH3 C
O
H2O
NH2
-NH3
амид
CH3 C
N
нитрил
2H2O
-NH3
O
CH3 C
OH
14.
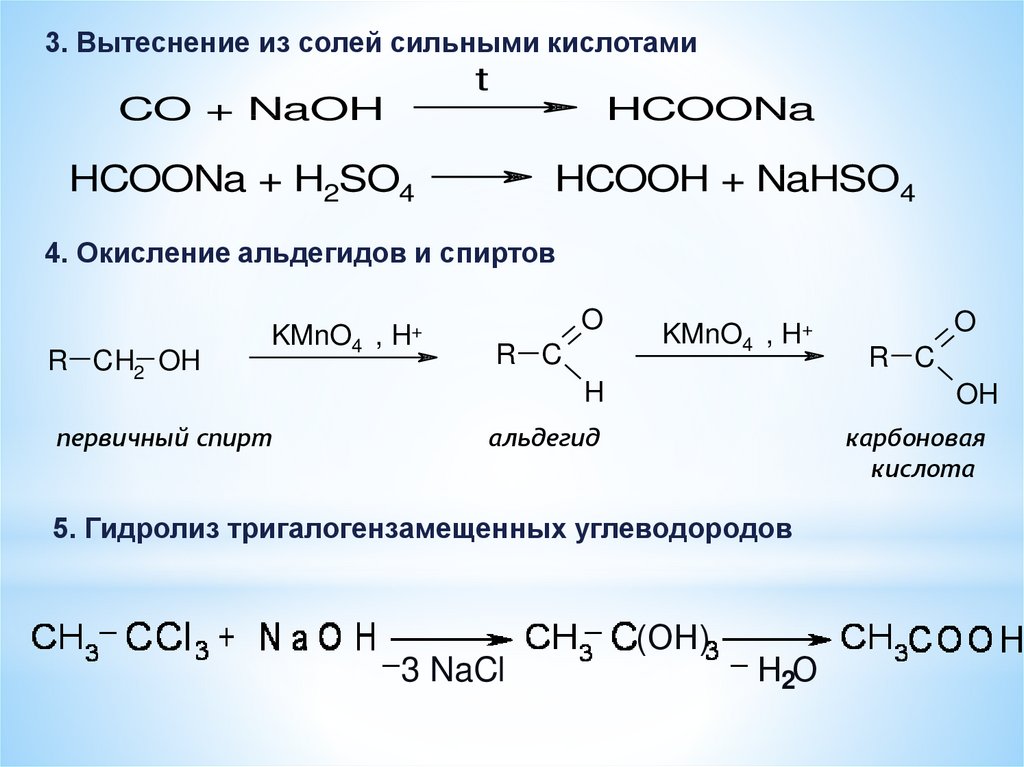
3. Вытеснение из солей сильными кислотамиt
CO + NaOH
HCOONa
HCOONa + H2SO4
HCOOH + NaHSO4
4. Окисление альдегидов и спиртов
R CH2 OH
KMnO4 , H+
первичный спирт
O
R C
KMnO4 , H+
H
R C
OH
альдегид
карбоновая
кислота
5. Гидролиз тригалогензамещенных углеводородов
(ОН)
3 NaCl
O
Н2О
15.
6. Гидролиз нитриловBr + NaCN
CN + NaBr
7. Синтез с реактивом Гриньяра
R-MgBr + СО2 → R-COO-MgBr → R-COOH + Mg(OH)Br
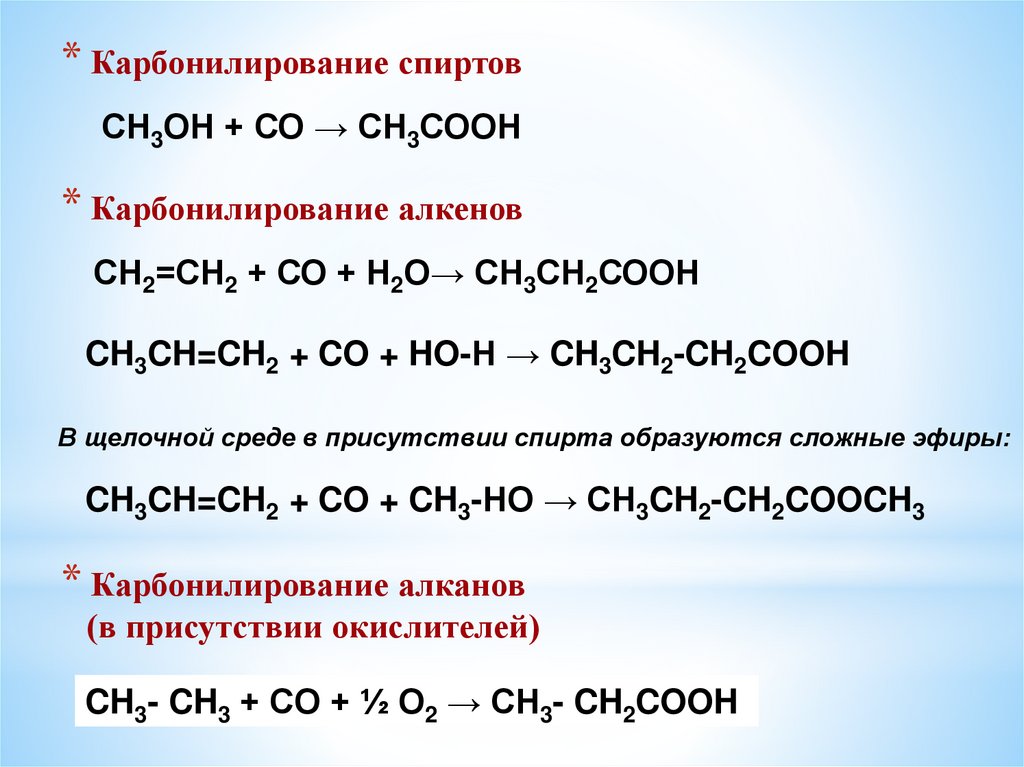
8. Реакции карбонилирования
Это химические реакции введения карбонильных групп С=О
путём взаимодействия с оксидом углерода.
Для проведения этих реакций обычно применяется гомогенные
катализаторы при повышенном давлении.
16.
* Карбонилирование спиртовСН3ОН + СО → СН3СООН
* Карбонилирование алкенов
СН2=СН2 + СО + Н2О→ СН3СН2СООН
CH3CH=CH2 + CO + HO-Н → CH3CH2-CH2COOH
В щелочной среде в присутствии спирта образуются сложные эфиры:
CH3CH=CH2 + CO + CH3-HO → CH3CH2-CH2COOCH3
* Карбонилирование алканов
(в присутствии окислителей)
CH3- CH3 + CO + ½ O2 → CH3- CH2COOH
17.
* Карбонилирование алкинов+ СО + Н2О→ СН3-СН=СН-СООН
При карбонилировании ацетилена возможно образование как
акриловой кислоты, так и образование двухосновных карбоновых
кислот:
+ СО + Н2О→ СН2=СН-СООН
2
+ 2СО + 2Н2О→ НООС-СН2-СН2-СООН
* Карбонилирование галогеналканов
СН2=СН-СН2-Сl + СО + Н2О→ СН2=СН-СН2СООН
СН2=СН-СН2-Сl + СО + СН3-НО→ СН2=СН-СН2СООСН3












 Химия
Химия