Похожие презентации:
Карбоновые кислоты
1. Карбоновые кислоты
28.03.20192.
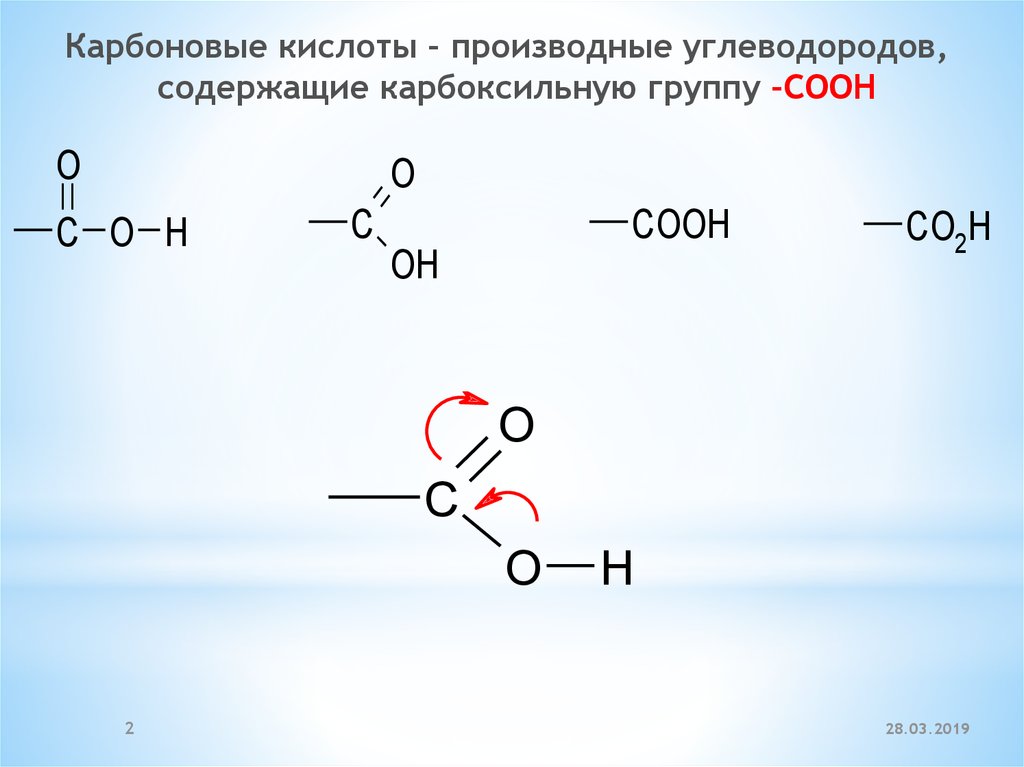
Карбоновые кислоты – производные углеводородов,содержащие карбоксильную группу –COOH
O
O
C O H
C
COOH
OH
CO2H
O
C
O
2
H
28.03.2019
3.
I. Классификация1.В зависимости от количества карбоксильных групп карбоновые
кислоты бывают:
1) одноосновные кислоты
H–C=O
|
OH
муравьиная кислота
CH3 – C = O
|
OH
уксусная кислота
CH3 – CH = CH – C = O
|
OH
кротоновая кислота
4.
2) двухосновные кислотыHOOC – COOH
щавелевая кислота
этандиовая кислота
HOOC – CH2 – COOH
малоновая кислота
пропандиовая кислота
HOOC – CH2 – CH2 – COOH
янтарная кислота
бутандиовая кислота
3) многоосновные кислоты
OH
|
HOOC – CH2 – C – CH2 – COOH
лимонная кислота
|
3-гидрокси-3-карбоксиCOOH
пентандиовая
28.03.2019
5.
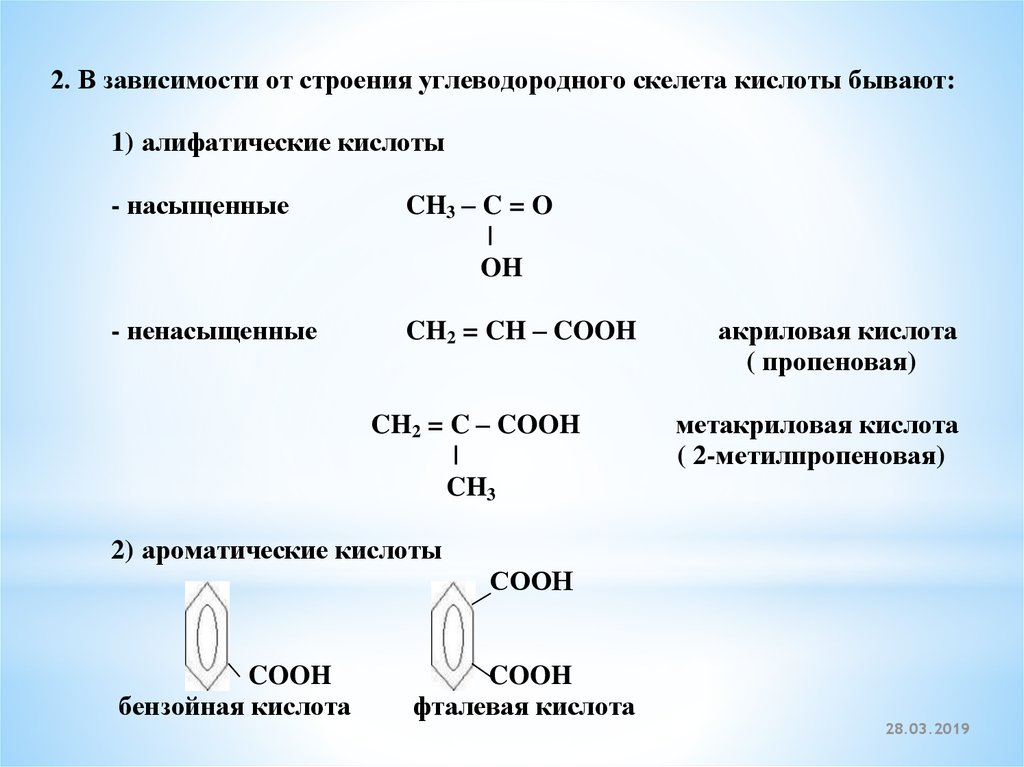
2. В зависимости от строения углеводородного скелета кислоты бывают:1) алифатические кислоты
- насыщенные
CH3 – C = O
|
OH
- ненасыщенные
CH2 = CH – COOH
CH2 = C – COOH
|
CH3
акриловая кислота
( пропеновая)
метакриловая кислота
( 2-метилпропеновая)
2) ароматические кислоты
СООН
COOH
бензойная кислота
COOH
фталевая кислота
28.03.2019
6.
II. Изомерия и номенклатура1.
Тривиальная (эмпирическая) номенклатура:
Насыщенные карбоновые кислоты
H – CООН
муравьиная кислота
СН3 – CООН
уксусная кислота
СН3 – СН2 – CООН
пропионовая кислота
СН3 – СН2 – СН2 – CООН масляная кислота
СН3 – СН2 – СН2 – СН2 – CООН валериановая кислота
СН3 – СН2 – СН2 – СН2 – СН2 – CООН капроновая кислота
СН3 – (СН2)14 – CООН пальмитиновая кислота
СН3 – (СН2)16 – CООН стеариновая кислота
28.03.2019
7.
Ненасыщенные карбоновые кислотыСН2 = СН – CООН акриловая кислота
СН3 – СН = СН – CООН кротоновая кислота
СН3 – (СН2)7 – СН = СН – (СН2)7 – CООН олеиновая кислота
СН3 – (СН2)4 – СН = СН – СН2 – СН = СН – (СН2)7 – CООН
линолевая кислота
СН3
|
СН2 – СН = СН – СН2– СН = СН – СН2 – СН = СН – (СН2)7 – CООН
линоленовая кислота
28.03.2019
8.
Двухосновные карбоновые кислотыHOOC – COOH
щавелевая кислота
HOOC – CH2 – COOH
малоновая кислота
HOOC – (CH2)2 – COOH янтарная кислота
HOOC – (CH2)3 – COOH
глутаровая кислота
HOOC – (CH2)4 – COOH
адипиновая кислота
28.03.2019
9.
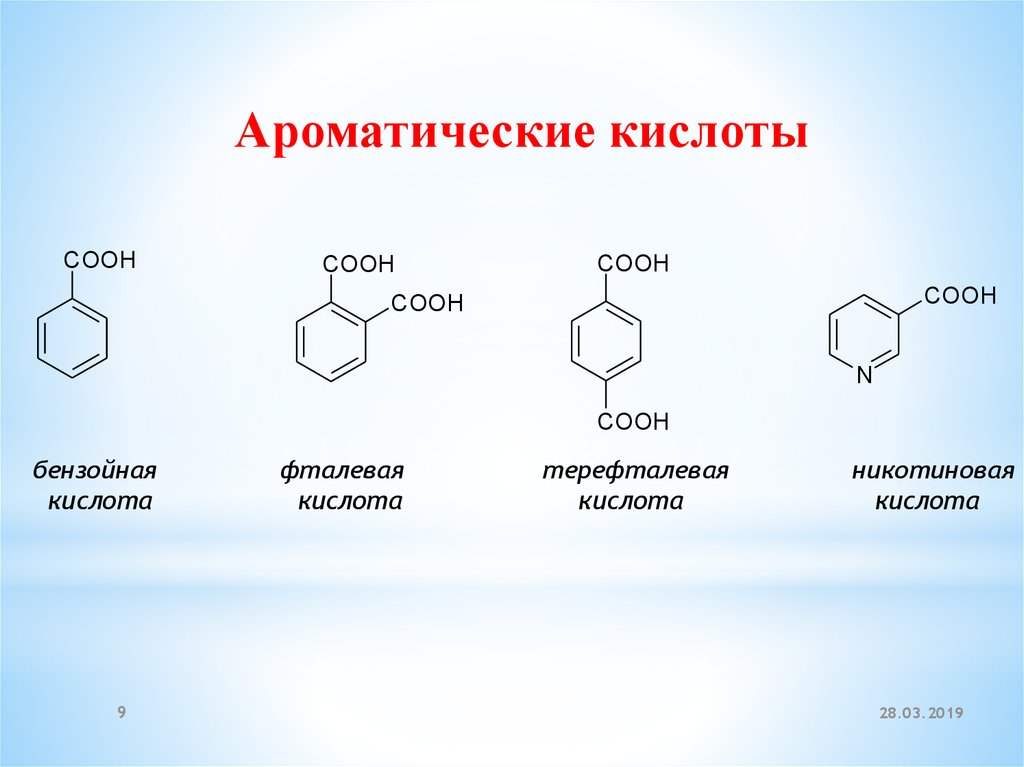
Ароматические кислотыCOOH
COOH
COOH
COOH
COOH
N
COOH
бензойная
кислота
9
фталевая
кислота
терефталевая
кислота
никотиновая
кислота
28.03.2019
10.
2. Рациональная номенклатура:δ
γ
β
α
CH3 – CH – CH2 – CH – COOH
|
|
CH3
CH3
α, γ – диметилвалериановая кислота
α – метилизокапроновая кислота
28.03.2019
11.
3. Систематическая (ИЮПАК) номенклатура:5
4
3
2
1
CH3 – CH – CH2 – CH – COOH
|
|
CH3
CH3
5
4
3
2
2,4 – диметилпентановая кислота
1
CH3 – CH – CH = C – CH2 – C = O
6|
|
|
CH2
CH3
OH
7|
CH3
3,5 – диметилгептен – 3 – овая кислота
5
4
3
2
1
CH3 – C – CH = C – CH2 – C = O
|
|
6 ||
CH
CH3
OH
7|
CH3
3, 5 – диметилгептадиен – 3, 5 – овая кислота
12.
При отщеплении -ОН от карбоксильной группыобразуются - ацилы
H–C=O
|
CH3 – C = O
|
CH3 – CH2 – C = O
|
CH3 – CH2 – CH2 – C = O
|
формил, метаноил
ацетил, этаноил
пропиоил, пропаноил
бутирил, бутаноил
28.03.2019
13.
При отщеплении Н+ образуются карбоксилат – анионыH–C=O
|
O–
CH3 – C = O
|
O–
CH3 – CH2 – C = O
|
O–
CH3 – CH2 – CH2 – C = O
|
O–
формиат, метаноат
ацетат, этаноат
пропионат, пропаноат
бутират, бутаноат
28.03.2019
14.
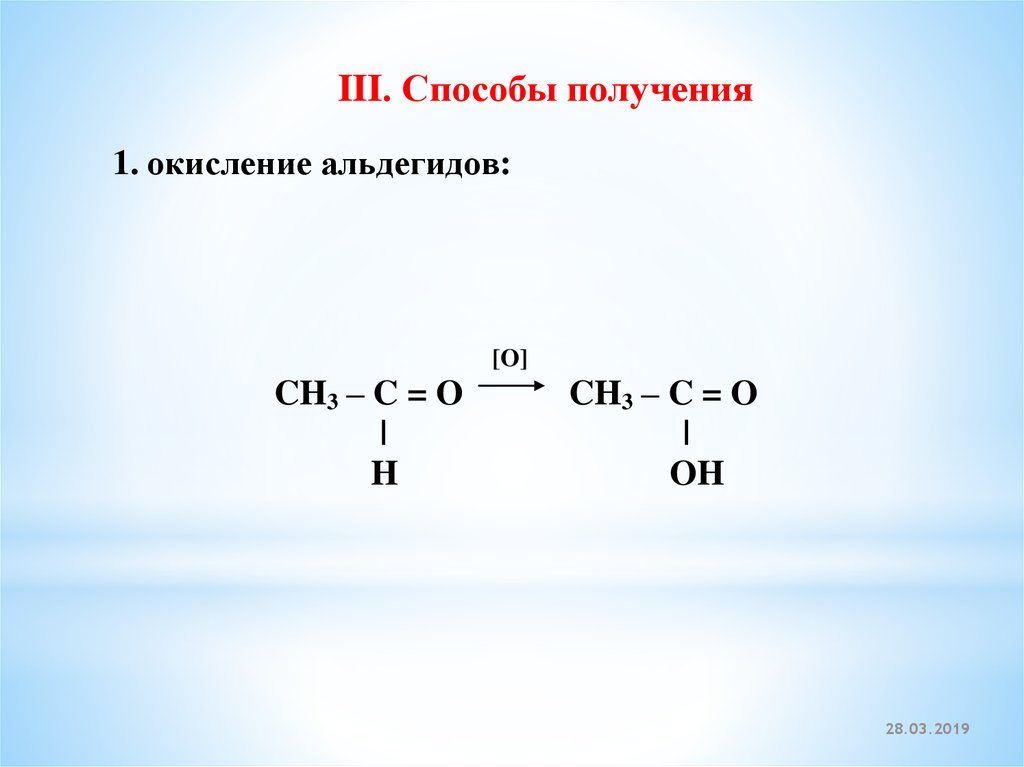
III. Способы получения1. окисление альдегидов:
[O]
CH3 – C = O
|
H
CH3 – C = O
|
OH
28.03.2019
15.
2. гидролиз тригалогенопроизводных углеводородов:Cl
|
CH3 – C – Cl
|
Cl
3NaOH
OH
|
[CH3 – C – OH]
|
OH
CH3 – C = O + Н2О
|
OH
28.03.2019
16.
3. реакция карбоксилирования:эфир
CH3–CH2+Mg
|
Cl
+СО 2
CH3–CH2
|
MgCl
+
+H
CH3–CH2–C=O
|
OMgCl
O
||
CH3–CH2–C + MgClOH
|
OH
28.03.2019
17.
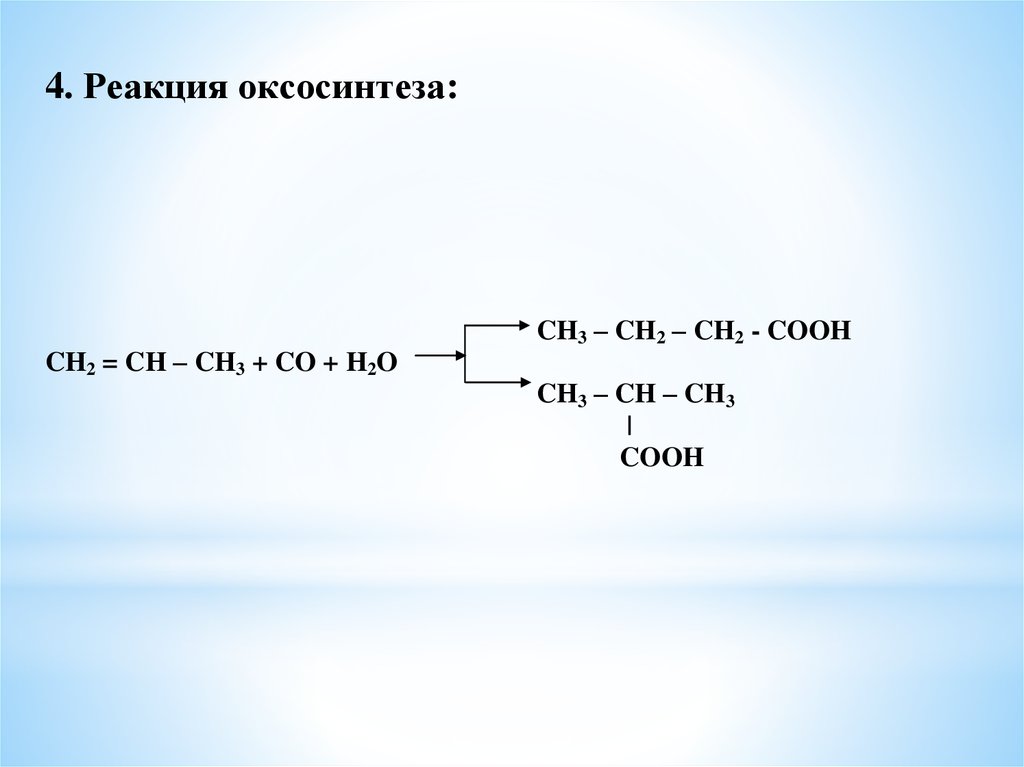
4. Реакция оксосинтеза:CH2 = CH – CH3 + CO + H2O
CH3 – CH2 – CH2 - COOH
CH3 – CH – CH3
|
COOH
18.
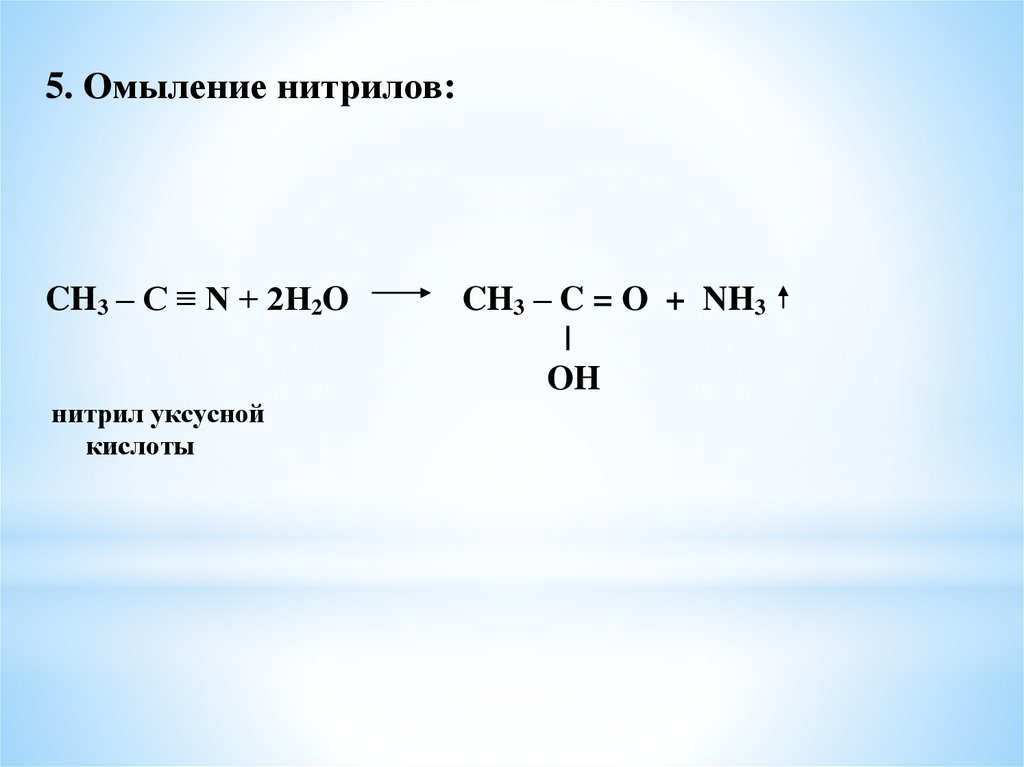
5. Омыление нитрилов:CH3 – C ≡ N + 2H2O
нитрил уксусной
кислоты
CH3 – C = O + NH3
|
OH
19.
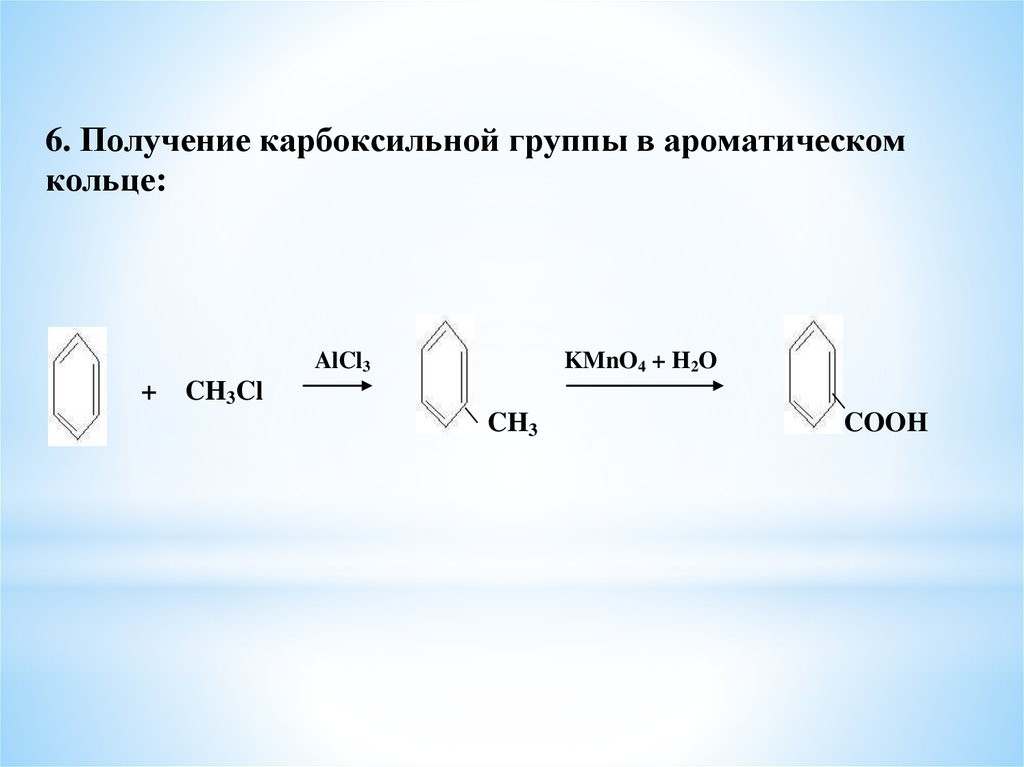
6. Получение карбоксильной группы в ароматическомкольце:
AlCl3
+
KMnO4 + H2O
CH3Cl
CH3
COOH
20.
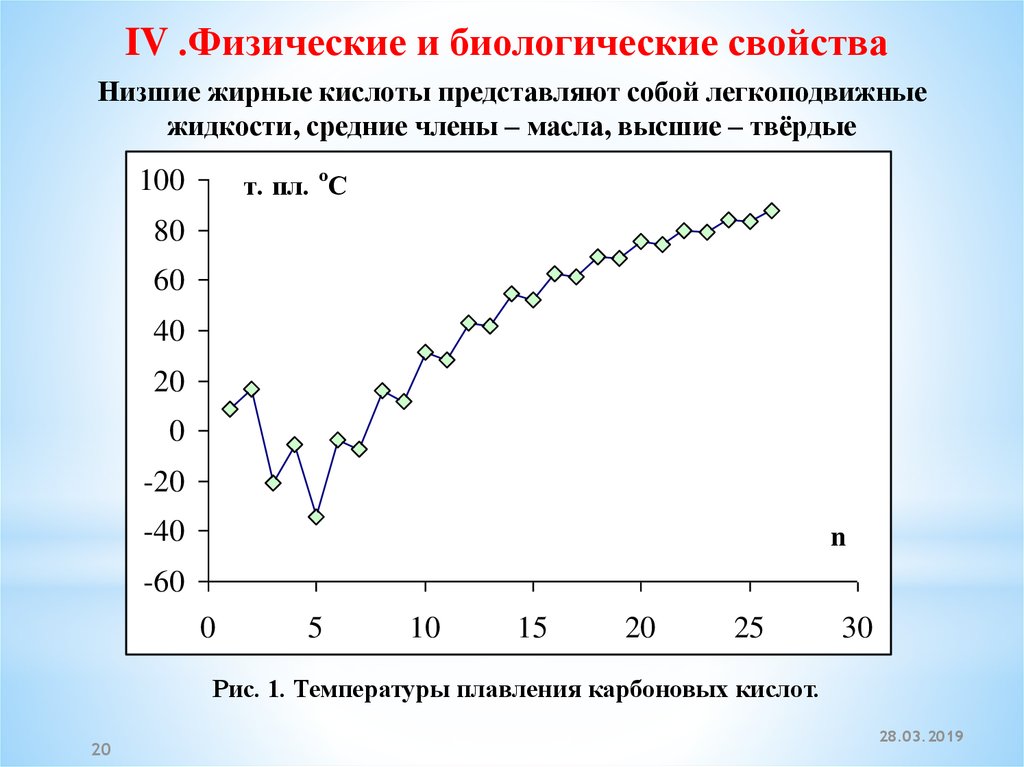
IV .Физические и биологические свойстваНизшие жирные кислоты представляют собой легкоподвижные
жидкости, средние члены – масла, высшие – твёрдые
кристаллические вещества.
о
100
т. пл. С
80
60
40
20
0
-20
-40
n
-60
0
5
10
15
20
25
30
Рис. 1. Температуры плавления карбоновых кислот.
20
28.03.2019
21.
250о
RCOOH
т. кип. С
200
R-CH2OH
150
R-CHO
100
50
0
n
-50
0
2
4
6
8
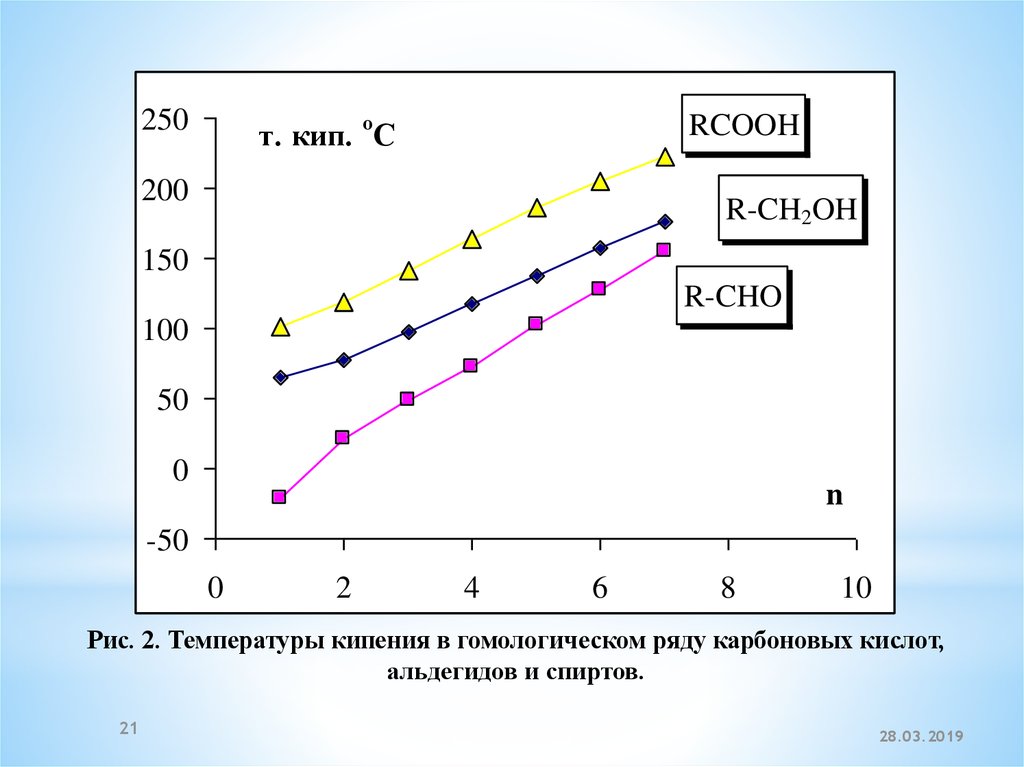
10
Рис. 2. Температуры кипения в гомологическом ряду карбоновых кислот,
альдегидов и спиртов.
21
28.03.2019
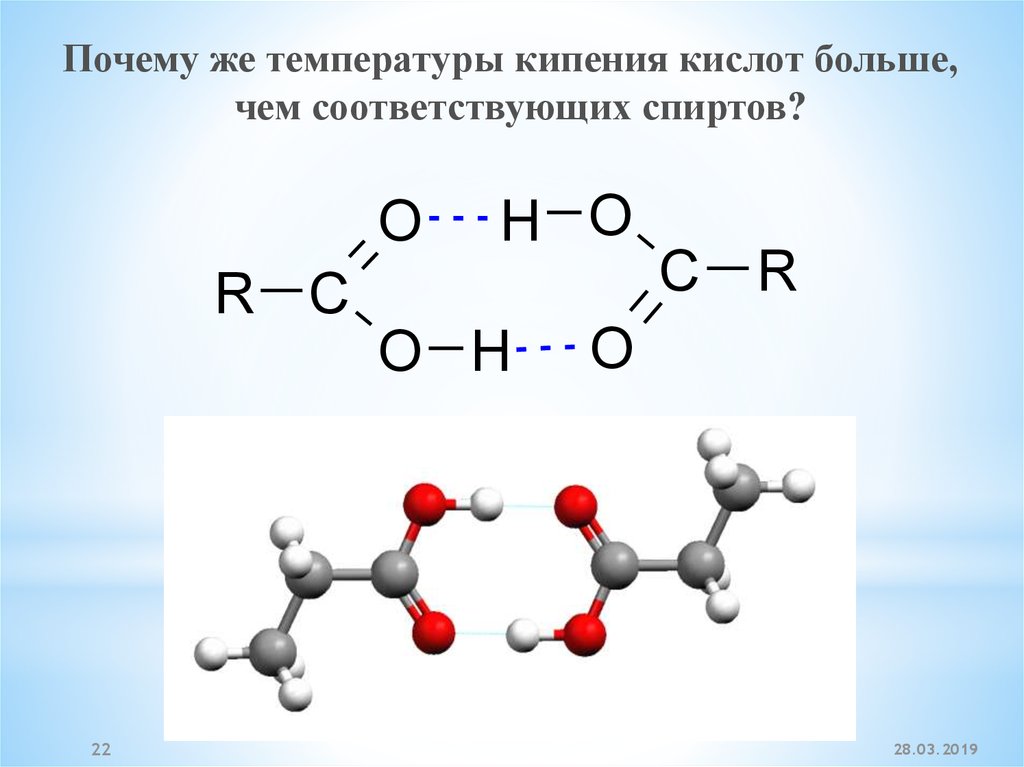
22.
Почему же температуры кипения кислот больше,чем соответствующих спиртов?
O
H O
R C
O H
22
C R
O
28.03.2019
23.
Первые челны гомологического ряда карбоновыхкислот обладают резким запахом, средние –
прогорклым, неприятным, например, масляная
кислота пахнет потом, высшие карбоновые
кислоты вследствие нелетучести лишены запаха.
Карбоновые кислоты, как правило, не ядовиты,
однако приём внутрь концентрированных
растворов (например, уксусной эссенции)
вызывает тяжёлые ожоги. Нежелательно
попадание этих растворов на кожу и тем более
внутрь.
23
28.03.2019
24.
Муравьиная кислота, HCOOH, жидкость срезким запахом, tкип 100,8 °С. Применяют в
качестве протравы при крашении текстиля
и бумаги, обработки кожи, для получения
лекарственных
средств,
пестицидов,
растворителей (ДМФА), как консервант
фруктовых соков, сена и для дезинфекции
бочек для пива и вина.
24
28.03.2019
25.
Уксусная кислота, СН3СООН, бесцветная срезким запахом жидкость. Т.пл. 16,75 °С, т.
кип. 118,1 °С. Применяют в пищевой
промышленности, для получения солей,
эфиров,
уксусного
ангидрида,
ацетилхлорида,
ацетатного
волокна,
лекарственных (аспирин) и душистых
веществ,
хлоруксусных
кислот,
как
растворитель, например, в производстве
ацетата целлюлозы (ацетатного волокна).
25
28.03.2019
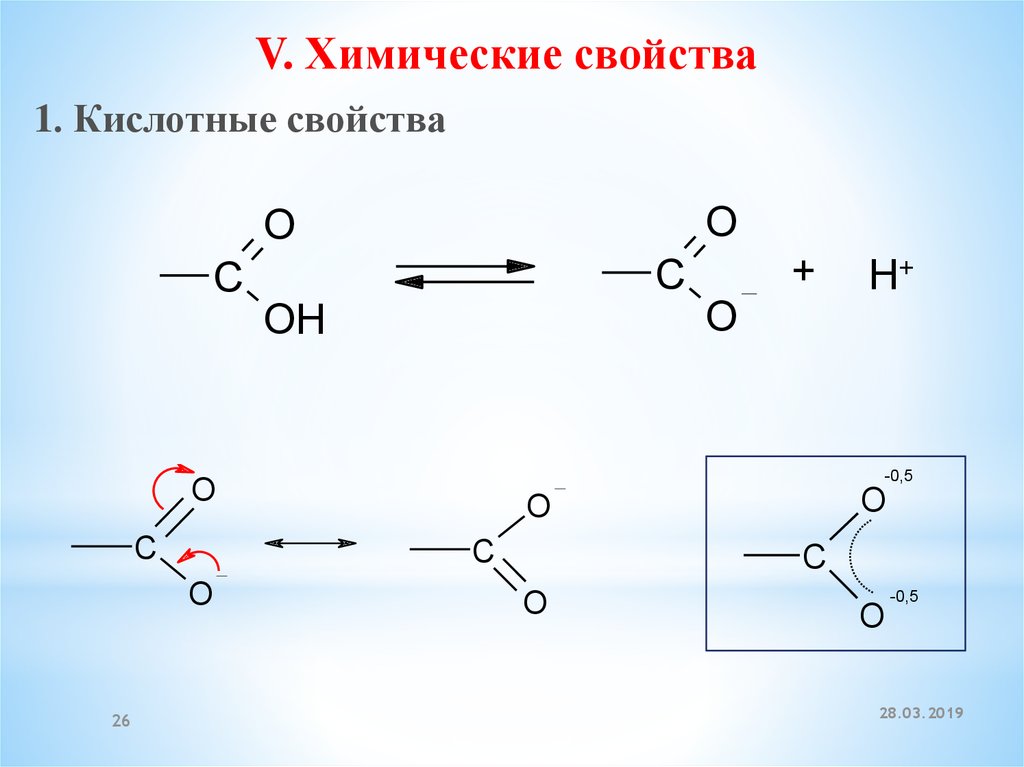
26.
V. Химические свойства1. Кислотные свойства
O
O
-0,5
O
26
O
O
C
O
H+
O
OH
C
+
C
C
C
O
O
-0,5
28.03.2019
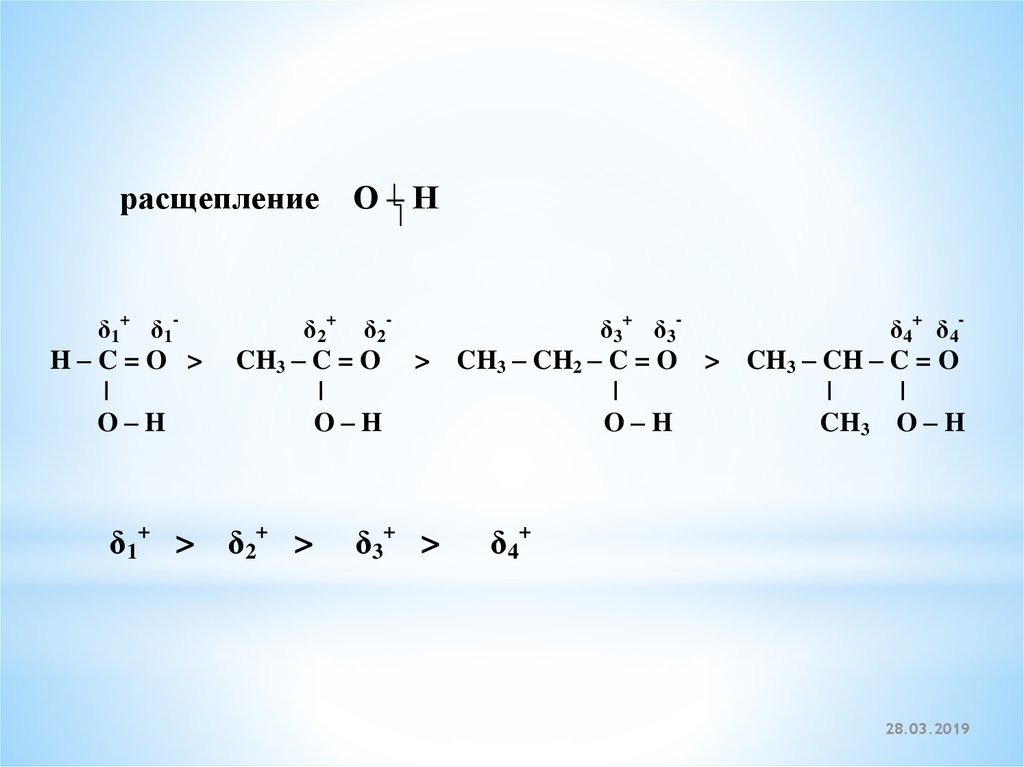
27.
расщепление О – Нδ1+ δ1H–C=O >
|
O–H
δ2+ δ2CH3 – C = O >
|
O–H
δ1+ > δ2+ >
δ3+ >
δ3+ δ3CH3 – CH2 – C = O >
|
O–H
δ4+ δ4CH3 – CH – C = O
|
|
CH3 O – H
δ4+
28.03.2019
28.
Кислоты слабые электролитыCH3 – C = O
|
OH
+
Н2О
CH3 – C = O + H3O+
|
O-
28.03.2019
29.
30.
31.
1) образование солей:R–C=O
|
O–H
CH3 – C = O + NaOH
|
OH
CH3 – C = O + H2O
|
ONa
натриевая соль уксусной кислоты,
ацетат натрия
28.03.2019
32.
33.
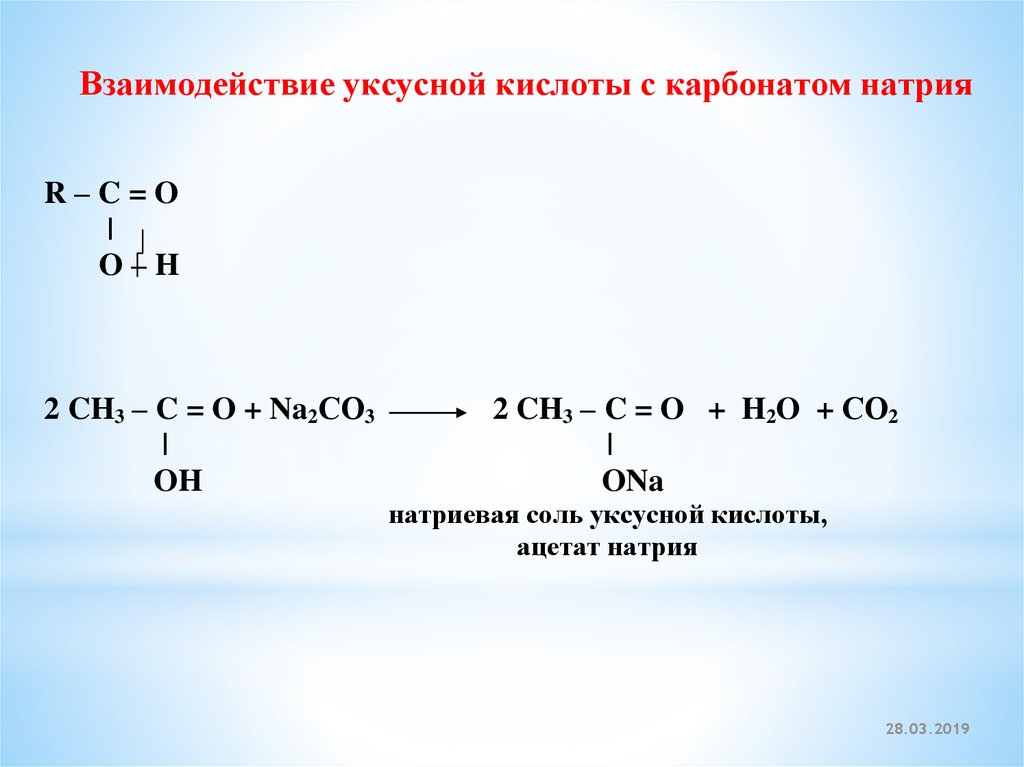
Взаимодействие уксусной кислоты с карбонатом натрияR–C=O
|
O–H
2 CH3 – C = O + Na2СО3
|
OH
2 CH3 – C = O + H2O + СО2
|
ONa
натриевая соль уксусной кислоты,
ацетат натрия
28.03.2019
34.
35.
Взаимодействие уксусной кислоты с металлами2CH3 – C = O + Zn
|
OH
CH3 – C = O
|
O – Zn + H2
|
CH3 – C – O
||
O ацетат цинка
2CH3 – C = O + Mg
|
OH
CH3 – C = O
|
O – Mg + H2
|
CH3 – C – O
||
O ацетат магния
28.03.2019
36.
37.
Образование кальциевых солей жирных кислот2CH3 – (CH2)16 – C = O
|
ONa
стеарат натрия
+
CaCl2
CH3 – (CH2)16 – C = O
|
O – Ca + 2NaCl
|
CH3 – (CH2)16 – C – O
||
O
стеарат кальция
28.03.2019
38.
39.
Выделение жирных кислот из мыла2CH3 – (CH2)16 – C = O
|
ONa
стеарат натрия
+ Н2SO4
2CH3 – (CH2)16 – COОН
+ Na2SO4
28.03.2019
40.
41.
2. Образование функциональных производных карбоновых кислот:R–C=O
|
OH
а) образование галогенангидридов карбоновых кислот
CH3 – C = O +
|
OH
PCl3
PCl5
SOCl2
+
+
+
H3PO3
POCl3
SO2
CH3 – C = O
|
Cl
хлорангидрид уксусной кислоты
(ацетилхлорид)
+
+
HCl
HCl
б) образование сложных эфиров
H+
O
||
CH3 – C – O – CH2 – CH3
CH3 – C = O + CH3 – CH2 – OH
+
|
OH
этиловый эфир уксусной кислоты
этилацетат
H2O
28.03.2019
42.
43.
Полимерные сложные эфирыO
O
O
C
C O CH2 CH2 O C
O
C O CH2 CH2 O
n
Полиэтилентерефталат - синтетический полимер, продукт
поликонденсации этиленгликоля с терефталевой кислотой (или ее
диметиловым эфиром);
Полиэтилентерефталат перерабатывают главным образом в
полиэфирные волокна – лавсан (дакрон, терилен и др. торговые
названия), идущие на производство тканей.
Глифталевые смолы являются продуктами поликонденсации
фталевой кислоты и глицерина (в промышленности их получают из
глицерина и фталевого ангидрида). Являются вязкими, липкими
веществами, которые используются для производства алкидных
лаков и олифы.
43
28.03.2019
44.
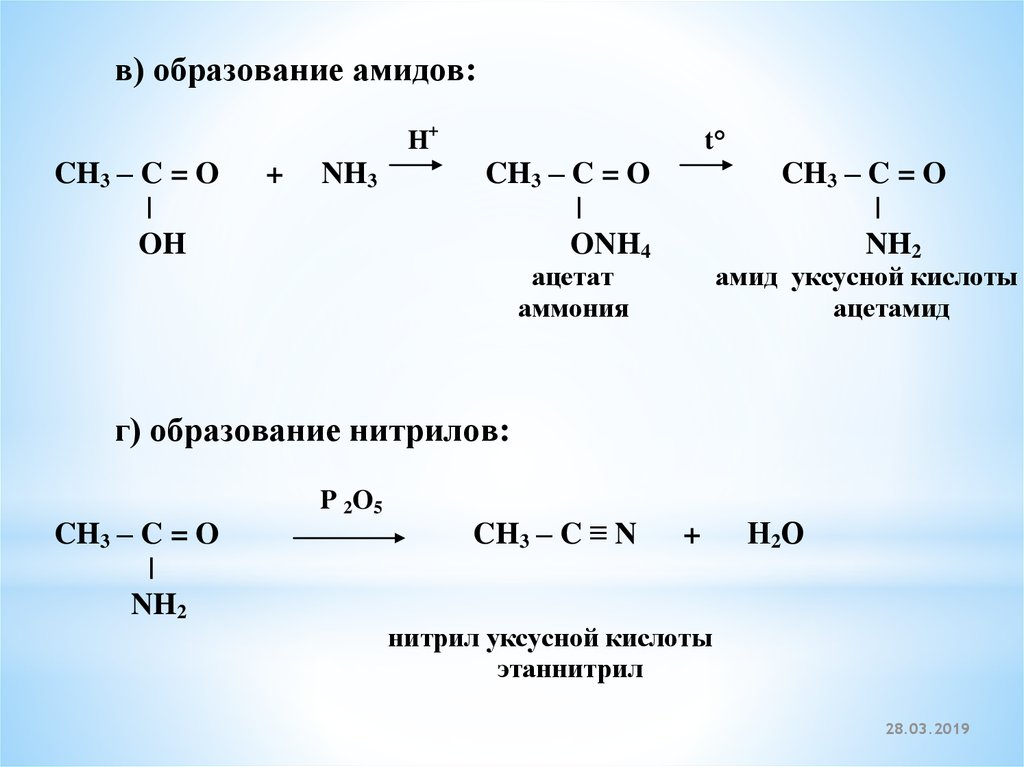
в) образование амидов:H+
CH3 – C = O
|
OH
+
NH3
t°
CH3 – C = O
|
ONH4
CH3 – C = O
|
NH2
ацетат
аммония
амид уксусной кислоты
ацетамид
г) образование нитрилов:
CH3 – C = O
|
NH2
P 2O5
CH3 – C ≡ N
+
Н2О
нитрил уксусной кислоты
этаннитрил
28.03.2019
45.
д) образование ангидридов карбоновых кислот:CH3 – C = O
|
OH
+
CH3 – C – OH
||
O
t
- Н 2O
CH3 – C = O
|
O
|
CH3 – C = O
андигид уксусной кислоты
CH3 – C = O
|
ONa
+
Cl
|
CH3 – C = O
–NaCl
CH3 – C = O
|
O
|
CH3 – C = O
28.03.2019
46.
3. Реакции функциональных производных карбоновых кислот:1) реакции галогенангидридов
CH3 – C = O
|
Cl
CH3 – C = O
|
Cl
CH3 – C = O
|
Cl
+
HOH
+
CH3OH
+
2NH3
CH3 – C = O
|
OH
+
HCl
CH3 – C = O +
|
OCH3
CH3 – C = O
|
NH2
+
HCl
NH4Cl
28.03.2019
47.
2) реакции ангидридов карбоновых кислотCH3 – C = O
|
O
|
CH3 – C = O
+
CH3 – C = O
|
O
|
CH3 – C = O
+ CH3OH
CH3 – C = O + CH3 – C = O
|
|
OCH3
OH
CH3 – C = O
|
O
|
CH3 – C = O
+
CH3 – C = O + CH3 – C = O
|
|
NH2
OH
NH3
HOH
2 CH3 – C = O
|
OH
28.03.2019
48.
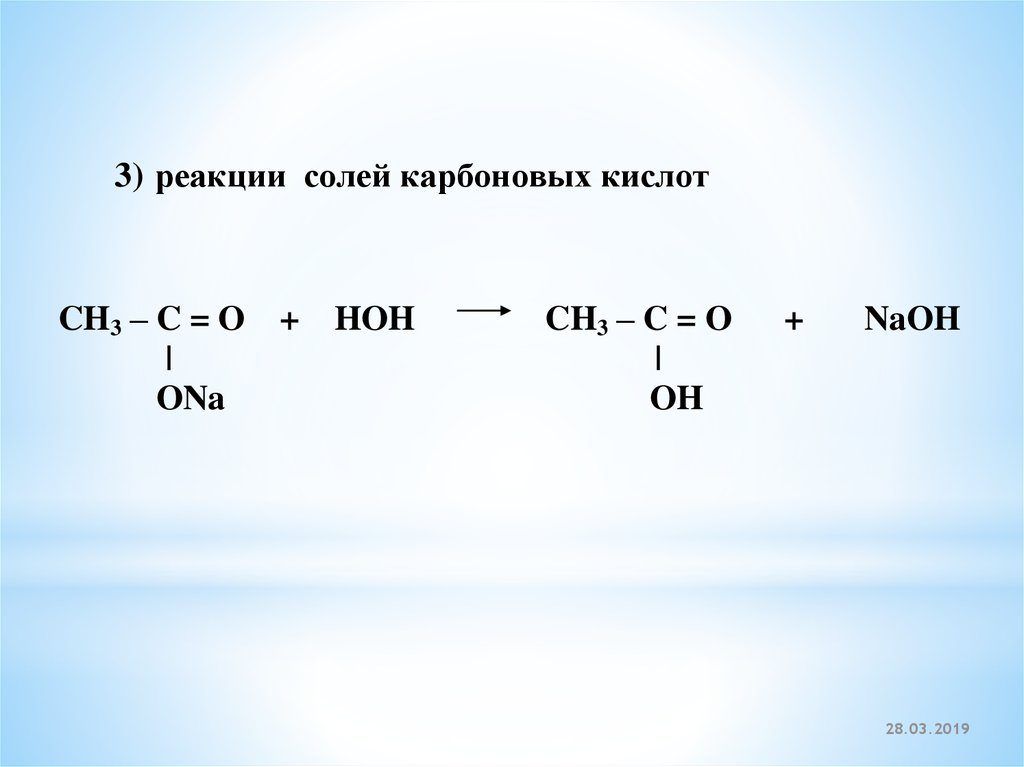
3) реакции солей карбоновых кислотCH3 – C = O
|
ONa
+
HOH
CH3 – C = O
|
OH
+
NaOH
28.03.2019
49.
50.
4. Реакции восстановления:[H]
CH3 – C = O
|
OH
[H]
CH3 – C = O
|
H
[H]
CH3 – CH2
|
OH
CH3 – CH3
28.03.2019
51.
Карбоксильная группа восстанавливается сбольшим трудом. Для того чтобы
восстановить карбоновую кислоту до
углеводорода требуется длительное
кипячение с HI в присутствии фосфора.
Прямое восстановление карбоновых кислот
до спиртов водородом достигается при
использовании высоких давлений и
катализаторов (Cu, Ni, Co, Zn-Cr-Cu-Cd,
Шраут, Норманн).
51
28.03.2019
52.
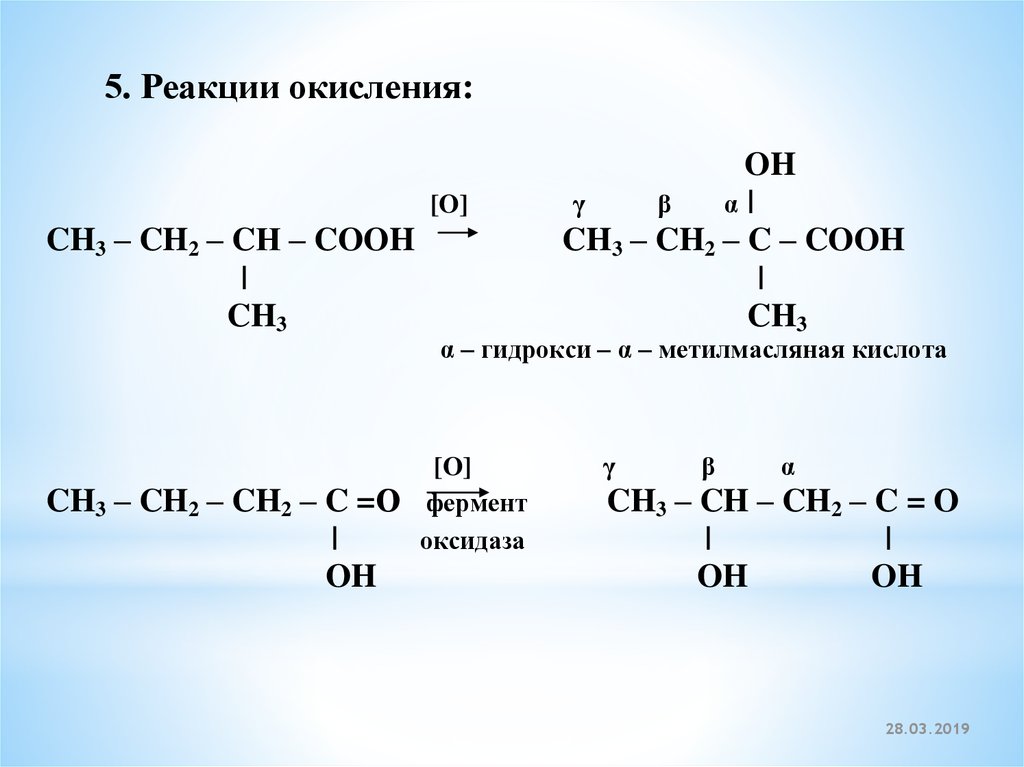
5. Реакции окисления:[O]
CH3 – CH2 – CН – COOH
|
CH3
CH3 – CH2 – CH2 – C =О
|
OH
OH
γ
β
α|
CH3 – CH2 – C – COOH
|
CH3
α – гидрокси – α – метилмасляная кислота
[O]
фермент
оксидаза
γ
β
α
CH3 – CH – CH2 – C = O
|
|
OH
OH
28.03.2019
53.
54.
6. Реакции замещения:P
CH3 – CH2 – C = O
|
OH
+
Cl2
Cl
|
CH3 – CH – COOH
+ HCl
28.03.2019
55.
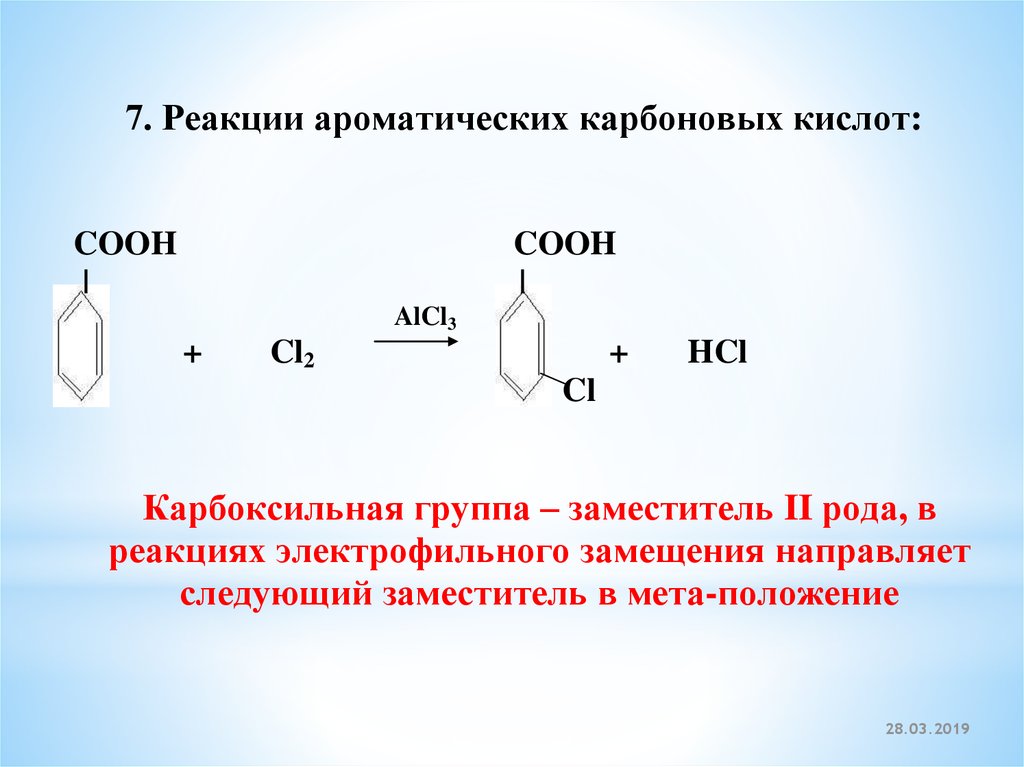
7. Реакции ароматических карбоновых кислот:COOH
|
COOH
|
AlCl3
+
Cl2
+
HCl
Cl
Карбоксильная группа – заместитель II рода, в
реакциях электрофильного замещения направляет
следующий заместитель в мета-положение
28.03.2019
56.
8. Реакции двухосновных карбоновых кислот:1) реакции декарбоксилирования
t
HOOC – COOH
H–C=O
|
OH
– CO2
t
HOOC – CH2 – COOH
CH3 – C = O
–CO2
|
OH
28.03.2019
57.
2) реакции дегидратации:CH2 – COOH
|
CH2 – COOH
t
–H2O
янтарная кислота
CH2 – COOH
|
CH2
|
CH2 – COOH
O
||
CH2 – C – O
|
|
CH2 – C = O
ангидрид янтарной кислоты
t
глутаровая кислота
CH2 – C = O
|
|
CH2 O
+
|
|
CH2 – C = O
H2O
ангидрид глутаровой кислоты
28.03.2019
58.
O||
CH2 – CH2 – C – OH
|
CH2 – CH2 – C – OH
||
O
адипиновая кислота
t
CH2 – CH2
|
C = O + Н2О + СО2
CH2 – CH2
циклопентанон
28.03.2019
59.
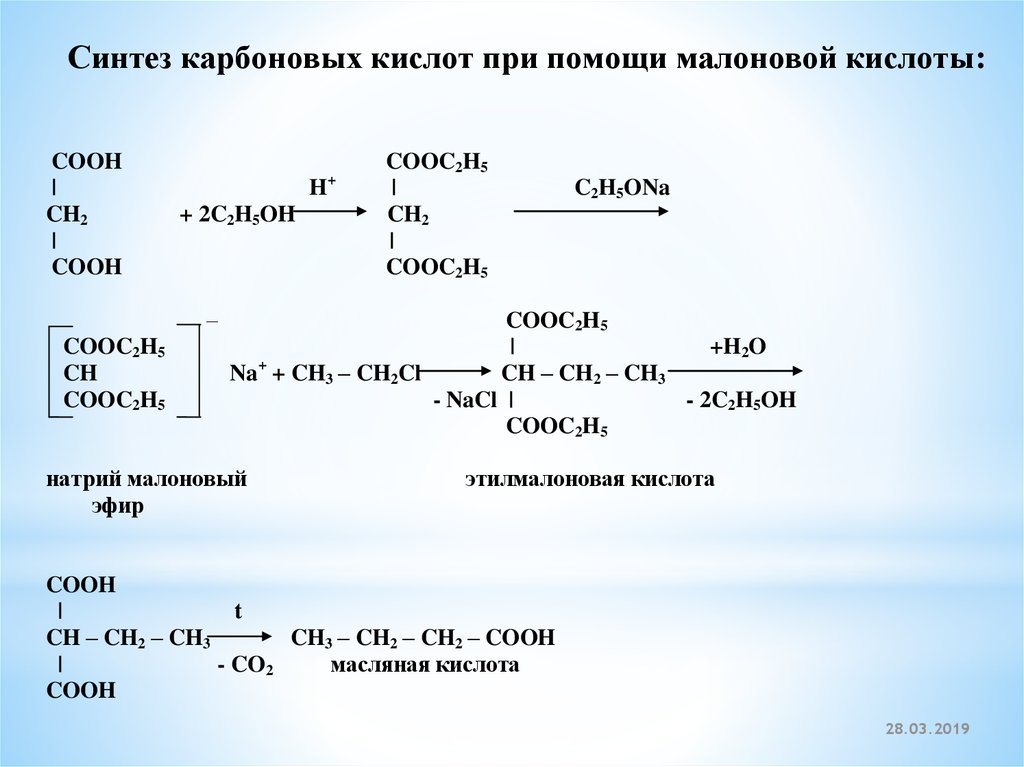
Синтез карбоновых кислот при помощи малоновой кислоты:COOH
|
CH2
|
COOH
H
+ 2C2H5OH
–
COOC2H5
CH
COOC2H5
+
COOC2H5
|
CH2
|
COOC2H5
C2H5ONa
COOC2H5
|
+H2O
+
Na + CH3 – CH2Cl
CH – CH2 – CH3
- NaCl |
- 2C2H5OH
COOC2H5
натрий малоновый
эфир
этилмалоновая кислота
COOH
|
t
CH – CH2 – CH3
CH3 – CH2 – CH2 – COOH
|
- CO2
масляная кислота
COOH
28.03.2019
60.
9. Реакция ненасыщенных карбоновых кислот (двойныесвязи в сопряжении относительно друг друга)
δ+
δ-
CH2 – CH = CH – C = O + H2O
|
OH
CH3 – CH – CH2 – C = O
|
|
OH
OH
δ+
CH3 – CH – CH = C – OH
|
|
OH
OH
В этом случае водород всегда
направляется в α- положение
относительно углерода
карбоксильной группы
δ-
CH2 – CH = CH – C = O + HBr
|
OH
CH3 – CH – CH = C – OH
|
|
Br
OH
CH3 – CH – CH2 – C = O
|
|
OH
OH
δ+
δ-
CH2 – CH = CH – C = O + NH3
|
OH
CH3 – CH – CH = C – OH
|
|
NH2
OH
28.03.2019
61.
Если двойные связи изолированныеотносительно друг друга, то реакция идёт по правилу
Марковникова
CH2 = CH – CH2 – C = O + HBr
|
OH
CH3 – CH – CH2 – C = O
|
|
Br
OH
28.03.2019
62.
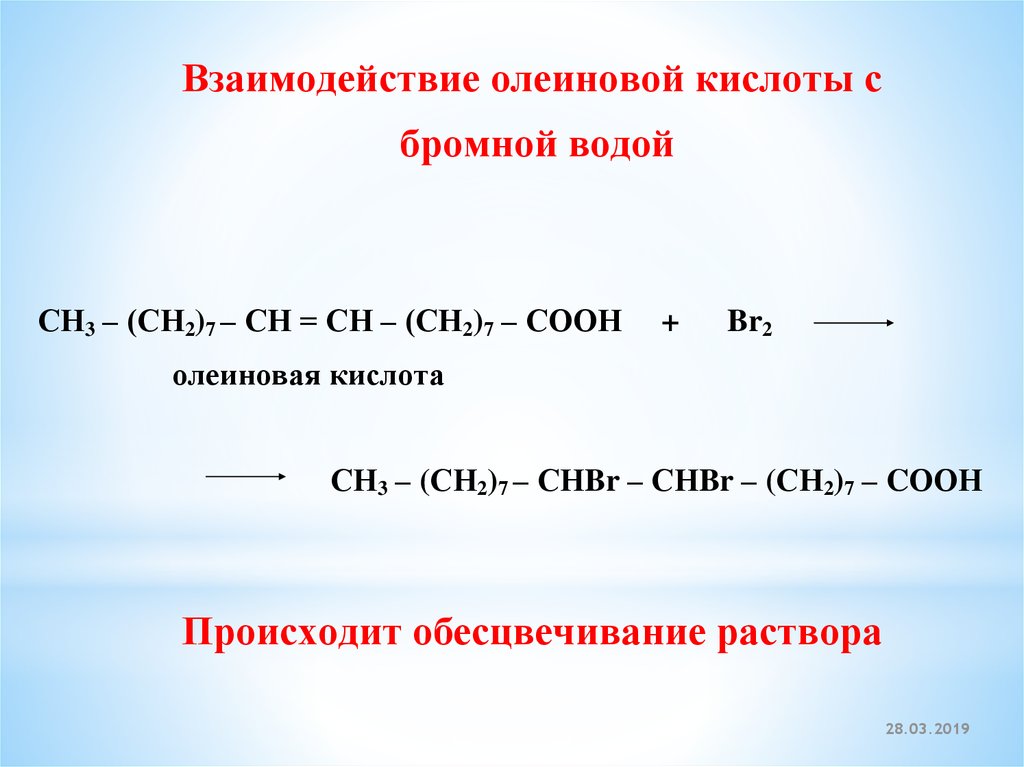
Взаимодействие олеиновой кислоты сбромной водой
СН3 – (СН2)7 – СН = СН – (СН2)7 – CООН
+
Br2
олеиновая кислота
СН3 – (СН2)7 – СНBr – СНBr – (СН2)7 – CООН
Происходит обесцвечивание раствора
28.03.2019
63.
64.
Реакция разложения муравьиной кислотыH–C=O
|
OH
Н2SO4
CO
+
Н2О
28.03.2019
65.
66.
67.
68.
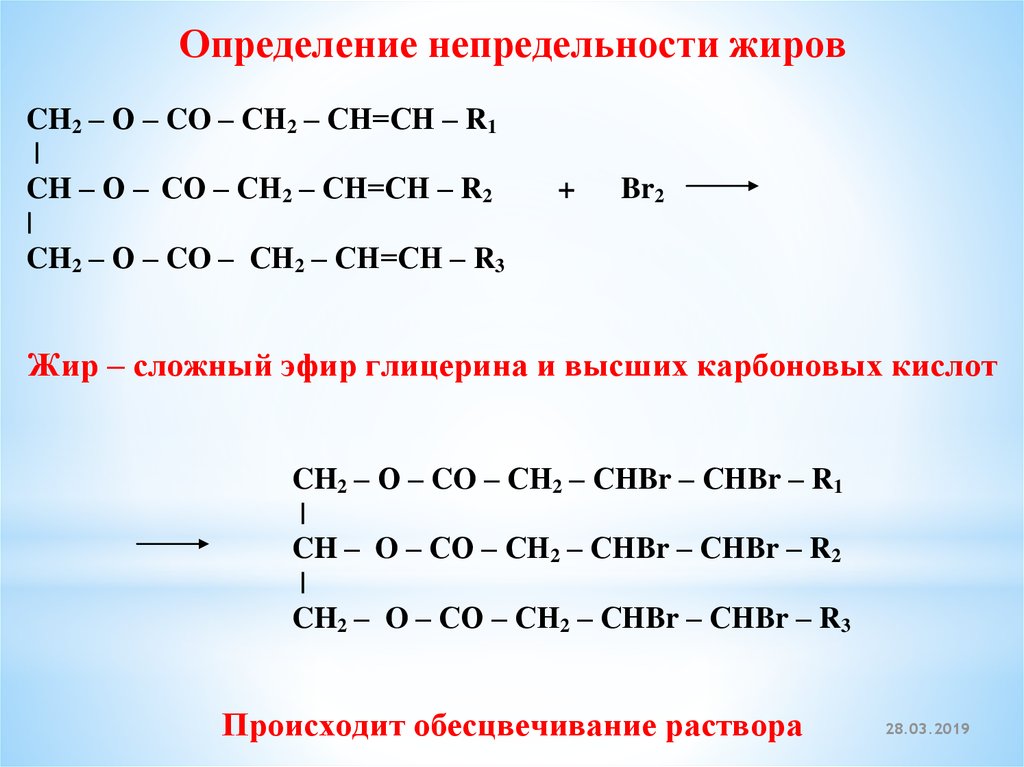
Определение непредельности жировCH2 – О – CO – СН2 – СН=СН – R1
|
CH – О – СО – СН2 – СН=СН – R2
|
CH2 – О – CO – СН2 – СН=СН – R3
+
Br2
Жир – сложный эфир глицерина и высших карбоновых кислот
CH2 – О – CO – СН2 – СНBr – СНBr – R1
|
CH – O – СО – СН2 – СНBr – СНBr – R2
|
CH2 – O – СО – СН2 – СНBr – СНBr – R3
Происходит обесцвечивание раствора
28.03.2019
69.
70.
71. Спасибо за Ваше внимание!
7128.03.2019



















































 Химия
Химия








