Похожие презентации:
Карбоновые кислоты (часть 2)
1.
6. Гидролиз нитриловBr + NaCN
CN + NaBr
7. Синтез с реактивом Гриньяра
R-MgBr + СО2 → R-COO-MgBr → R-COOH + Mg(OH)Br
8. Реакции карбонилирования
Это химические реакции введения карбонильных групп С=О
путём взаимодействия с оксидом углерода.
Для проведения этих реакций обычно применяется гомогенные
катализаторы при повышенном давлении.
2.
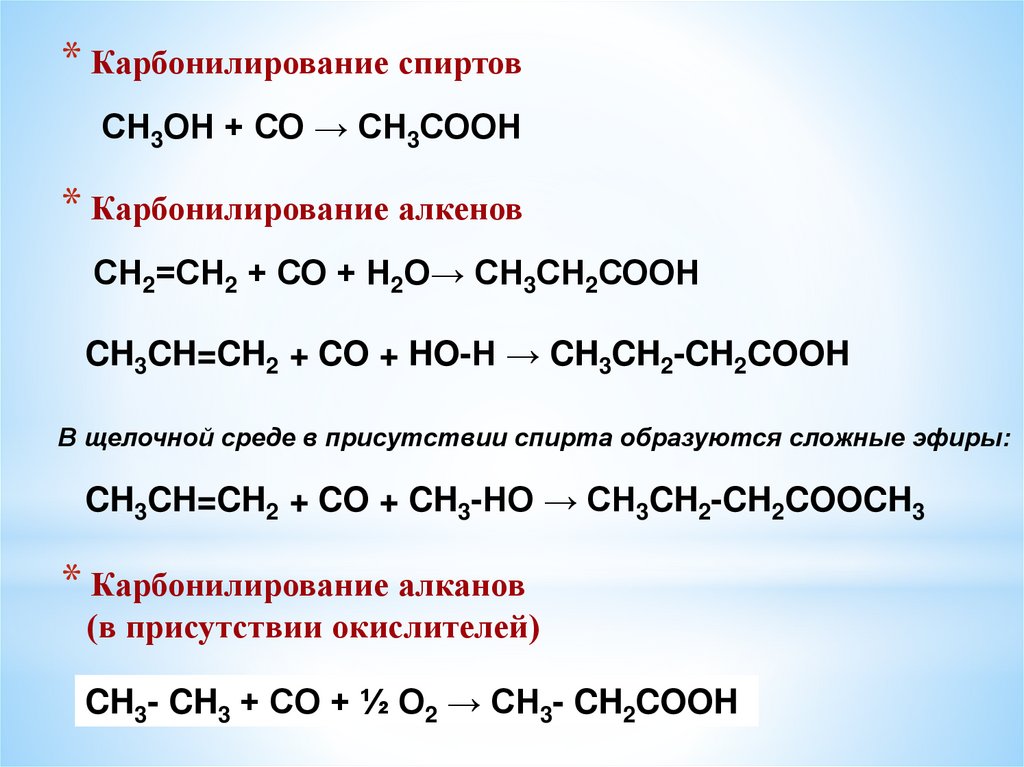
* Карбонилирование спиртовСН3ОН + СО → СН3СООН
* Карбонилирование алкенов
СН2=СН2 + СО + Н2О→ СН3СН2СООН
CH3CH=CH2 + CO + HO-Н → CH3CH2-CH2COOH
В щелочной среде в присутствии спирта образуются сложные эфиры:
CH3CH=CH2 + CO + CH3-HO → CH3CH2-CH2COOCH3
* Карбонилирование алканов
(в присутствии окислителей)
CH3- CH3 + CO + ½ O2 → CH3- CH2COOH
3.
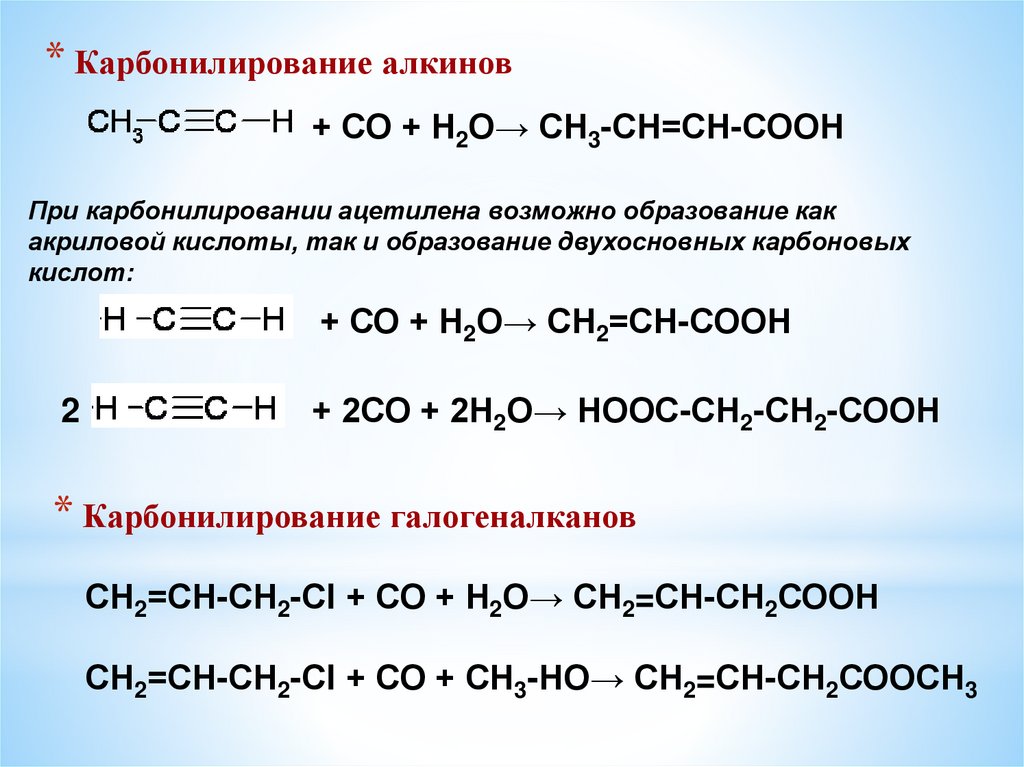
* Карбонилирование алкинов+ СО + Н2О→ СН3-СН=СН-СООН
При карбонилировании ацетилена возможно образование как
акриловой кислоты, так и образование двухосновных карбоновых
кислот:
+ СО + Н2О→ СН2=СН-СООН
2
+ 2СО + 2Н2О→ НООС-СН2-СН2-СООН
* Карбонилирование галогеналканов
СН2=СН-СН2-Сl + СО + Н2О→ СН2=СН-СН2СООН
СН2=СН-СН2-Сl + СО + СН3-НО→ СН2=СН-СН2СООСН3
4.
IV. Химические свойстваХимические свойства карбоновых кислот определяются
особенностями строения карбоксильной группы и строением
связанного с ней алкильного радикала.
Карбоксильная группа -СООН состоит из карбонильной группы С=О
и гидроксильной группы ОН, при этом свойства карбоксильной
группы отличаются от свойств составляющих ее групп, которые в
свою очередь оказывают взаимное влияние друг на друга:
5.
В группе С = О атом углерода несет частичный положительныйзаряд и притягивает к себе неподеленную электронную пару атома
кислорода в группе ОН. При этом электронная плотность на атоме
кислорода уменьшается, и связь О-Н ослабляется – происходит
усиление кислотных свойства карбоновых кислот.
В свою очередь, группа -ОН частично "гасит" положительный
заряд на группе С=О, которая из-за этого теряет способность к
реакциям присоединения, характерным для карбонильных
соединений.
Отсюда, карбоновые кислоты — более сильные кислоты, чем
спирты, поскольку атом водорода в карбоксильной группе обладает
повышенной подвижностью благодаря влиянию группы СО.
При этом следует учитывать, что на изменение кислотных
свойств оказывает влияние как особенности строения алкильных
заместителей, так и количество карбоксильных групп в кислоте.
6.
1. Кислотные свойстваO
O
+
C
C
OH
O
O
C
H+
O
C
O
O
! Карбоновые кислоты с точки зрения электролитической
диссоциации являются более слабыми кислотами по сравнению с
сильными неорганическими кислотами, такими как серная, соляная,
азотная. Однако, они более сильнее, чем угольная, сернистая,
сероводородная и другие.
7.
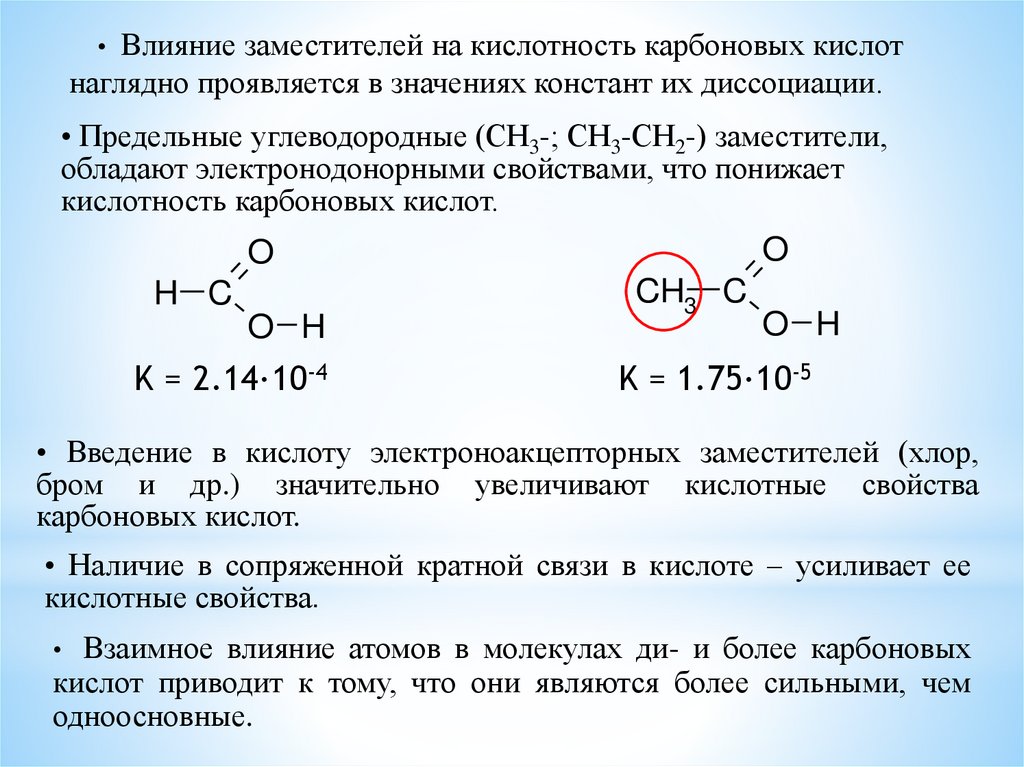
Влияние заместителей на кислотность карбоновых кислотнаглядно проявляется в значениях констант их диссоциации.
• Предельные углеводородные (СН3-; СН3-СН2-) заместители,
обладают электронодонорными свойствами, что понижает
кислотность карбоновых кислот.
O
O
H C
O H
K = 2.14·10-4
CH3 C
O H
K = 1.75·10-5
• Введение в кислоту электроноакцепторных заместителей (хлор,
бром и др.) значительно увеличивают кислотные свойства
карбоновых кислот.
• Наличие в сопряженной кратной связи в кислоте – усиливает ее
кислотные свойства.
Взаимное влияние атомов в молекулах ди- и более карбоновых
кислот приводит к тому, что они являются более сильными, чем
одноосновные.
8.
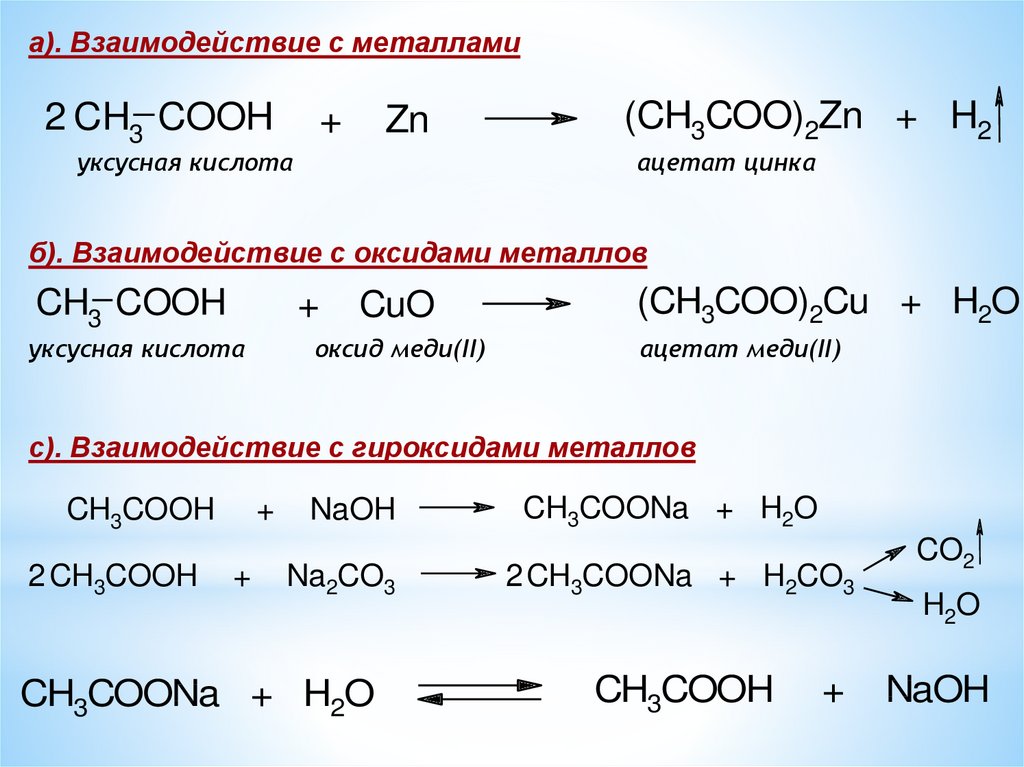
а). Взаимодействие с металлами2 CH3 COOH
+
Zn
уксусная кислота
(CH3COO)2Zn + H2
ацетат цинка
б). Взаимодействие с оксидами металлов
CH3 COOH
+
уксусная кислота
CuO
оксид меди(II)
(CH3COO)2Cu + H2O
ацетат меди(II)
с). Взаимодействие с гироксидами металлов
CH3COOH
2 CH3COOH
+
+
NaOH
Na2CO3
CH3COONa + H2O
CH3COONa + H2O
2 CH3COONa + H2CO3
CH3COOH
+
CO2
H2O
NaOH
9.
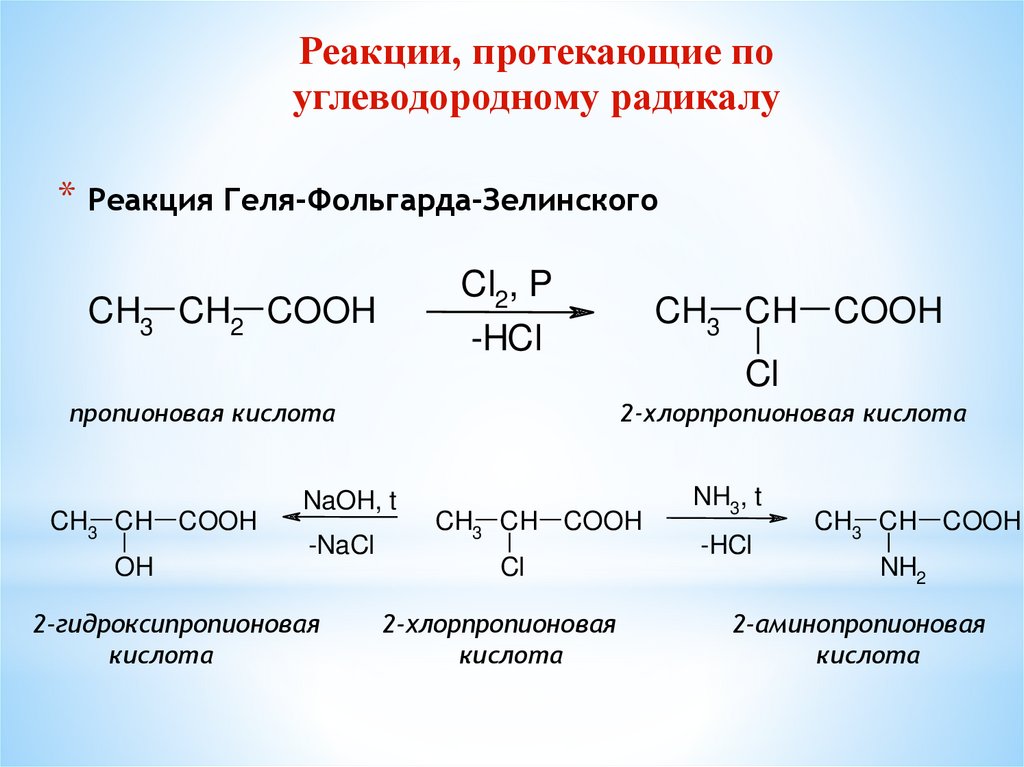
Реакции, протекающие поуглеводородному радикалу
* Реакция Геля-Фольгарда-Зелинского
Cl2, P
CH3 CH2 COOH
CH3 CH COOH
-HCl
Cl
пропионовая кислота
CH3 CH COOH
OH
2-хлорпропионовая кислота
NaOH, t
-NaCl
2-гидроксипропионовая
кислота
CH3 CH COOH
Cl
2-хлорпропионовая
кислота
NH3, t
-HCl
CH3 CH COOH
NH2
2-аминопропионовая
кислота
10.
Непредельные карбоновые кислоты способнык реакциям присоединения:
11.
Реакции декарбоксилированиякарбоновых кислот
R COOH
CH3 COOH
CH3COONa + NaOH
ацетат натрия
R H
+
H2C C O
t
CO2
+
H2O
CH4 + Na2CO3
метан
12.
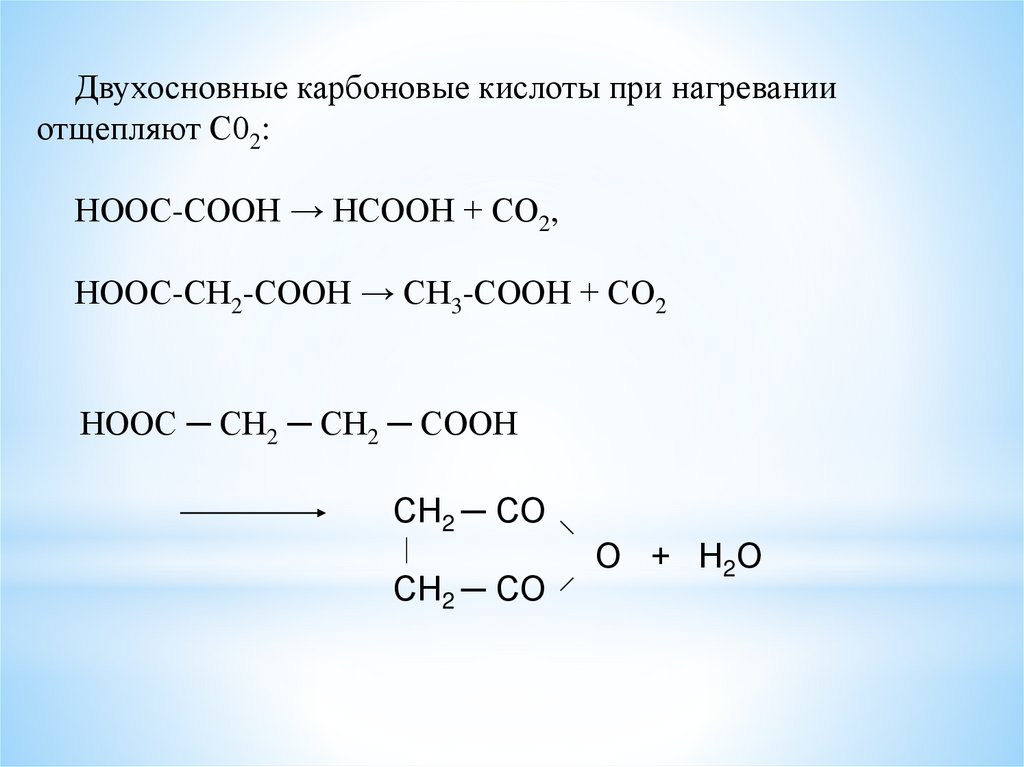
Двухосновные карбоновые кислоты при нагреванииотщепляют С02:
НООС-СООН → НСООН + СО2,
НООС-СН2-СООН → СН3-СООН + СО2
НООС ─ СН2 ─ СН2 ─ СООН
СН2 ─ СО
СН2 ─ СО
О + Н2О
13.
Если при декарбоксилировании происходит ещё и окислениекислоты, то такое декарбоксилирование называется
окислительным.
* Реакция Бородина-Хунсдиккера
CH3 CH2 CH2 COOAg
+
Br2
CH3 CH2 CH2 Br
+ CO2 + AgBr
Реакция Кочи
CH3 CH2 COOH
(CH3COO)4Pb LiCl
CH3 CH2 Cl
14.
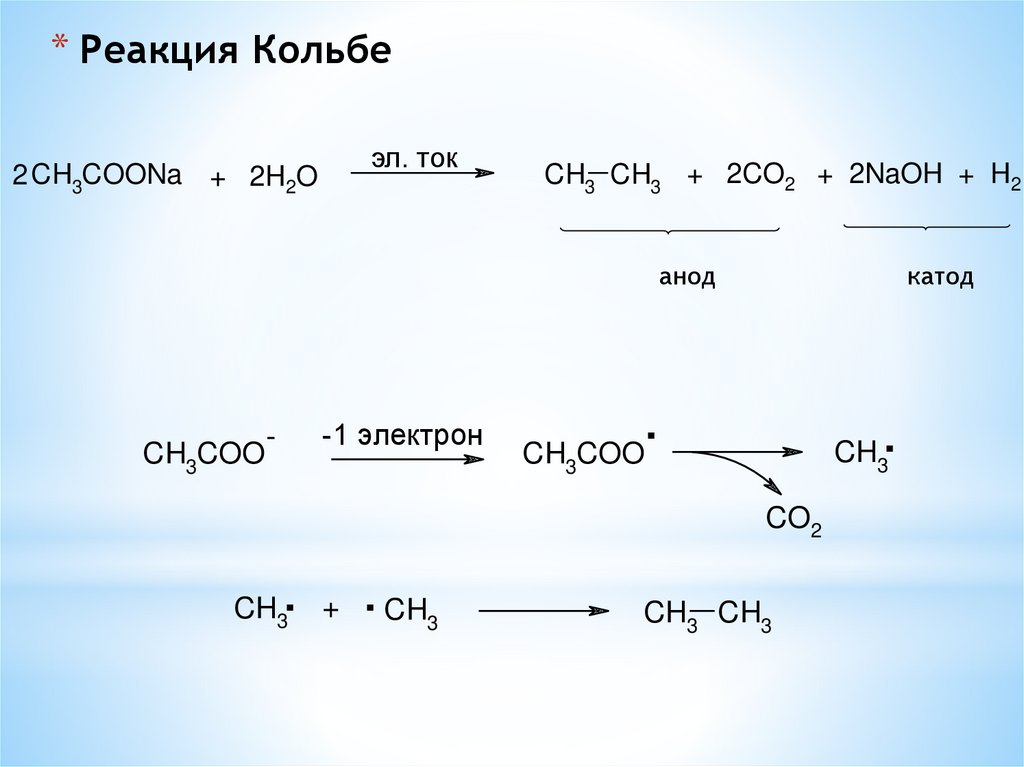
* Реакция Кольбеэл. ток
2 CH3COONa + 2H2O
CH3 CH3 + 2CO2 + 2NaOH + H2
анод
CH3COO
-1 элeктрон
-
катод
.
CH COO
.
CH3
3
CO2
.
CH3
+
. CH
3
CH3 CH3
15.
Окисление и восстановлениекарбоновых кислот
* Все карбоновые кислоты горят с образованием углекислого
газа и воды (например, горение стеариновой и
пальмитиновой кислот наблюдается при горении стеариновой
свечи).
* В организме карбоновые кислоты окисляются в основном за
счёт т.н. b-окисления. Кроме того in vivo встречается также
a- и w-окисление.
* In vitro некоторые аналогичные реакции b-окисления можно
осуществить с помощью 3% перекиси водорода.
CH3 CH2 CH2 COOH
H2O2
CH3 CH CH2 COOH
OH
H2O2
CH3 C CH2 COOH
O
16.
*a-ОкислениеR CH2 COOH
R CHO
H2O2
H2O, CO2
H2O, НАД+
R COOH
НАДН+Н+
Процесс идёт в пероксисомах. При нарушении этого процесса развивается
синдром Рефсума, характеризующийся накоплением фитановой кислоты в
мозге









 Химия
Химия