Похожие презентации:
Общая характеристика металлов. Физические и химические свойства металлов
1. Общая характеристика металлов. Физические и химические свойства металлов
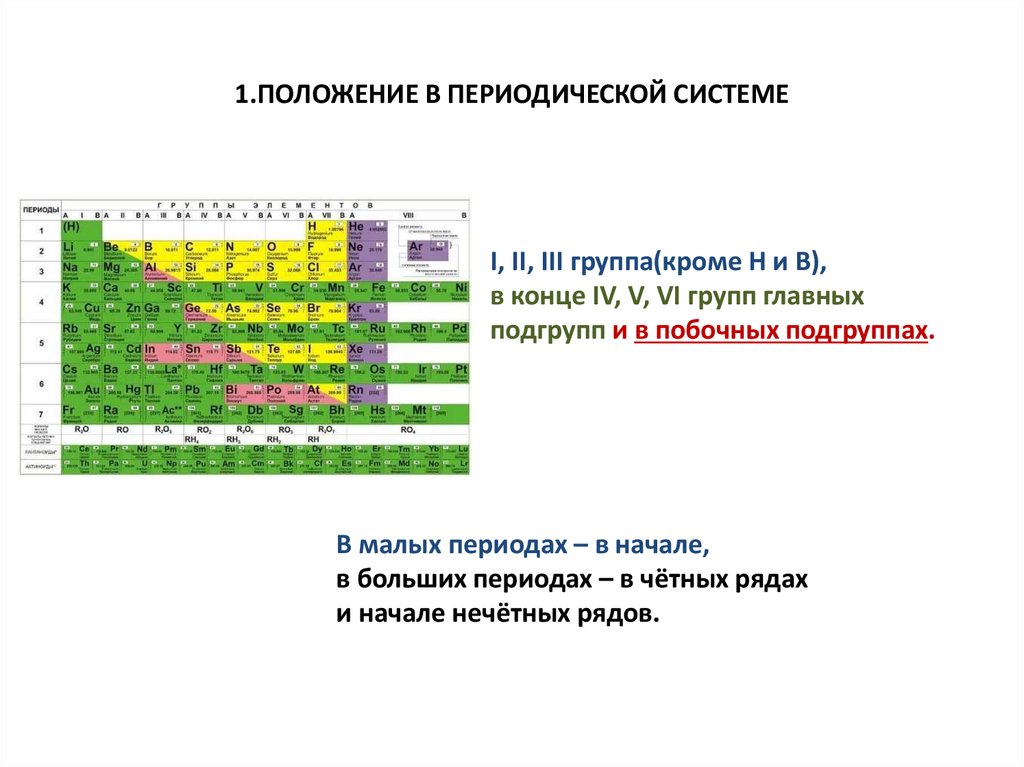
2. 1.ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
I, II, III группа(кроме Н и В),в конце IV, V, VI групп главных
подгрупп и в побочных подгруппах.
В малых периодах – в начале,
в больших периодах – в чётных рядах
и начале нечётных рядов.
3. 2. Особенности строения атомов
-Малое число наружных электронов –1,2,3 е
*Исключение составляют Ме IV-VI групп
главных подгрупп (4, 5, 6 наружных е)
-Относительно большой радиус атома
Ra (Me) ›Ra (HeMe)
*в одном периоде
4. 3. Окислительно-восстановительные свойства
0+n
Ме - ne→Ме
(окисление)
Только
восстановитель
Степень окисления Ме :
0,+1,+2,+3 - низшая
+4,+5,+6,+7,+8 -высшая
5. Изменение окислительно-восстановительных свойств в периодической системе
Изменение окислительновосстановительных свойств впериодической системе
В периоде
Восстановительные (Ме) свойства уменьшаются,
так как увеличивается заряд ядра,
увеличивается число электронов на внешнем
слое, частично стягивается (уменьшается) Ra
В группе
В главной подгруппе восстановительные
(Ме) свойства увеличиваются, так как
увеличивается Ra
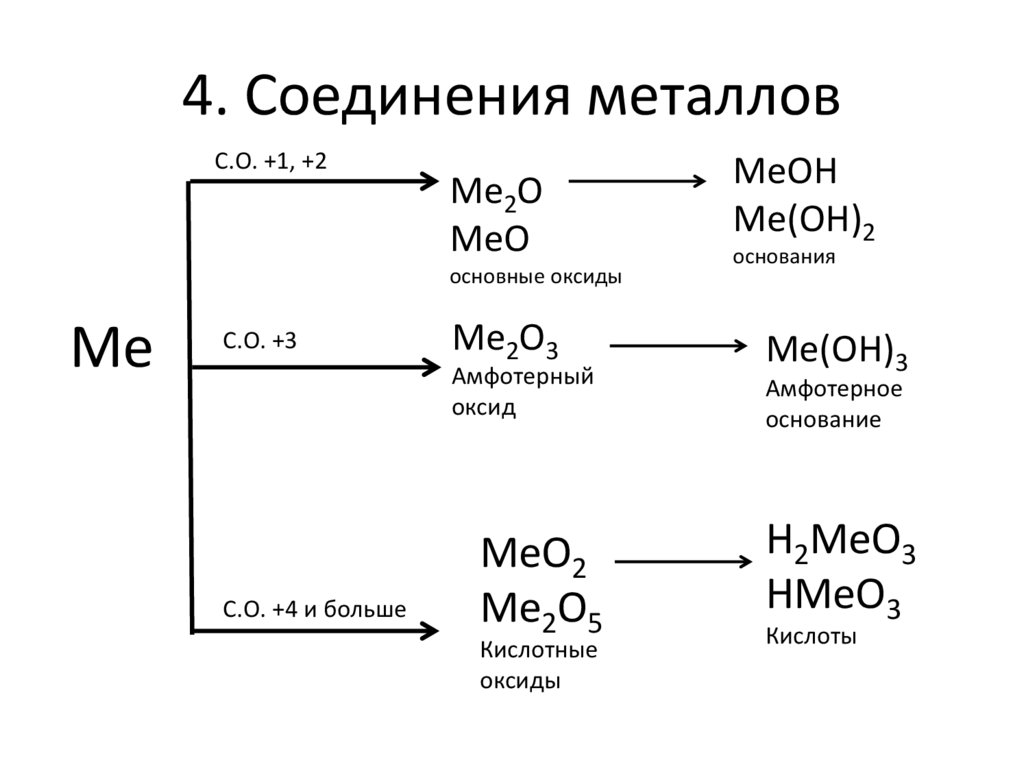
6. 4. Соединения металлов
С.О. +1, +2Ме2О
МеО
основные оксиды
Ме
С.О. +3
Ме2О3
Амфотерный
оксид
С.О. +4 и больше
МеО2
Ме2О5
Кислотные
оксиды
МеОН
Ме(ОН)2
основания
Ме(ОН)3
Амфотерное
основание
Н2МеО3
НМеО3
Кислоты
7. 5.Нахождение в природе
Самыйраспространённый Al,
затем Fe, Ca, Na, K…
Активные и средней активности Ме встречаются
только в виде соединений.
* Исключение – самородное железо
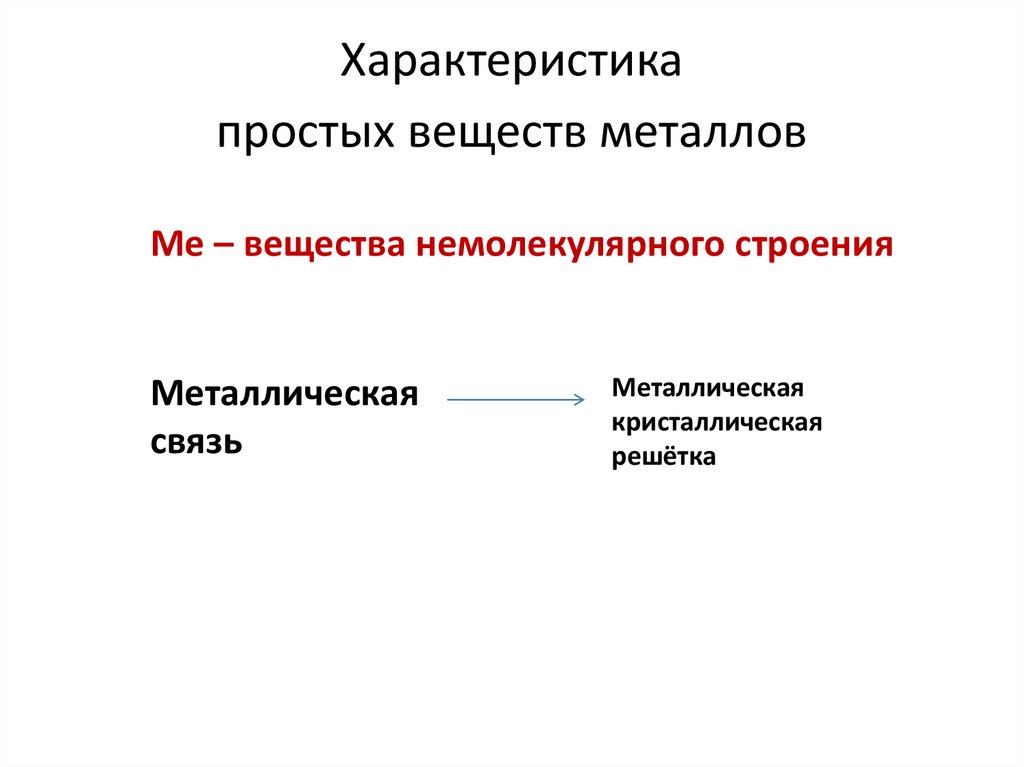
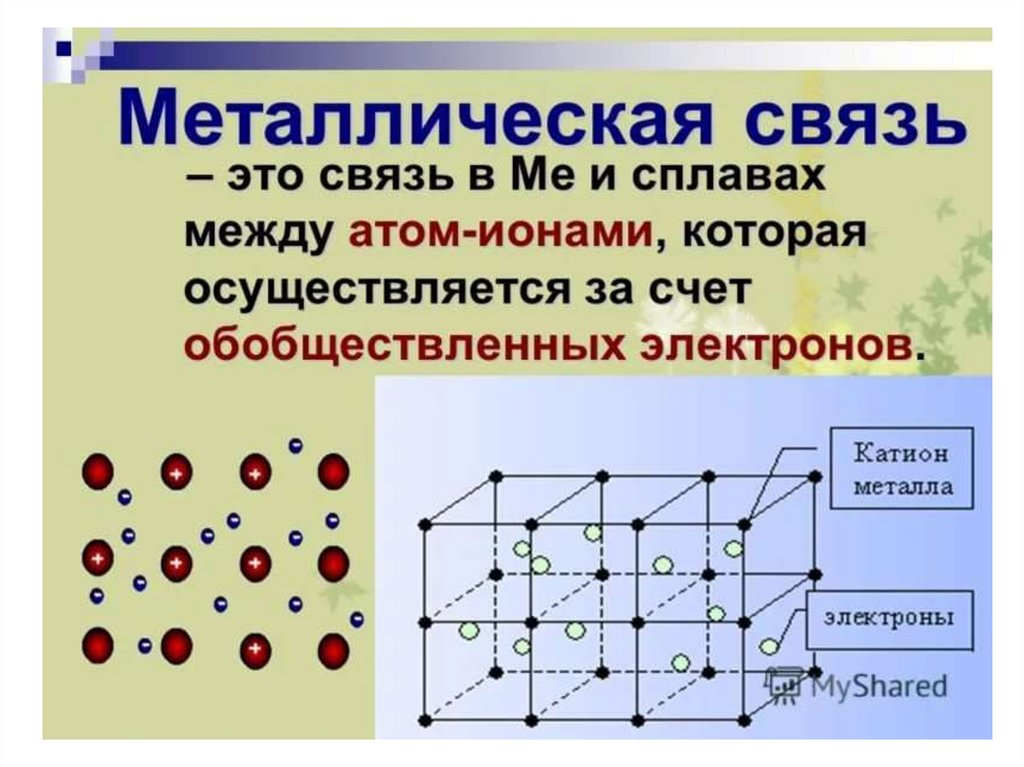
8. Характеристика простых веществ металлов
Ме – вещества немолекулярного строенияМеталлическая
связь
Металлическая
кристаллическая
решётка
9.
10.
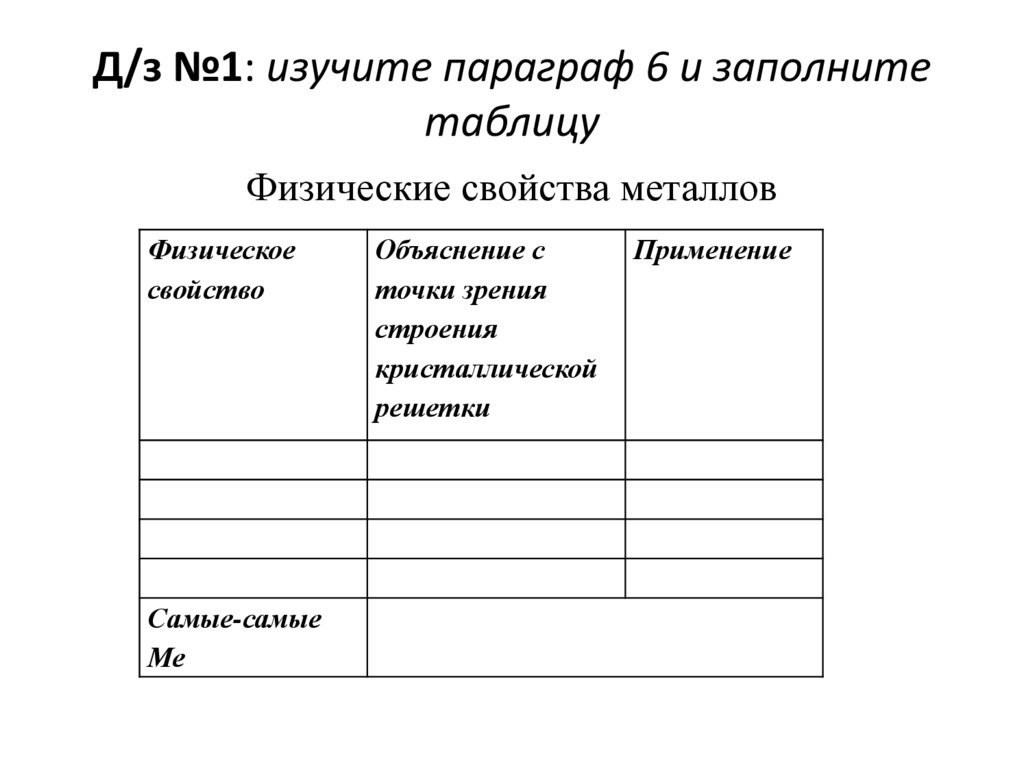
11. Д/з №1: изучите параграф 6 и заполните таблицу
Физические свойства металловФизическое
свойство
Самые-самые
Ме
Объяснение с
точки зрения
строения
кристаллической
решетки
Применение
12. Д/з №2: из параграфа 7 приведите 2-3 примера применения сплавов, основанного на их свойствах.
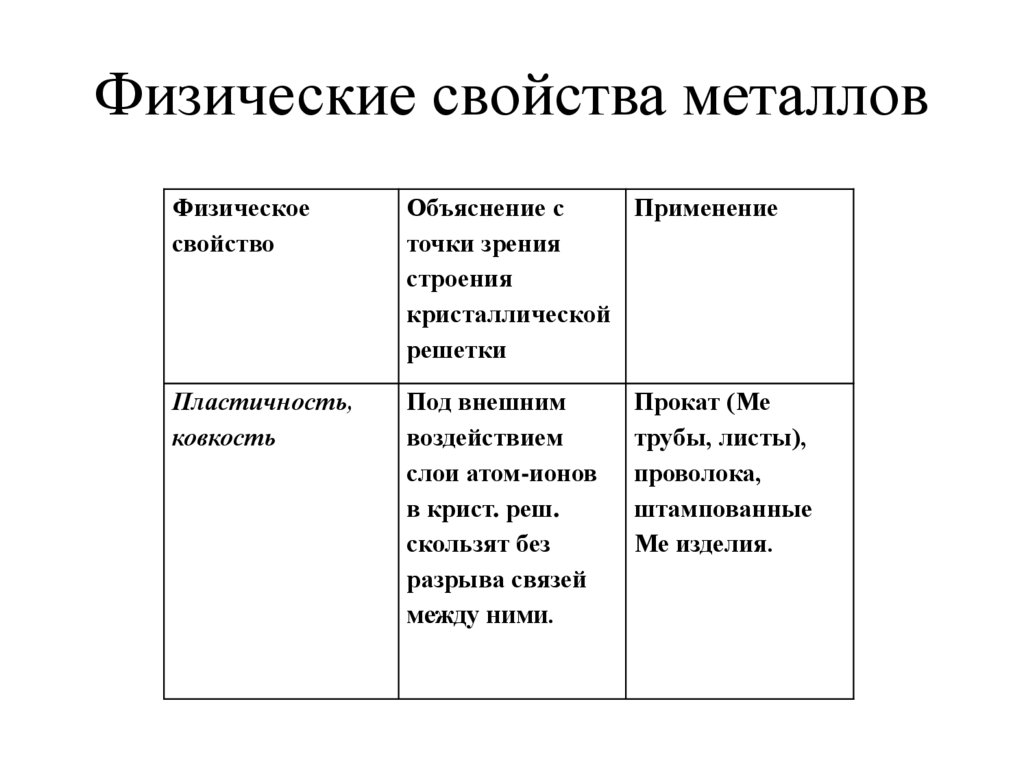
13. Физические свойства металлов
Физическоесвойство
Объяснение с
Применение
точки зрения
строения
кристаллической
решетки
Пластичность,
ковкость
Под внешним
воздействием
слои атом-ионов
в крист. реш.
скользят без
разрыва связей
между ними.
Прокат (Ме
трубы, листы),
проволока,
штампованные
Ме изделия.
14.
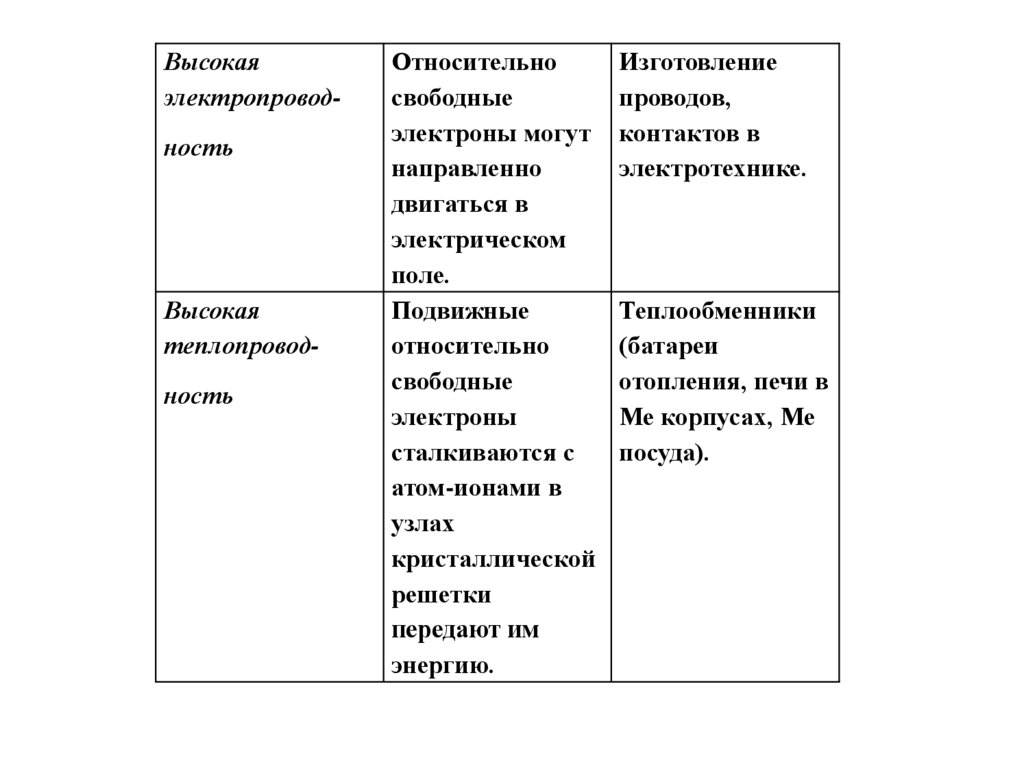
Высокаяэлектропроводность
Высокая
теплопроводность
Относительно
свободные
электроны могут
направленно
двигаться в
электрическом
поле.
Подвижные
относительно
свободные
электроны
сталкиваются с
атом-ионами в
узлах
кристаллической
решетки
передают им
энергию.
Изготовление
проводов,
контактов в
электротехнике.
Теплообменники
(батареи
отопления, печи в
Ме корпусах, Ме
посуда).
15.
Металлический ОтносительноИзготовление
блеск
свободные
зеркал,
электроны
металлических
между узлами
покрытий.
крист. решетки
повышают
отражательную
способность
металлов.
Самые-самые
Твердые – хром, Ме VI B группы.
Ме
Мягкие – щелочные Ме.
Легкие – литий, щелочные Ме,
алюминий.
Тяжелый – осмий (Os).
Тугоплавкий – вольфрам (W).
Легкоплавкий – ртуть (Hg).








 Химия
Химия








