Похожие презентации:
Основные классы неорганических соединений
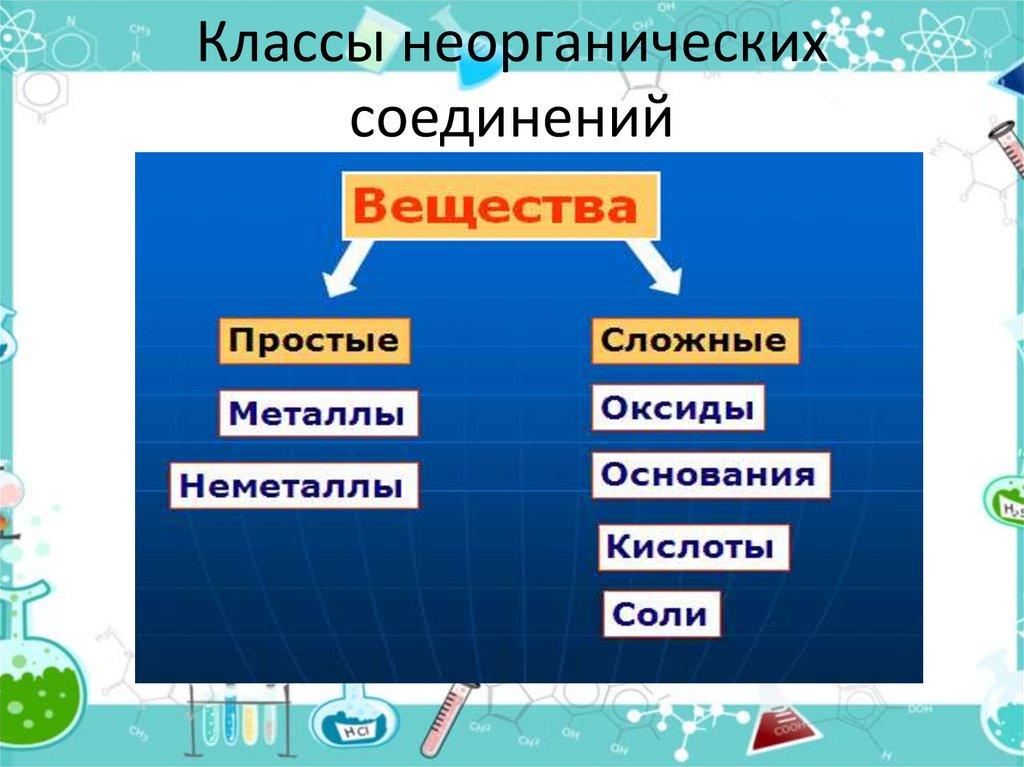
1. Основные классы неорганических соединений
2. Классы неорганических соединений
3.
ВАЖНЕЙШИЕ КЛАССЫНЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
4. Эпиграф урока «Просто знать еще не все, знания необходимо еще использовать» И.В.Гете (немецкий естествоиспытатель)
5. Цели урока:
-Обобщение знаний о :• классификации солей по составу;
• номенклатуре солей;
• физических и химических свойствах
солей;
• нахождении солей в природе и их
применении;
• обнаружение солей важнейших кислот:
сульфатов и хлоридов;
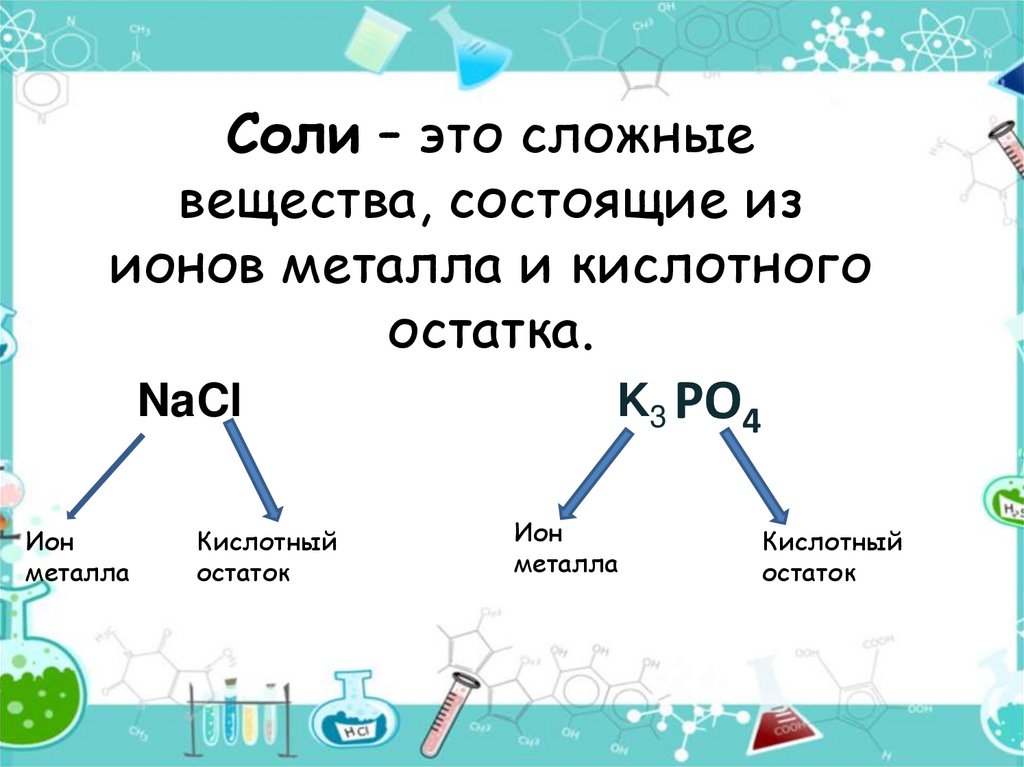
6. Соли
7. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
NaClИон
металла
Кислотный
остаток
K3 PO4
Ион
металла
Кислотный
остаток
8. Соли как электролиты
Соли – это электролиты, образующиепри электролитической диссоциации
катионы металлов и анионы
кислотных остатков.
1.K3PO4= 3 K+ + PO4 32.CaCL2 = Ca 2+ + 2CL-
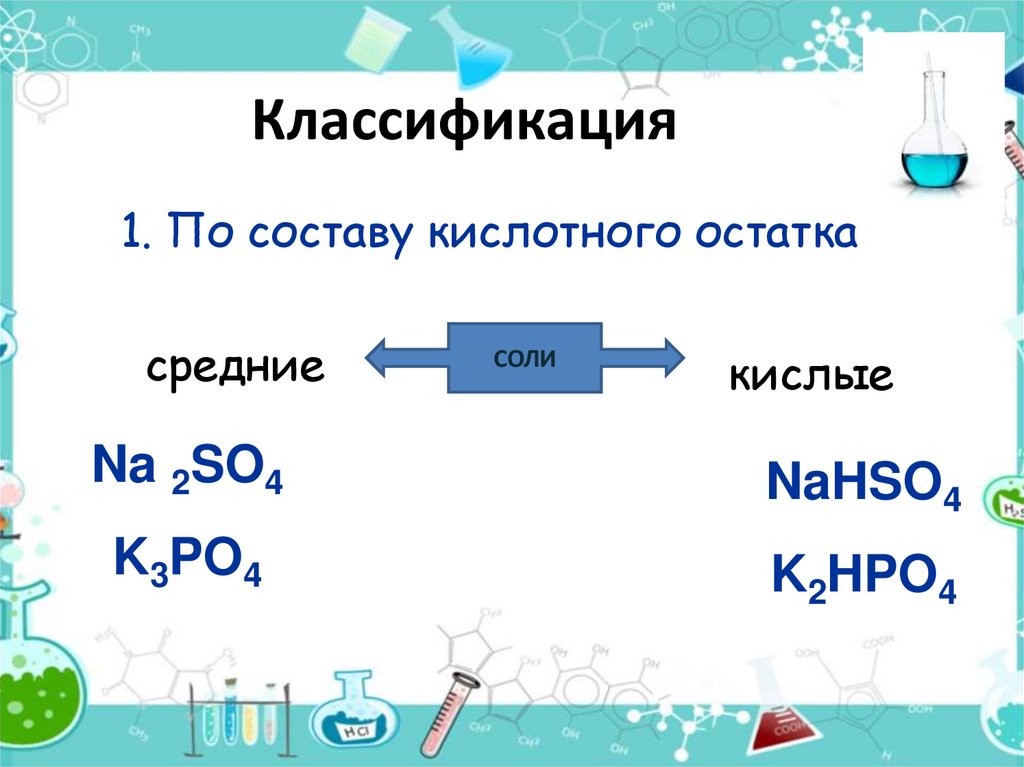
9. Классификация
1. По составу кислотного остаткасредние
СОЛИ
кислые
Na 2SO4
NaHSO4
K3PO4
K2HPO4
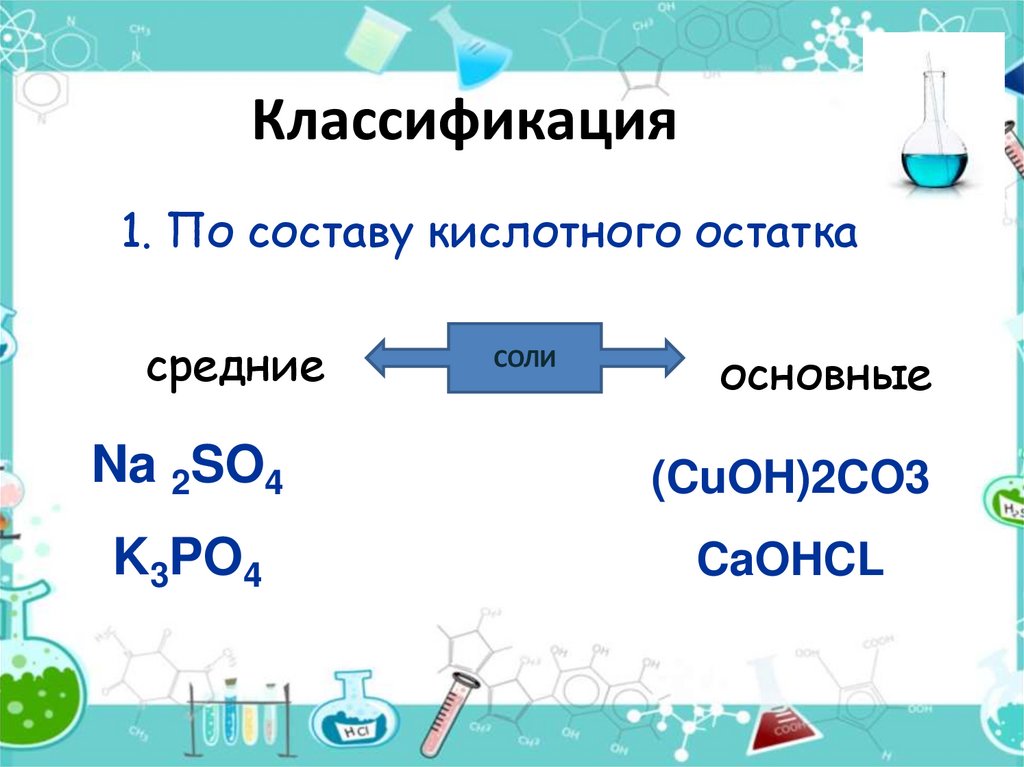
10. Классификация
1. По составу кислотного остаткасредние
СОЛИ
основные
Na 2SO4
(CuOH)2CO3
K3PO4
CaOHCL
11. Номенклатура кислых солей
1. Указать название кислотного остатка2. К названию кислотного остатка
прибавить «гидро-»
NaHSO4
3. Наименование металла в
родительном падеже
сульфат
натрия
гидро
12. Номенклатура основных солей
1. Указать название кислотного остатка2. К названию кислотного остатка
прибавить (CuOH)2CO3
«гидроксо-»
1. Наименование металла в
родительном падеже
гидро ксокарбонат
меди
13. Способы получения солей: Средних: AL(OH)3 +3HNO3=AL(NO3)3 +3HOH Кислых: NaOH + H2CO3 =NaHCO3+HOH Основных: Сu(OH)2 + H2CO3
=(CuOH)2CO3+HOH14. Химические свойства
1. Взаимодействие с металлами:SnCl2 + Zn
Свободный металл должен быть
расположен …………… металла соли
в вытеснительном ряду металлов
Н.Н.Бекетова.
15. Химические свойства
2. Взаимодействие с основаниями:2NaОН + CuSO4 →
Соли взаимодействуют
с ………………..
основаниями, или ………..
16. Химические свойства
3.Взаимодействие с кислотами:CaCO3 + HCl →
Сильные кислоты
вытесняют более
…………. из их солей!
17. Химические свойства
4. Взаимодействие солеймежду собой
КСl + AgNO3 → AgCl + KNO3
18. Химические свойства
5. Разложениепри нагревании :
СаСО3= CaO + CO2
KNO3 = KNO2 + O2
19. Викторина о солях
1.Из какой муки нельзя испечь хлеб?2.Какую соль называют «несъедобным
сахаром»?
3.При лечении малокровия используют
«железное» яблоко. Что оно из себя
представляет?
20. Способы получения
10способов
Способы получения
10
способов
Основаны на химических свойствах оксидов,
оснований, кислот
1. Кислота + основание = соль + вода
H2SO4 +2NaOH = Na2SO4 + 2H2O
2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
21. Способы получения
• 5. Основание + соль = новое основание + новая соль2КОН + СаSO4 = Са(ОН) 2 + К2SO4
• 6. Основание + кислотный оксид + = соль + вода
2NaOH + SO3 = Na2SO4 + H2O
• 7. Кислотный оксид + основный оксид = соль
СО2+ СаО = СаСО3
• 8. Соль + соль = новая соль + новая соль
КСl + AgNO3 → AgCl + KNO3
• 9. Соль + металл = новая соль + металл
CuSO4 + Fe = FeSO4 + Cu
• 10. Металл + неметалл = соль
Fe +S = FeS
10
способов
10
способов
10
способов

















 Химия
Химия








