Похожие презентации:
Важнейшие классы неорганических соединений. Соли
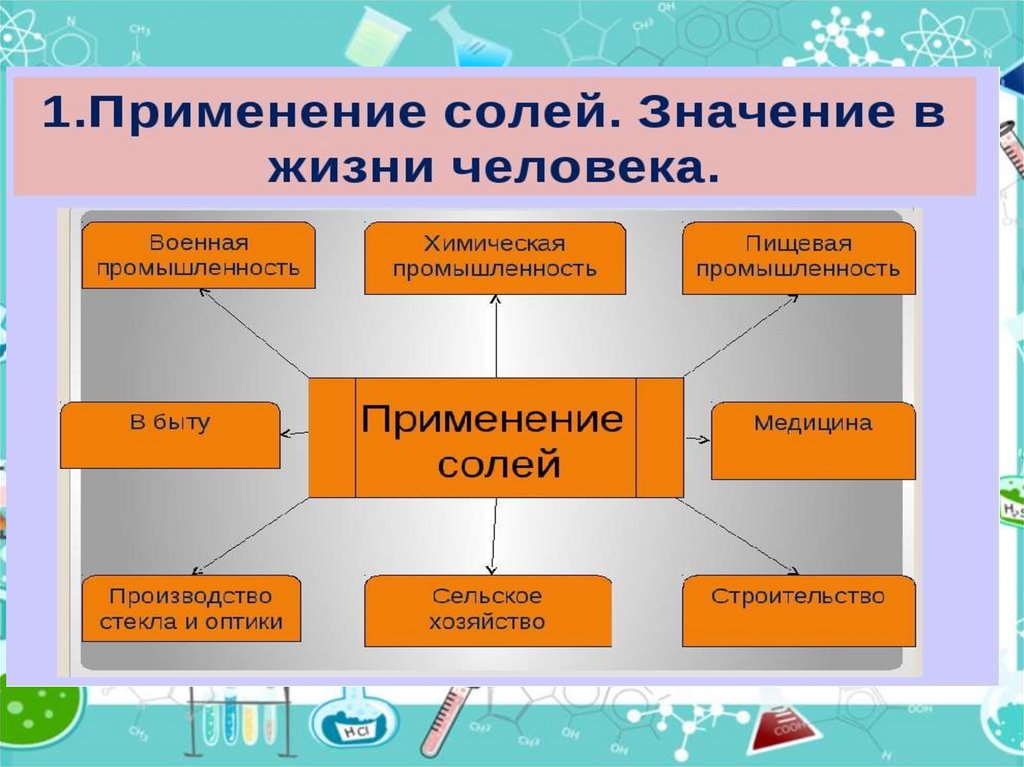
1.
ВАЖНЕЙШИЕ КЛАССЫНЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
2. Вспомним! Что называется:
• Оксидами• Основаниями
• Кислотами
3. Назовите вещества
• Na2O CaO Al2О3 P2O5• NaOH Ca(OH)2 Al(OH)3
• HCl HNO3 H2S H2SO4 H3PO4
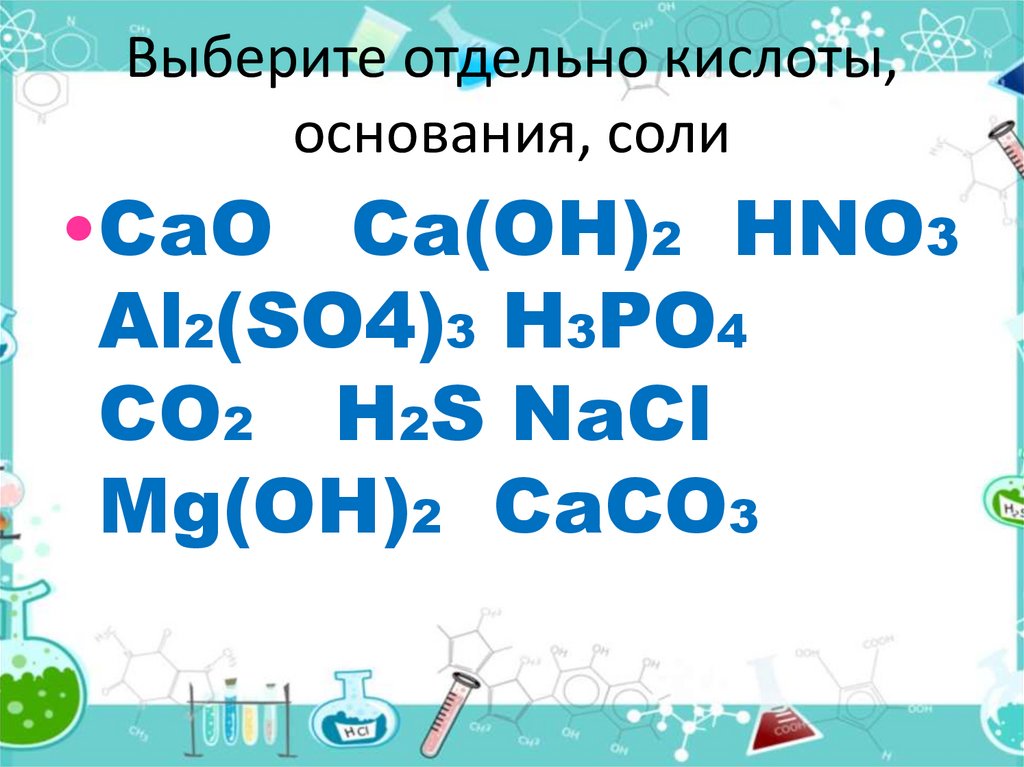
4. Выберите отдельно кислоты, основания, соли
•CaO Ca(OH)2 HNO3Al2(SO4)3 H3PO4
CO2 H2S NaCl
Mg(OH)2 CaCO3
5. Назовите соли
• MgSO4Al2(SO4)3
Fe(NO3)3
CaCO3
NaCl
6. Напишите формулы
• Хлорид магния• Сульфат калия
• Нитрат алюминия
• Фосфат цинка
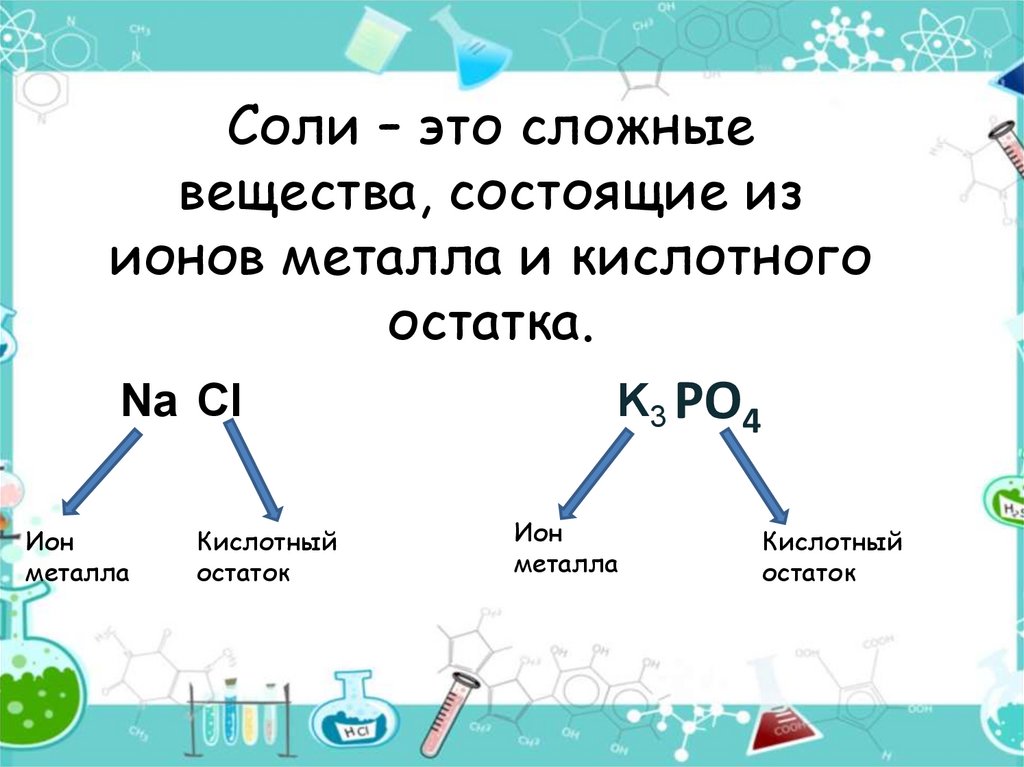
7. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
Na ClK3 PO4
Ион
металла
Кислотный
остаток
Ион
металла
Кислотный
остаток
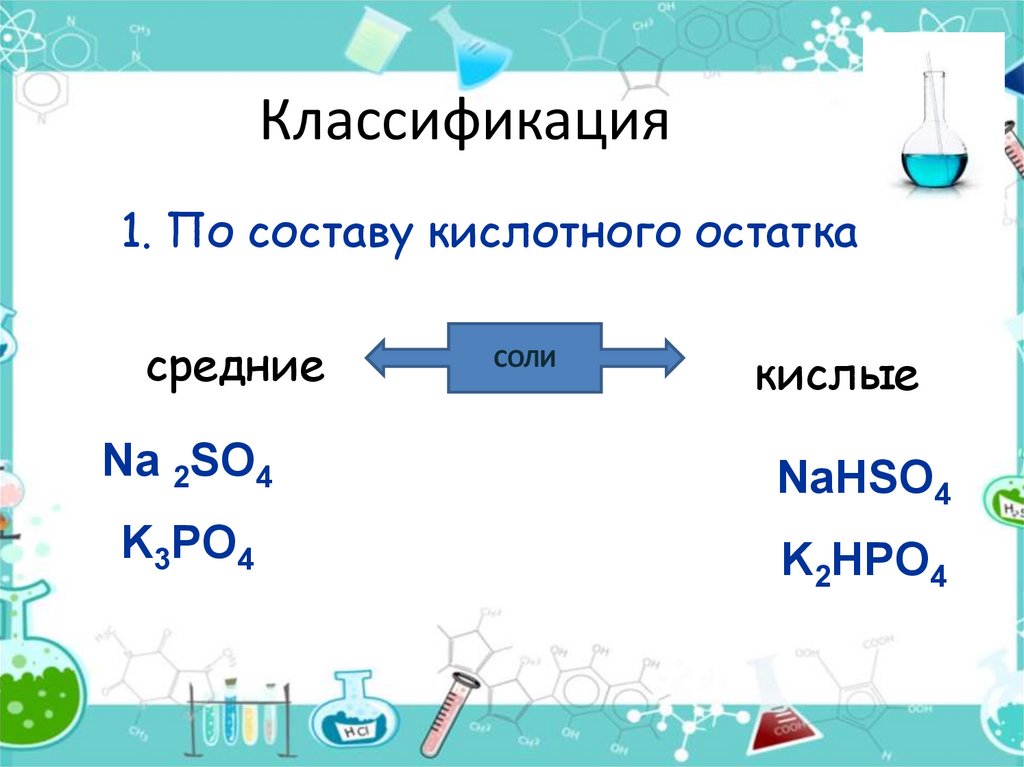
8. Классификация
1. По составу кислотного остаткасредние
СОЛИ
кислые
Na 2SO4
NaHSO4
K3PO4
K2HPO4
9. Номенклатура средних солей
1. Название кислотного остатка2.Наименование металла в
родительном падеже
МgСL2
хлорид магния
10. Номенклатура кислых солей
1. Указать название кислотного остатка2. К названию кислотного остатка
прибавить «гидро-»
NaHSO4
3. Наименование металла в
родительном падеже
гидро сульфат
натрия
11. Химические свойства
1. Взаимодействие с металлами:SnCl2 + Zn ZnCl2 + Sn
12. Химические свойства
2. Взаимодействие со щелочами:2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
13. Химические свойства
3. Взаимодействие солеймежду собой
КСl + AgNO3 → AgCl + KNO3
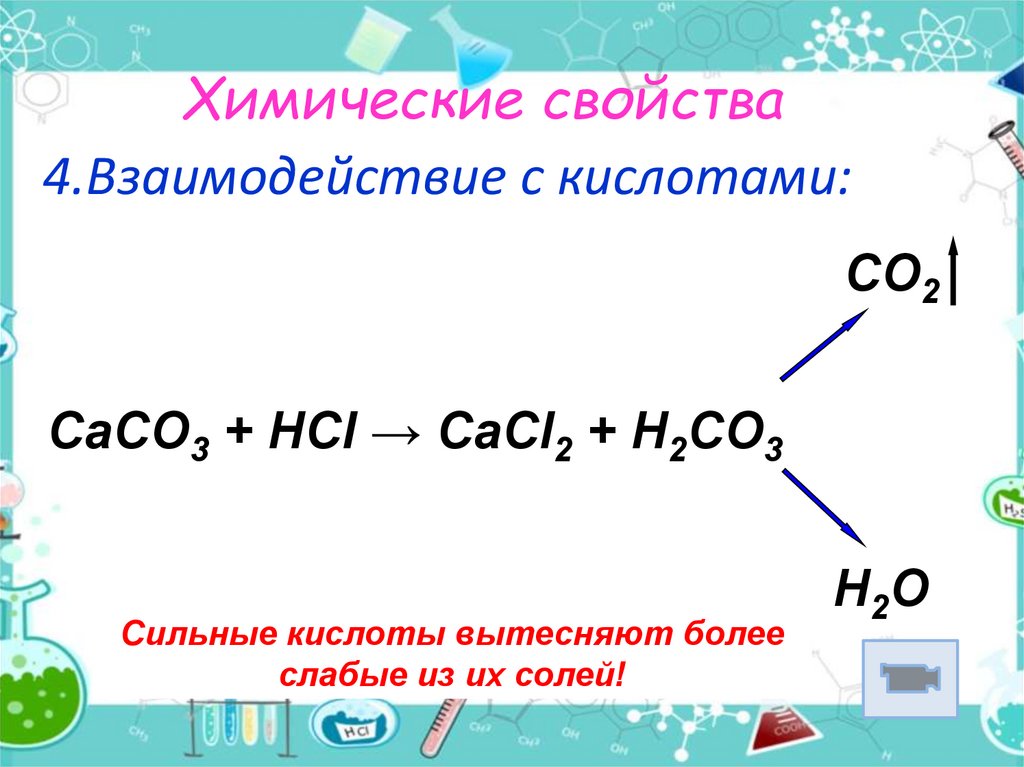
14. Химические свойства
4.Взаимодействие с кислотами:CO2
CaCO3 + HCl → CaCl2 + H2CO3
Сильные кислоты вытесняют более
слабые из их солей!
H2O
15. Химические свойства
Разложение при нагревании
СаСО3= СО2 + Н2О
16. Способы получения
10способов
Способы получения
10
способов
Основаны на химических свойствах оксидов,
оснований, кислот
1. Кислота + основание = соль + вода
H2SO4 +2NaOH = Na2SO4 + 2H2O
2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
17. Способы получения
• 5. Основание + соль = новое основание + новая соль2КОН + СаSO4 = Са(ОН) 2 + К2SO4
• 6. Основание + кислотный оксид + = соль + вода
2NaOH + SO3 = Na2SO4 + H2O
• 7. Кислотный оксид + основный оксид = соль
СО2+ СаО = СаСО3
• 8. Соль + соль = новая соль + новая соль
КСl + AgNO3 → AgCl + KNO3
• 9. Соль + металл = новая соль + металл
CuSO4 + Fe = FeSO4 + Cu
• 10. Металл + неметалл = соль
Fe +S = FeS
10
способов
10
способов
10
способов
18.
19. Домашнее задание
• Решить задачу по вариантам:• 1. Найти объем сероводорода,
образовавшегося в результате реакции
сульфида натрия и соляной кислоты, если
масса Na2S=20,2 г (30,4г.)














 Химия
Химия








