Похожие презентации:
Электролитическая диссоциация
1.
ЭЛЕКТРОЛИТИЧЕСКАЯДИССОЦИАЦИЯ
2.
Сванте АррениусВ 1887 г. Шведский ученый С.Арениус
для объясннеия особенностей водных
растворов веществ предложил теорию
электролитической диссоциации. В
дальнейшем эта теория была развита
многими учеными, в том числе И.А.
Каблуковым и В.А. Кистяковским.
3.
СОВРЕМЕННОЕ СОДЕРЖАНИЕ ТЭД МОЖНОСВЕСТИ К ЧЕТЫРЕМ ОСНОВНЫМ
ПОЛОЖЕНИЯМ. 1-ОЕ ПОЛОЖЕНИЕ
Все вещества по их способности проводить
электрический ток в растворах делятся на
электролиты и неэлектролиты.
4.
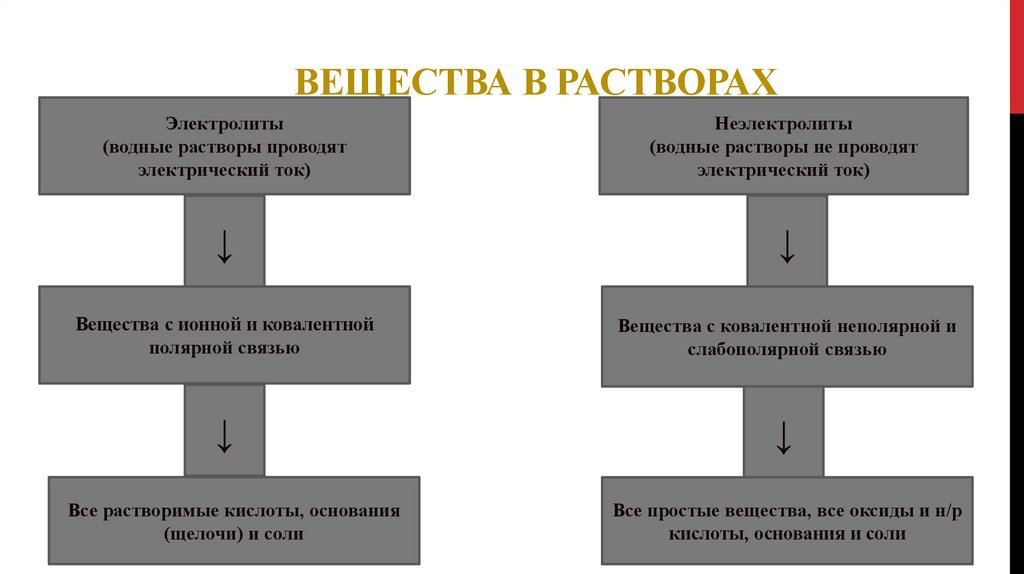
ВЕЩЕСТВА В РАСТВОРАХЭлектролиты
(водные растворы проводят
электрический ток)
Неэлектролиты
(водные растворы не проводят
электрический ток)
↓
↓
Вещества с ионной и ковалентной
полярной связью
Вещества с ковалентной неполярной и
слабополярной связью
↓
↓
Все растворимые кислоты, основания
(щелочи) и соли
Все простые вещества, все оксиды и н/р
кислоты, основания и соли
5.
ЗАДАНИЯ К 1-МУ ПОЛОЖЕНИЮ ТЭДКакие вещества называются электролитами и
неэлектролитами
Назовите по два вещества, которые являются
электролитами и неэлектролитами
Укажите вид связи и принадлежность данных
вещества к электролитам: KCl, O2, HNO3., CuO.
Назовите из перечисленных ниже веществ
электролиты (см. таблицу растворимости): BaCl2, CaO,
H2SO4, NaOH, Cl2, Zn(OH)2
6.
В РАСТВОРАХ ЭЛЕКТРОЛИТЫДИССОЦИИРУЮТ (РАСПАДАЮТСЯ) НА
ПОЛОЖИТЕЛЬНО И ОТРИЦАТЕЛЬНО
ЗАРЯЖЕННЫЕ ИОНЫ
Процесс распада электролита на ионы называется
электролитической диссоциацией (ЭД)
Причиной диссоциации электролита является его
взаимодействие с молекулами воды (гидратация).
7.
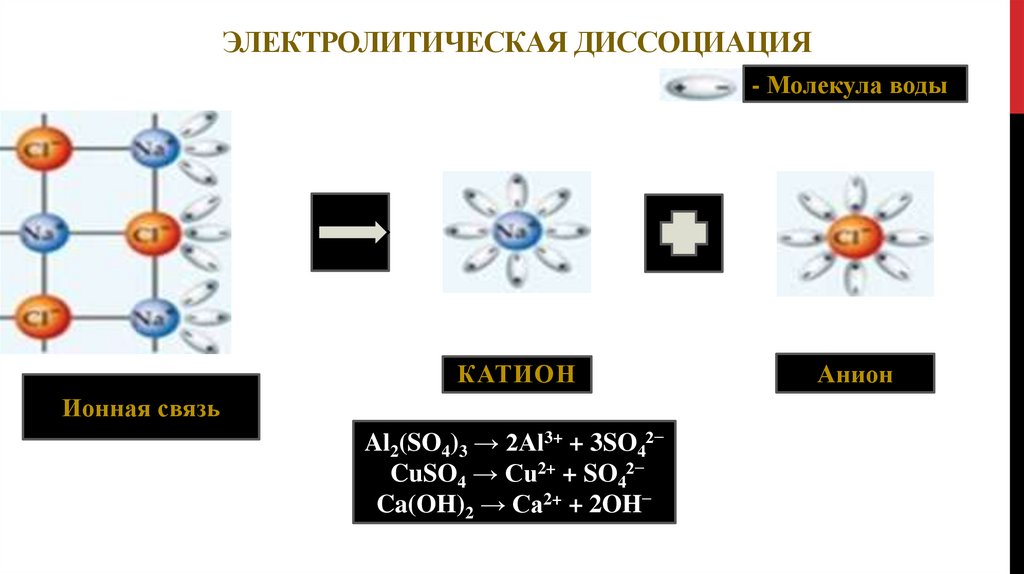
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ- Молекула воды
КАТИОН
Ионная связь
Al2(SO4)3 → 2Al3+ + 3SO42−
CuSO4 → Cu2+ + SO42−
Ca(OH)2 → Ca2+ + 2OH−
Анион
8.
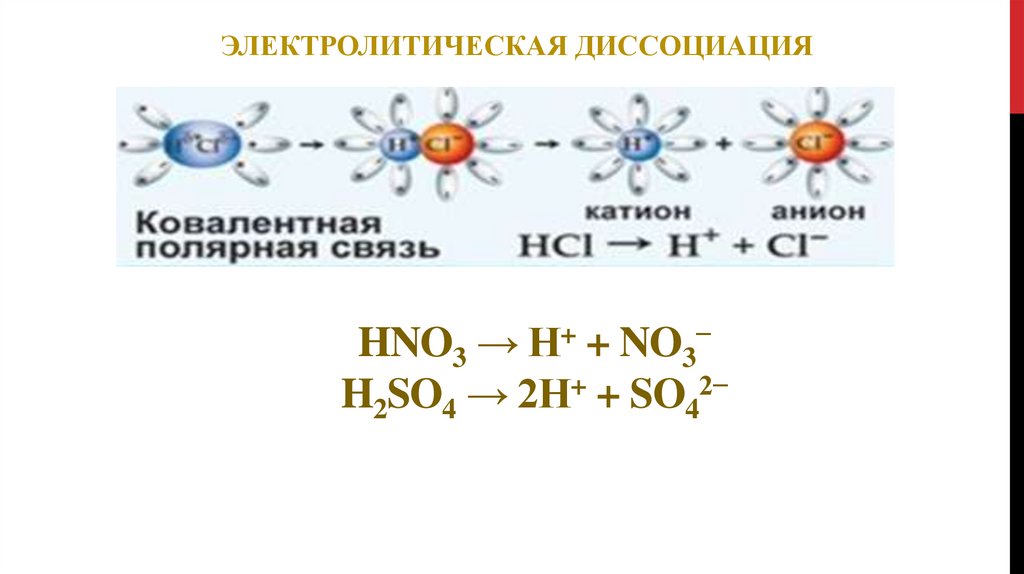
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯHNO3 → H+ + NO3−
H2SO4 → 2H+ + SO42−
9.
МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИВЕЩЕСТВА ИОННОЙ СВЯЗЬЮ:
ОРИЕНТАЦИЯ ДИПОЛЕЙ ВОДЫ →
ГИДРАТАЦИЯ → ДИССОЦИАЦИЯ
ВЕЩЕСТВА КОВАЛЕНТНОЙ СВЯЗЬЮ:
ОРИЕНТАЦИЯ ДИПОЛЕЙ ВОДЫ →
ГИДРАТАЦИЯ → ИОНИЗАЦИЯ →
ДИССОЦИАЦИЯ
10.
ТИПЫ ИОНОВ1) ПО ЗАРЯДУ:
КАТИОНЫ (ПОЛОЖИТЕЛЬНО ЗАРЯЖЕНЫ) И АНИОНЫ
(ОТРИЦАТЕЛЬНО ЗАРЯЖЕНЫ)
2) ПО ОТНОШЕНИЮ К ВОДЕ:
ГИДРАТИРОВАННЫЕ И НЕГИДРАТИРОВАННЫЕ (В БЕЗВОДНЫХ
СРЕДАХ)
3) ПО СОСТАВУ:
ПРОСТЫЕ И СЛОЖНЫЕ
11.
УПРОЩЕННО ПРОЦЕСС ДИССОЦИАЦИИИЗОБРАЖАЮТ С ПОМОЩЬЮ УРАВНЕНИЙ:
NACL → NA+ + CL−
HCL → H+ + CL−
12.
ЗАДАНИЕ КО 2-МУ ПОЛОЖЕНИЮ ТЭД1. СФОРМУЛИРУЙТЕ ВТОРОЕ ПОЛОЖЕНИЕ ТЭД
2. ЧТО ТАКОЕ ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ?
3. ЧТО ЯВЛЯЕТСЯ ПРИЧИНОЙ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ?
4. КАКОВ МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ: А)
ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ, Б) ВЕЩЕСТВ С КОВАЛЕНТНОЙ СВЯЗЬЮ?
5) НАЗОВИТЕ ЧАСТИЦЫ: А) H, H2, H+ В) CL2, CL, CL−
6) НАЗОВИТЕ КАТИОНЫ И АНИОНЫ В СОЕДИНЕНИЯХ,
ФОРМУЛЫ КОТОРЫХ: CUCL2, AGNO3, CA(OH)2, H3PO4









 Химия
Химия








