Похожие презентации:
Электролитическая диссоциация. Вещества в растворах
1. Электролитическая диссоциация
2. Домашнее задание:
§ 35, вопросы3.
4.
Все вещества по их способностипроводить электрический ток в
растворах делятся на
электролиты и
неэлектролиты.
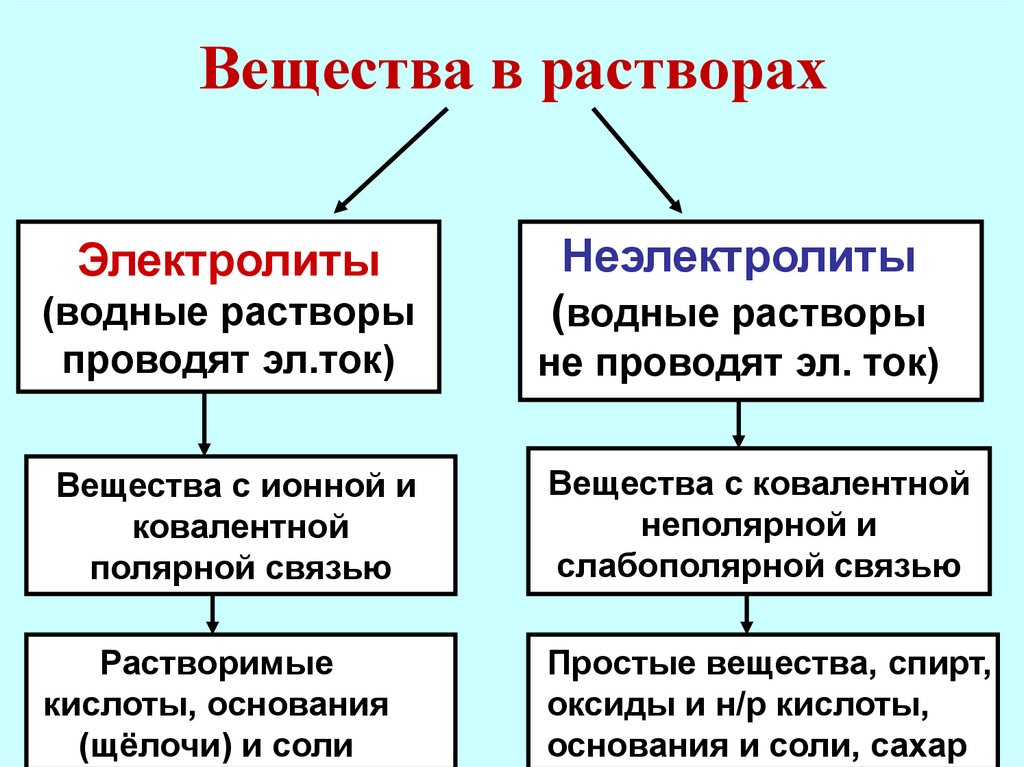
5. Вещества в растворах
Электролиты(водные растворы
проводят эл.ток)
Вещества с ионной и
ковалентной
полярной связью
Растворимые
кислоты, основания
(щёлочи) и соли
Неэлектролиты
(водные растворы
не проводят эл. ток)
Вещества с ковалентной
неполярной и
слабополярной связью
Простые вещества, спирт,
оксиды и н/р кислоты,
основания и соли, сахар
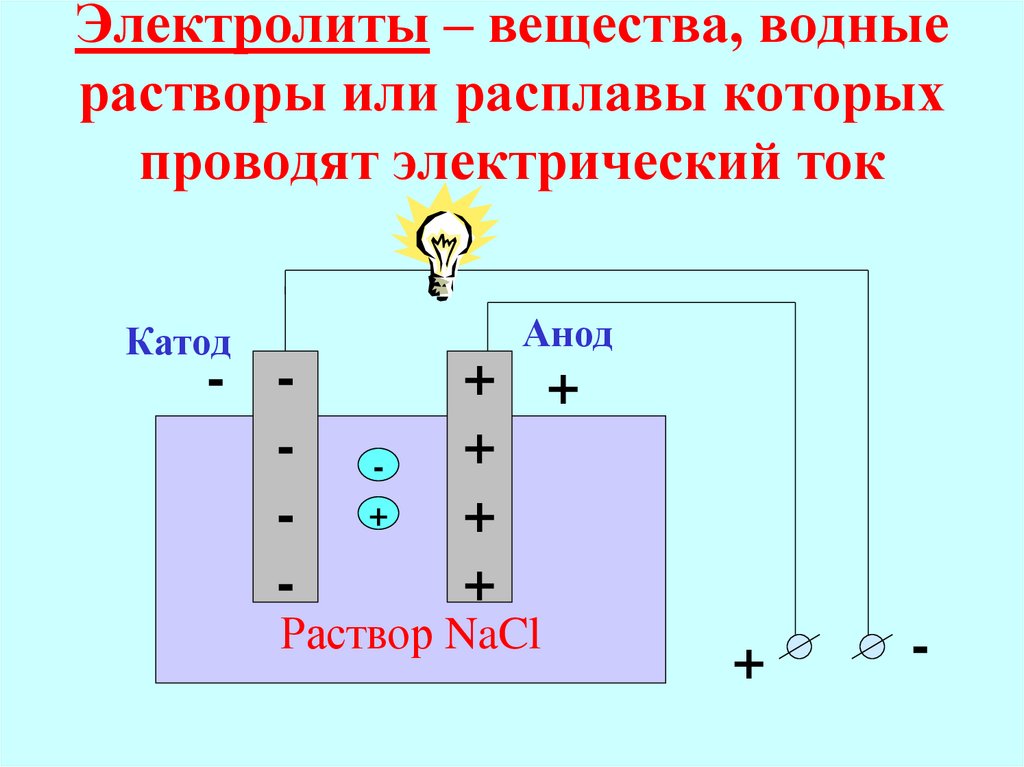
6. Электролиты – вещества, водные растворы или расплавы которых проводят электрический ток
АнодКатод
- -
+
+ +
+
+
+
Раствор NaCl
+
-
7. Неэлектролиты – вещества, водные растворы или расплавы которых не проводят электрический ток
8.
• Кислоты:HCl, H2SO4
• Основания:
NaOH,
Ba(OH)2
• Соли:
NaCl, CuSO4
• Органические
вещества
• Газы:
O2, H2, CO2
• Оксиды:
CuO, Fe2O3
9. Из предложенных веществ выпишите электролиты
HClNaCl
Cl2
KOH
H2SO4
SO2
10.
Электролитическаядиссоциация –
процесс распада
электролита на ионы при
растворении в воде или
расплавлении.
11. Теория электролитической диссоциации (ТЭД)
В 1887г. Шведский учёныйС. Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными.
Сванте
Аррениус
12.
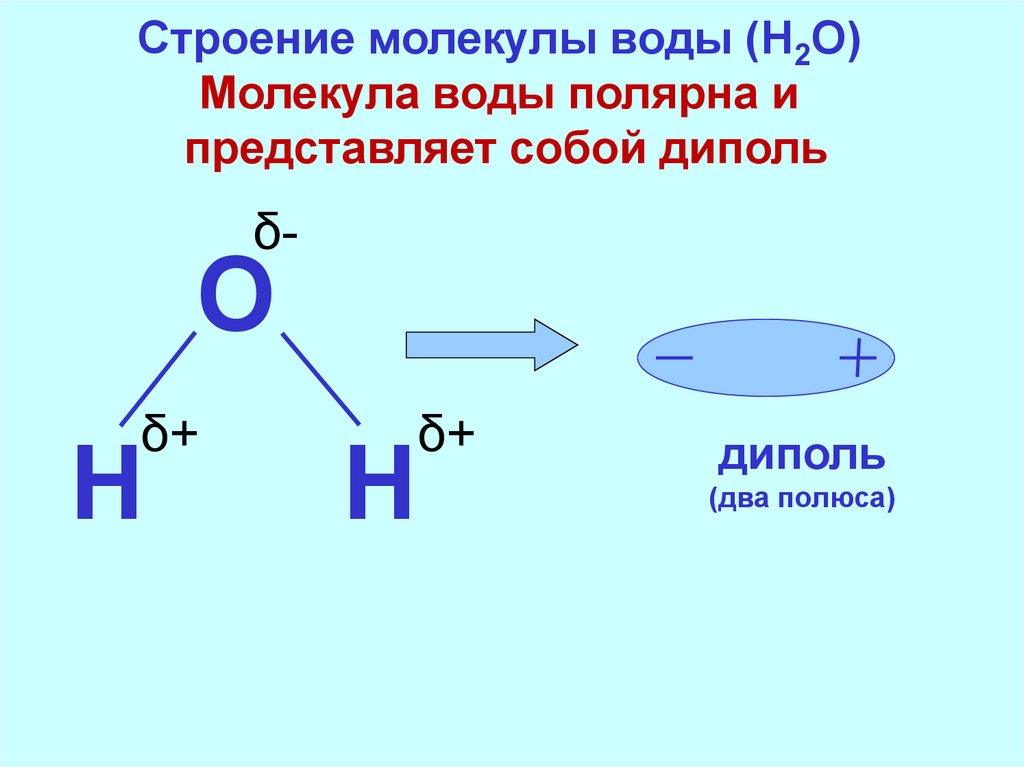
Строение молекулы воды (H2O)Молекула воды полярна и
представляет собой диполь
δ-
O
δ+
H
H
δ+
диполь
(два полюса)
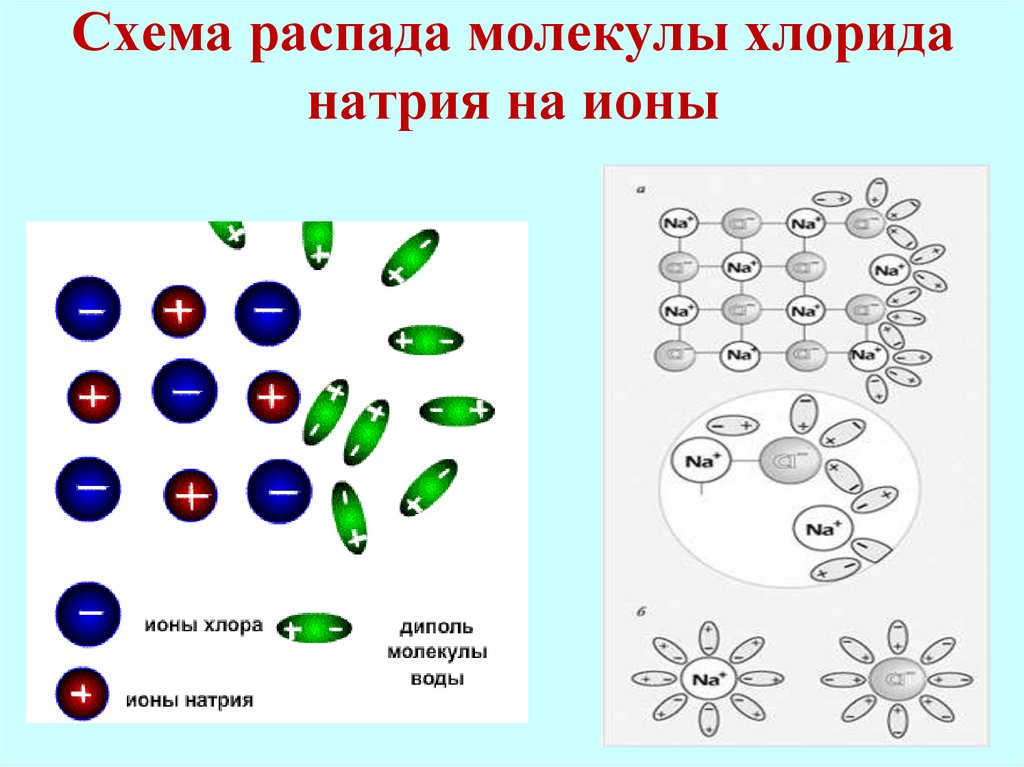
13. Схема распада молекулы хлорида натрия на ионы
14.
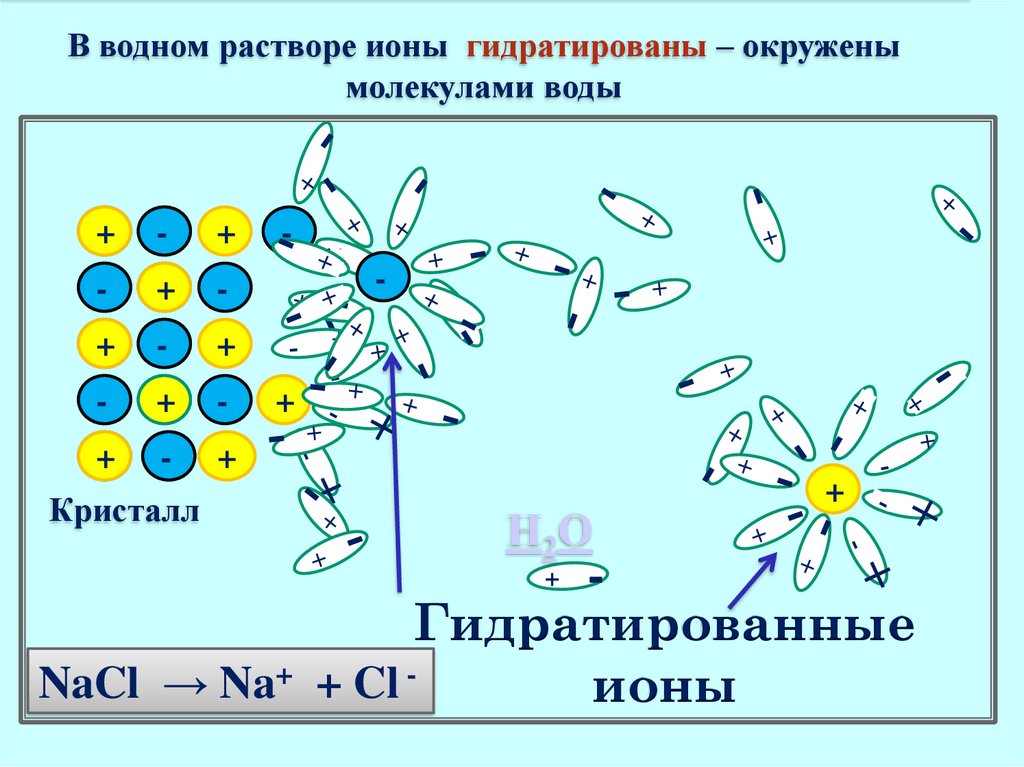
В водном растворе ионы гидратированы – окруженымолекулами воды
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
Кристалл
-
+
Н2О
+
Гидратированные
NaCl → Na+ + Cl ионы
+
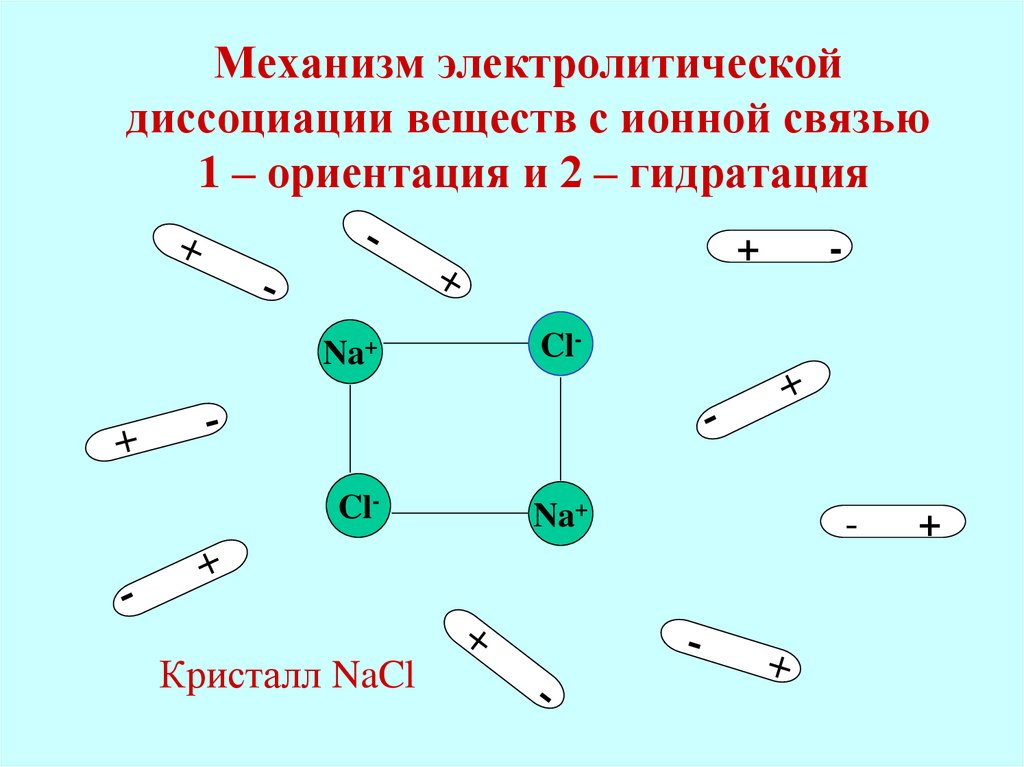
15. Механизм электролитической диссоциации веществ с ионной связью 1 – ориентация и 2 – гидратация
+Na+
Cl-
Cl-
Na+
Кристалл NaCl
-
-
+
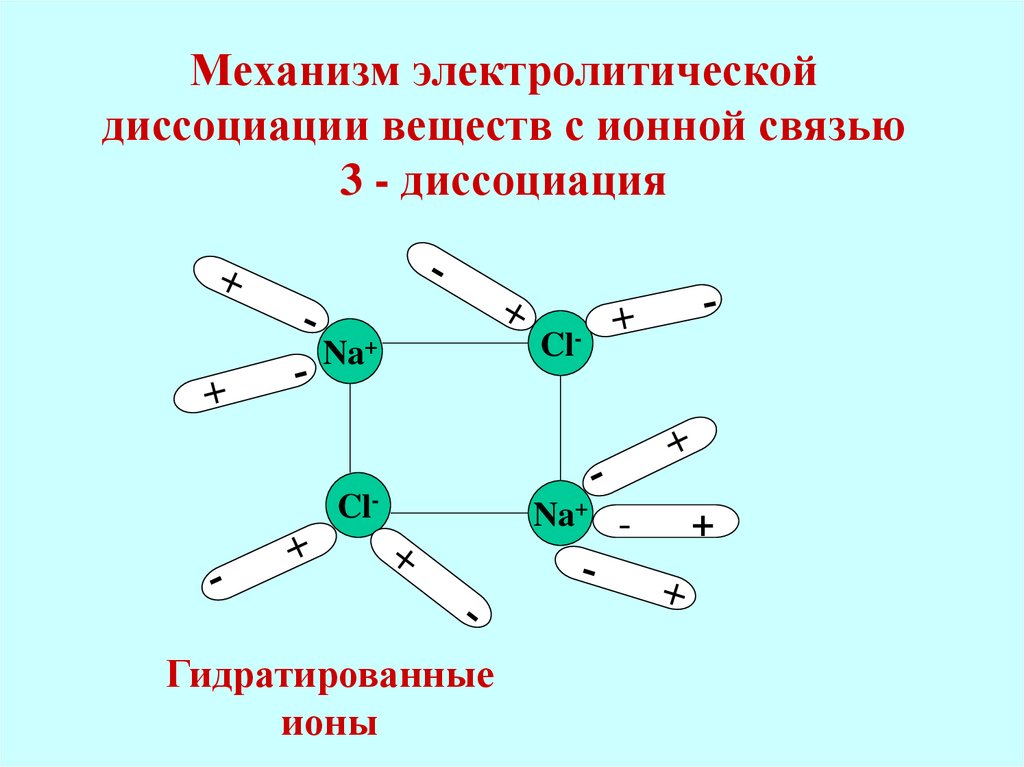
16. Механизм электролитической диссоциации веществ с ионной связью 3 - диссоциация
Na+Cl-
Гидратированные
ионы
Cl-
Na+ -
+
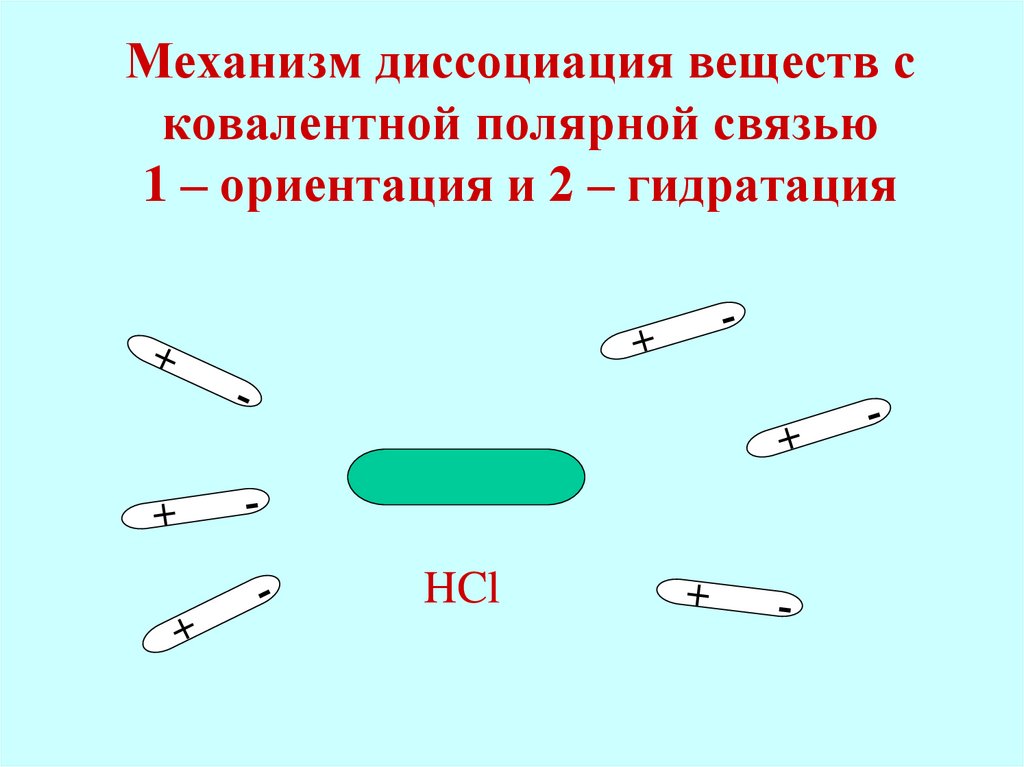
17. Механизм диссоциация веществ с ковалентной полярной связью 1 – ориентация и 2 – гидратация
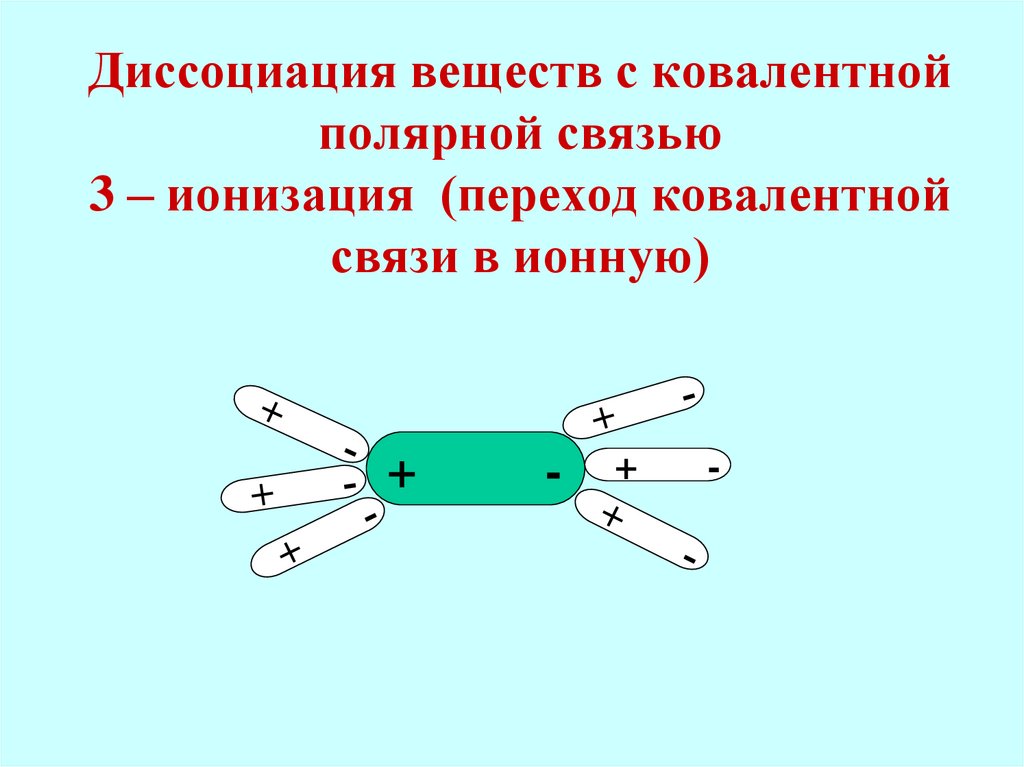
HCl18. Диссоциация веществ с ковалентной полярной связью 3 – ионизация (переход ковалентной связи в ионную)
+-
+
-
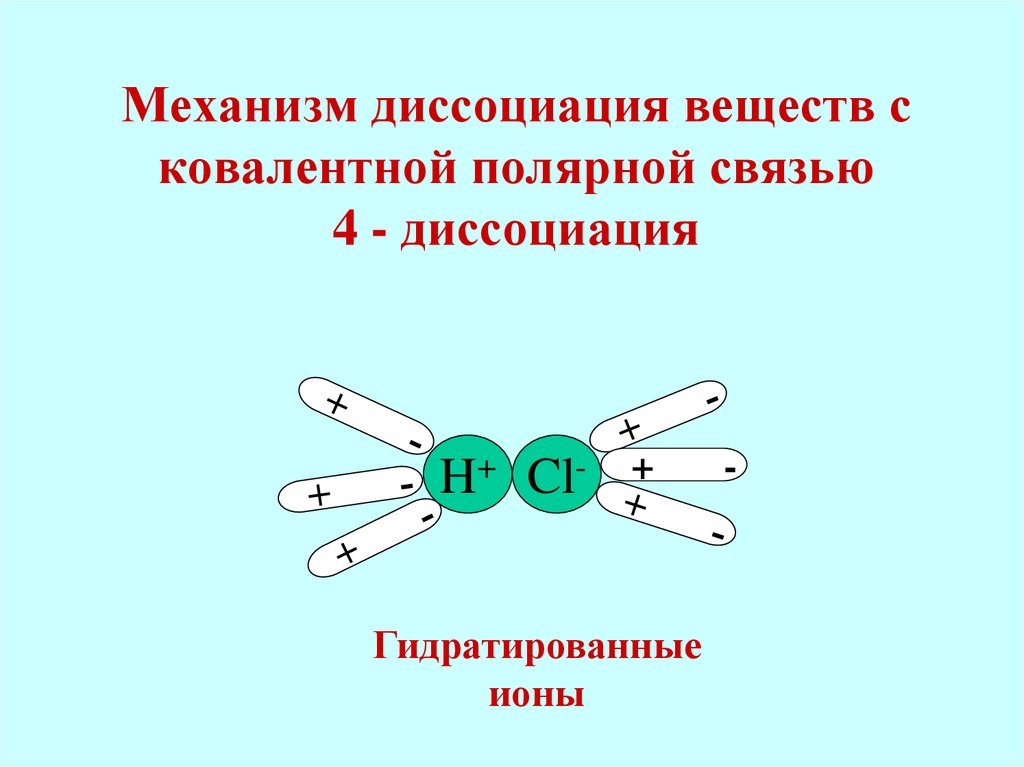
19. Механизм диссоциация веществ с ковалентной полярной связью 4 - диссоциация
H+ Cl-+
Гидратированные
ионы
-
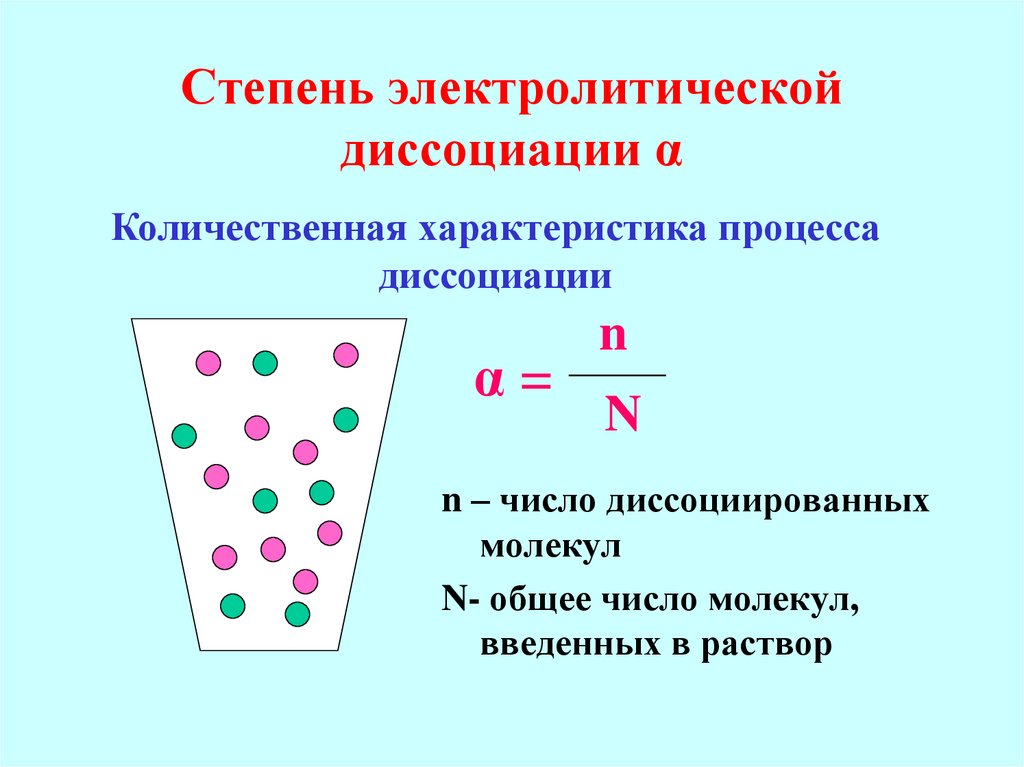
20. Степень электролитической диссоциации α
Количественная характеристика процессадиссоциации
α=
n
N
n – число диссоциированных
молекул
N- общее число молекул,
введенных в раствор
21. Электролиты
Сильныеα>30%
Все соли
NaOH, KOH,
Ca(OH)2,
Ba(OH)2, HCl,
H2SO4, HNO3
Средние
30%>α>3%
Mg(OH)2,
H2SO3, HNO2,
H3PO4
Слабые
α<3%
NH3·H2O,
Al(OH)3,
Fe(OH)3,H2CO3,
H2SiO3, H2S,
H2O,
CH3COOH
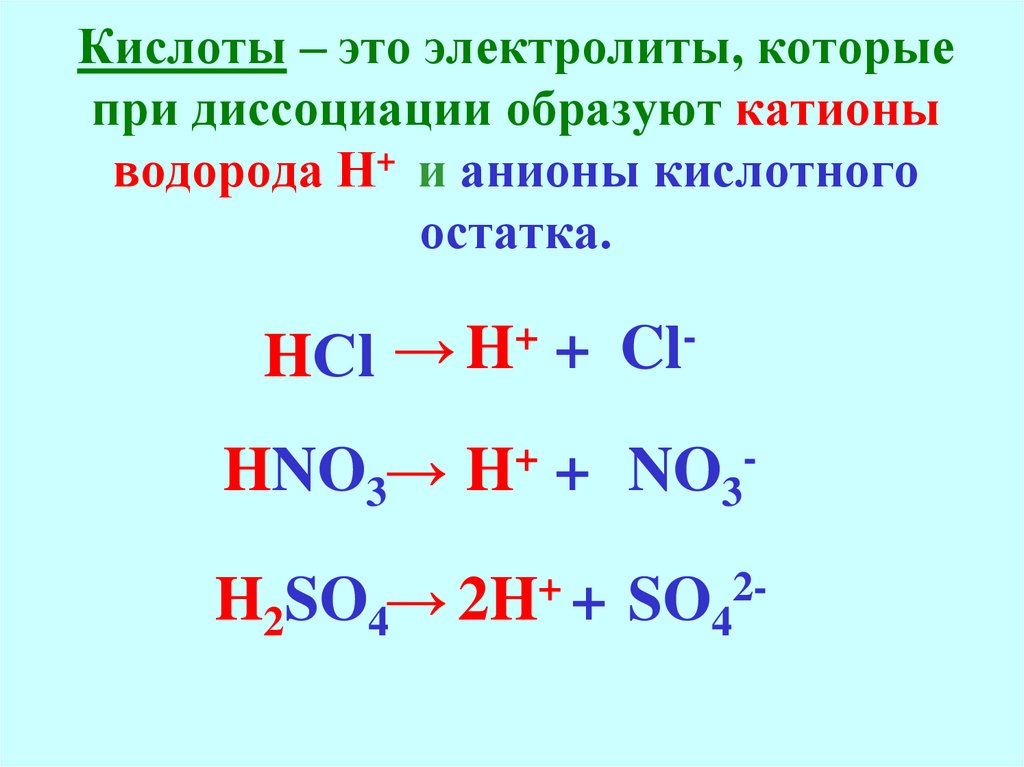
22. Кислоты – это электролиты, которые при диссоциации образуют катионы водорода Н+ и анионы кислотного остатка.
+ + Cl→H
HСl
HNO3→
+
H
-
+ NO3
H2SO4→ 2H+ + SO42-
23. Основания – это электролиты, которые при диссоциации образуют катионы металла и гидроксид – анионы ОН-
Основания – это электролиты, которыепри диссоциации образуют катионы
металла и гидроксид – анионы ОН+ + OH→
Na
NaOH
KOH →
+
K
+
OH
Ca(OH)2 → Ca2+ + 2OH-
24. Соли – это электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+ ) и анионы кислотного остатка
+ + Cl→Na
NaСl
AlCl3 →
3+
Al
+
Cl
Ba(NO3)2→ Ba2+ + 2NO3-
25. Напишите уравнения диссоциации электролитов
KNO3
Mg(NO2)2
Ba(OH)2
HCl
Na2SO4
NaOH
H2SO4
Fe2(SO4)3
26. Правило Бертолле – условия течения химических реакций до конца
• 1. Образование газа• 2. Выпадение осадка
• 3. Образование воды
Н2О
27. Закончите уравнения реакций, протекающих до конца, составьте для них ионные уравнения:
FeCl2 + LiOH =KOH + H3PO4 =
BaCL2 + HNO3 =
Li2CO3 + НСl =















 Химия
Химия








