Похожие презентации:
Арены
1.
2.
Ароматические соединения, или арены,— большая группа соединений
карбоциклического ряда, молекулы
которых содержат устойчивую
циклическую группировку из шести
атомов углерода (бензольное кольцо),
обладающую особыми физическими и
химическими свойствами.
СnН2n-6
3. Фридрих Август Кекуле 7.09. 1829 г.–13.07. 1896 г. Первую наиболее удачную структурную формулу строения бензола предложил
немецкий химикФ.А.Кекуле в 1865 г.
4.
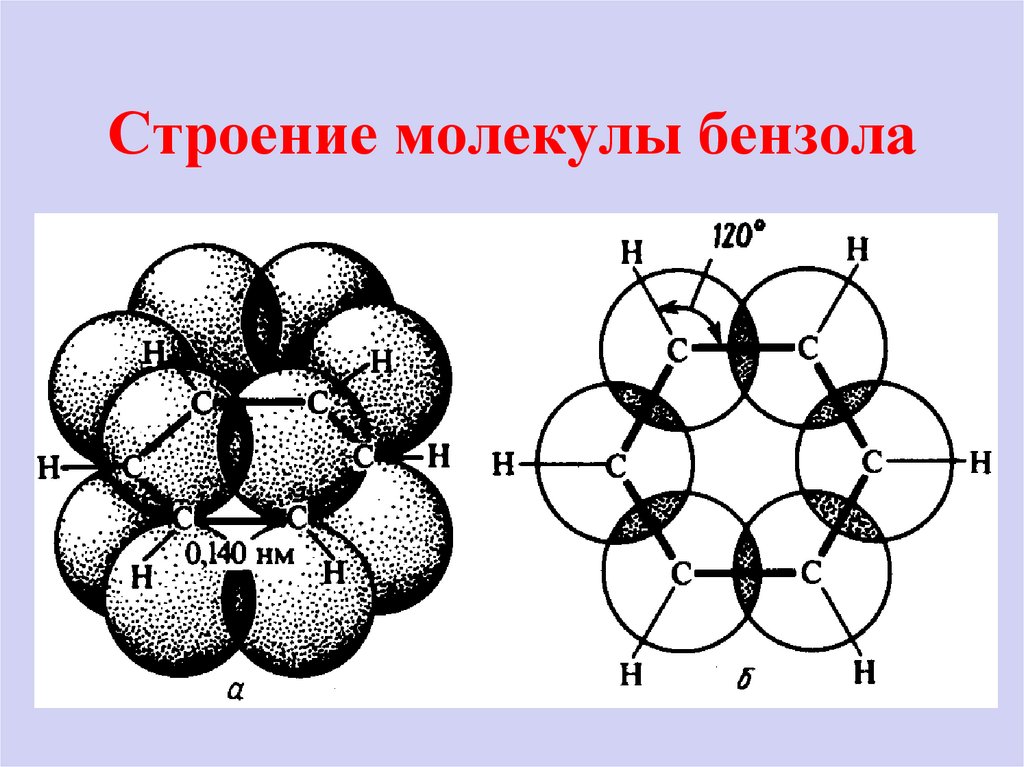
5. Атомы углерода в бензоле замкнуты в цикл, в котором соблюдается валентность углерода (IV) и двойные связи чередуются с
одинарными.По современным представлениям молекула бензола
является
правильным
шестиугольником.
Эта формула отражает равноценность 6 атомов
углерода.
Атомы углерода находятся в SP2 – гибридизации.
Валентные углы между σ – связями равны 120 0,
длина связи С-С равна 0,14 нм. Лежащие в одной
плоскости 6 атомов углерода образуют σ –скелет
молекулы. При взаимном перекрывании образуется
единое π – электронное облако, т е. происходит
декализация электронов. Все связи между атомами
углерода выравнены.
6. Строение молекулы бензола
7. Строение молекулы бензола Совокупность свойств бензола называется ароматичностью.
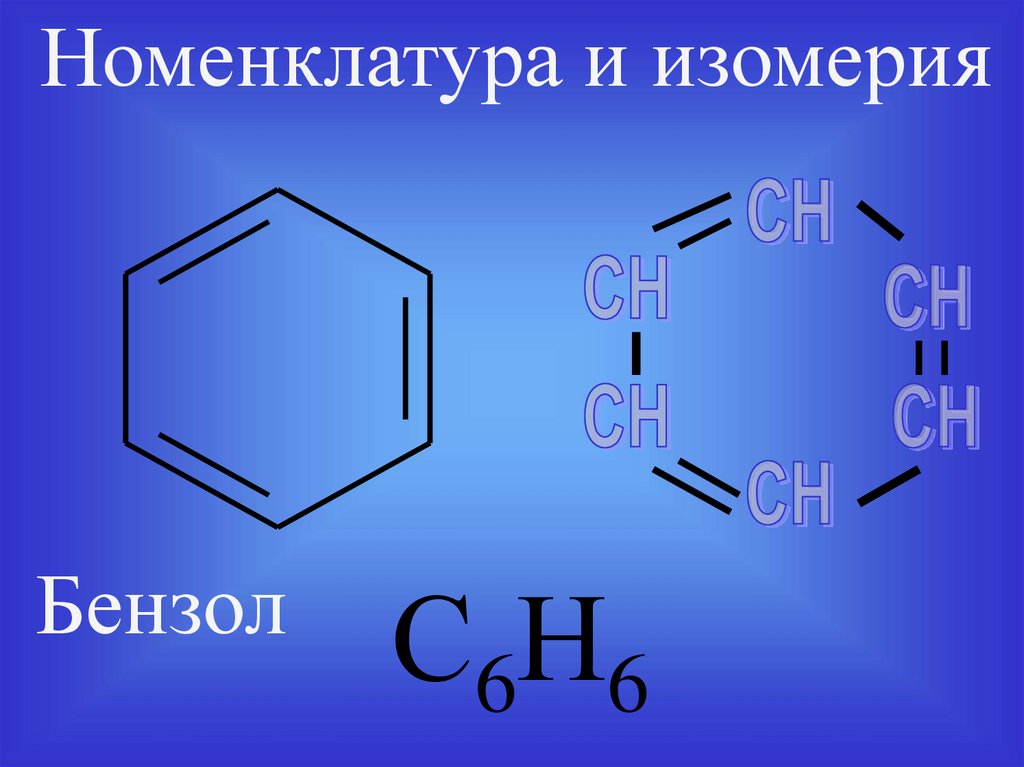
8.
Номенклатура и изомерияБензол
С6Н6
9. 1. Монозамещенные производные бензола изомеров не имеют: СН3 СН3 метилбензол (толуол)
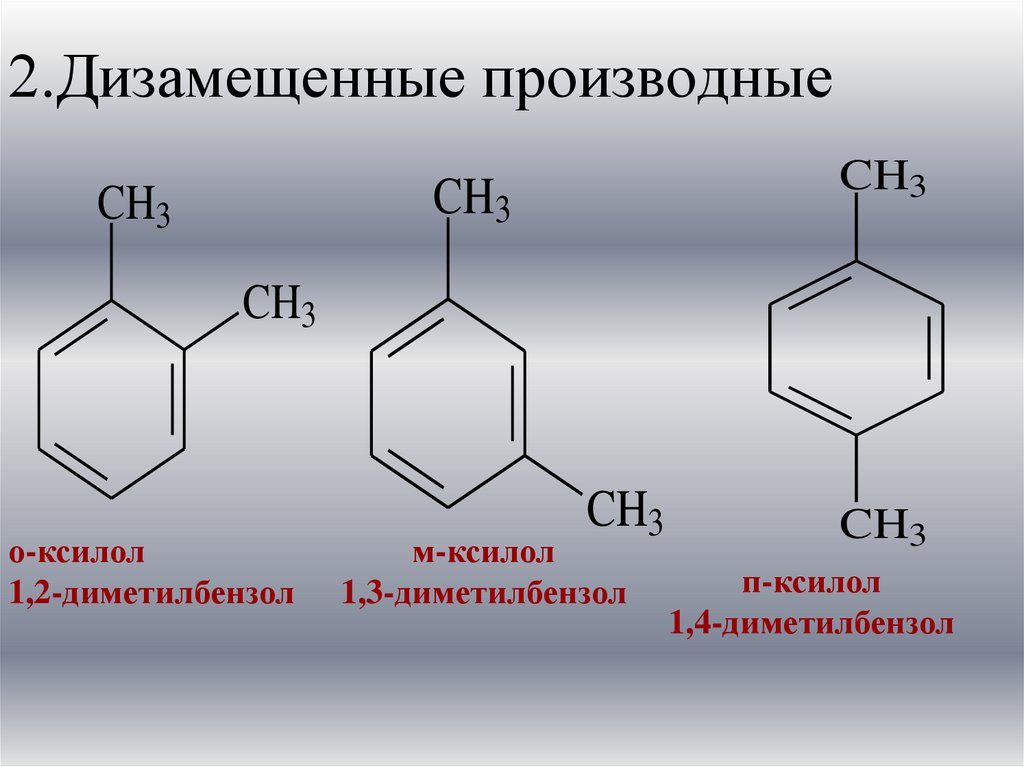
10. 2.Дизамещенные производные
CH3CH3
CH3
CH3
о-ксилол
1,2-диметилбензол
CH3
м-ксилол
1,3-диметилбензол
CH3
п-ксилол
1,4-диметилбензол
11.
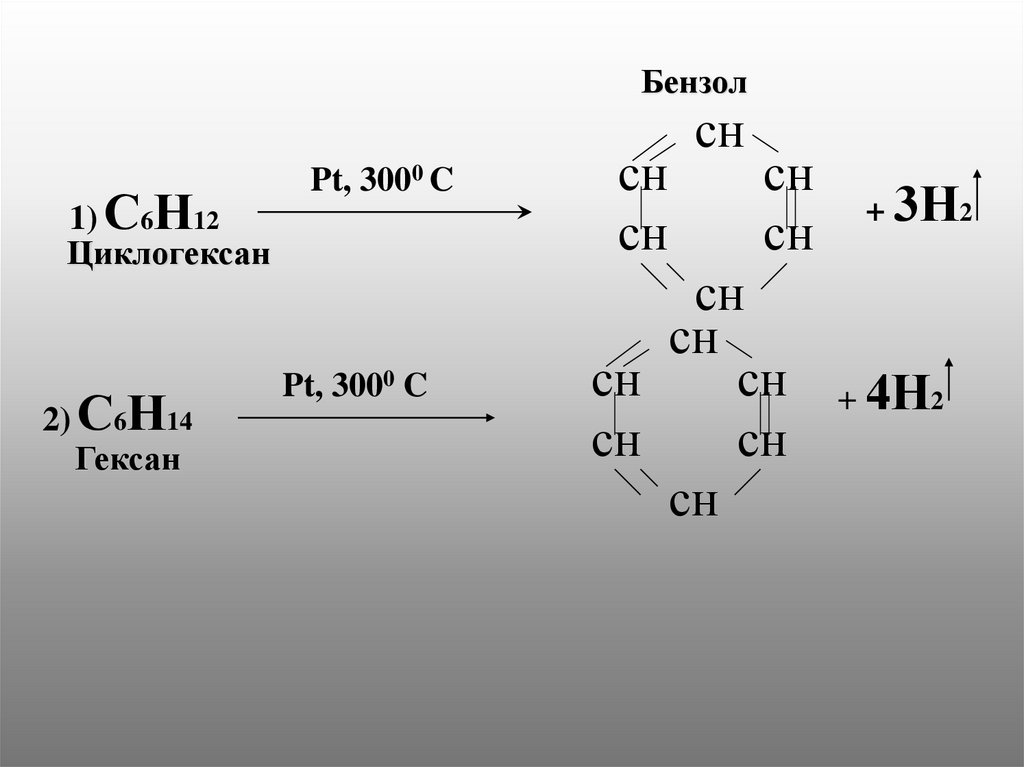
1) . Бензол образуется из циклогексана2) . Бензол образуется из гексана
3) .Бензол образуется из ацетилена
(реакция Зелинского)
4). Лабораторный способ получения бензола
12.
Бензол1) С6Н12
Циклогексан
2) С6Н14
Гексан
Pt, 3000 C
Pt, 3000 C
сн
сн
сн
сн
сн
сн
сн
сн
сн
сн
сн
сн
+ 3Н2
+ 4Н2
13.
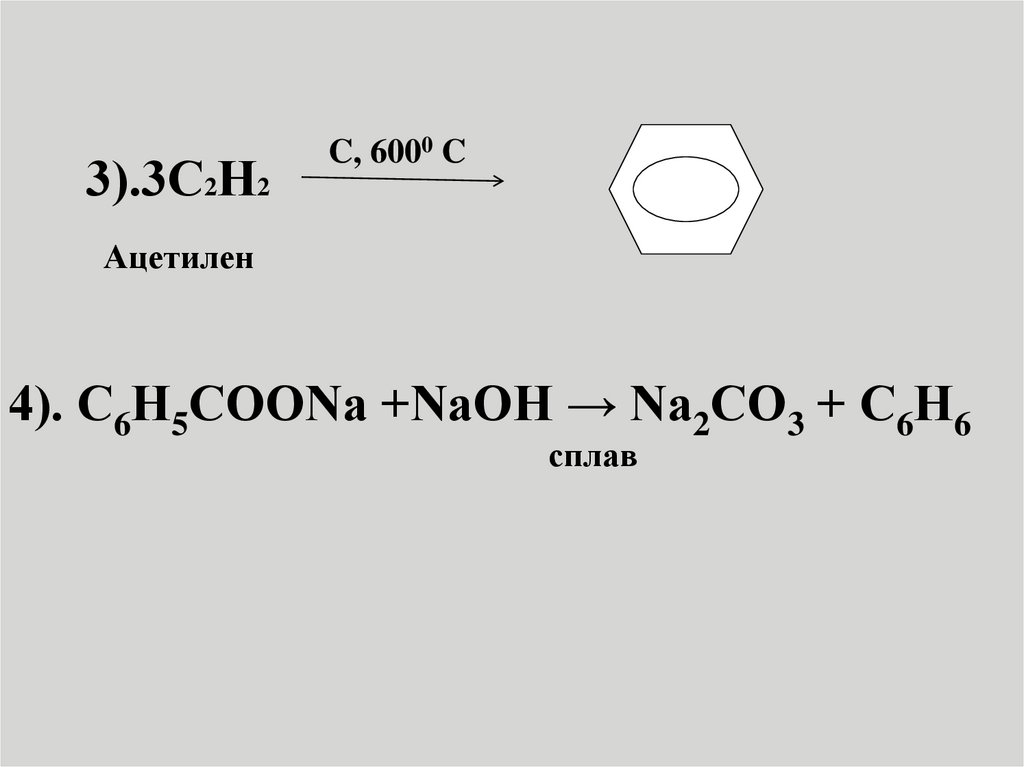
3).3С2Н2C, 6000 C
Ацетилен
4). С6Н5СООNа +NаОН → Nа2СО3 + С6Н6
сплав
14.
Агрегатноесостояние
ЖИДКОСТЬ
Температура 5,50С (ПОВЫШАЕТСЯ С УВЕЛИЧЕНИЕМ
плавления
относительных молекулярных МАСС)
Температура
кипения
80,10С (ПОВЫШАЕТСЯ С УВЕЛИЧЕНИЕМ
ОТНОСИТЕЛЬНЫХ
МОЛЕКУЛЯРНЫХ МАСС)
15.
1. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ(замещение атомов Н в бензольном кольце)
а) Реакция галогенирования
СН
СН
СН
СН
СН
СН
БЕНЗОЛ
+ Br2
FeCl3 ,t
БРОМБЕНЗОЛ
C6H5Br + HBr
16.
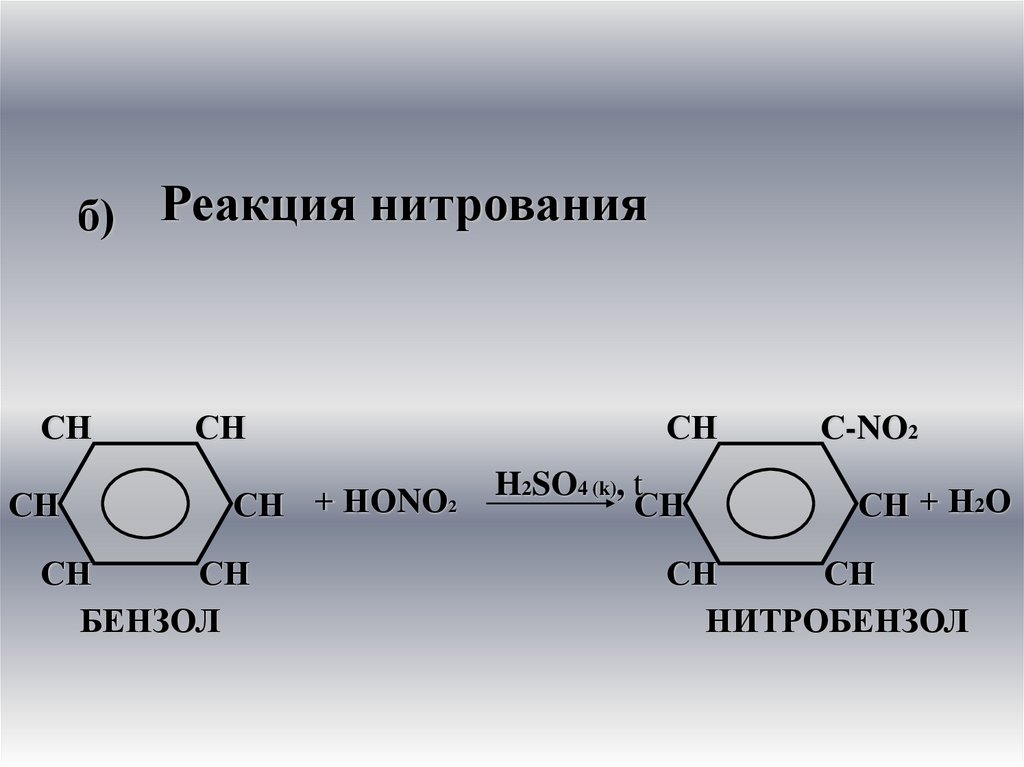
б) Реакция нитрованияСН
СН
СН
СН + НОNО2
СН
СН
БЕНЗОЛ
СН
H2SO4 (k), t
СН
С-NO2
СН + Н2О
СН
СН
НИТРОБЕНЗОЛ
17. в)Реакция сульфирования +НОSО3Н С6Н6 С6Н5SО3Н - Н2О сульфобензол
18.
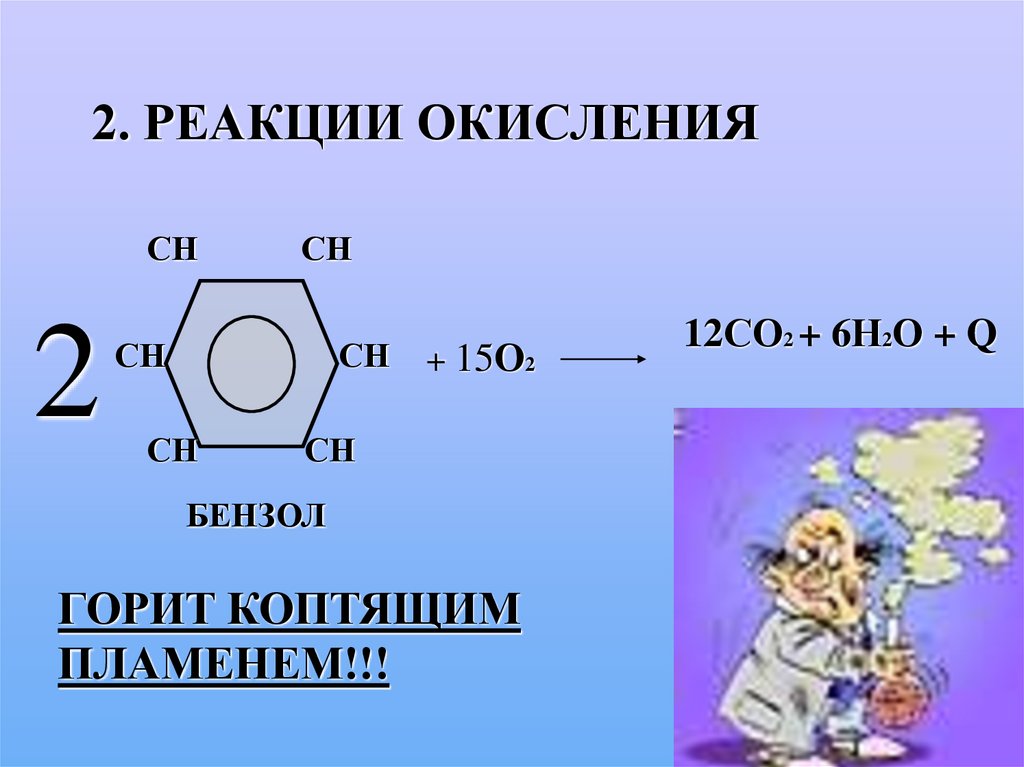
2. РЕАКЦИИ ОКИСЛЕНИЯСН
2
СН
СН
СН
СН
+ 15О2
СН
БЕНЗОЛ
ГОРИТ КОПТЯЩИМ
ПЛАМЕНЕМ!!!
12СО2 + 6Н2О + Q
19.
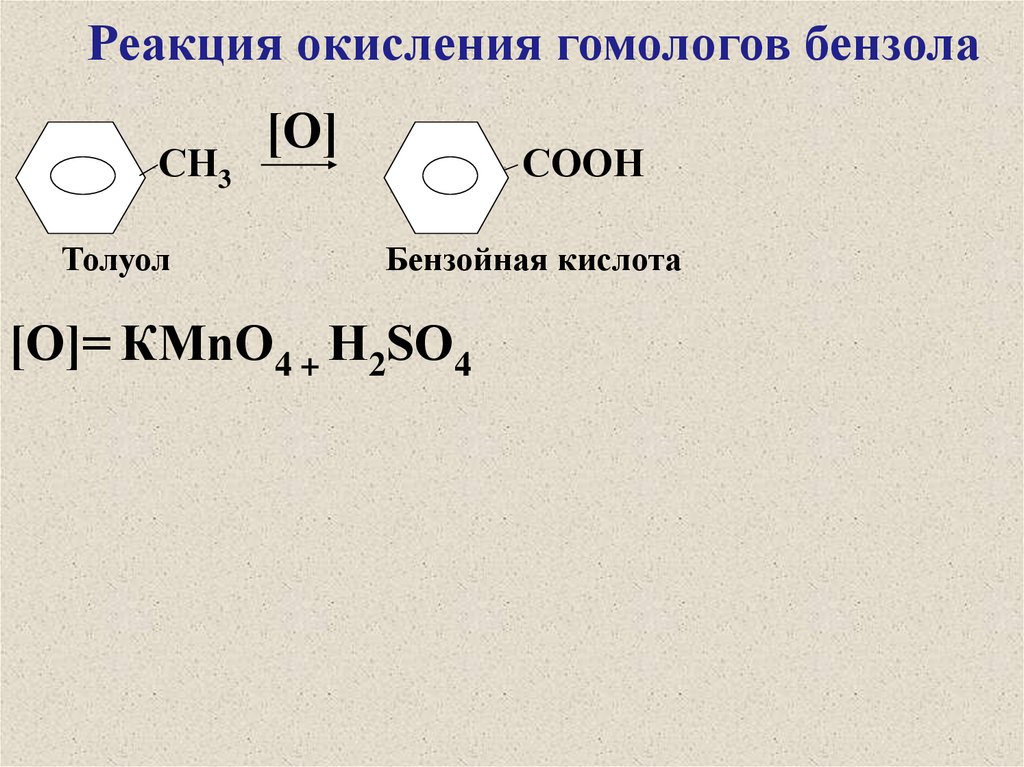
Реакция окисления гомологов бензолаСН3
Толуол
[О]
СООН
Бензойная кислота
[О]= КМnО4 + Н2SО4
20.
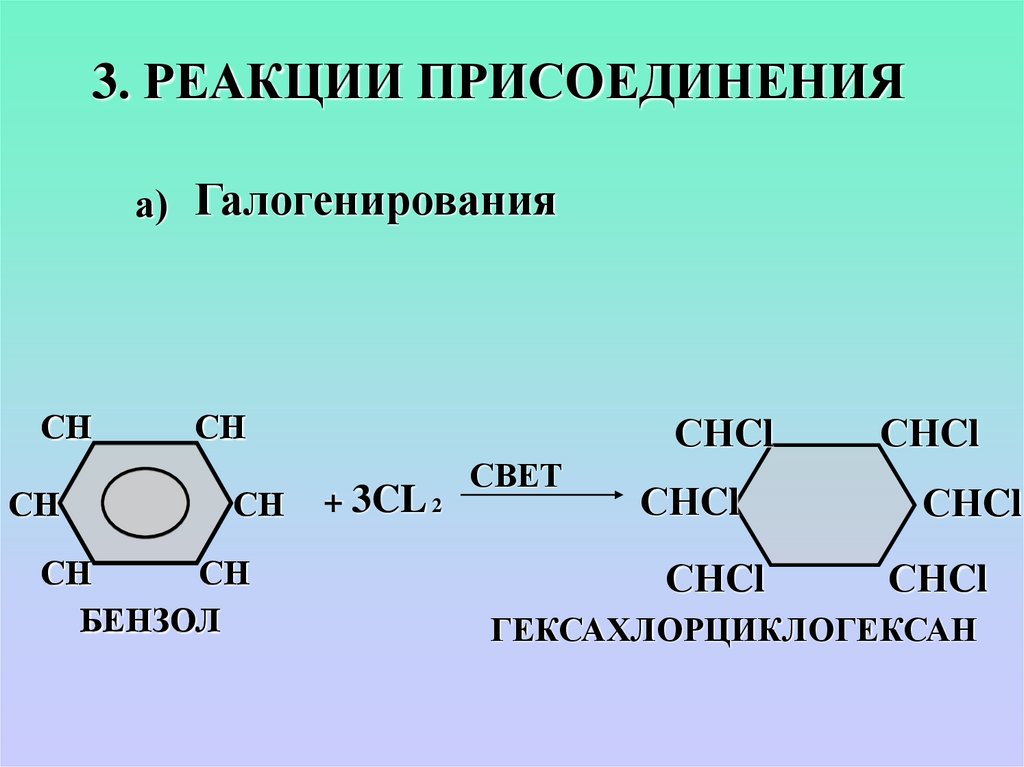
3. РЕАКЦИИ ПРИСОЕДИНЕНИЯа) Галогенирования
СН
СН
СН
СН
СН
СН
БЕНЗОЛ
СНCl
+ 3CL 2
СВЕТ
СНCl
СНCl
СНCl
СНCl
СНCl
ГЕКСАХЛОРЦИКЛОГЕКСАН
21.
б)СН
СН
Гидрирование
СН
СН + 3Н2
СН
СН
БЕНЗОЛ
СН2
КТ, t
СН2
СН2
СН2
СН2
СН2
ЦИКЛОГЕКСАН
22.
Реакции электрофильногозамещения для гомологов бензола
Эффекты заместителей при электрофильном
замещении
1. Заместители (ориентанты) первого рода: —ОН, —
OR, —OCOR, —SH, —NH2, —NHR, (Hal). Эти
заместители смещают электронную плотность в
сторону бензольного кольца, т.е. обладают
электронодонорными свойствами. Они активируют
бензольное кольцо (за исключением галогенов).
Облегчая вхождение электрофильных реагентов в
бензольное кольцо, они ориентируют новый
заместитель в орто- и пара-положения. Такие
заместители называют орто- и пара-ориентантами.
23.
OH-
-
фенол
-
24.
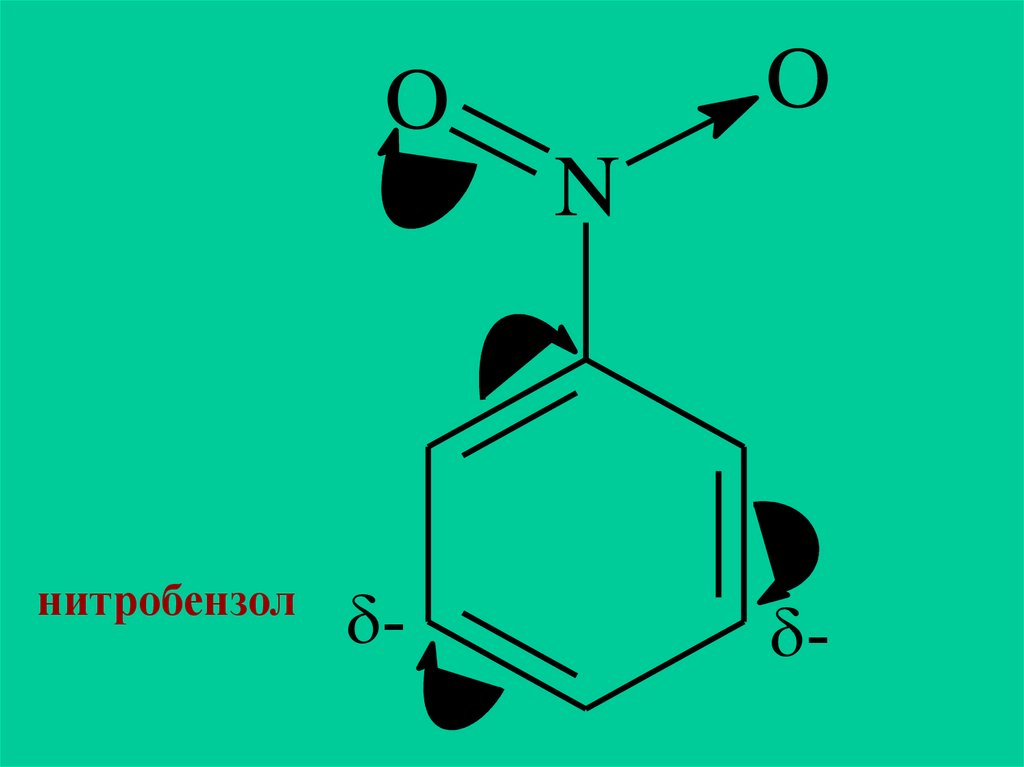
2. Заместители (ориентанты) второго рода: —CN, —СООН, —SO3H, —СНО, —COR, —COOR, —NO2.
Эти заместители смещают электронную плотность
от бензольного кольца, т.е. они обладают
электроноакцепторными свойствами. Эти
заместители дезактивируют бензольное кольцо,
затрудняя вхождение электрофильных реагентов.
При этом вновь входящий заместитель ориентируют
в мета-положение. Такие заместители называют
мета-ориентантами.
25.
OO
N
нитробензол
-
-
26.
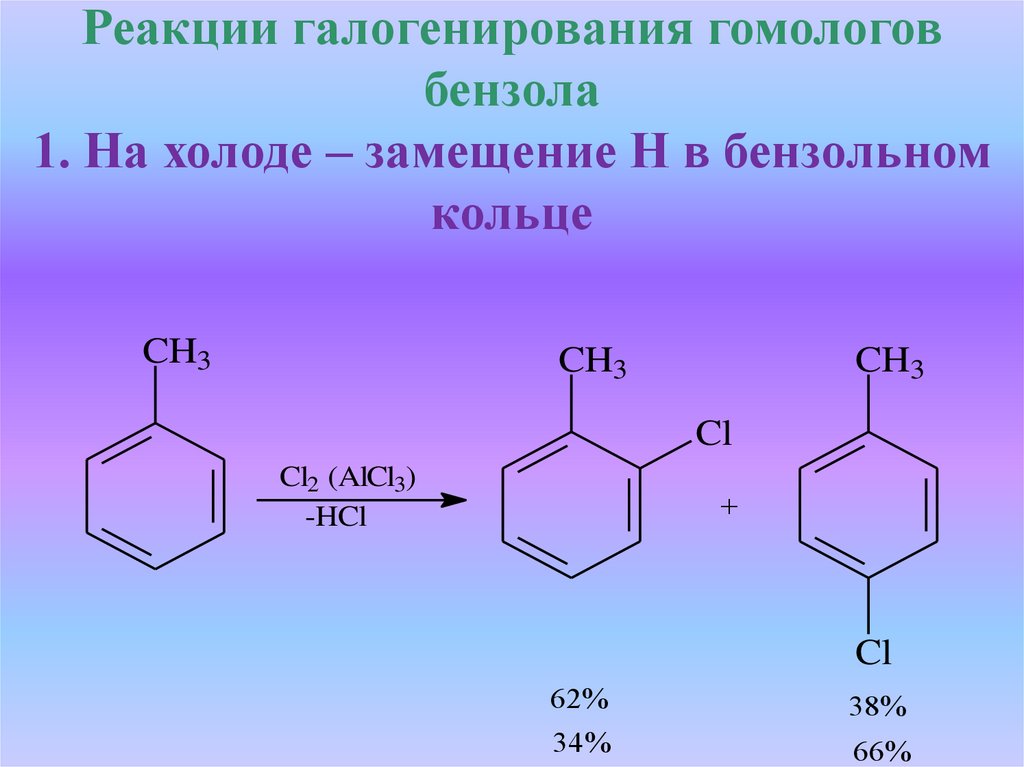
Реакции галогенирования гомологовбензола
1. На холоде – замещение Н в бензольном
кольце
CH3
CH3
CH3
Cl
Cl2 (AlCl3)
-HCl
+
Cl
62%
38%
34%
66%
27.
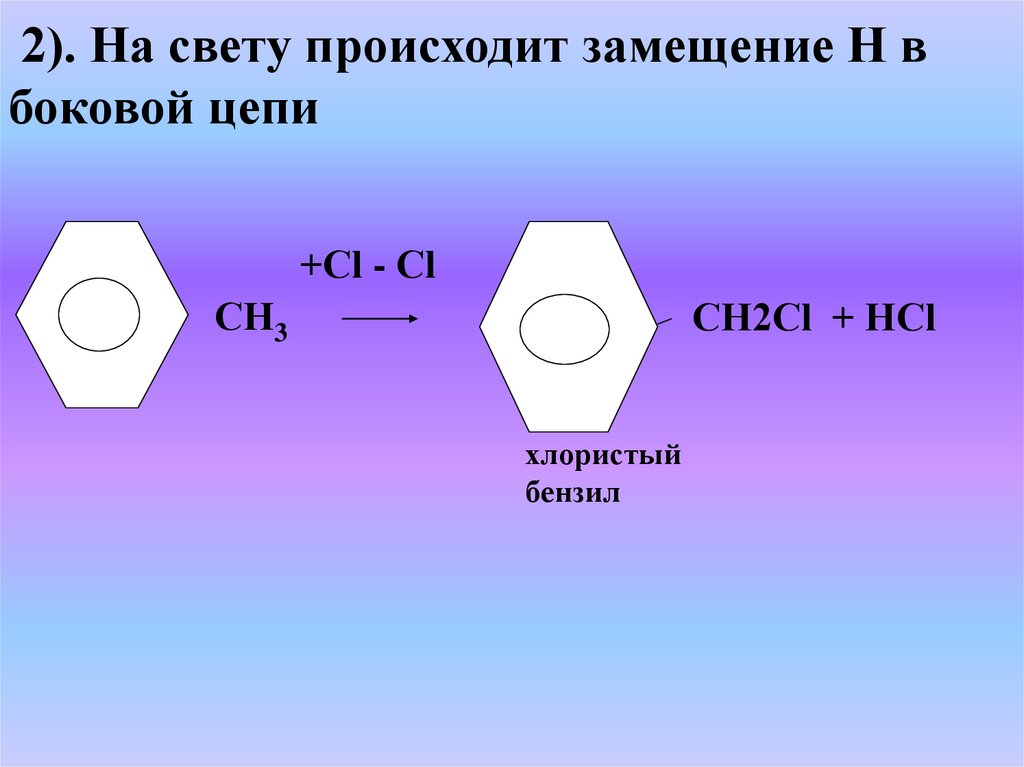
2). На свету происходит замещение Н вбоковой цепи
+Сl - Сl
СН3
СН2Сl + НСl
хлористый
бензил
28.
Многоядерные ареныНафталин - бесцветное
кр.вещество, tплавл. = 800 С
8
1
7
2
3
6
5
4
29.
Антрацен – белое кр. вещество tплавл. = 2170Симеет ряд производных являющихся
слабительными средствами
8
7
6
9
1
2
3
5
10
4
антрацен
30.
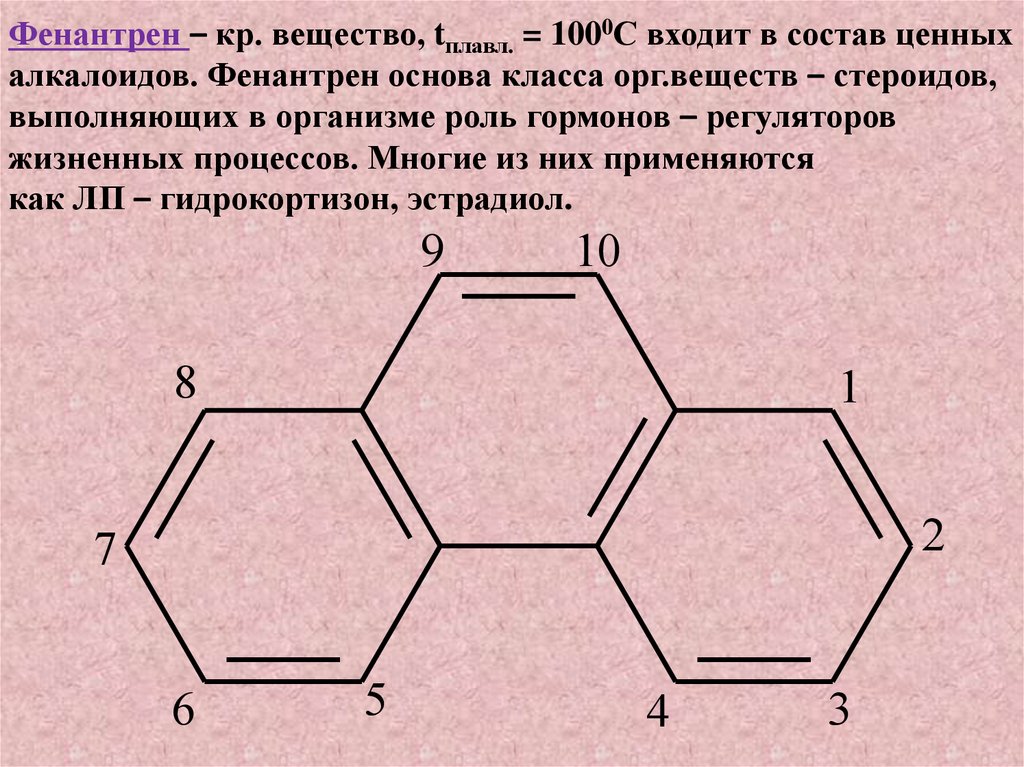
Фенантрен – кр. вещество, tплавл. = 1000С входит в состав ценныхалкалоидов. Фенантрен основа класса орг.веществ – стероидов,
выполняющих в организме роль гормонов – регуляторов
жизненных процессов. Многие из них применяются
как ЛП – гидрокортизон, эстрадиол.
9
10
8
1
2
7
6
5
4
3
31.
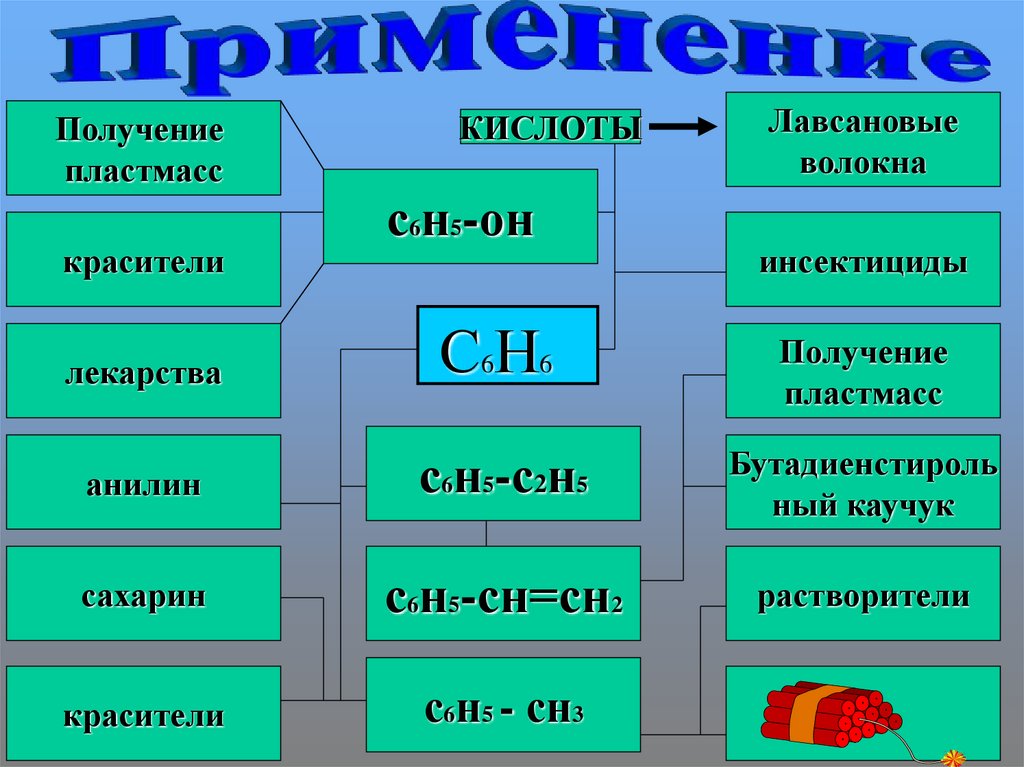
Получениепластмасс
красители
КИСЛОТЫ
с6н5-он
Лавсановые
волокна
инсектициды
лекарства
С6Н6
Получение
пластмасс
анилин
с6н5-с2н5
Бутадиенстироль
ный каучук
сахарин
с6н5-сн=сн2
растворители
красители
с6н5 - сн3

















 Химия
Химия








