Похожие презентации:
История экспениментального восстановления потенций в ядрах дифференцированных клеток. Клоны животных
1.
ИСТОРИЯ ЭКСПЕНИМЕНТАЛЬНОГО ВОССТАНОВЛЕНИЯПОТЕНЦИЙ В ЯДРАХ ДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК
Идея восстановления потенций в клетках, утраченных ими в процессе
дифференцировки, витала в умах исследователей начиная с 30-х годов прошлого
столетия. В лаборатории Ганса Шпемана (Hans Spemann) были проведены
первые эксперименты по переносу ядер в энуклеированный ооцит амфибий
(1939).
Бригс и Кинг в 1952 г. (Briggs and King, 1952) инъецировали ядра клеток со
стадии бластулы или ранней гаструлы (8000-16000 клеток) в предварительно
энуклеированые яйца Rana pipiens и наблюдали нормальное развитие до стадии
питающейся личинки (головастика).Эти же авторы позднее (1960) описали
полное развитие до взрослой лягушки.
Существенный вклад в развитии техники переноса ядер соматических клеток в
энуклеированный ооцит Xenopus laevis внес Джон Гордон (J. Gordon) впервые
показавший возможность полного развития реконструированного ооцита под
контролем ядра эпителиальной клетки кишечника и эпителиальной клетки кожи
головастика.
Вилмут и др. (Wilmut et al., 1997) первое клонированное млекопитающее –
овца Долли.
2.
Эпигенетические механизмы определяющие исопровождающие эмбриональную и клеточную
дифференцировку
- метилирование ДНК (цитозин-метилазы и деметилазы, белкисвязывающие метил-CpG)
- ремоделирование хроматина - «гистоновый код»
- укорочение теломерной ДНК
- снижение или отсутствие пролиферативной активности
- полиплоидизация, политенизация хромосом
- элиминация хроматина (диминуция хроматина)
- энуклеация (эритроциты, клетки хрусталика и т.д.)
- формирование цитоплазмы с тканевой или
стадио-специфическими свойствами (?)
3.
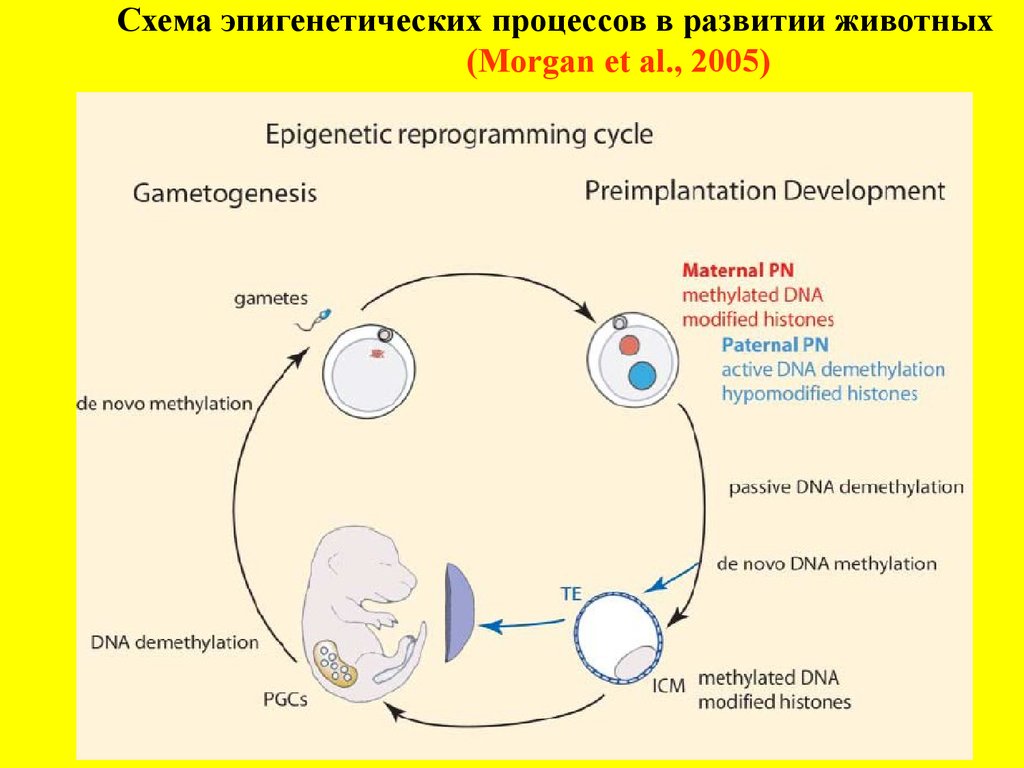
Схема эпигенетических процессов в развитии животных(Morgan et al., 2005)
4.
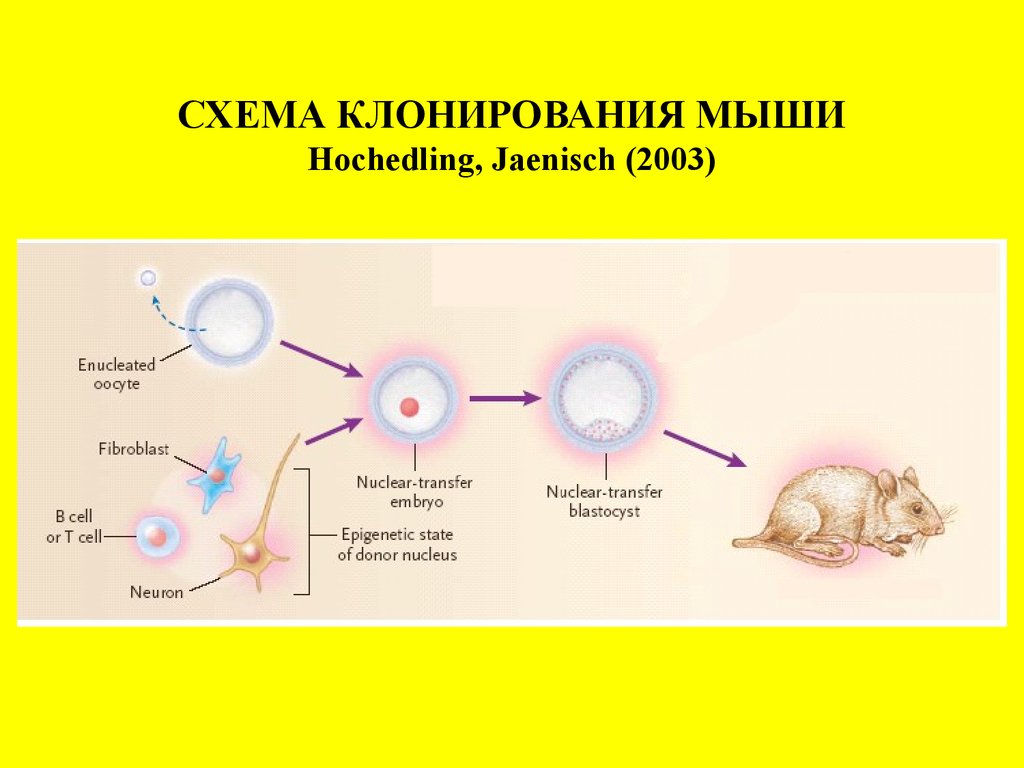
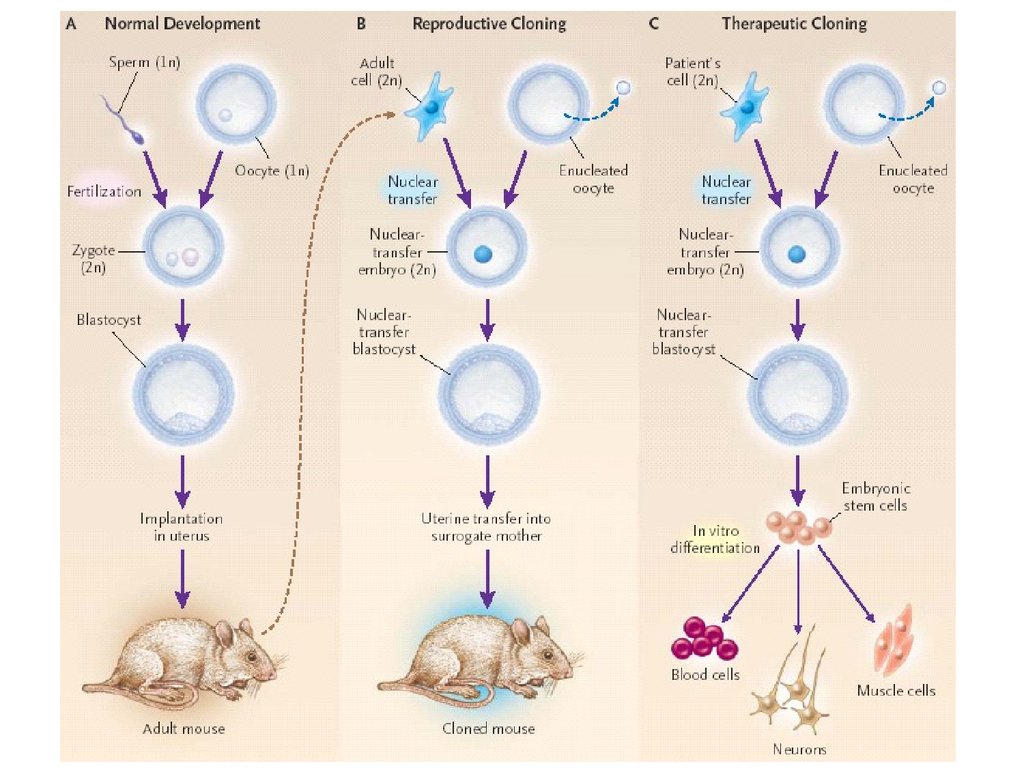
СХЕМА КЛОНИРОВАНИЯ МЫШИHochedling, Jaenisch (2003)
5.
Somatic Cell Nuclear TransferDOLLY
1997
“Decisions”
not irreversible
Melissa Henriksen, PhD
6.
7. Оплодотворенная яйцеклетка мыши
8.
_________________________________________________________________Перечень «клонированных» видов млекопитающих
Вид
Клетки
Эффективность
Ссылки
____________________________________________________________________
Овца
эпителий
1/277 (0.4%)
Wilmut et al. 1997
Мышь
клетки кумулюса
41/2468 (1.7%)
Wakayama et al.1998
Корова
клетки кумулюса
4/276 (1.4%)
Cibelli et al.1998
Коза
фибробласт
3/285 (1.1%)
Baguisi et al.1999
Свинья
фибробласт
1/210 (0.5%)
Onishi et al.2000
Кролик
клетки кумулюса
6/1852 (2.7%)
Chesne et al.2002
Кошка
клетки кумулюса
Shin et al. 2002
Мул
фибробласт
1/334 (0.3%)
Woods et al.2003
Лошадь фибробласт
1/841 (0.1%)
Galli et al. 2003
Крыса
фибробласт
Zhou et al.2003
Собака
Lee et al., 2005
Гаур
Vogel et al. 2001
Красный олень
(Cervus elaphus) остеогенные клетки
Berg et al. 2007
Хорек
МакакаРезус
Li et al. 2006
фибробласты
35|213 (16%)
бластоциста
Byme et al.2007
9.
«Клонированные» животныеMelissa Henriksen, PhD
10.
Эффективность клонирования мышей в опытах по пересадкеядер клеток с разных стадий развития
_________________________________________________________
Донорские
% развившихся
% родившихся
Ссылки
клетки
бластоцист
___________________________________________________________________
_
2-х клеточный
эмбрион
29
10
Cheong et al. (1993)
4- клеточный
22
22
8-клеточный
17
3
4-клеточный
83
57
Kwon and Kono (1996)
Клетки кумулуса
2
Wakayama and
немедленная
30-345
2-3
Yanagimachi (1998)
активация
Wakayama and
1-3 ч активации
42-61
1-3
Yanagimachi (1998)
Фибробласт
1
Фетальный
30
1-3
Ono et al. (2001)
фибробласт
Клетки мозга
эмбриона
5,5
Yamazaki et al. (2001)
11.
Nuclear transfer has become almost synonymous with‘cloning’, although the aims of the two processes differ; cloning is
used to generate near-identical genetic copies of an organism
whereas nuclear transfer is used to generate stem cells for
regenerative medicine.
Vogelstein B, Alberts B, Shine K: Genetics. Please don’t call it
cloning! Science 2002, 295:1237.
Перенос ядер в энуклеированный ооцит или яйцо часто
используется как синоним «клонирование», хотя цели этих двух
экспериментальных подходов разные: клонирование
используется для получения идентичных генетических копий, в
то время как перенос ядер в настоящее время предполагает
получение стволовых клеток для регенеративной медицины»
12.
Развитие реконструированных ооцитов мышей и коров в условиях in vitroдо стадии бластоцисты в сравнении с оплодотворением in vitro (Yang et al.,
2007)
13.
Рождение «клонированных» мышей и коров по сравнению сконтрольными, развившихся из зигот после их оплодотворения
in vitro (Yang et al., 2007)
14.
15.
16.
Taeyoung Shin et al.A cat cloned by nuclear transplantation.
Nature 2002, v.415, 723
17.
Аберрантная экспрессия генов у клонированных млекопитающих(Tamada and Kikyo 2004)
________________________________________________________
Вид
Донорские
Стадия
клетки
Аберрантная экспрессия/ Метод
Ссылки
общее число генов
____________________________________________________________________________________
Корова
Гранулезные 2-х -бластоциста 3/7 (42,9%)
ОТ-ПЦР
Daniels et al.2000
Корова
Эпителиальные Бластоциста
ОТ-ПЦР
Daniels et al.2001
Корова Фолликулярные Бластоциста
1/4 (25%)
1/8 (12,5%),3/8 (37,5%) ОТ-ПЦР
Wrenzycki et al.
2001
Мышь
Мышь
ЭСК
Плацента
221/12654 (1,7%)
Микрочип Humpherys et al.
Печень
26/12654 (0,2%)
Микрочип 2002
Кумулюсные
Плацента
286/12654 (2,3%)
ЭСК
Плацента
1807/15247 (11,9%)
Suernizu et al.2003
1964/15247 (12,9%)
____________________________________________________________________________________
18.
Схема развития ооцита и раннее развитие мыши.Метилирование ДНК материнского (красный цвет) и отцовского
(синий) геномов. Сиреневый цвет показывает метилирование ДНК
«клонированных» эмбрионов мыши. Черным выделено
метилирование ВКМ и ТЭ у «клонированных» мышей (Yang et al.
2007)
19.
Метилирование ДНК материнского (красный цвет) и отцовского (синий)геномов в раннем развитии коров в сравнении с «клонированными
эмбрионами (сиреневый).
Черным цветом показано метилирование ДНК ВКМ и ТЭ у «клонированных»
эмбрионов (Yang et al., 2007)
20.
Профиль активных генов в хромосомах нормальных иклонированных» мышей (Inoue et al., 2010)
21.
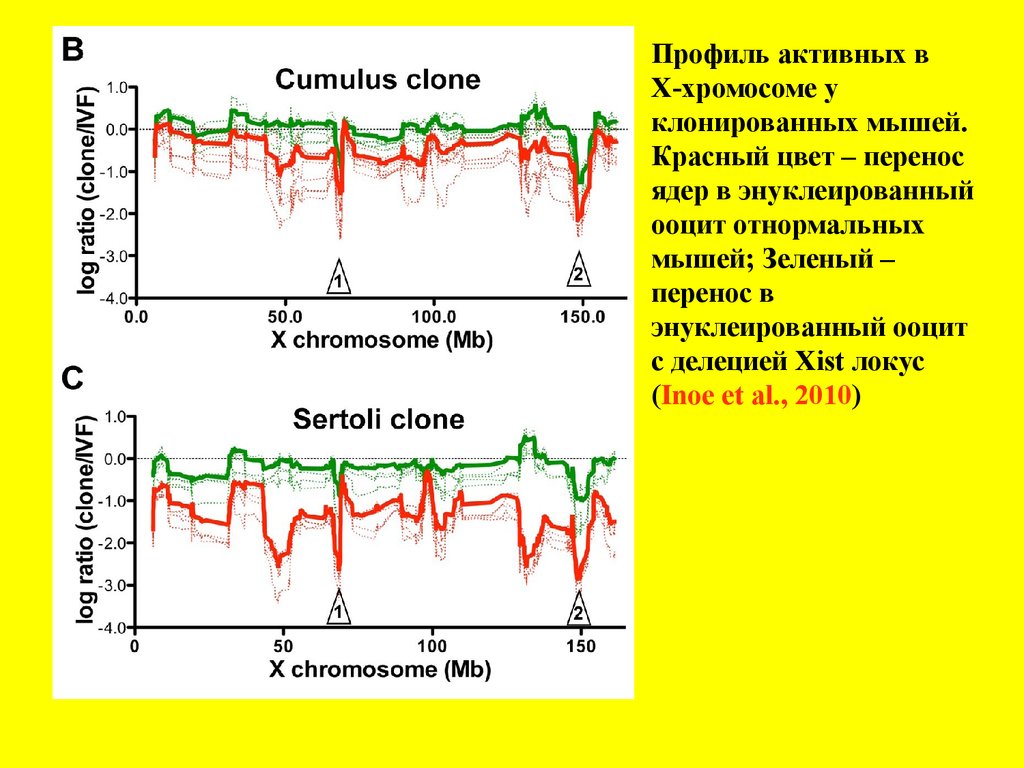
Профиль активных вХ-хромосоме у
клонированных мышей.
Красный цвет – перенос
ядер в энуклеированный
ооцит отнормальных
мышей; Зеленый –
перенос в
энуклеированный ооцит
с делецией Xist локус
(Inoe et al., 2010)
22.
Рождение«клонированных»
мышей
(Inoe et al., 2010)
23.
Инактивация Х-хромосому нормальных и
клонированных
эмбрионов мыши
(Yang et al., 2007)
24.
Эффективность развития эмбрионов после оплодотворения in vitro (a), инъекцииЭС клеток в тетраплоидные бластоцисты (b,c) и переноса ядер (Yang et al., 2007)
25.
Первые стадии развития эмбриона2
2 клетки
клетки
4 клетки
8 клетки
морула
бластоциста
26.
Схема получения линий ЭС клеток из бластоцист, развившихся изреконструированных ооцитов млекопитающих (Yang et al., 2007)
27.
Схема получения ЭСК из «клонированных»бластоцист человека
Melissa Henriksen, PhD
28.
29.
30.
31.
32.
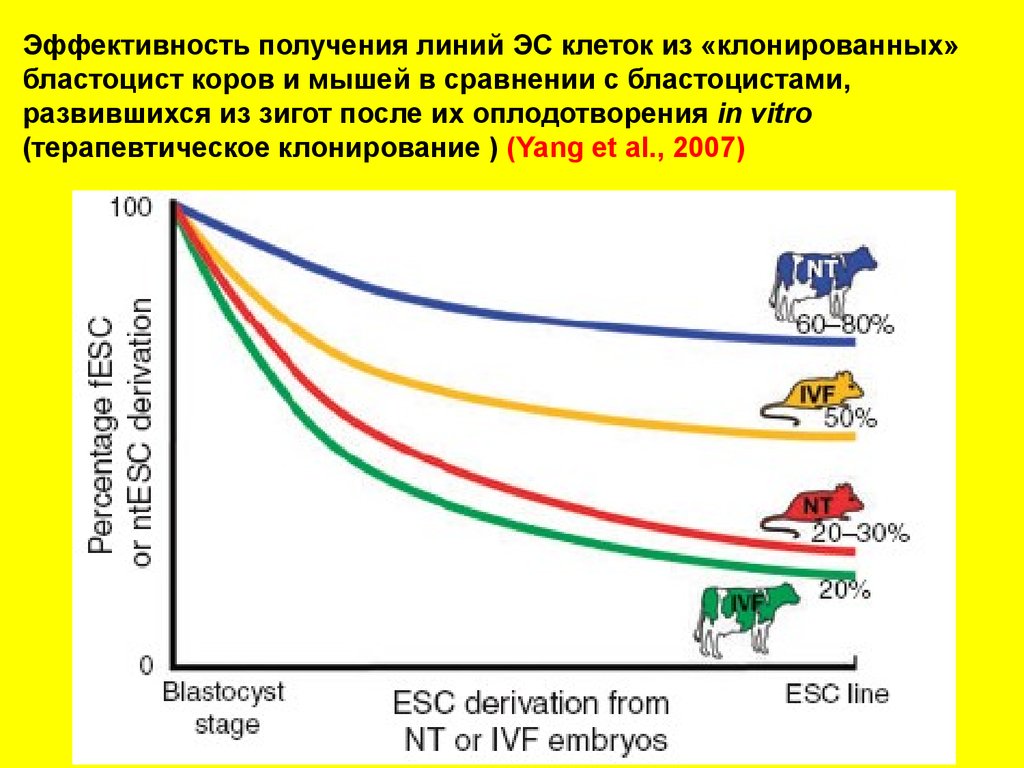
Эффективность получения линий ЭС клеток из «клонированных»бластоцист коров и мышей в сравнении с бластоцистами,
развившихся из зигот после их оплодотворения in vitro
(терапевтическое клонирование ) (Yang et al., 2007)

























 Биология
Биология








