Похожие презентации:
Соли
1.
СОЛИ2.
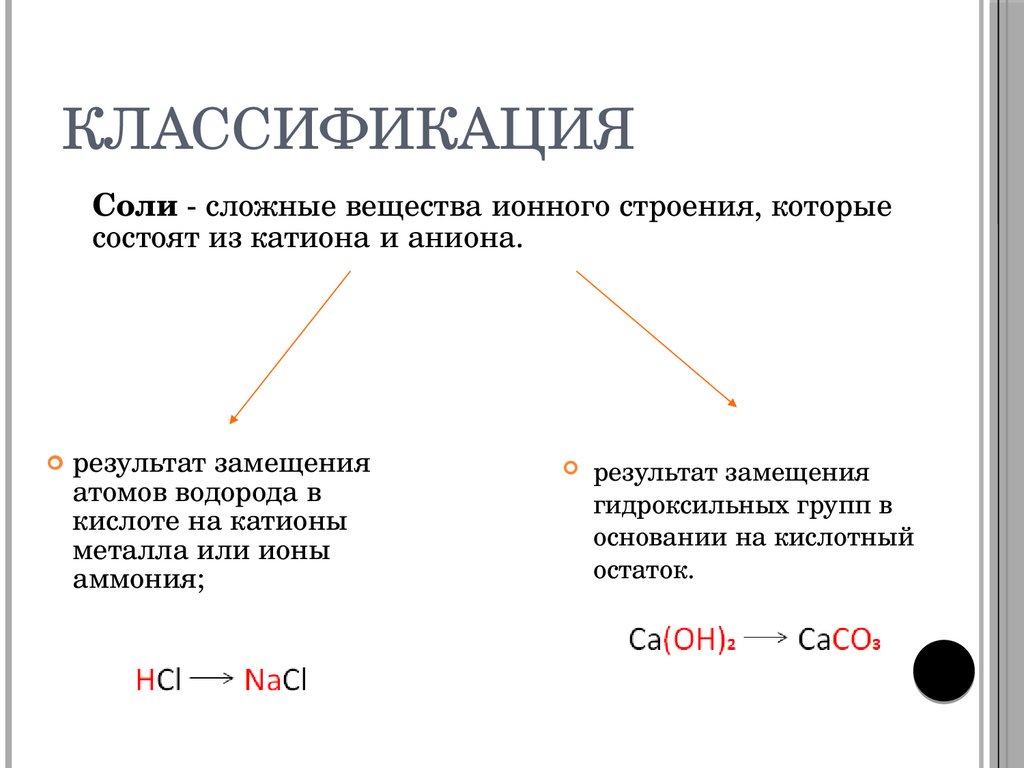
КЛАССИФИКАЦИЯСоли - сложные вещества ионного строения, которые
состоят из катиона и аниона.
результат замещения
атомов водорода в
кислоте на катионы
металла или ионы
аммония;
результат замещения
гидроксильных групп в
основании на кислотный
остаток.
3.
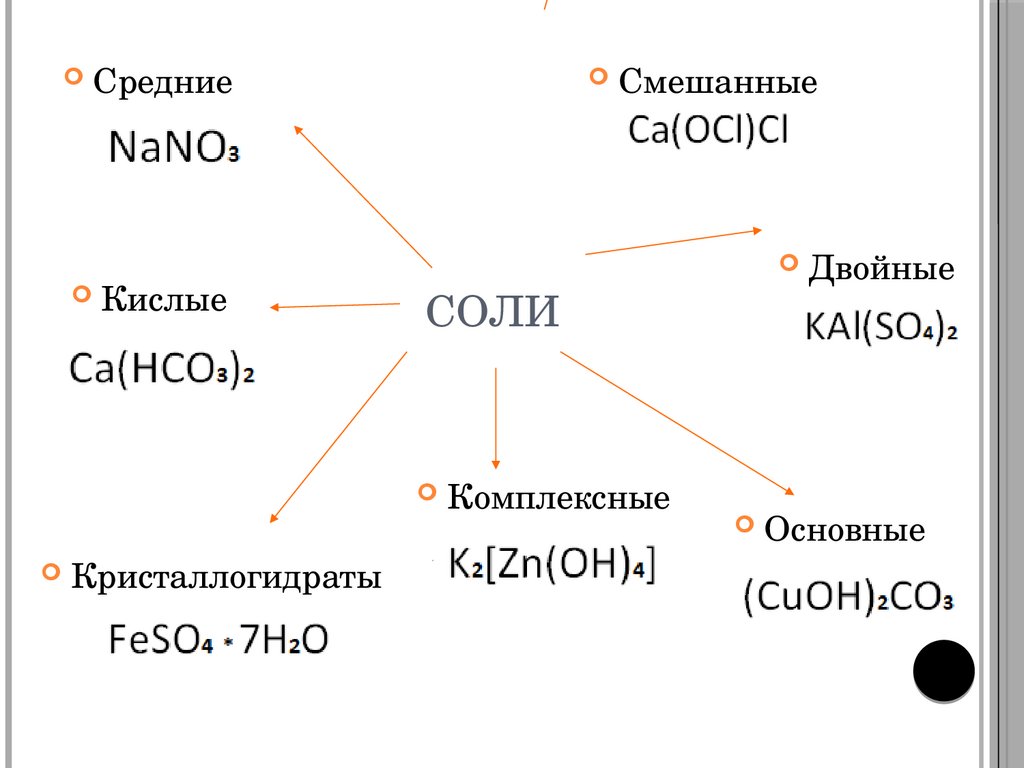
СредниеСмешанные
Кислые
СОЛИ
Кристаллогидраты
Двойные
Комплексные
Основные
4.
Средние солирезультат полного замещения атомов водорода в кислоте на
катионы металла или ионы аммония.
КCl, Li2SO4, Na3PO4, (NH4) 2SO4
Кислые соли
продукты неполного замещения атомов водорода в кислоте на
катионы металлов или аммония.
NaHCO3, Ba(H2PO4)2, NaHS
Основные соли
продукты неполного замещения гидроксогрупп в основаниях
или амфотерных гидроксидах на кислотные остатки.
Mg(OH)Cl, (CuOH)2CO3, Al(OH)2Cl
Комплексные соли
содержат сложный анион или катион, который записывают в
квадратных скобках.
Na[Al(OH) 4], K3 [Fe(CN)6]
5.
Двойные солисодержат два разных катиона.
KAl(SO4)2, NH4MgPO4
Смешанные соли
содержат разные кислотные остатки.
MgClBr, Ca(OCl)Cl
Кристаллогидраты
содержат в своем составе молекулы воды. Существуют
только в твердом виде, при растворении разрушаются.
CuSO4 · 5H2O, Na2CO3·10H2O, FeSO4·7H2O
6.
ГИДРОЛИЗТо, как ведет себя соль в растворе, зависит от
того, какой по силе кислотой и основанием
(амфотерным гидроксидом) она образована.
Гидролиз идёт по слабому иону!
1. Слабая кислота + сильное основание
+
Na2S
2-
S + HOH
2-
2Na + S
-
HS + OH
Гидролиз по аниону;
Среда щелочная.
-
7.
2. Сильная кислота + слабое основание2+
CuCl2
-
Cu + 2Cl
2+
+
Cu + HOH
+
CuOH + H
Гидролиз по катиону;
Среда кислая.
3. Слабая кислота + слабое основание
+
NH4F
_
NH4 + F
+
NH4 + HOH
_
F + HOH
+
NH3 + H2O + H
_
HF + OH
Гидролиз по катиону и по аниону;
Среда нейтральная.
8.
4. Сильная кислота + сильноеоснование
Гидролизу не подвергается;
Среда нейтральная.
9.
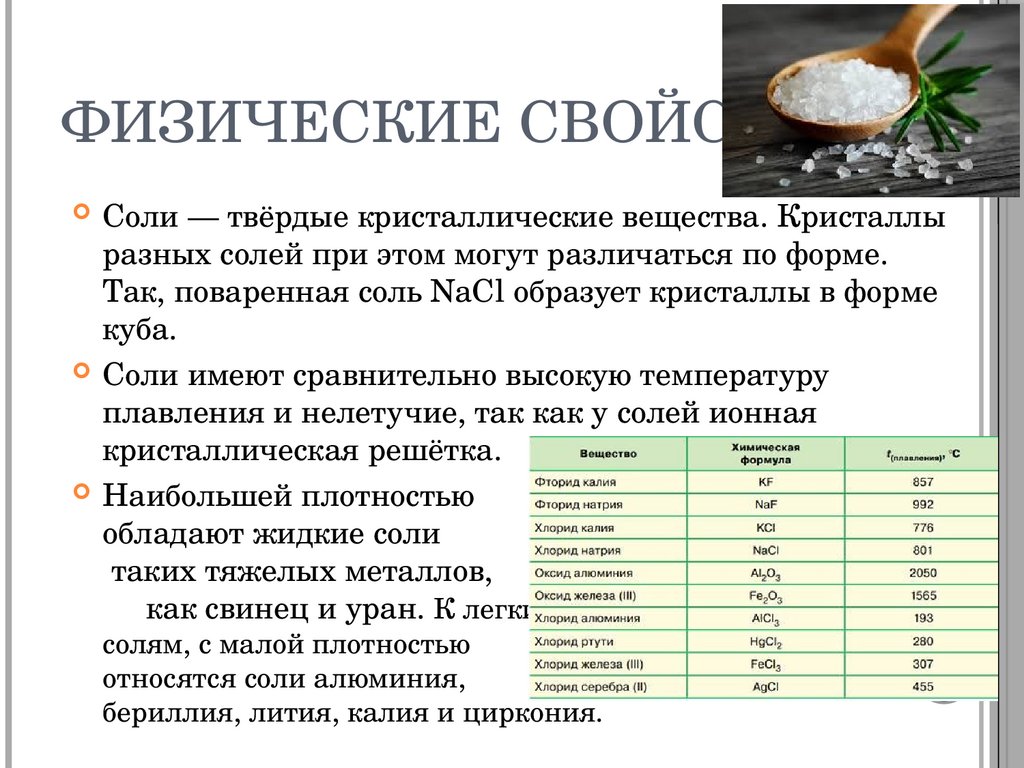
ФИЗИЧЕСКИЕ СВОЙСТВАСоли — твёрдые кристаллические вещества. Кристаллы
разных солей при этом могут различаться по форме.
Так, поваренная соль NaCl образует кристаллы в форме
куба.
Соли имеют сравнительно высокую температуру
плавления и нелетучие, так как у солей ионная
кристаллическая решётка.
Наибольшей плотностью
обладают жидкие соли
таких тяжелых металлов,
как свинец и уран. К легким
солям, с малой плотностью
относятся соли алюминия,
бериллия, лития, калия и циркония.
10.
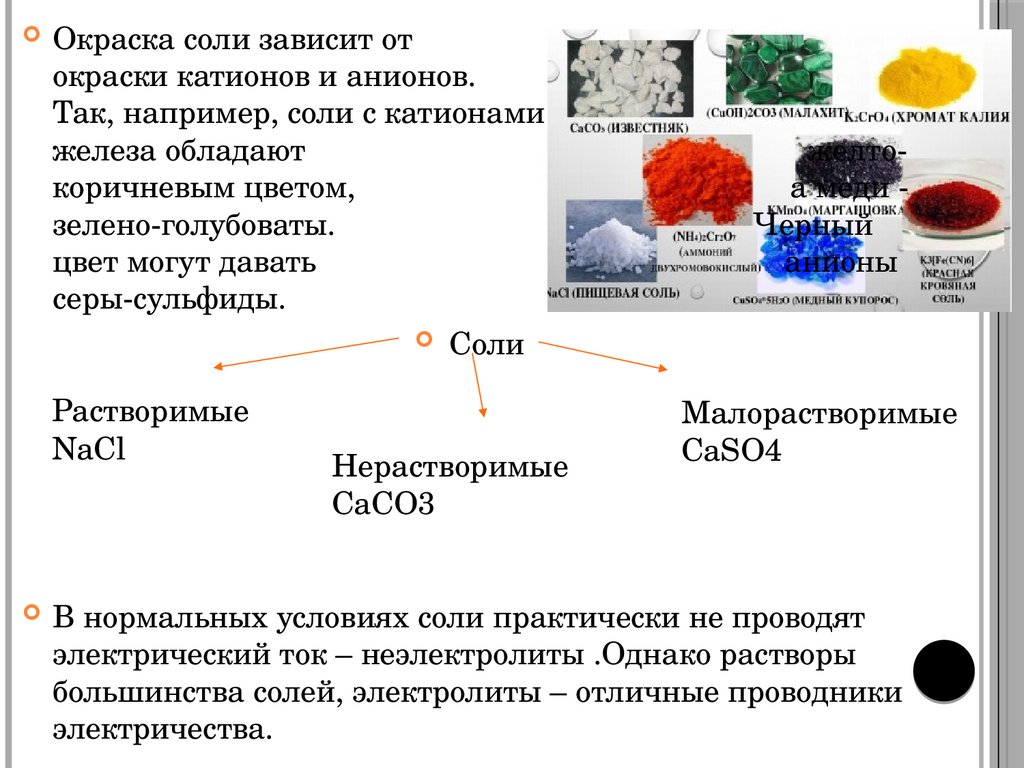
Окраска соли зависит отокраски катионов и анионов.
Так, например, соли с катионами
железа обладают
коричневым цветом,
зелено-голубоваты.
цвет могут давать
серы-сульфиды.
Соли
Растворимые
NaCl
Нерастворимые
CaCO3
желтоа меди Черный
анионы
Малорастворимые
CaSO4
В нормальных условиях соли практически не проводят
электрический ток – неэлектролиты .Однако растворы
большинства солей, электролиты – отличные проводники
электричества.
11.
СПОСОБЫ ПОЛУЧЕНИЯНа самом деле существует много способов получения
неорганических солей. Но самые часто используемые способы это:
1) Из простых веществ: металл + неметалл
2Na+Br2=2NaBr
2) Из оксидов: кислотный оксид + основный/амфотерный
оксид
CaO+N2O3= Ca(NO2)2
Al2O3+SO3=Al2(SO4)3
основный оксид + амфотерный оксид
K2O+Al2O3=2KAlO2
3) Кислота + основание Реакция нейтрализации!
H2SO4+2NaOH=Na2SO4+2H2O
4) Металл (до водорода!) + кислота
Исключения: взаимодействие металлов, стоящих после водорода,
с азотной кислотой (концентрированной, разбавленной) и
серной(концентрированной) Zn+H2SO4(разб.)=ZnSO4+H2
12.
5) Щелочь + кислотаKOH+HCl=KCl+H2O
H3PO4+KOH=KH2PO4+H2O
6) Кислотный оксид + растворимое основание
Ca(OH)2+CO2=CaCO3+H2O
2NaOH+SO3=Na2SO4+H2O
7) Растворимая соль + щелочь
CuCl2+NaOH=Cu(OH)2+2NaCl
8) Металл + соль (образованная катионом менее
металла)
CuSO4+Fe=FeSO4+Cu
9) Основный оксид + кислота
CuO + HCl=CuCl2+H2O
10) Растворимая соль1 + растворимая соль2
выпадением осадка!
KCl+AgNO3=KNO3+AgCl
11) Соль + кислота
Na2CO3+HBr=NaBr+H2O+CO2
активного
С
13.
ХИМИЧЕСКИЕ СВОЙСТВА1) Соль + Щёлочь = Нерастворимое основание + Соль
Реакция обмена возможна в том случае, если в результате
хотя бы один из продуктов является практически
нерастворимым (выпадает осадок).
Ni(NO3)2+2NaOH→Ni(OH)2↓+2NaNO3
2) Соль1 + Кислота1 = Кислота2 + Соль2
Протекает реакция обмена, в ходе которой химически более
активная кислота вытесняет менее активную.
BaCl2+H2SO4→BaSO4↓+2HCl .
3) Соль1 + Соль2 =Соль3 + Соль4
Реакция обмена между солями протекает в растворе (обе
соли должны быть растворимы) только в том случае, если
хотя бы один из продуктов – осадок
AgNO3+NaCl = AgCl↓+ NaNO3
14.
4) Соль (менее активного металла) + Металл (болееактивный) = Металл (менее активный) + Соль
Более активный металл вытесняет менее активный металл из
раствора его соли. При этом образуется новая соль, а менее
активный металл выделяется в свободном виде. Исключения –
щелочные и щелочно-земельные металлы в растворе в первую
очередь взаимодействуют с водой.
Fe + CuCl2 = Cu + FeCl2
5) Соль + Кислотный оксид(нелетучий) → Кислотный
оксид(летучий) + Соль
Нелетучие кислотный оксиды вытесняют при сплавлении
летучие кислотный оксиды из их солей.
SiO2 + CaCO3 → CaSiO3 + CO2↑
6) Соль +Амфотерный оксид →Кислотный
оксид(летучий) + Соль
Амфотерные оксиды вытесняют при сплавлении летучие
кислотные оксиды из их солей.
Al2O3 + K2CO3 →2KAlO2 + CO2↑
15.
7) Соль → Продукты термического разложенияI) СОЛИ АЗОТНОЙ КИСЛОТЫ.
Продукты термического разложения нитратов зависят от положения
металла в ряду напряжений металлов:
а) если металл левее Mg (исключая Li), то
MeNO3 →t° MeNO2 + O2↑
б) если металл от Mg до Cu, а также Li, то
MeNO3 →t° MeO + NO2↑ +O2↑
в) если металл правее Cu, то
MeNO3 →t° Me + NO2↑ + O2↑
II) СОЛИ УГОЛЬНОЙ КИСЛОТЫ.
Почти все карбонаты разлагаются до соответствующего оксида металла и
CO2.
MeCO3 →t° MeO + CO2↑
Карбонаты щелочных металлов, кроме Li, не разлагаются при
нагревании! Карбонаты серебра и ртути разлагаются до свободного
металла.
2Ag2CO3 →t° 4Ag + 2CO2↑ +O2↑
Все гидрокарбонаты разлагаются до соответствующего карбоната.
MeHCO3 →t° MeCO3 + CO2↑ + H2O
16.
III) СОЛИ АММОНИЯ.Многие соли аммония (NH4Cl, NH4Br, NH4I, (NH4)2S,
(NH4)2CO3 и др.) при прокаливании разлагаются с
выделением NH3 и соответствующей кислоты или продуктов
ее разложения. Некоторые соли аммония, содержащие
анионы-окислители, разлагаются с выделением N2, NO или
NO2.
(NH4)2Cr2O7 →(t°) N2↑ + Cr2O3 + 4H2O
NH4Cl →(t°) NH3↑ + HCl↑
NH4NO2 →(t°) N2↑ + H2O
NH4NO3 →(t°) N2O↑ +2H2O
17.
СПАСИБО ЗАВНИМАНИЕ













 Химия
Химия








