Похожие презентации:
Химические превращения веществ
1.
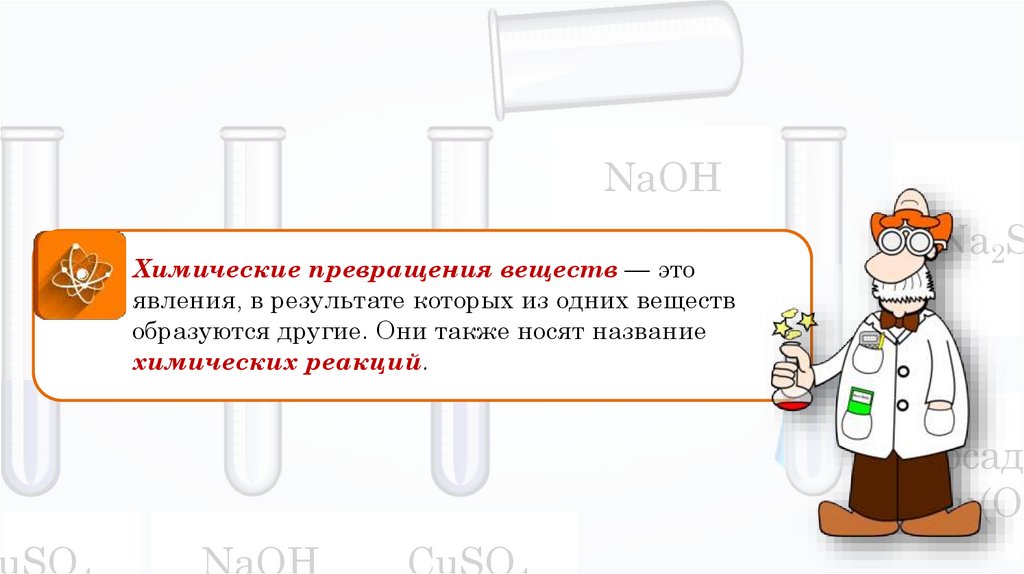
NaOHХимические превращения веществ — это
явления, в результате которых из одних веществ
образуются другие. Они также носят название
химических реакций.
Na2S
осадо
Cu(OH
2.
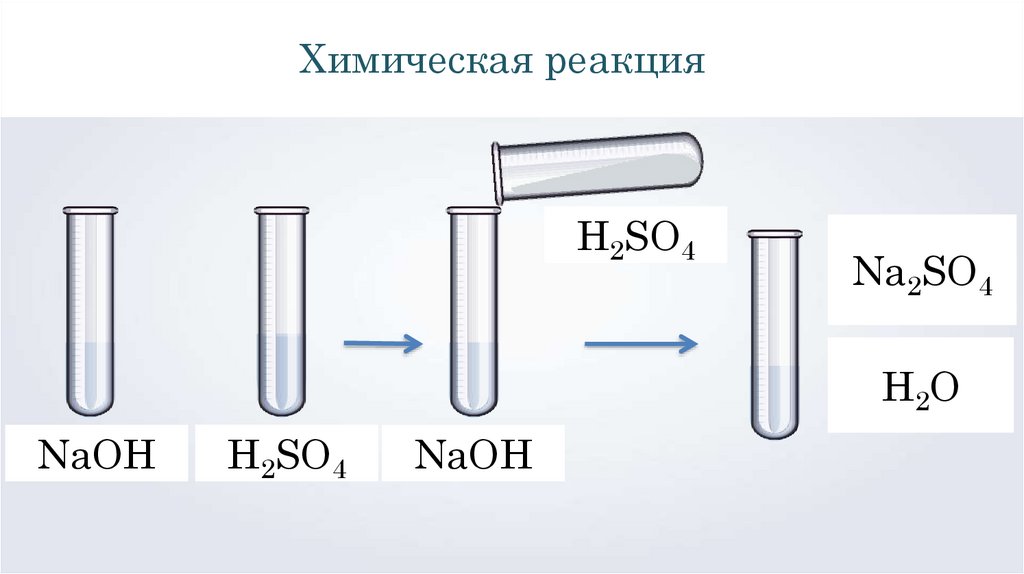
Химическая реакцияH2SO4
Na2SO4
Н2О
NaOH
H2SO4
NaOH
3.
Закон сохранения массы веществМасса веществ, вступивших в
химическую реакцию, равна
массе веществ, получившихся
в результате её.
М.В. Ломоносов
4.
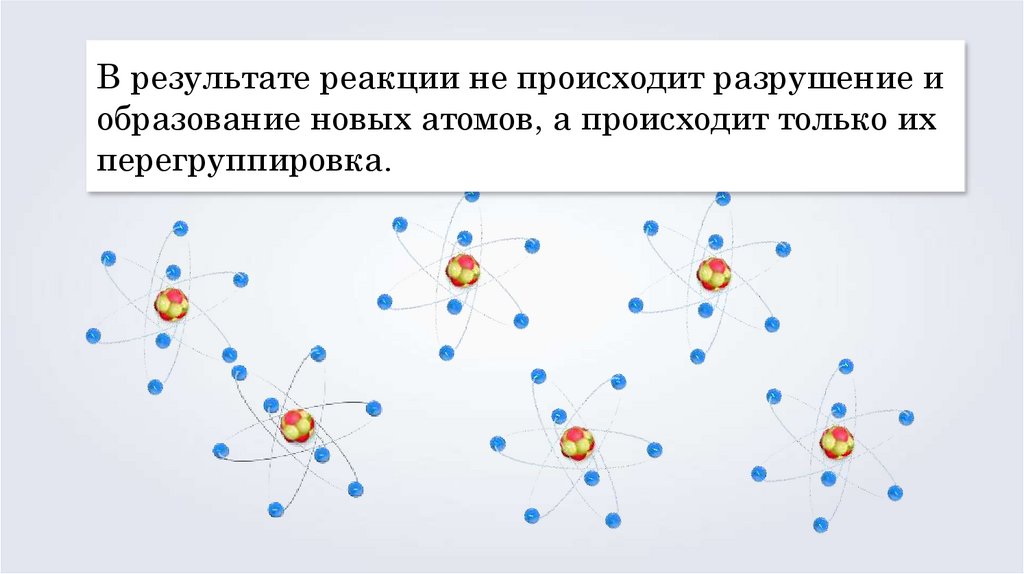
В результате реакции не происходит разрушение иобразование новых атомов, а происходит только их
перегруппировка.
5.
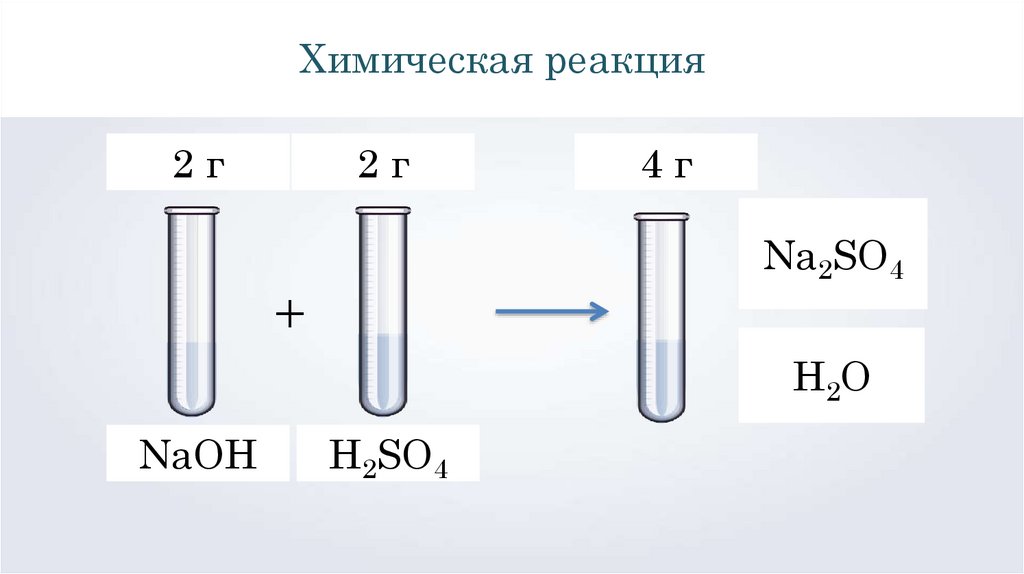
Химическая реакция2г
2г
4г
Na2SO4
+
Н2О
NaOH
H2SO4
6.
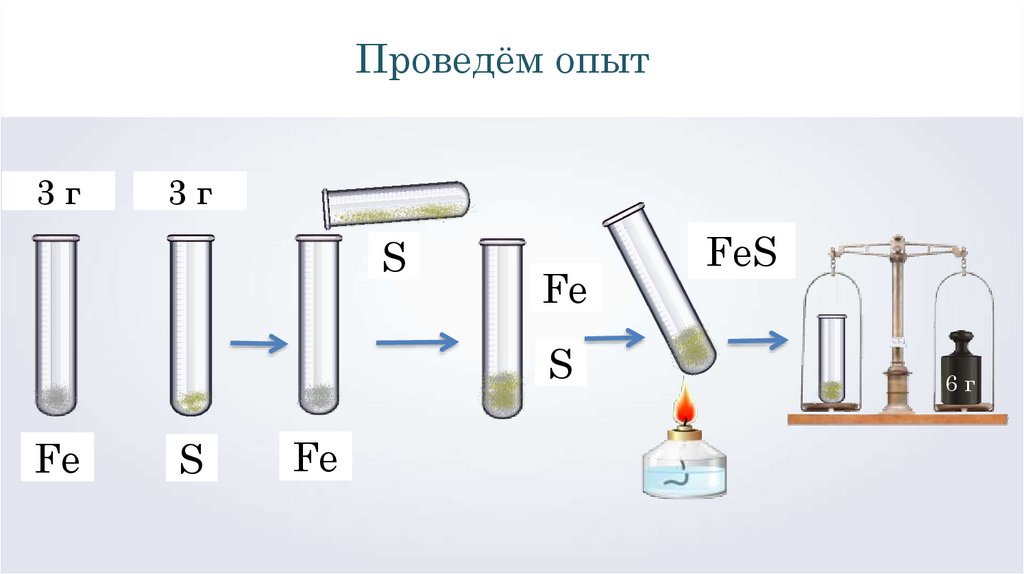
Проведём опыт3г
3г
S
Fe
S
Fe
S
Fe
FeS
6г
7.
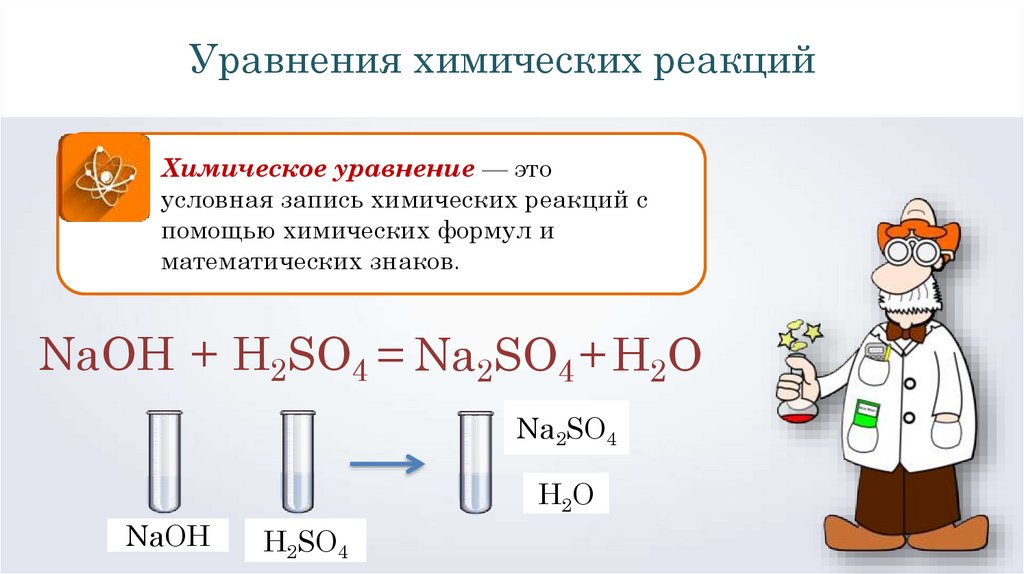
Уравнения химических реакцийХимическое уравнение — это
условная запись химических реакций с
помощью химических формул и
математических знаков.
NaOH + H2SO4 = Na2SO4 + H2O
Na2SO4
Н2О
NaOH
H2SO4
8.
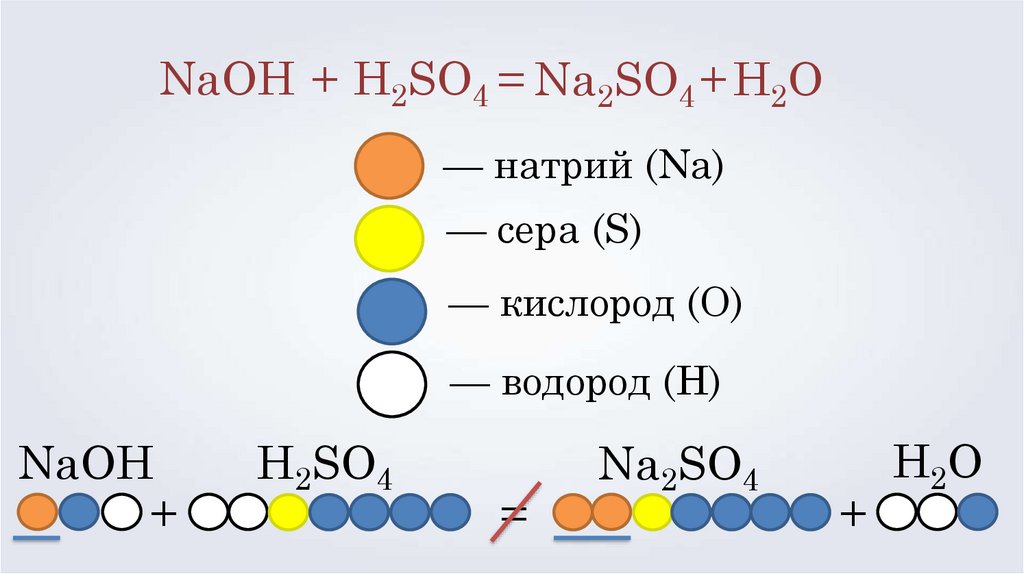
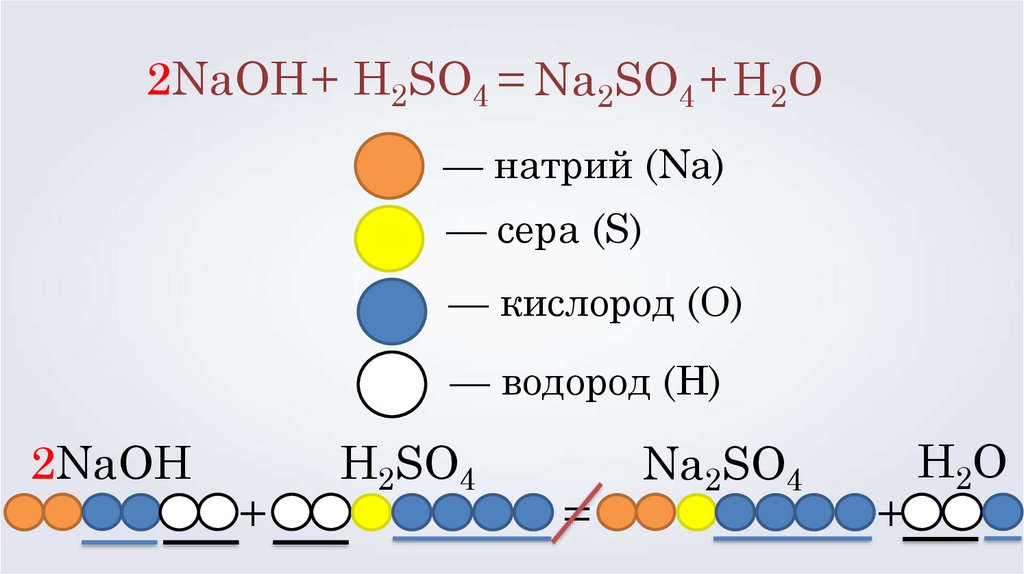
NaOH + H2SO4 = Na2SO4 + H2O— натрий (Na)
— сера (S)
— кислород (O)
— водород (H)
NaOH
+
H2SO4
=
Na2SO4
+
H2O
9.
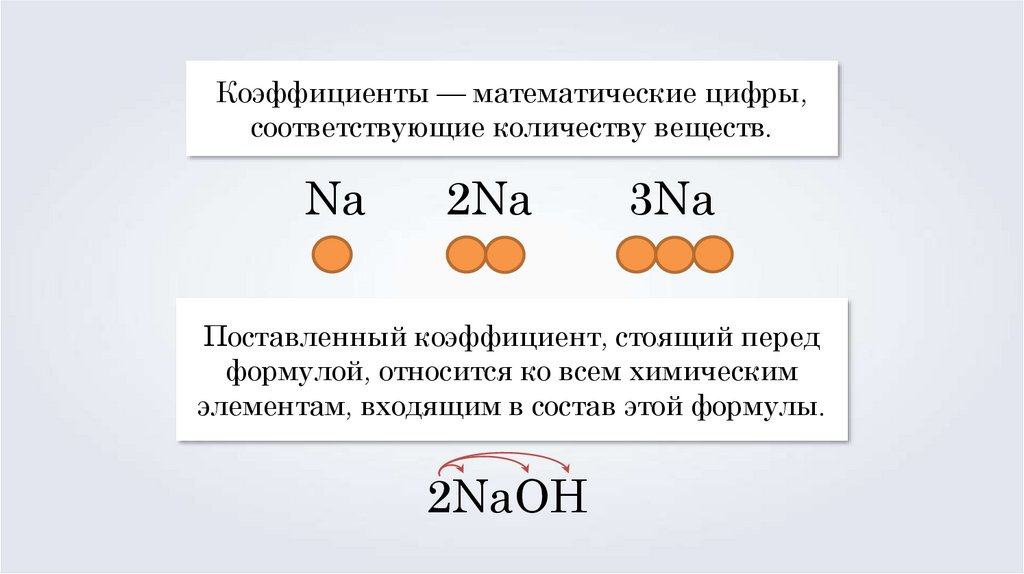
Коэффициенты — математические цифры,соответствующие количеству веществ.
Na
2Na
3Na
Поставленный коэффициент, стоящий перед
формулой, относится ко всем химическим
элементам, входящим в состав этой формулы.
2NaOH
10.
2NaOH + H2SO4 = Na2SO4 + H2O— натрий (Na)
— сера (S)
— кислород (O)
— водород (H)
2NaOH
+
H2SO4
=
Na2SO4
+
H2O
11.
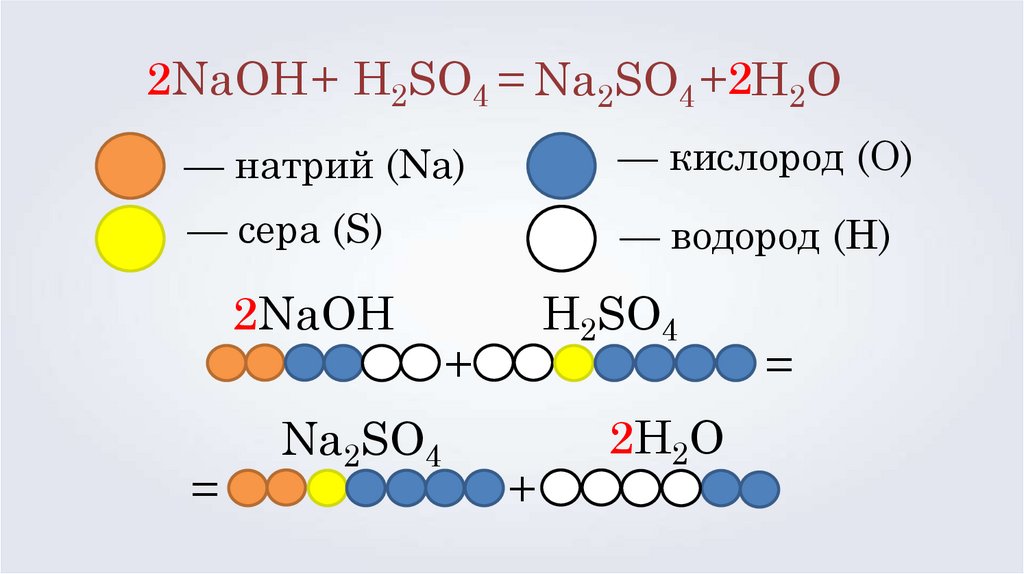
2NaOH + H2SO4 = Na2SO4 +2H2O— натрий (Na)
— кислород (O)
— сера (S)
— водород (H)
2NaOH
=
Na2SO4
H2SO4
+
+
2H2O
=
12.
С помощью коэффициентов мы уравниваем левуючасть записи и правую, ставим между левой и
правой частью знак равенства, то есть, приводим в
соответствие с законом сохранения массы
веществ.
2NaOH + H2SO4 = Na2SO4 +2H2O
Химическое уравнение
13.
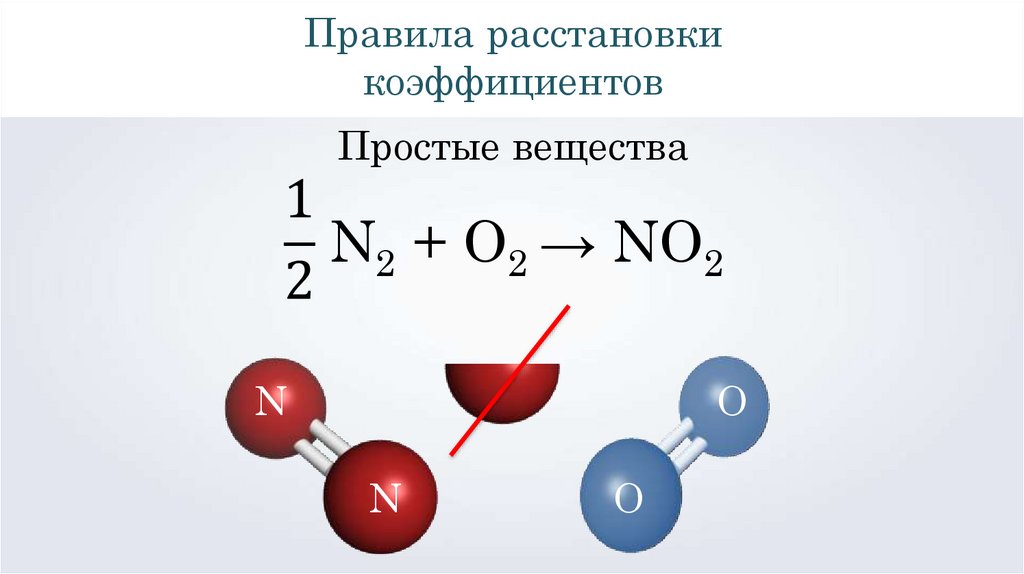
Правила расстановкикоэффициентов
Простые вещества
N2 + O2 → NO2
N
O
N
O
14.
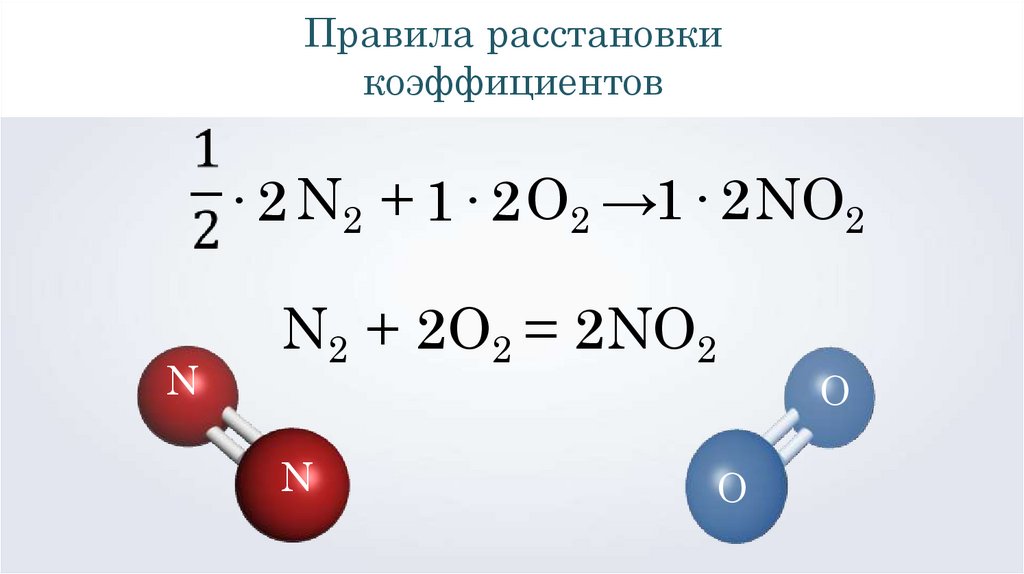
Правила расстановкикоэффициентов
· 2 N2 + 1· 2 O2 →1· 2 NO2
N
N2 + 2O2 = 2NO2
N
O
O
15.
Правила расстановкикоэффициентов
Сложные вещества
H3PO4
Na2CO3
H3PO4 + Na2CO3 → Na3PO4 + CO2↑ + H2O
16.
Алгоритм уравнивания1. Рассматриваем, входит ли в схему реакции соль.
Уравниваем уравниваем
кислород. атомы водорода.
2. С помощью коэффициентов
Именно с неё начинается уравнивание реакции.
+
2-
H3PO4 + Na2CO3 → Na3PO4 + CO2↑ + H2O
H3PO4 + 3Na2CO3 → 2Na3PO4 + CO2↑ + H2O
2H3PO4 + 3Na2CO3 → 2Na3PO4 + CO2↑ + 3H2O
2H3PO4 + 3Na2CO3 = 2Na3PO4 + 3CO2↑ + 3H2O
17.
Алгоритм уравнивания3+ иначинается
3.
Уравниваем
Если
в
реакцию
количество
вступают
ионов
две
соли,
алюминия
уравнивание
Al
сульфат
Уравниваем ионы калия калий2- К и нитрат-ионы
NO3-.
с соли, содержащей наибольшее
ионов SO4 число
.
ионов.
3+
2-
K2SO4 + Al(NO3)3 → Al2(SO4)3 + KNO3
3K2SO4 + 2Al(NO3)3 → Al2(SO4)3 + KNO3
3K2SO4 + 2Al(NO3)3 → Al2(SO4)3 + 6KNO3
3K2SO4 + 2Al(NO3)3 = Al2(SO4)3 + 6KNO3
18.
2H3PO4 + 3Na2CO3 = 2Na3PO4 + 3CO2↑ + 3H2OПостроение химических
уравнений идёт с учетом
химических формул веществ
и с соблюдением закона
сохранения массы веществ.
6г






 Химия
Химия








