Похожие презентации:
Ковалентная химическая связь. 11 класс
1.
15.11.202011 класс
базовый уровень
1
2.
15.11.2020Что
такое химическая связь?
Каковы
причины образования
химической связи?
Какую
связь называют ионной?
Каким
образом атомы
завершают внешний уровень
при образовании И.Х.С.?
2
3.
15.11.2020что
является движущей силой
образования химических
связей?
oдин
из таких путей –
обобществление электронов
К.Х.С.
- связь при помощи
общих электронных пар.
3
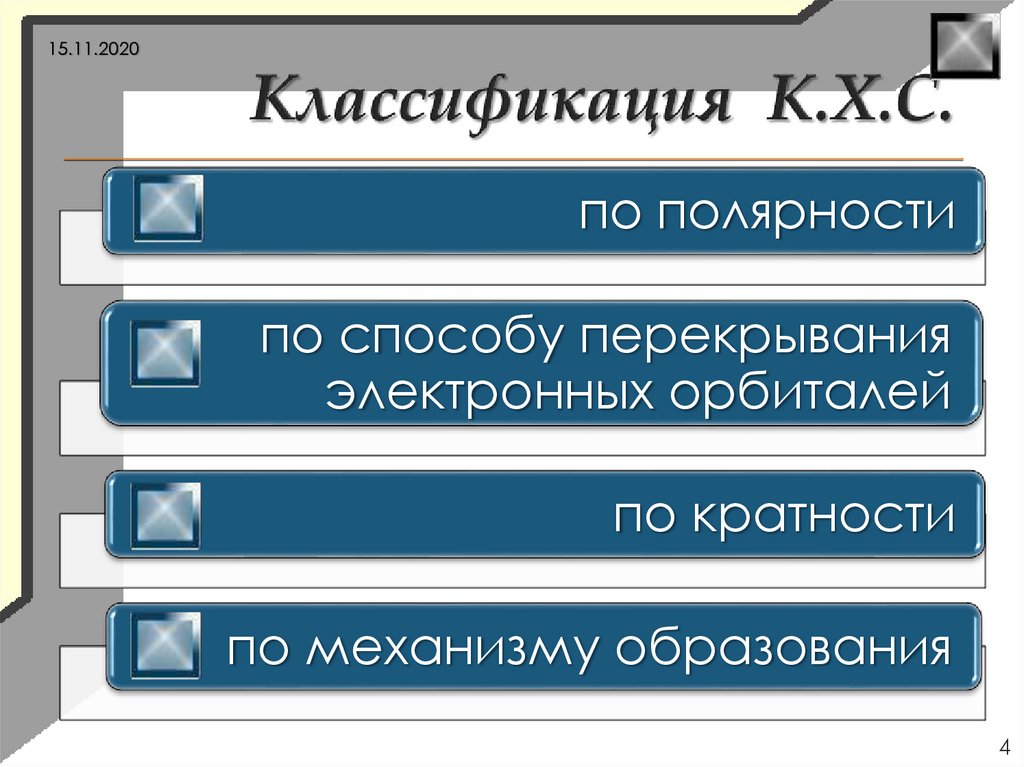
4.
15.11.2020по полярности
по способу перекрывания
электронных орбиталей
по кратности
по механизму образования
4
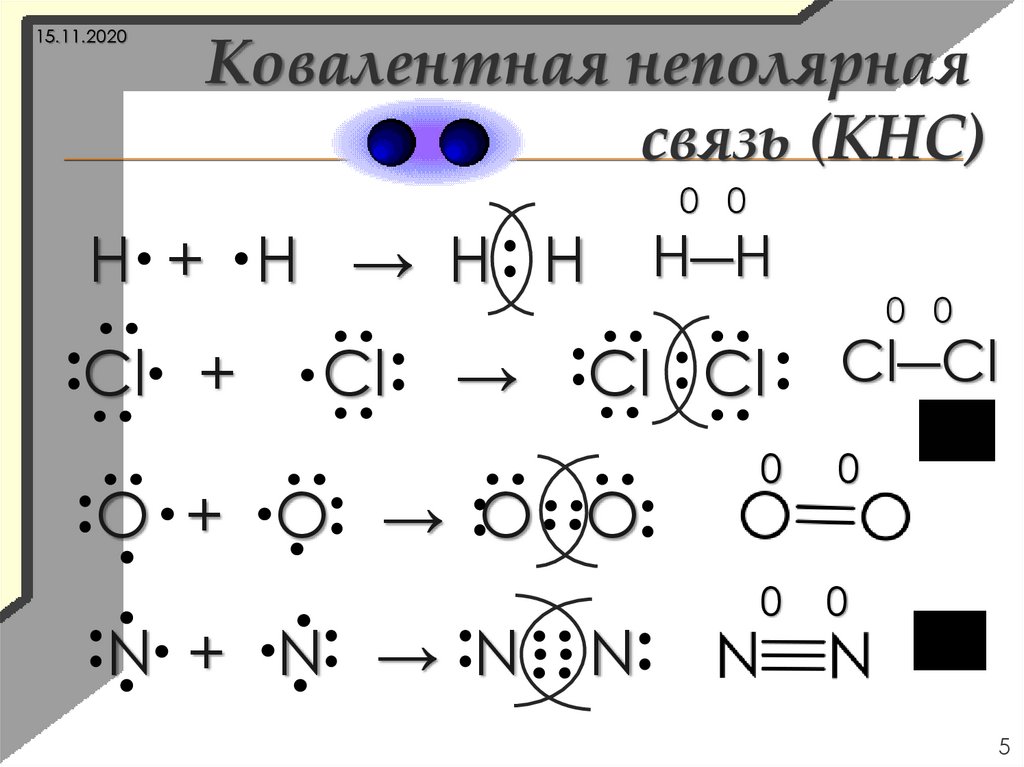
5.
15.11.2020Ковалентная неполярная
связь (КНС)
0 0
Н + Н → H H
Cl +
Cl
→
Н―Н
Cl Cl
O + O → O O
N + N → N
N
0 0
Cl―Cl
0
0
0
0
5
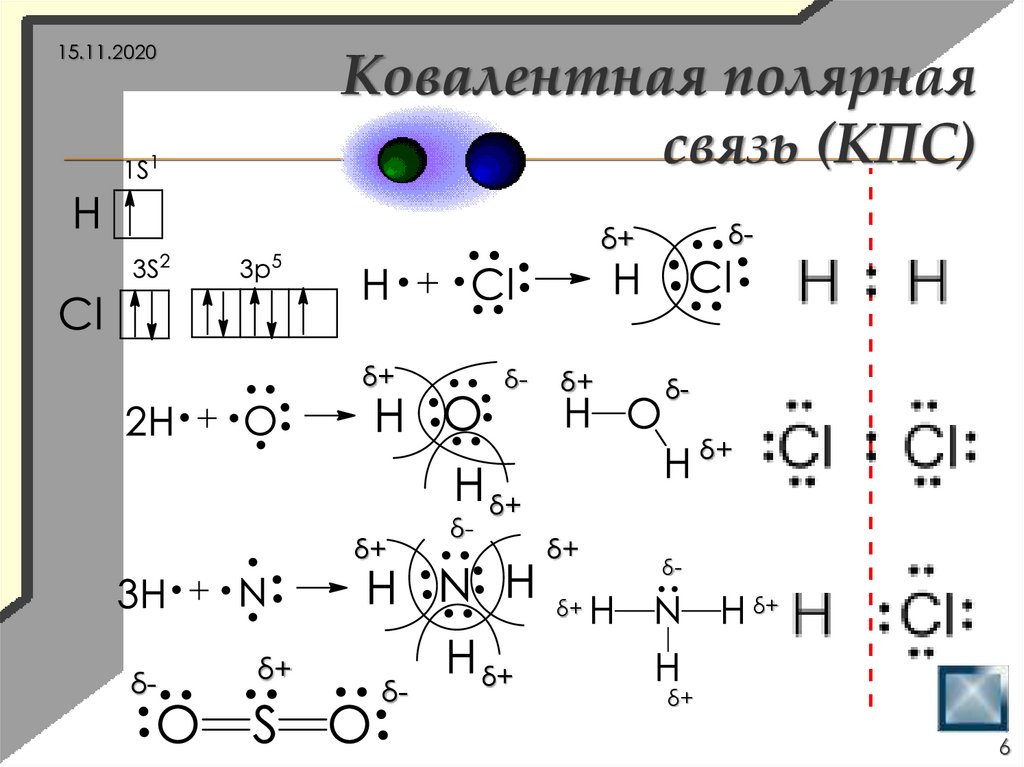
6.
15.11.2020Ковалентная полярная
связь (КПС)
δ-
δ+
δ+
δ-
δ+
δ-
δ+
δ+
δ-
δ+
δ+
δ-
δ+
δ+
δ-
δ+
δ-
δ+
δ+
6
7.
15.11.2020К.Х.С. по способу
перекрывания электронных
облаков
что такое орбиталь?
какие
орбитали известны в
настоящее время, какова их
форма?
пара
электронов, связывающих
два атома, находится в области
перекрывания их атомных
орбиталей.
7
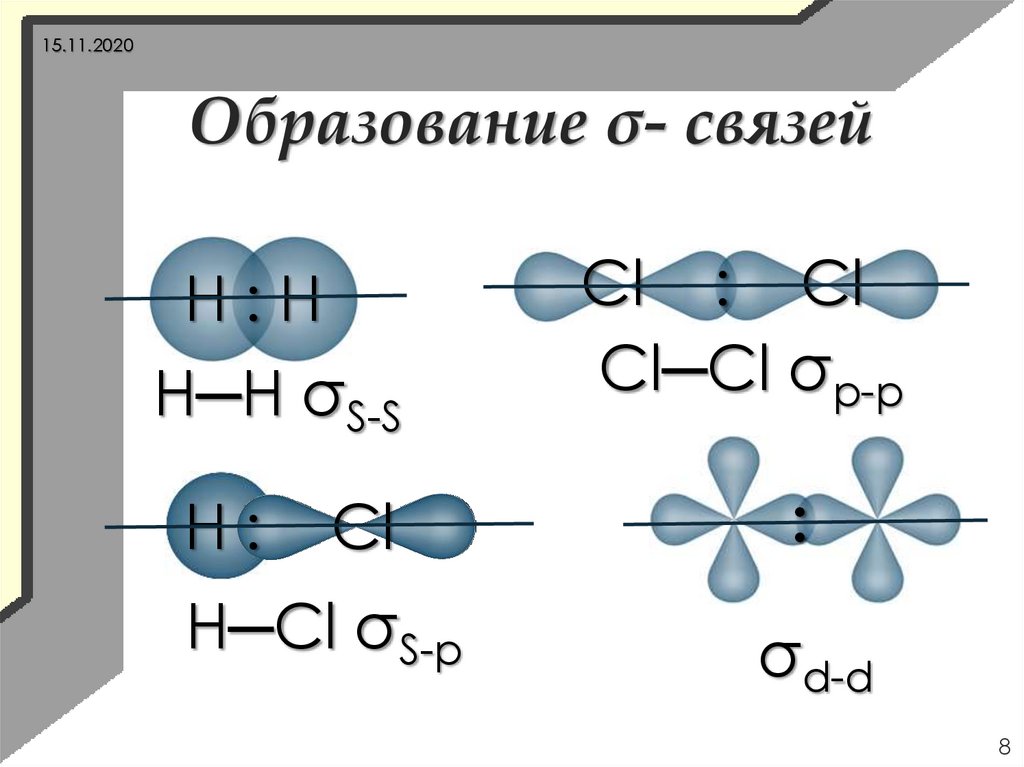
8.
15.11.2020Образование σ- связей
Н:Н
Н─Н σS-S
Н:
Cl
Н─Cl σS-p
Cl : Cl
Cl─Cl σp-p
:
σd-d
8
9.
15.11.2020πp-p
πd-d
9
10.
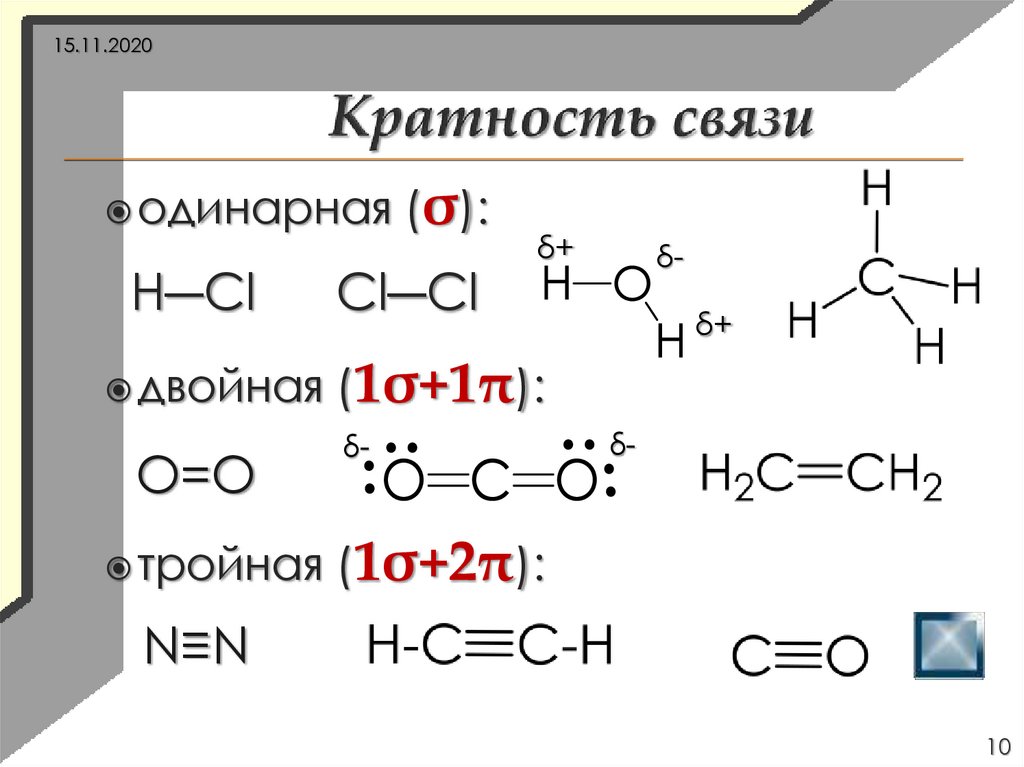
15.11.2020одинарная
H―Cl
двойная
O=O
тройная
(σ):
Cl―Cl
δ+
δ-
δ+
(1σ+1π):
δ-
δ-
(1σ+2π):
N≡N
10
11.
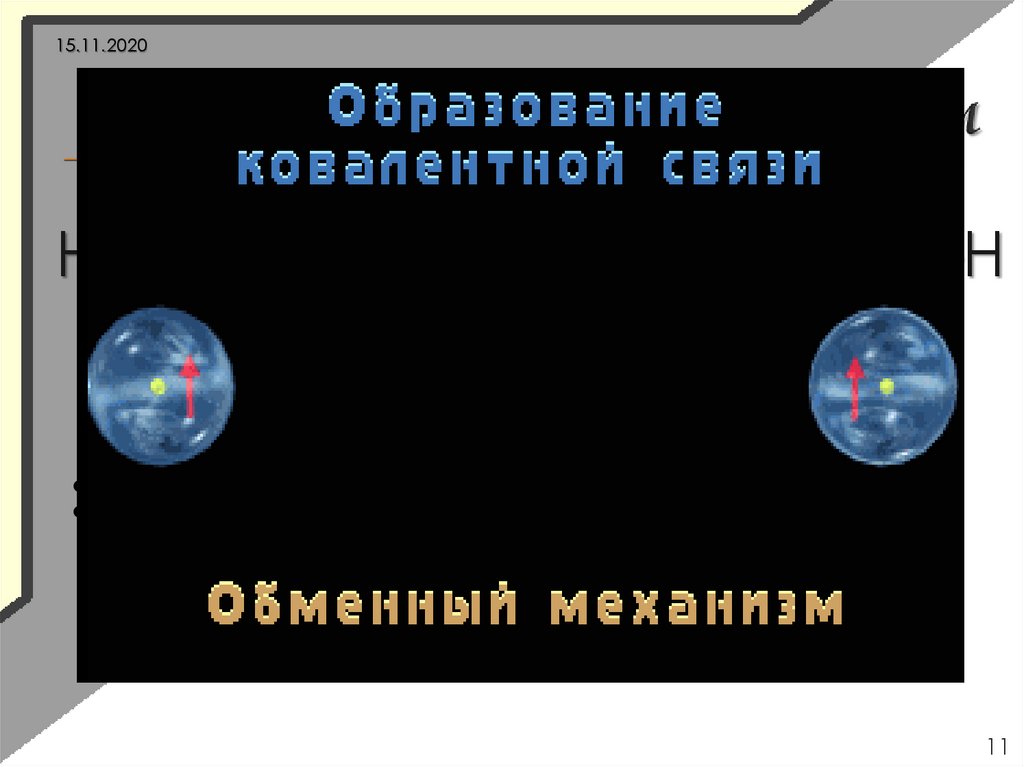
15.11.2020Н
+
Н→Н
3S2
3p5
Cl +
Cl
Cl
→
Н Н Н Н―Н
Cl Cl
11
12.
15.11.2020донор
акцептор
12
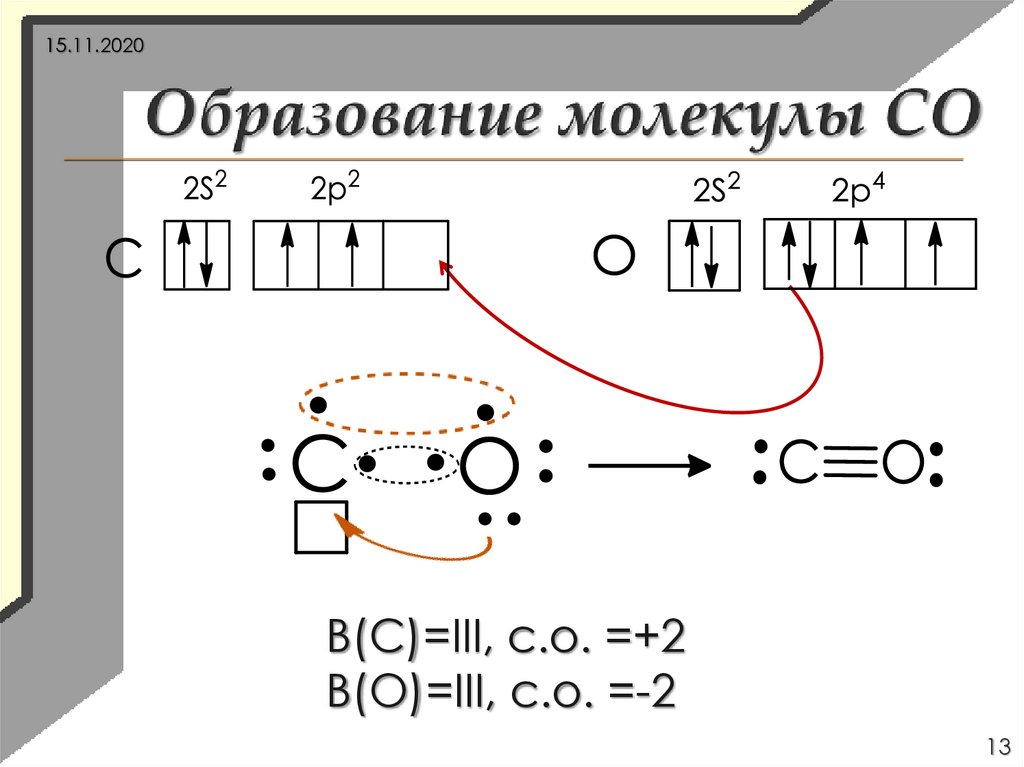
13.
15.11.2020В(С)=III, с.о. =+2
В(О)=III, с.о. =-2
13
14.
15.11.2020К.Х.С. может быть:
неполярной и полярной;
по
способу перекрывания
орбиталей связь σ или π;
по
кратности может быть
(–), (=), (Ξ);
по
механизму
образования – обменной
и донорно-акцепторной.
14
15.
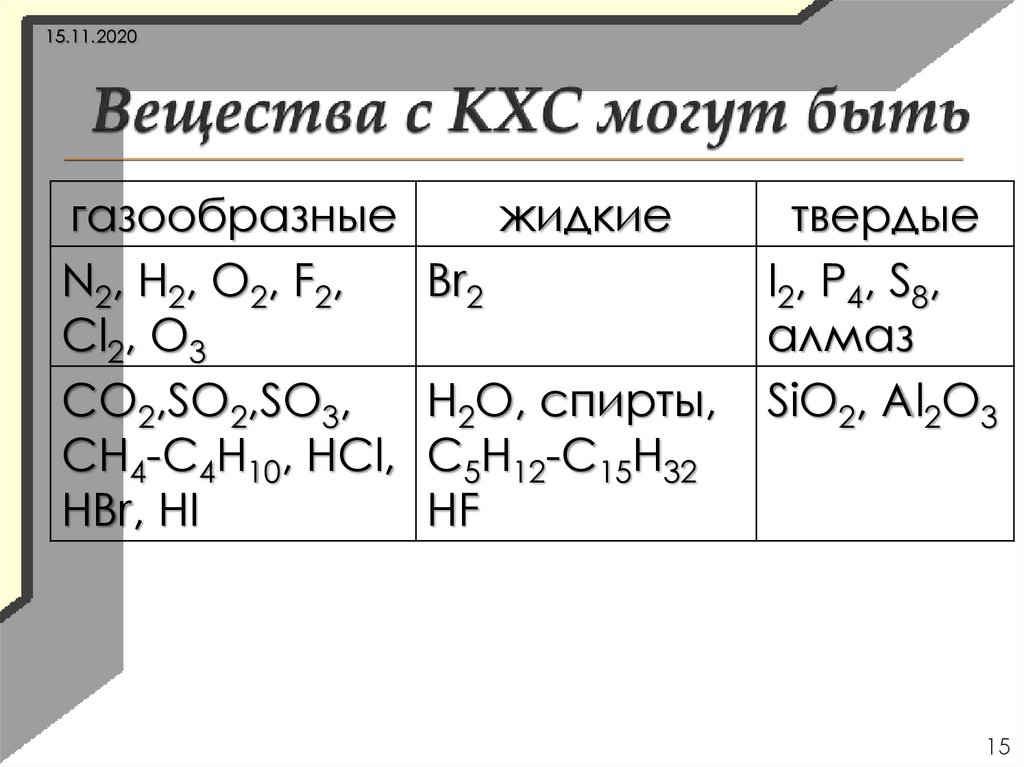
15.11.2020газообразные
N2, H2, O2, F2,
Cl2, O3
CO2,SO2,SO3,
CH4-C4H10, HCl,
HBr, HI
жидкие
Br2
H2O, спирты,
C5H12-C15H32
HF
твердые
I2, P4, S8,
алмаз
SiO2, Al2O3
15
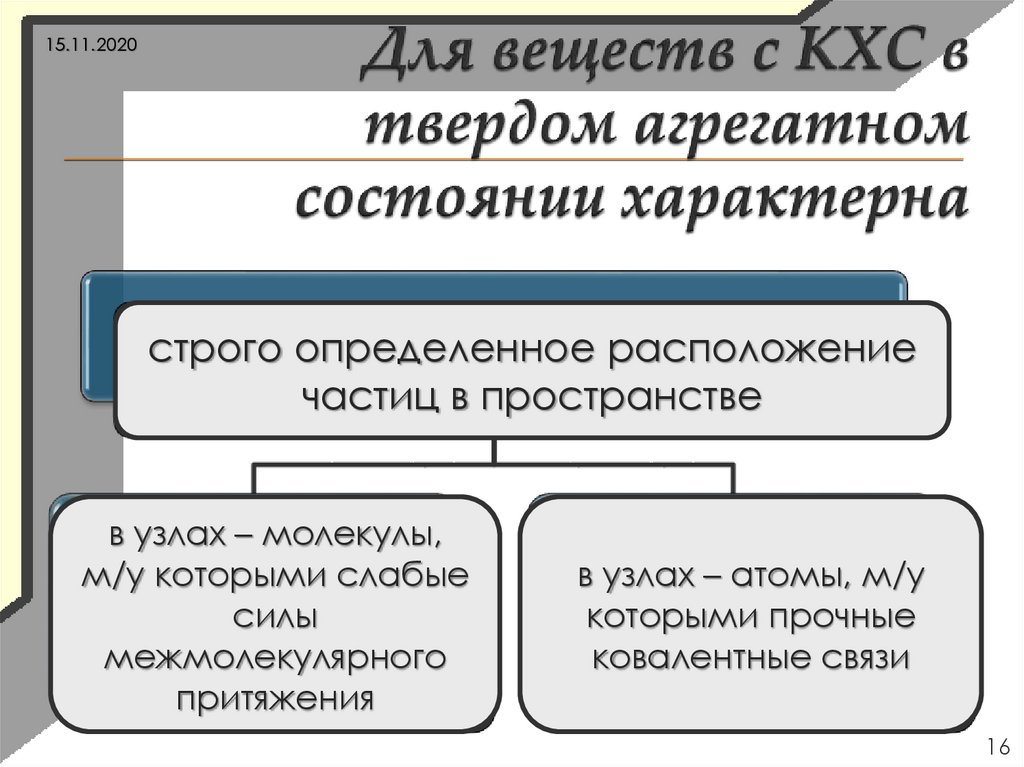
16.
15.11.2020строго определенное расположение
кристаллическая
решетка
частиц в пространстве
в узлах – молекулы,
м/у которыми слабые
силы
молекулярная
межмолекулярного
притяжения
в узлах – атомы, м/у
которыми прочные
атомная
ковалентные связи
16
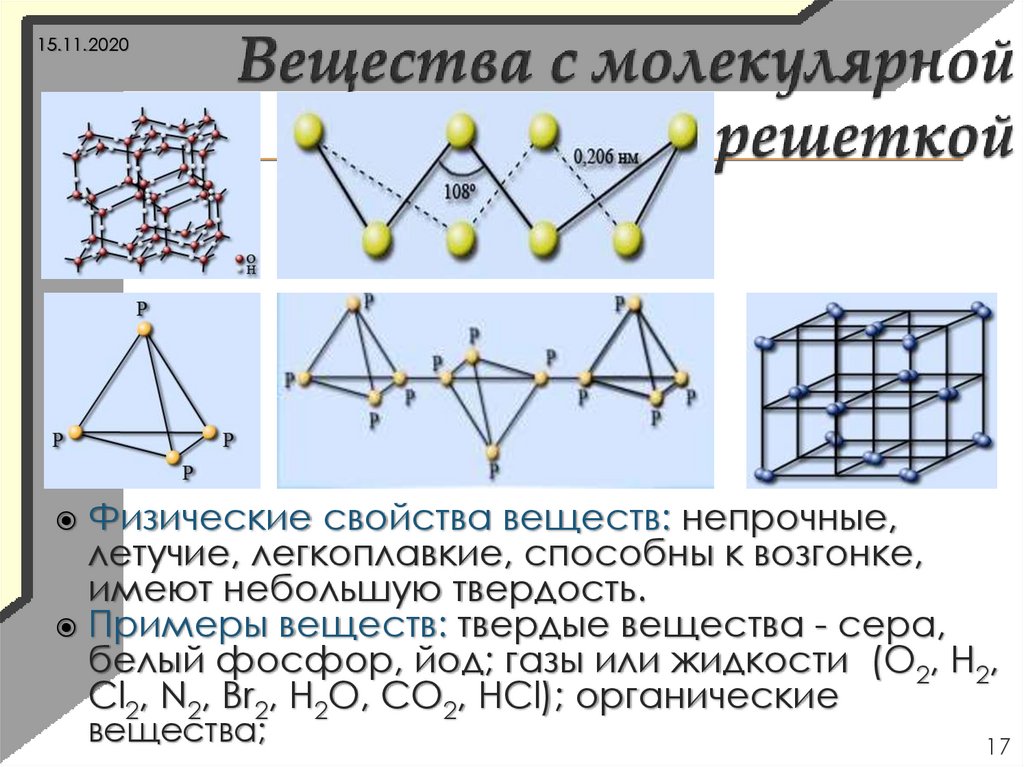
17.
15.11.2020Физические свойства веществ: непрочные,
летучие, легкоплавкие, способны к возгонке,
имеют небольшую твердость.
Примеры веществ: твердые вещества - сера,
белый фосфор, йод; газы или жидкости (О2, Н2,
Cl2, N2, Br2, H2O, CO2, HCl); органические
вещества;
17
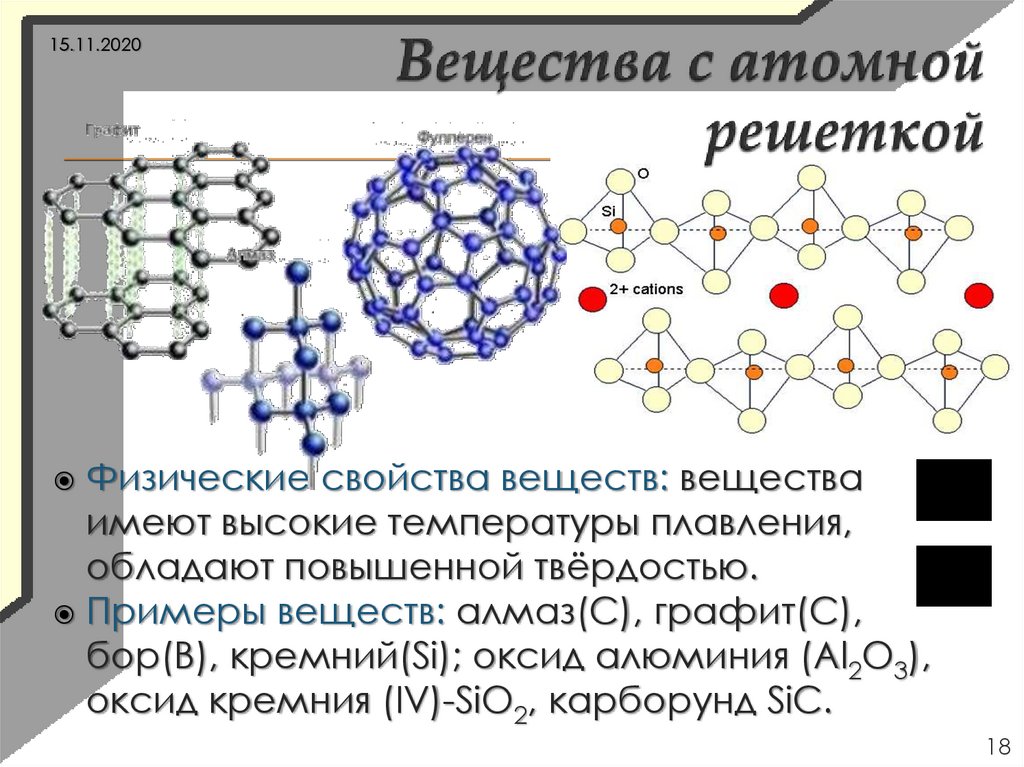
18.
15.11.2020Физические свойства веществ: вещества
имеют высокие температуры плавления,
обладают повышенной твёрдостью.
Примеры веществ: алмаз(C), графит(C),
бор(B), кремний(Si); оксид алюминия (Al2O3),
оксид кремния (IV)-SiO2, карборунд SiC.
18
19.
15.11.2020§4
упр.1-13 стр 37
ТПО (КХС)
выписать типы
кристаллических
решеток, характерных
для веществ с КХС и их
физические свойства.
19








 Химия
Химия








