Похожие презентации:
Галогены
1.
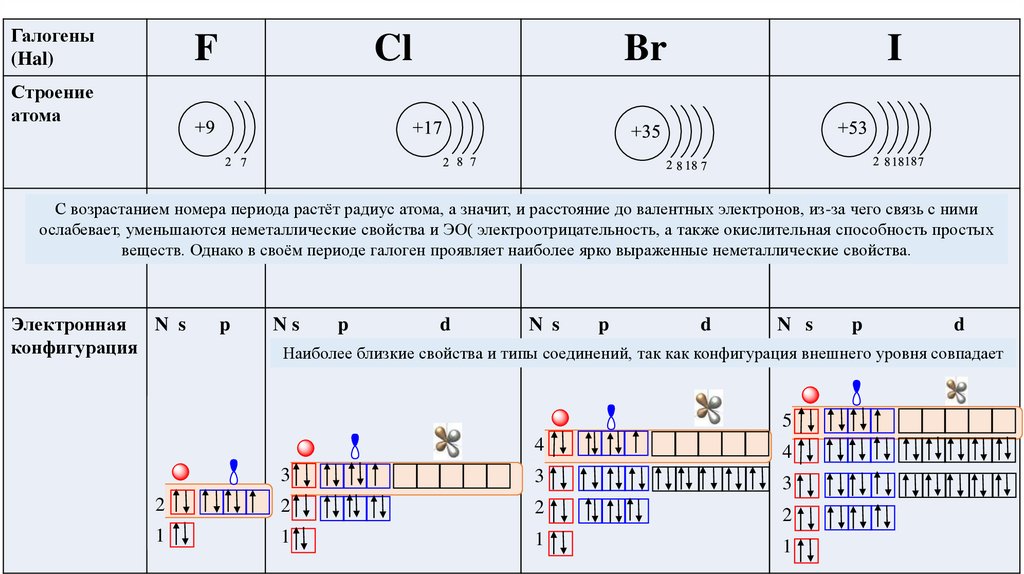
Галогены(Hal)
F
Cl
Br
I
Строение
атома
С возрастанием номера периода растёт радиус атома, а значит, и расстояние до валентных электронов, из-за чего связь с ними
ослабевает, уменьшаются неметаллические свойства и ЭО( электроотрицательность, а также окислительная способность простых
веществ. Однако в своём периоде галоген проявляет наиболее ярко выраженные неметаллические свойства.
Электронная N s
конфигурация
p
Ns
p
d
N s
p
d
N s
p
d
Наиболее близкие свойства и типы соединений, так как конфигурация внешнего уровня совпадает
5
4
4
3
3
3
2
2
2
2
1
1
1
1
2.
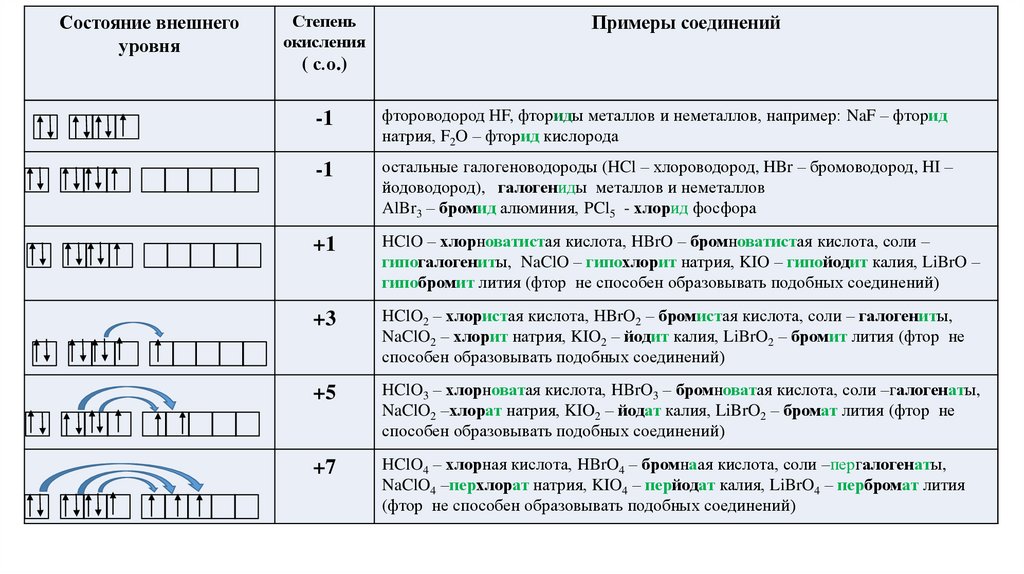
Состояние внешнегоуровня
Степень
окисления
Примеры соединений
( с.о.)
-1
фтороводород HF, фториды металлов и неметаллов, например: NaF – фторид
натрия, F2O – фторид кислорода
-1
остальные галогеноводороды (HCl – хлороводород, HBr – бромоводород, HI –
йодоводород), галогениды металлов и неметаллов
AlBr3 – бромид алюминия, PCl5 - хлорид фосфора
+1
HClO – хлорноватистая кислота, HBrO – бромноватистая кислота, соли –
гипогалогениты, NaClO – гипохлорит натрия, KIO – гипойодит калия, LiBrO –
гипобромит лития (фтор не способен образовывать подобных соединений)
+3
HClO2 – хлористая кислота, HBrO2 – бромистая кислота, соли – галогениты,
NaClO2 – хлорит натрия, KIO2 – йодит калия, LiBrO2 – бромит лития (фтор не
способен образовывать подобных соединений)
+5
HClO3 – хлорноватая кислота, HBrO3 – бромноватая кислота, соли –галогенаты,
NaClO2 –хлорат натрия, KIO2 – йодат калия, LiBrO2 – бромат лития (фтор не
способен образовывать подобных соединений)
+7
HClO4 – хлорная кислота, HBrO4 – бромнаая кислота, соли –пергалогенаты,
NaClO4 –перхлорат натрия, KIO4 – перйодат калия, LiBrO4 – пербромат лития
(фтор не способен образовывать подобных соединений)
3.
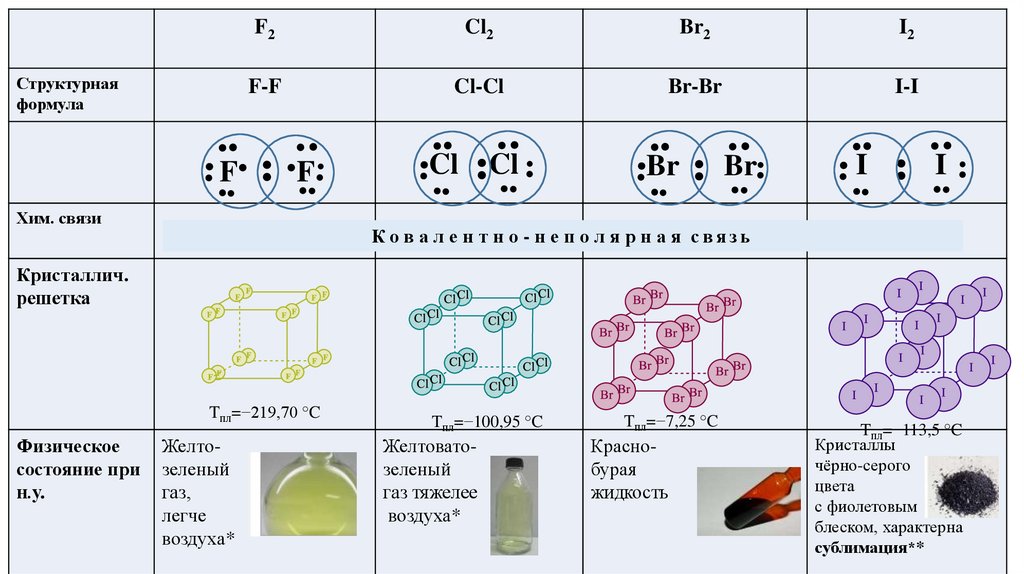
Структурнаяформула
F
F2
Cl2
Br2
I2
F-F
Cl-Cl
Br-Br
I-I
F
Хим. связи
Cl
Cl
Br
Br
I
I
К о в а л е н т н о - н е п о л я р н а я связь
Кристаллич.
решетка
Tпл=−219,70 °C
Физическое
состояние при
н.у.
Желтозеленый
газ,
легче
воздуха*
Tпл=−100,95 °C
Желтоватозеленый
газ тяжелее
воздуха*
Tпл=−7,25 °C
Краснобурая
жидкость
Tпл=−113,5 °C
Кристаллы
чёрно-серого
цвета
с фиолетовым
блеском, характерна
сублимация**
4.
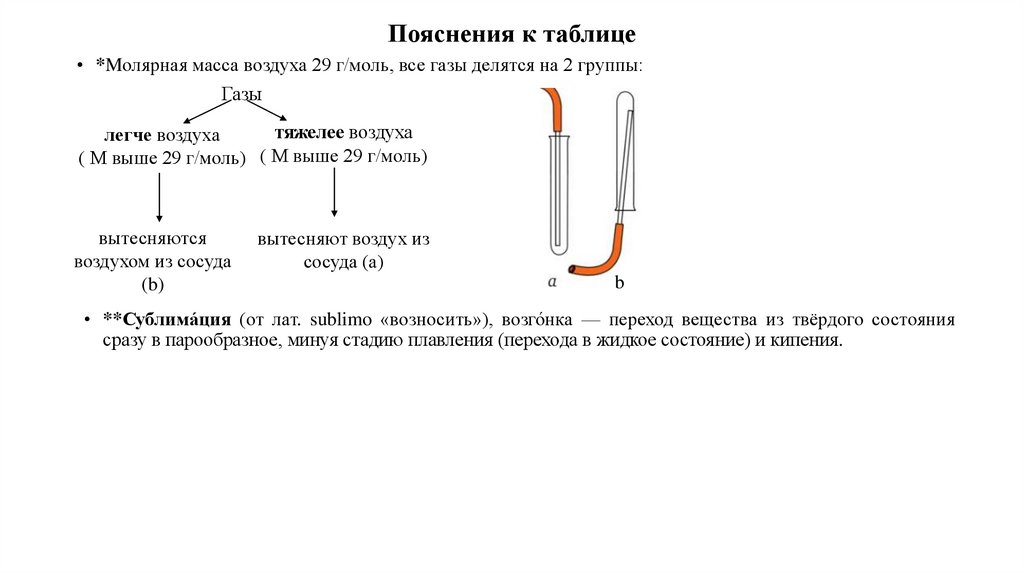
Пояснения к таблице• *Mолярная масса воздуха 29 г/моль, все газы делятся на 2 группы:
Газы
тяжелее воздуха
легче воздуха
( М выше 29 г/моль) ( М выше 29 г/моль)
вытесняются
воздухом из сосуда
(b)
вытесняют воздух из
сосуда (а)
b
• **Сублима́ция (от лат. sublimo «возносить»), возго́нка — переход вещества из твёрдого состояния
сразу в парообразное, минуя стадию плавления (перехода в жидкое состояние) и кипения.
5.
Нахождение в природе и способы получения:• В природе встречаются в виде различных минералов, основным компонентом которых являются
галогениды металлов.
• Фтор встречается в природе в виде фторидов, например, флюорита CaF2.
• Хлор встречается в природе, в основном, в виде хлоридов. Например, известны мощные
залежи галита (NaCl, поваренная соль), образовавшиеся при испарении соленых морей и озер.
• Бром, содержащийся в морской воде и буровых водах в виде бромидов.
• Аналогичным образом из буровых вод и золы, образующейся при сгорании морских водорослей,
выделяют иод.
Получение в лаборатории (основано на окислении галогенидов)
1) электролиз галогенидов
2) взаимодействие галогенидов с сильными окислителями
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
2HBr + Cl2 → Br2 + 2HCl
2KI + Cl2 → I2 + 2KCl
6.
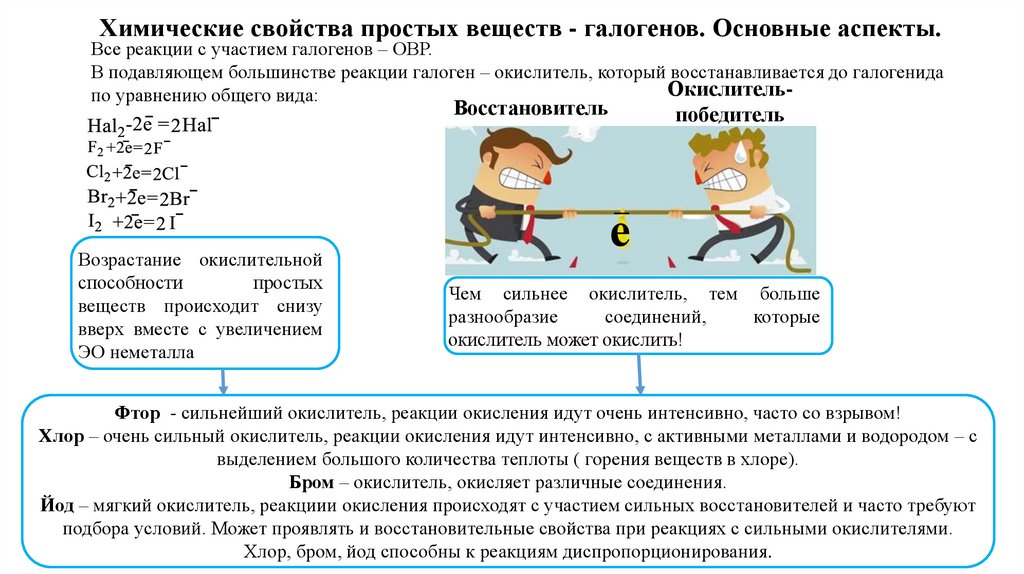
Химические свойства простых веществ - галогенов. Основные аспекты.Все реакции с участием галогенов – ОВР.
В подавляющем большинстве реакции галоген – окислитель, который восстанавливается до галогенида
Окислительпо уравнению общего вида:
Восстановитель
Возрастание окислительной
способности
простых
веществ происходит снизу
вверх вместе с увеличением
ЭО неметалла
победитель
Чем сильнее окислитель, тем больше
разнообразие
соединений,
которые
окислитель может окислить!
Фтор - сильнейший окислитель, реакции окисления идут очень интенсивно, часто со взрывом!
Хлор – очень сильный окислитель, реакции окисления идут интенсивно, с активными металлами и водородом – с
выделением большого количества теплоты ( горения веществ в хлоре).
Бром – окислитель, окисляет различные соединения.
Йод – мягкий окислитель, реакциии окисления происходят с участием сильных восстановителей и часто требуют
подбора условий. Может проявлять и восстановительные свойства при реакциях с сильными окислителями.
Хлор, бром, йод способны к реакциям диспропорционирования.
7.
Химические свойства.Реакция с металлами
• Фтор и хлор реагирует со всеми металлами без исключения, многие из них в атмосфере этих
галогенов самовоспламеняются, выделяя большое количество теплоты.
• Бром и йод реагирует с большинством активных металлов менее интенсивно, чем хлор и фтор.
F2+2Na=2NaF
F2 + Mg =MgF2
3F2 + 2Al =2AlF3
3F2 + 2Fe =2FeF3
Cl2+2Na=2NaCl
Cl2 + Mg =MgCl2
3Cl2 + 2Al =2AlCl3
3Cl2 + 2Fe =2FeCl3
Br2+2Na=2NaBr
Br2 + Mg =MgBr2
3Br2 + 2Al =2AlBr3
3Br2 + 2Fe =2FeBr3
I2+2Na=2NaI
I2 + Mg =MgI2
HO
3I2 + 2Al =2AlI3
I2 + Fe =FeI2
(йод не может
окислить
железо до
более высокой
степени
окисления)
2
8.
Химические свойства.Реакция с неметаллами
С водородом:
Hal2+H2=2HHal
F2+H2=2HF (со взрывом);
Cl2+H2=2HCl (при освещении со взрывом);
Br2+H2=2HBr ( при нагревании выше 200 С);
I2+H2 2HI (эндотермическая, обратимая реакция);
С углеродом (кроме I2):
2Hal2+С=СHal4
С кремнием (кроме I2) :
2Hal2+Si=SiHal4
С фосфором:
5F2 + 2P =2PF5
5Cl2 + 2P =2PCl5
(в избытке хлора)
С сурьмой
5F2 + 2Sb =2SbF5
5Cl2 + 2Sb =2SbCl5
( в избытке хлора)
С серой:
3F2 + S =SF6
3Cl2 + S =SСl6
( в избытке хлора)
С кислородом (только F2):
2F2+O2=2F2O
9.
Химические свойства.Реакция с водой
• Фтор (окисление O-2 в составе воды).
Аналогично хлор в жестких условиях.
2F2+ 2Н2О =4 HF+O2
2Cl2 + 2H2O = 4HCl + O2 (на свету или кип.)
• Хлор и бром диспропорционируют в водном
растворе.
Cl2+ H2O HClO+ HCl (хлорная вода)
Br2+ H2O
HBrO+ HBr (бромная вода)
Реакция обратима, поэтому водные растворы хлора и
брома содержат как сам галоген, так и образованные в
результате диспропорционирования кислоты. Если
галоген вступает в реакцию, то химическое равновесие
смещается в стороны его образования, поэтому формулу
бромной воды можно записать просто как Br2, а хлорной
Cl2.
однако наличие этой реакции объясняет их
растворимость в воде
• Йод не диспропорционируют в водном растворе!
Нельзя приготовить йодную воду!
Хлорная
вода
Бромная
вода
10.
Химические свойства.Реакция с бескислородными кислотами и их солями.
• Общее правило: галоген, являющийся более сильным окислителем, вытесняет галоген,
являеющийся более слабым окислителем ( и серу) из раствора его соли.
• Примеры
F2+HCl=2HCl+ Cl2
F2+AlCl3=2HF+ Cl2
F2+HBr=2HF+ Br2
F2+MgBr2=2HF+ Br2
F2+HI=2HF+ I2
F2+NaI=2NaCl+ I2
F2+ H2S=S+2HF
Cl2+HBr=2HCl+ Br2
Cl2+MgBr2=2HCl+ Br2
Cl2+HI=2HCl+ I2
Cl2+NaI=2NaCl+ I2
Cl2+ H2S=S+2HCl
Br2+HI=2HBr+ I2
Br2+NaI=2NaBr+ I2
Br2+ H2S=S+2HBr
I2+ H2S=S+2HI
11.
Химические свойства.Реакция с щелочамии (LiOH, NaOH, KOH, Ba(OH)2)
• Диспропорционирование в щелочном растворе происходит более интенсивно, возможно
даже для йода и в зависимости от температуры приводит к получению разных продуктов.
Cl2+ NaOH = NaClO+ NaCl+H2O
3Cl2+ 6NaOH = NaClO3+ 5NaCl+3H2O
Br2+ NaOH= NaBrO+ NaBr+H2O
3Br2+ 6NaOH = NaBrO3+ 5NaBr+3H2O
I2+ NaOH=NaIO+ NaI+H2O
3I2+6NaOH = NaIO3+ 5NaI+3H2O
• Хлор реагирует с гидроксидом кальция, твердую смесь
продуктов их реакции, в которой может снова
образовываться хлор в небольших количествах,
называют, белильной (хлорной) известью, в просторечии –
хлоркой.
2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 + 2H2O
Жидкий бром легко растворяется в растворе
щелочи; при этом образуется раствор,
желтоватый. При добавлении избытка кислоты
к щелочному раствору из него снова выделяется
бром результате реакции
HBr + HBrO = Br2 + H2O
12.
Окисление других сложных веществ (примеры)SiO2 + 2F2 = SiF4 + O2 ( фтор окисляет основной компонент стекла, нельзя использовать стеклянную
посуду при работе с ним);
Hal2 +H2O2 =2HCl + O2 (окисление пероксида водорода происходит любыми галогенами);
Галоген – более сильный окислитель
окисляет галоген с более слабыми
окислительными свойствами в воде.
Cl2 + 2KBr = 2NaCl + Br2
5Cl2 + Br2 + 6H2O = 10HCl + 2HBrO3
Cl2 + 2KI = 2KCl + I2
5Cl2 + I2 + 6H2O = 10HCl + 2HIO3
Na2S2O3 + 4Cl2 + 5H2O=6HCl + 2NaCl + 2H2S
SO2+Br2+H2O=H2SO4+HBr
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
13.
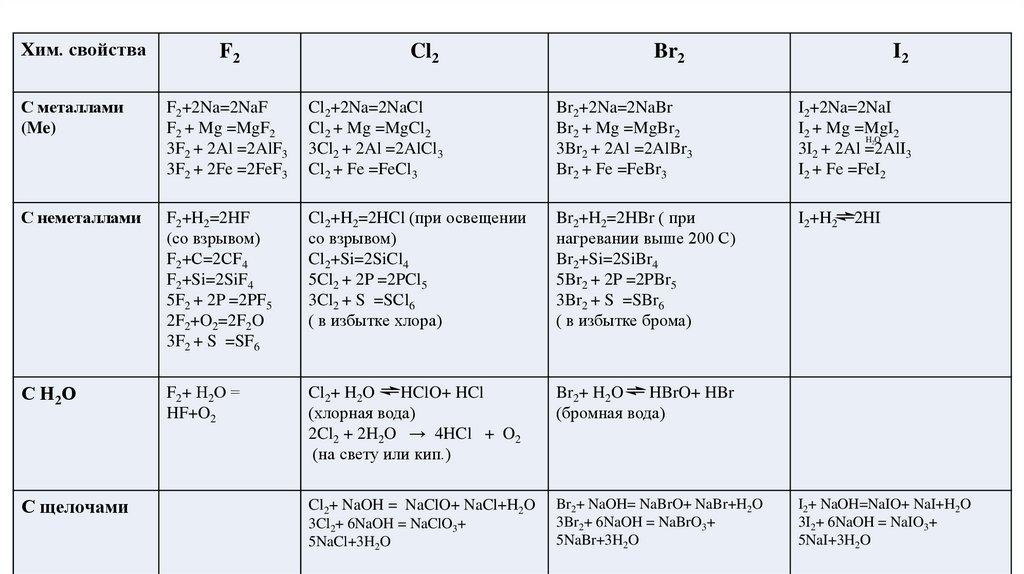
Хим. свойстваF2
С металлами
(Me)
Cl2
Br2
I2
F2+2Na=2NaF
F2 + Mg =MgF2
3F2 + 2Al =2AlF3
3F2 + 2Fe =2FeF3
Cl2+2Na=2NaCl
Cl2 + Mg =MgCl2
3Cl2 + 2Al =2AlCl3
Cl2 + Fe =FeCl3
Br2+2Na=2NaBr
Br2 + Mg =MgBr2
3Br2 + 2Al =2AlBr3
Br2 + Fe =FeBr3
I2+2Na=2NaI
I2 + Mg =MgI2
HO
3I2 + 2Al =2AlI3
I2 + Fe =FeI2
С неметаллами
F2+H2=2HF
(со взрывом)
F2+С=2СF4
F2+Si=2SiF4
5F2 + 2P =2PF5
2F2+O2=2F2O
3F2 + S =SF6
Cl2+H2=2HCl (при освещении
со взрывом)
Cl2+Si=2SiCl4
5Cl2 + 2P =2PCl5
3Cl2 + S =SСl6
( в избытке хлора)
Br2+H2=2HBr ( при
нагревании выше 200 С)
Br2+Si=2SiBr4
5Br2 + 2P =2PBr5
3Br2 + S =SBr6
( в избытке брома)
I2+H2 2HI
С Н2О
F2+ Н2О =
HF+O2
Cl2+ H2O
HClO+ HCl
(хлорная вода)
2Cl2 + 2H2O → 4HCl + O2
(на свету или кип.)
Br2+ H2O
HBrO+ HBr
(бромная вода)
Cl2+ NaOH = NaClO+ NaCl+H2O
Br2+ NaOH= NaBrO+ NaBr+H2O
3Br2+ 6NaOH = NaBrO3+
5NaBr+3H2O
С щелочами
3Cl2+ 6NaOH = NaClO3+
5NaCl+3H2O
2
I2+ NaOH=NaIO+ NaI+H2O
3I2+ 6NaOH = NaIO3+
5NaI+3H2O
14.
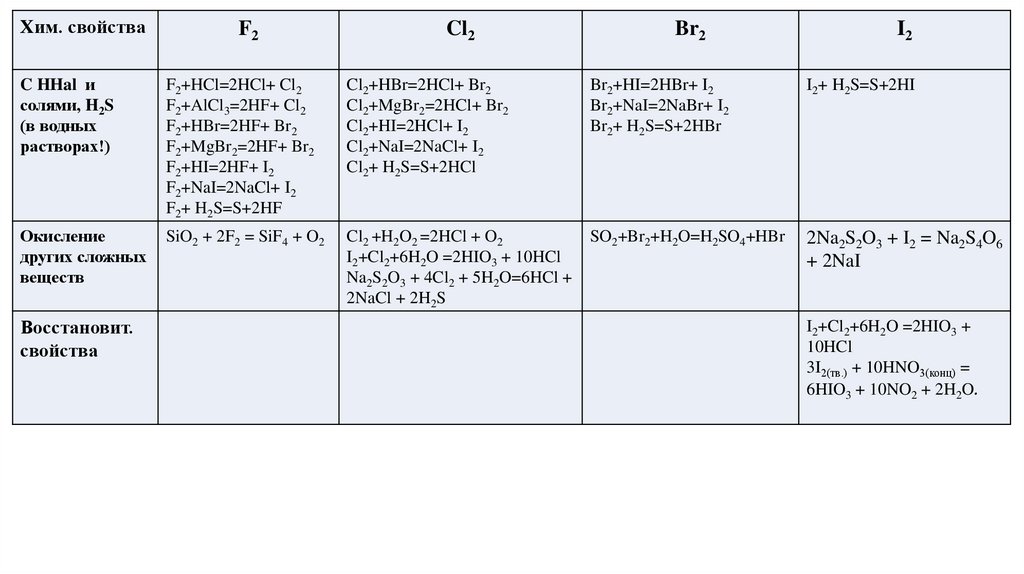
Хим. свойстваF2
Cl2
Br2
I2
C HHal и
солями, H2S
(в водных
растворах!)
F2+HCl=2HCl+ Cl2
F2+AlCl3=2HF+ Cl2
F2+HBr=2HF+ Br2
F2+MgBr2=2HF+ Br2
F2+HI=2HF+ I2
F2+NaI=2NaCl+ I2
F2+ H2S=S+2HF
Cl2+HBr=2HCl+ Br2
Cl2+MgBr2=2HCl+ Br2
Cl2+HI=2HCl+ I2
Cl2+NaI=2NaCl+ I2
Cl2+ H2S=S+2HCl
Br2+HI=2HBr+ I2
Br2+NaI=2NaBr+ I2
Br2+ H2S=S+2HBr
I2+ H2S=S+2HI
Окисление
других сложных
веществ
SiO2 + 2F2 = SiF4 + O2
Cl2 +H2O2 =2HCl + O2
I2+Cl2+6H2O =2HIO3 + 10HCl
Na2S2O3 + 4Cl2 + 5H2O=6HCl +
2NaCl + 2H2S
SO2+Br2+H2O=H2SO4+HBr
2Na2S2O3 + I2 = Na2S4O6
+ 2NaI
Восстановит.
свойства
I2+Cl2+6H2O =2HIO3 +
10HCl
3I2(тв.) + 10HNO3(конц) =
6HIO3 + 10NO2 + 2H2O.






 Химия
Химия








