Похожие презентации:
Химические источники тока. Электролиз
1.
2.
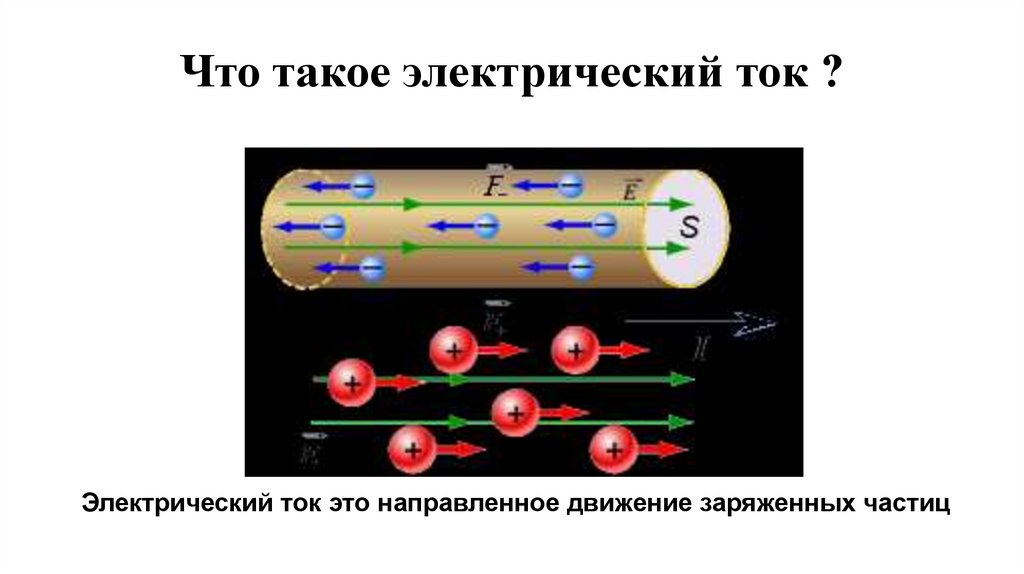
Что такое электрический ток ?Электрический ток это направленное движение заряженных частиц
3.
Перечислите условия существования тока4.
Условия существования электрического тока• Наличие свободных заряженных частиц
• Наличие электрического поля
• Замкнутая электрическая цепь
5.
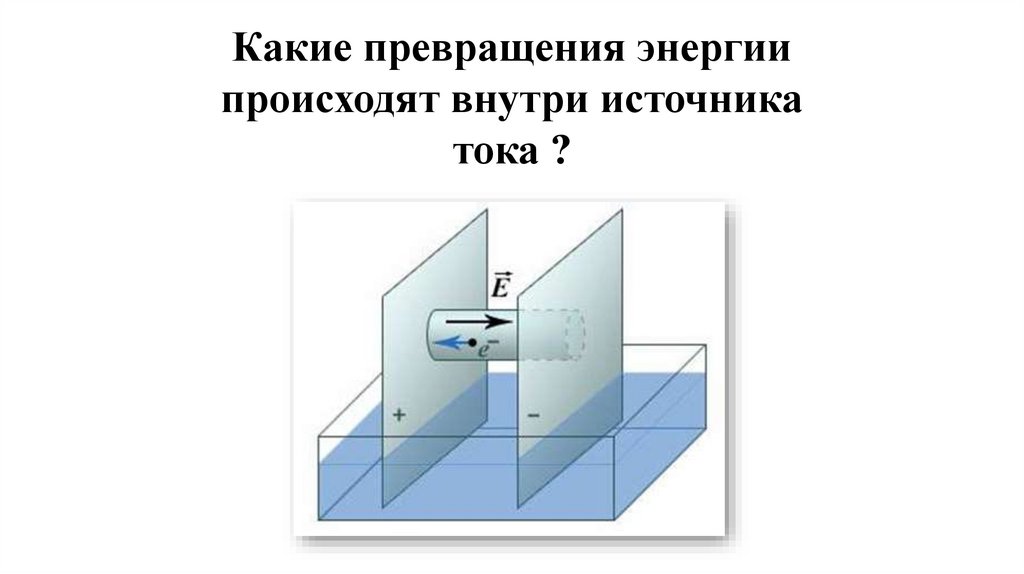
Какие превращения энергиипроисходят внутри источника
тока ?
6.
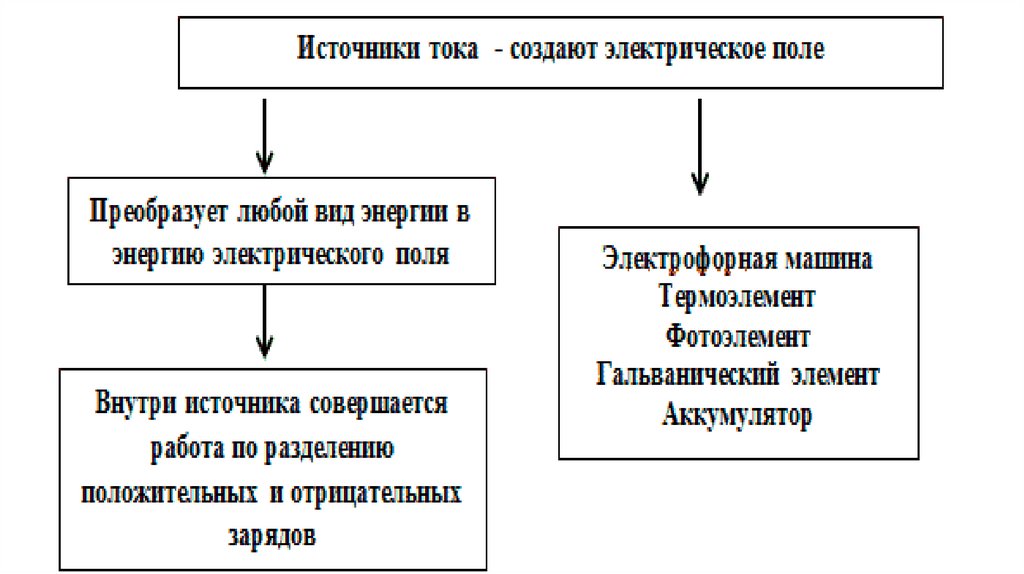
• Источники тока - это устройства, которые преобразуюткакой-либо вид энергии в электрическую энергию.
К ним относятся: генераторы электростанций,
гальванические элементы, аккумуляторы,
фотоэлементы и др.
7.
8.
Что такое окислительно-восстановительные реакции (ОВР)? (Этореакции, в процессе которых меняются степени окисления как
минимум двух элементов, один из которых является
восстановителем, а другой – окислителем.)
– Что такое окислитель и что такое
восстановитель? (Восстановитель – это элемент, который в
процессе реакции отдает электроны, и сам при этом окисляется,
окислитель – это тот элемент, который в процессе реакции
принимает электроны, и сам при этом восстанавливается)
– Какие бывают ионы? Что такое катионы и анионы?(Катионы –
положительно заряженные ионы, анионы – отрицательно
заряженные ионы)
9.
Что такое окислительно-восстановительные реакции (ОВР)?Это реакции, в процессе которых меняются степени окисления как минимум
двух элементов, один из которых является восстановителем, а другой –
окислителем.
Что такое окислитель и что такое восстановитель?
Восстановитель – это элемент, который в процессе реакции отдает
электроны, и сам при этом окисляется.
Окислитель – это тот элемент, который в процессе реакции принимает
электроны, и сам при этом восстанавливается
10.
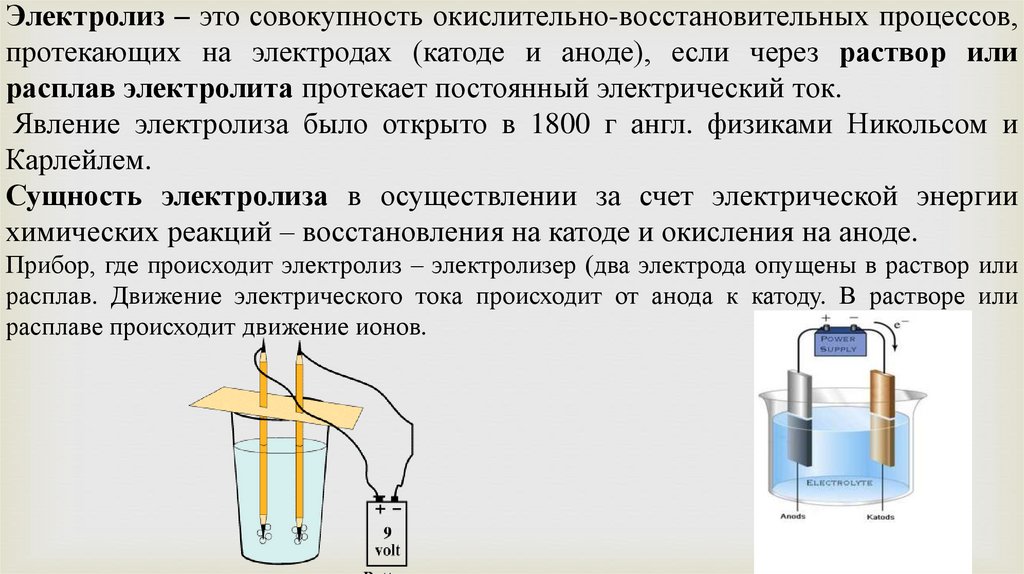
Электролиз – это совокупность окислительно-восстановительных процессов,протекающих на электродах (катоде и аноде), если через раствор или
расплав электролита протекает постоянный электрический ток.
Явление электролиза было открыто в 1800 г англ. физиками Никольсом и
Карлейлем.
Сущность электролиза в осуществлении за счет электрической энергии
химических реакций – восстановления на катоде и окисления на аноде.
Прибор, где происходит электролиз – электролизер (два электрода опущены в раствор или
расплав. Движение электрического тока происходит от анода к катоду. В растворе или
расплаве происходит движение ионов.
11.
При электролизе окислителем и восстановителем являетсяэлектрический ток. Процессы окисления и восстановления разделены в
пространстве, они совершаются не при контакте частиц друг с другом, а при
соприкосновении с электродами электрической цепи.
Виды электродов
Катод - отрицательно- заряженный электрод, на котором происходит процесс
восстановления катиона (катод отдает электроны, катион принимает
электроны).
Анод – положительно-заряженный электрод, на котором происходит процесс
окисления ( анод принимает электроны, анион отдает электроны).
Анод может быть двух типов: инертным (он не участвует в реакции, остается
неизменным) или растворимым, который участвует в реакции и переходит в
среду реакции, т.е. со временем уменьшается, растворяется).
Катион- «+»ион, анион- «-» ион.
12.
ХАРАКТЕРИСТИКА:• энергетически ёмкий (электролиты плавятся при очень высоких
температурах);
• при плавлении разрушаются кристаллические решётки;
• в расплаве беспорядочно двигаются не гидратированные ионы.
ПРИМЕНЕНИЕ:
Электролиз расплава солей или оксидов – для получения высокоактивных металлов
(калия, алюминия и др.), легко вступающих во взаимодействие с водой.
13.
14.
15.
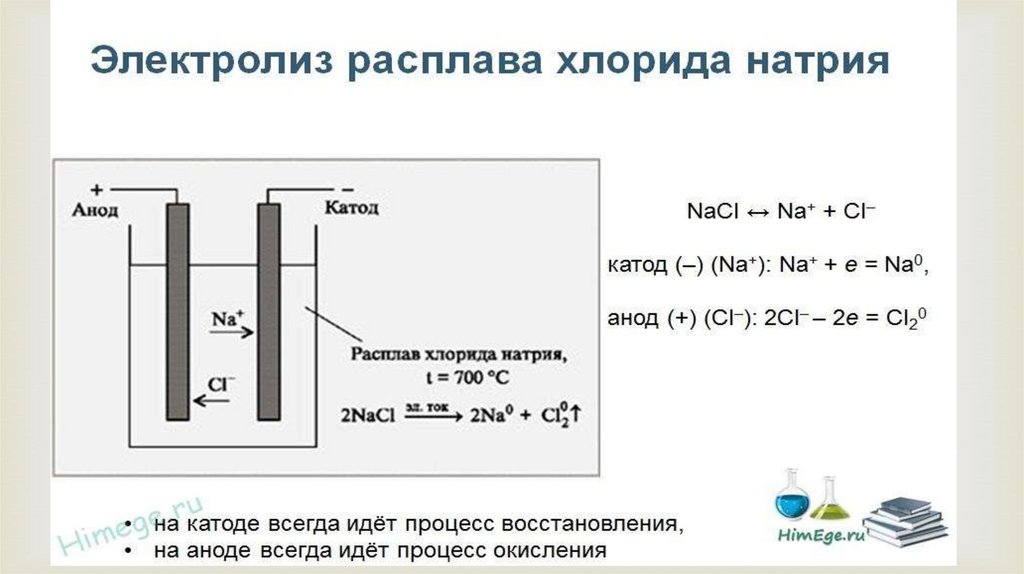
1. NaCl2. FeF3
3. Na2SO4
Примеры электролиза расплавов
K(-): Na ++ 1e → Na0
A(+): 2Cl- - 2e → Cl2
2NaCl → 2Na + Cl2
K(-): Fe3+ + 3e → Fe0 | 2
A(+): 2F- - 2e → F20 | 3
2FeF3 → 2Fe + 3F2
K(-): 2Na+ + 2e → 2Na0 | 2
A(-): 2SO42- - 4e → 2SO3 + O2
2Na2SO4 → 4Na + 2SO3 + O2
K(-): 2Na+ + 2e → 2Na0 | 2
A(-): 2CO32- - 4e → 2CO2 + O2
2Na2CO3 → 4Na + 2CO2 + O2
4. Na2CO3
5. KOH
K(-): K+ +1e → K0 | 4
A(+): 4OH- - 4e → O2 + 2H20
4KOH → 4K + O2 + 2H2O
16.
•процесс более энергетически выгодный, чемэлектролиз расплавов
• при электролизе как на аноде, так и на катоде могут
происходить конкурирующие процессы
• при выборе наиболее вероятного процесса на аноде
и катоде исходят из положения, что протекает та
реакция, которая требует наименьшей затраты
энергии.
17.
•Если металл стоит до Н, то вместо него электролизу подвергается вода:2H2O + 2е = H2 + 2OH–
Образовавшийся водород H2 идет к катоду
•Если металл стоит после Н, то он сам восстанавливается:
Cu2+ + 2е = Cu0 Медь осаждается на катоде
•Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут
восстанавливаться вместе с молекулами воды:
2Н2О + 2е = Н2 + 2ОН—Zn2+ + 2e = Zn0
18.
катионы металлыметаллы главных
катионы – другие металлы,
подгрупп I и II групп
в основном побочных
(Na+, Ca+2 и т.п., а также подгрупп (Cu+2, Ag+ и т.п.)
Al+3)
На катоде разряжается*
водород:
2Н+1 +2e
Н20
На катоде разряжается
металл:
Ме+n + ne
Me0
19.
Li K Rb Ba Ca Na Mg Al| Mn Zn Cr Fe Cd Co Ni Sn Pb H| Cu Hg Ag Pt AuЧем правее металл (больше алгебраическое значение
электродного потенциала), тем меньше энергии
расходуется на разрядку его ионов.
Если в растворе катионы Cu2+, Hg2+, Ag+, то
последовательность выделения на катоде: Ag+, Hg2+, Cu2+ и
только после исчезновения в растворе ионов металлов
начнется разрядка ионов Н+.
20.
ЭЛЕКТРОЛИЗ РАСТВОРА ХЛОРИДА НАТРИЯ21.
Теперь анионы-кислотные остатки:•Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H+ Образовавшийся O2 выделяется на аноде
•Бескислородные кислотные остатки — окисляются до простого вещества
Cl− — 1e = Cl20 Хлор выделяется на аноде
•Исключение: F− — вместо него будет выделяться кислород.
анионы – кислотные остатки
кислотный остаток не
кислотный остаток содержит
содержит кислорода (Cl- кислород (SO4-2, NO3-1, СО3-2,
1, Br – 1, S – 2 …);
SO3-2…), а также F – 1
исключение F – 1
На аноде разряжается
кислотный остаток:
2Сl – 1 – 2e
Cl20 или
S-2 – 2e
S0
На катоде разряжаются группы
OH-1
4ОН – 1 – 4e
2Н2О + О20
22.
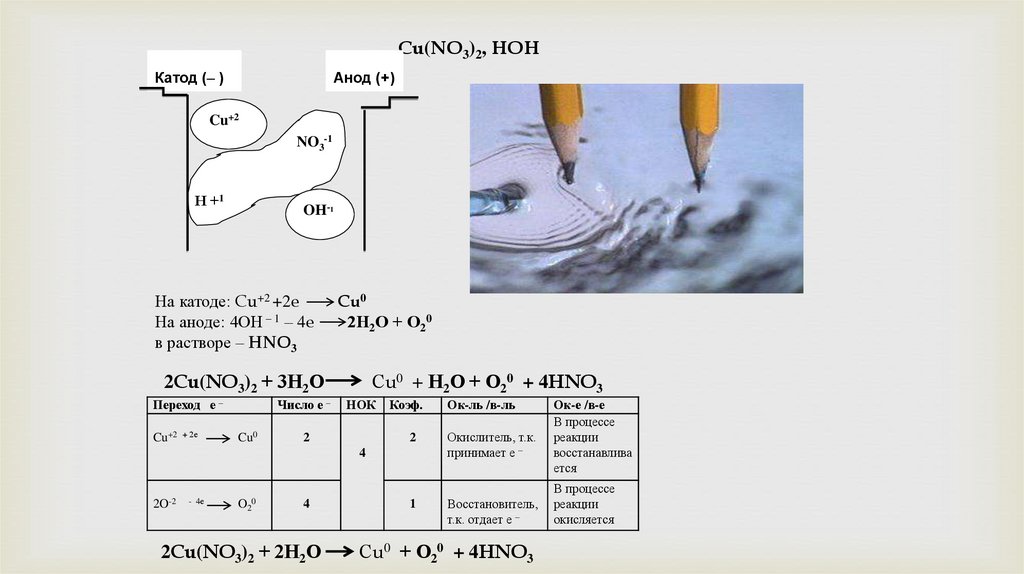
Cu(NO3)2, HOHКатод (– )
Анод (+)
Cu+2
NO3-1
Н +1
OH-1
На катоде: Cu+2 +2e
На аноде: 4ОН – 1 – 4e
в растворе – HNO3
Cu0
2Н2О + О20
2Cu(NO3)2 + 3Н2О
Переход е –
Cu+2
+ 2е
Число е –
Cu0
Сu0 + Н2О + О20 + 4HNO3
НОК
2
Коэф.
2
4
2O-2
- 4е
O2
0
4
2Cu(NO3)2 + 2Н2О
1
Ок-ль /в-ль
Окислитель, т.к.
принимает е –
Восстановитель,
т.к. отдает е –
Сu0 + О20 + 4HNO3
Ок-е /в-е
В процессе
реакции
восстанавлива
ется
В процессе
реакции
окисляется
23.
ЗадачаПри электролизе раствора нитрата серебра масса катода увеличилась на 6 г.
Вычислите объем газа выделившегося на аноде.
Дано
Решение
AgNO3, HOH
m катода увел на 6г,
следовательно,
m (Ag) = 6 г.
1) Составим схему электролиза
Анод (+)
Катод (– )
Ag+1
NO3
NO3-1
V газа на аноде?
H+1
OH-1
На катоде: Ag+1 +1e Ag0
На аноде: 4ОН – 1 – 4e 2Н2О + О20
в растворе – HNO3
2) Составим уравнение реакции электролиза:
4AgNO3 + 3Н2О
4Ag0 + Н2О + О20 + 4HNO3
Переход е –
Ag+1
+ 1е
Число е –
Ag0
НОК
1
Коэф.
4
Окислитель, т.к.
принимает е –
1
Восстановитель,
т.к. отдает е –
4
2O-2
- 4е
O20
4
Ок-ль /в-ль
Ок-е /в-е
В процессе
реакции
восстанавлива
ется
В процессе
реакции
окисляется
24.
ЗадачаПри электролизе раствора нитрата серебра масса катода увеличилась на 6 г.
Вычислите объем газа выделившегося на аноде.
Дано
Решение
AgNO3, HOH
m катода увел на 6г,
следовательно,
m (Ag) = 6 г.
1) Составим схему электролиза
Анод (+)
Катод (– )
Ag+1
NO3
NO3-1
V газа на аноде?
H+1
OH-1
На катоде: Ag+1 +1e Ag0
На аноде: 4ОН – 1 – 4e 2Н2О + О20
в растворе – HNO3
2) Составим уравнение реакции электролиза:
4AgNO3 + 3Н2О
4Ag0 + Н2О + О20 + 4HNO3
Переход е –
Ag+1
+ 1е
Число е –
Ag0
НОК
1
Коэф.
4
Окислитель, т.к.
принимает е –
1
Восстановитель,
т.к. отдает е –
4
2O-2
- 4е
O20
4
Ок-ль /в-ль
Ок-е /в-е
В процессе
реакции
восстанавлива
ется
В процессе
реакции
окисляется
25.
Задача (продолжение)Сократим Н2О в обоих частях уравнения:
4AgNO3 + 2Н2О
4Ag0 + О20 + 4HNO3
3. v (Ag)= m/M = 6г/108 г/моль = 0,56 моль
4
Ag
O2
По уравнению
4 моль
1 моль
По условию
0,56 моль
х = 0,56 / 4 = 0,14 моль
5. V (O2)= 0,14 моль * 22,4 л/моль = 3,136 л
Ответ: V O2 =3,136 л





















 Химия
Химия








