Похожие презентации:
Электролиз
1.
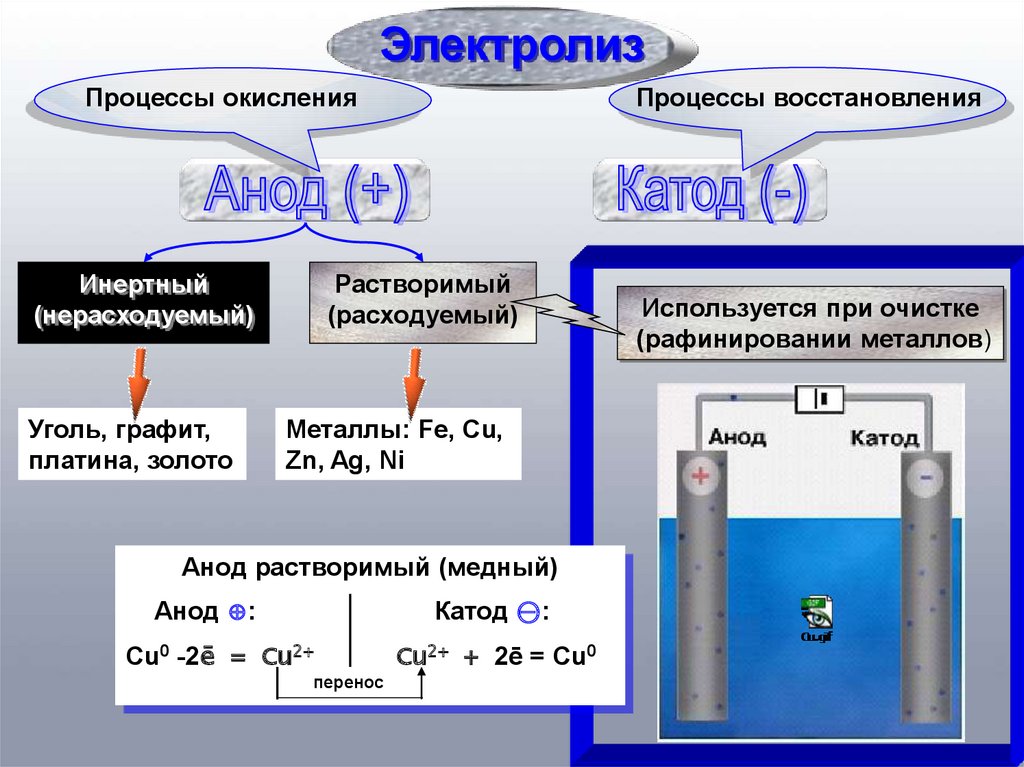
ЭлектролизПроцессы окисления
Инертный
(нерасходуемый)
Уголь, графит,
платина, золото
Процессы восстановления
Растворимый
(расходуемый)
Металлы: Fe, Cu,
Zn, Ag, Ni
Анод растворимый (медный)
Анод ⊕:
Катод ⊝:
Cu2+ + 2ē = Cu0
Cu0 -2ē = Cu2+
перенос
Используется при очистке
(рафинировании металлов)
2.
Электролизрастворов
расплавов
CaCl2 ⇄ Ca2+ + 2Clрасплав
⊝ катод
анод ⊕
Ca2+ + 2ē = Ca0
2Cl- -2ē = Cl2
электролиз
CaCl2 Ca + Cl2
NaOH
⇄ Na+ + OH-
расплав
⊝ катод
анод ⊕
Na+ + ē = Na
4OH- -4ē = O2 + 2H2O
электролиз
4NaOH 4Na + O2 + 2H2O
3.
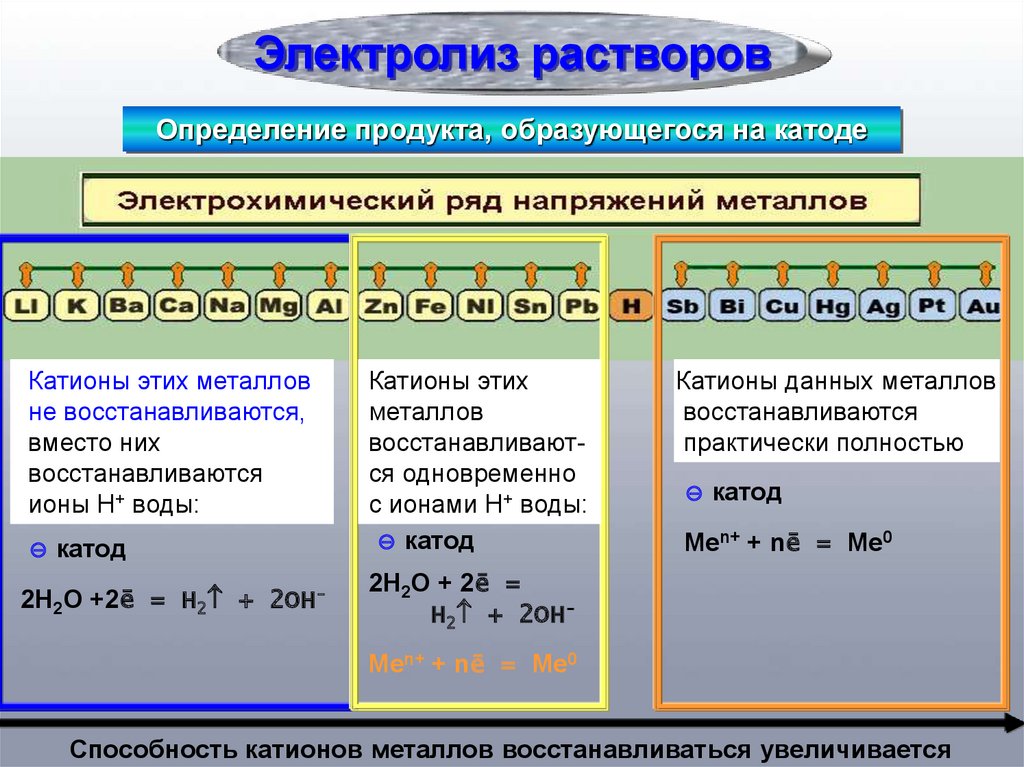
Электролиз растворовОпределение продукта, образующегося на катоде
Катионы этих металлов
не восстанавливаются,
вместо них
восстанавливаются
ионы H+ воды:
⊝ катод
2H2O +2ē = H2 + 2OH-
Катионы этих
металлов
восстанавливаются одновременно
с ионами H+ воды:
⊝ катод
Катионы данных металлов
восстанавливаются
практически полностью
⊝ катод
Меn+ + nē = Ме0
2H2O + 2ē =
H2 + 2OHМеn+ + nē = Ме0
Способность катионов металлов восстанавливаться увеличивается
4.
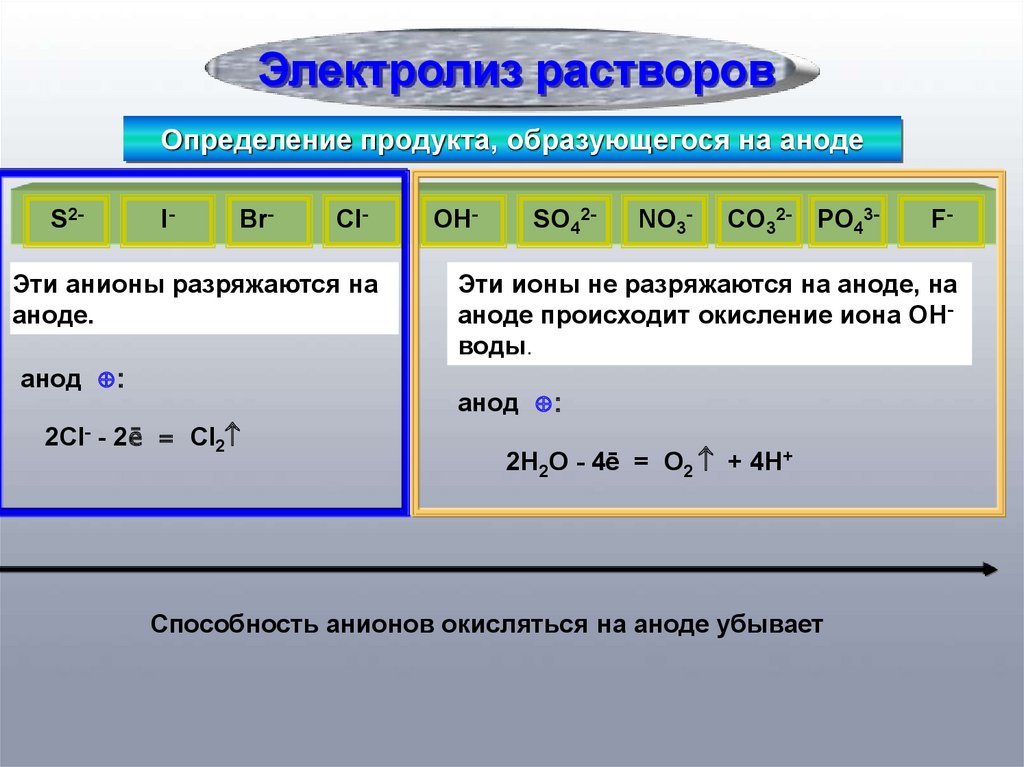
Электролиз растворовОпределение продукта, образующегося на аноде
S2-
I-
Br-
Cl-
Эти анионы разряжаются на
аноде.
анод ⊕:
OH-
SO42-
NO3-
CO32-
PO43-
Эти ионы не разряжаются на аноде, на
аноде происходит окисление иона OHводы.
анод ⊕:
2Cl- - 2ē = Cl2
F-
2H2O - 4ē = O2 + 4H+
Способность анионов окисляться на аноде убывает
5.
Электролиз растворовCuCl2, H2O
KI, H2O
KI ⇄ K+ + IH2O ⇄ H+ + OH-
CuCl2 ⇄ Cu2+ + 2Cl⊝ катод
анод ⊕
Cu2+ + 2ē = Cu0
2Cl- -2ē = Cl2
электролиз
CuCl2 Cu + Cl2
анод ⊕
⊝ катод
2H2O +2ē = H2 + 2OH-
2I- -2ē = I2
электролиз
KI +H2O H2 + I2 + 2K+ + 2OHNa2SO4, H2O
Na2SO4 ⇄ 2Na+ + SO42H2O ⇄
H+
+ OH-
⊝ катод
анод ⊕
2H2O +2ē = H2 + 2OH2H2O - 4ē = O2 + 4H+
электролиз
2H2O 2H2 + O2
6.
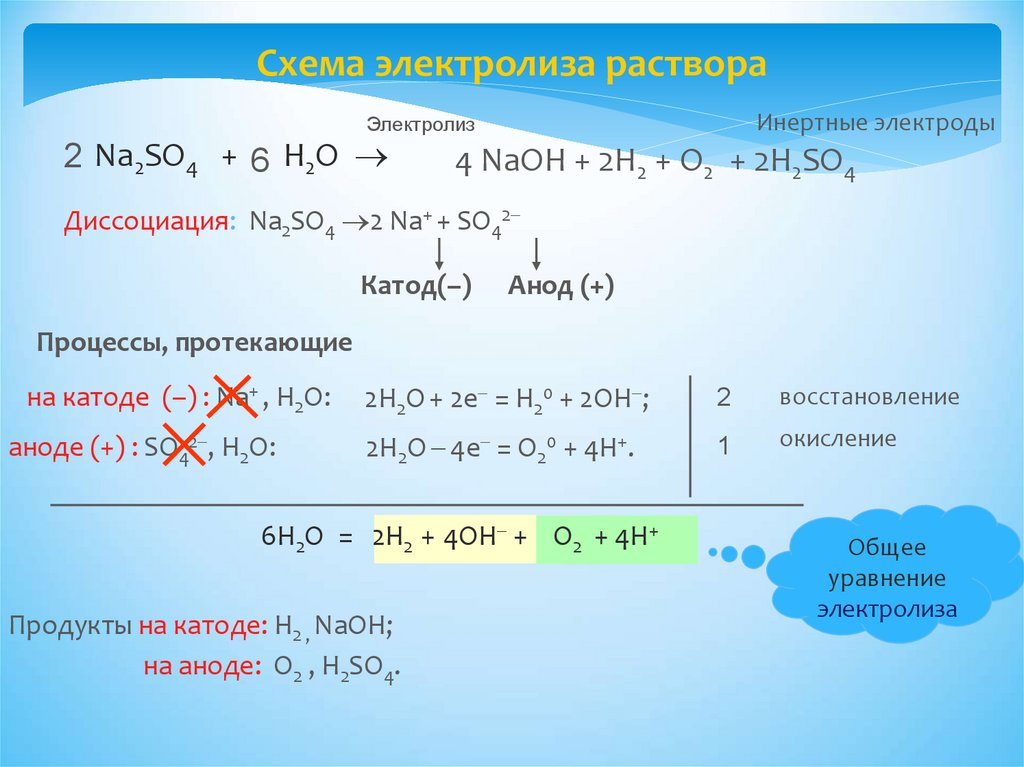
Схема электролиза раствораИнертные электроды
Электролиз
2 Na2SO4 + 6 H2O
4 NaОН + 2Н2 + O2 + 2Н2SO4
Диссоциация: Na2SO4 2 Na+ + SO42
Катод(–)
Анод (+)
Процессы, протекающие
на катоде (–) : Na+ , Н2О:
аноде (+) : SO42 , Н2О:
2Н2О + 2e = Н20 + 2ОН ;
2
восстановление
2Н2О 4e = О20 + 4Н+.
1
окисление
6Н2О = 2Н2 + 4ОН + O2 + 4Н+
Продукты на катоде: Н2 , NaОН;
на аноде: O2 , Н2SO4.
Общее
уравнение
электролиза
7.
Схема электролиза раствораNiSO4 + H2O
Электролиз
Инертные электроды
Ni + Н2 + O2 + Н2SO4
Диссоциация: NiSO4 Ni2+ + SO42
Катод(–) Анод (+)
Процессы, протекающие
на катоде (–) : Ni2+ , Н2О:
Ni2+ + 2e = Ni0
2Н2О + 2e = Н20 + 2ОН ;
1
восстановление
аноде (+) : SO42 , Н2О:
2Н2О 4e = О20 + 4Н+.
1
окисление
Ni + 4Н2О = Ni + Н2 + 2ОН + O2 + 4 Н+
2 H2O
2 Н2O
Продукты на катоде: Ni, Н2;
на аноде: O2 , H2SO4.
2H+
Общее
уравнение
электролиза
8.
Применениеэлектролиза
9.
Применениеэлектролиза
Электрополирование стали,
покрытие оксидными пленками
Гальваностегия нанесение на
поверхность
металлических
изделий слоев других
металлов путем
электролиза
Гальванопластика получение точных
металлических копий
различных
предметов путем
электроосаждения
металла на
поверхности гипсовой
формы





 Химия
Химия








