Похожие презентации:
Галогены. 9 класс
1.
Галогены2.
Общая характеристика• Галогены (от греч. «рождающие соли»)
главная подгруппа 7 группы: F, Cl, Br, I и At.
• Все галогены, кроме At встречаются в виде
соединений.
В природе галогены в виде простых веществ не
встречаются!
• Молекулы простых веществ состоят из двух
атомов, в общем виде Г2.
3.
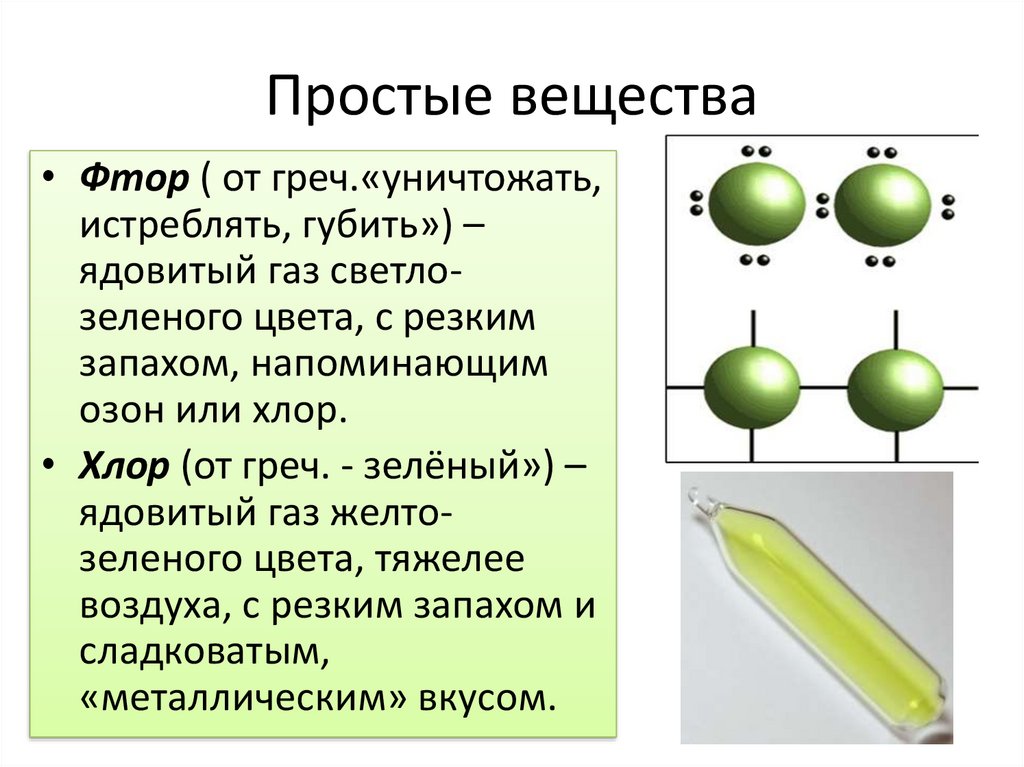
Простые вещества• Фтор ( от греч.«уничтожать,
истреблять, губить») –
ядовитый газ светлозеленого цвета, с резким
запахом, напоминающим
озон или хлор.
• Хлор (от греч. - зелёный») –
ядовитый газ желтозеленого цвета, тяжелее
воздуха, с резким запахом и
сладковатым,
«металлическим» вкусом.
4.
• Бром (от др.-греч.«вонючий») - токсичная
тяжелая жидкость краснобурого цвета с сильным
неприятным запахом.
• Йод (от др.-греч.—
«фиолетовый») –
кристаллы чёрно-серого
цвета с фиолетовым
металлическим блеском,
легко образует
фиолетовые пары,
обладающие резким
запахом.
5.
Физические свойства• Плотность растет;
• Температура кипения и плавления
растут;
• Окраска усиливается.
• Растворимость от хлора к йоду
уменьшается. (Фтор активно
реагирует с водой!)
• Окислительные и неметаллические
свойства уменьшаются.
6.
Химические свойства• Галогены – типичные окислители.
• Более активный галоген вытесняет менее
активный из его соединений с металлами и
водородом (исключение: F2).
• Ионы галогенов Г- способны только
отдавать электроны и являются
восстановителями:
7.
Галогеноводороды• HГ – летучие, хорошо растворимые в воде
соединения.
• Водные растворы являются кислотами.
Сила кислот от HF к HI растет.
• Устойчивость уменьшается.
• Восстановительная активность для Г-1 в
ряду увеличивается:
8.
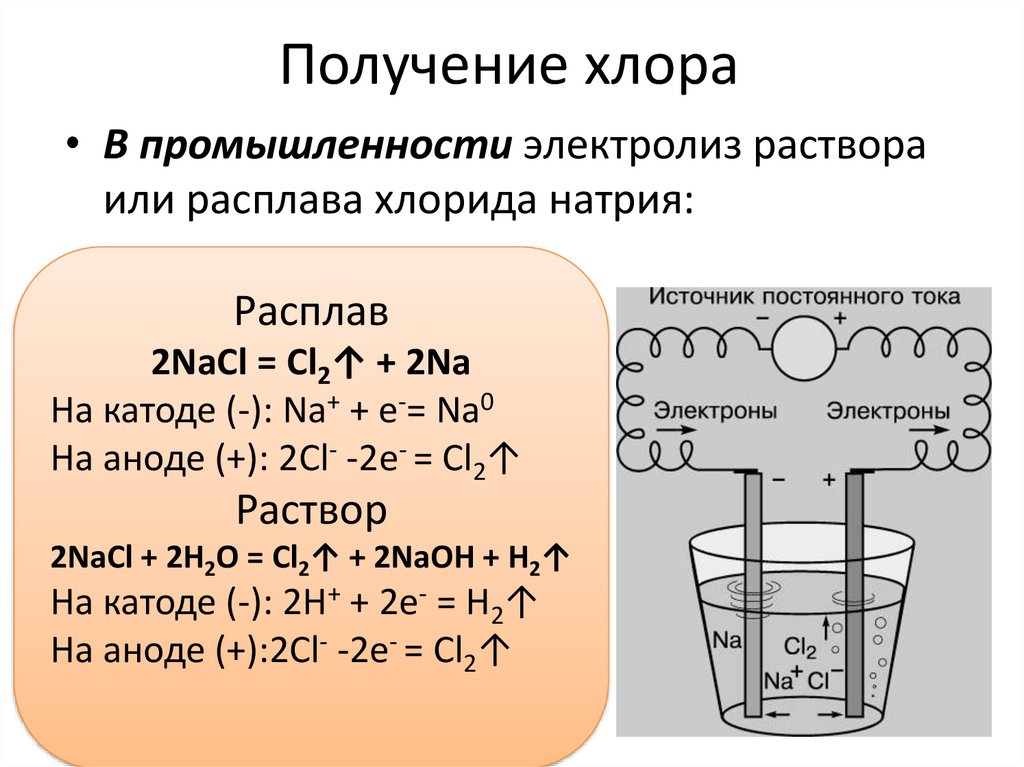
Получение хлора• В промышленности электролиз раствора
или расплава хлорида натрия:
Расплав
2NaCl = Cl2↑ + 2Na
На катоде (-): Na+ + e-= Na0
На аноде (+): 2Cl- -2e- = Cl2↑
Раствор
2NaCl + 2H2O = Cl2↑ + 2NaOH + H2↑
На катоде (-): 2H+ + 2e- = H2↑
На аноде (+):2Cl- -2e- = Cl2↑
9.
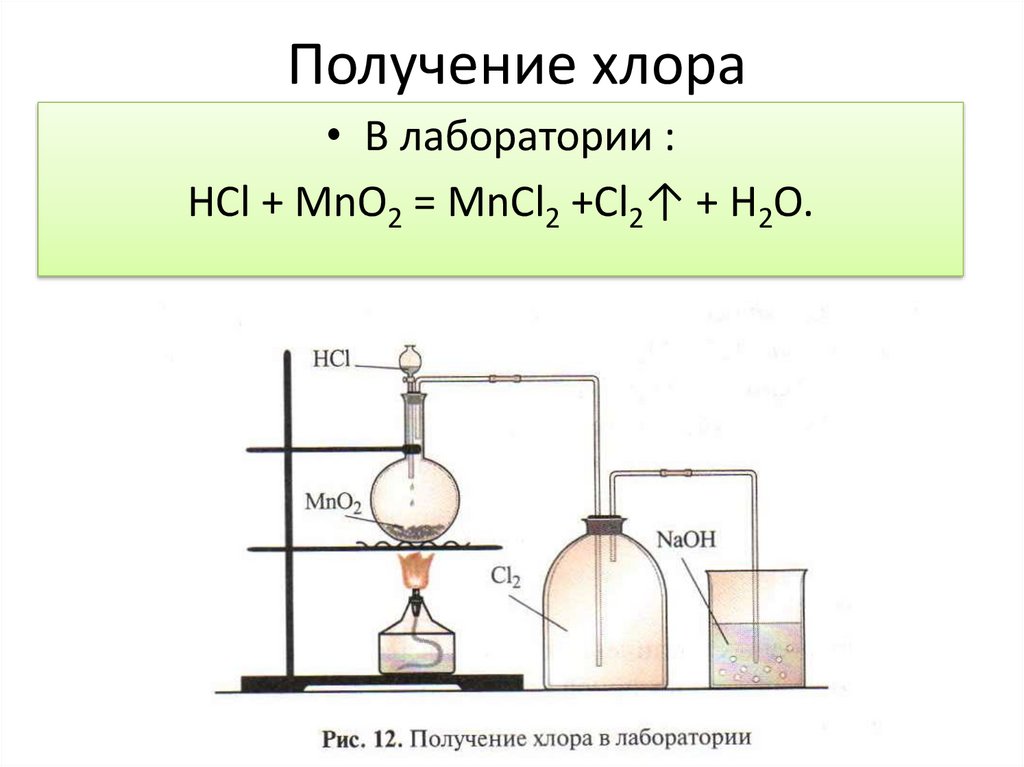
Получение хлора• В лаборатории :
HCl + MnO2 = MnCl2 +Cl2↑ + H2O.
10.
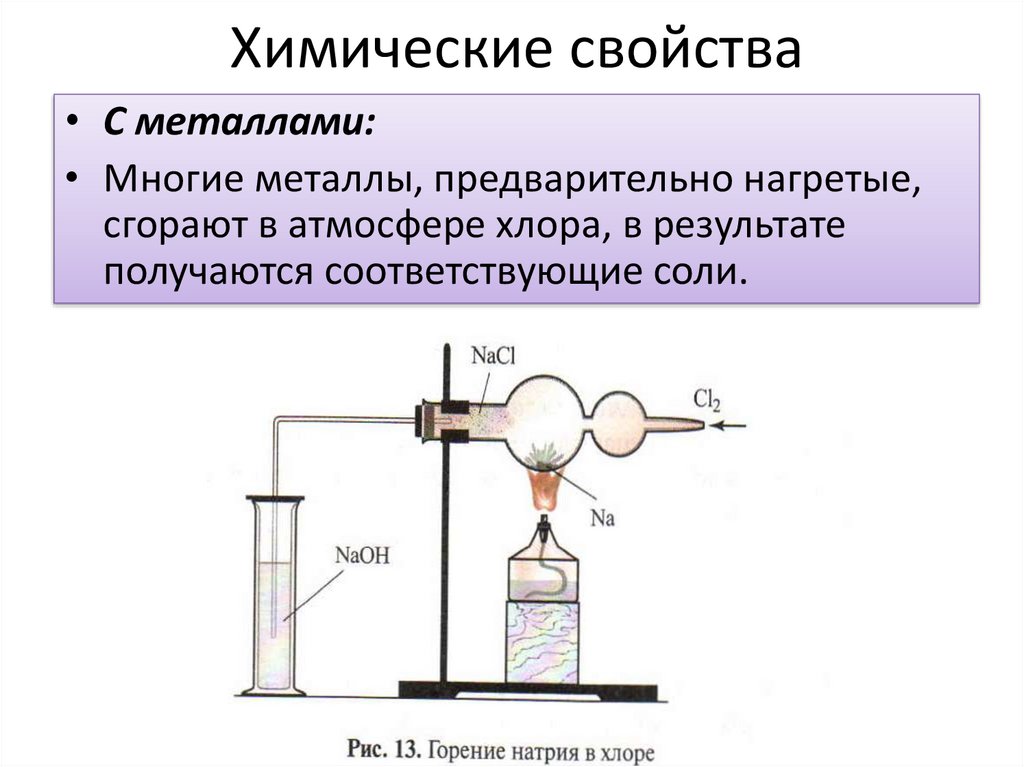
Химические свойства• С металлами:
• Многие металлы, предварительно нагретые,
сгорают в атмосфере хлора, в результате
получаются соответствующие соли.
11.
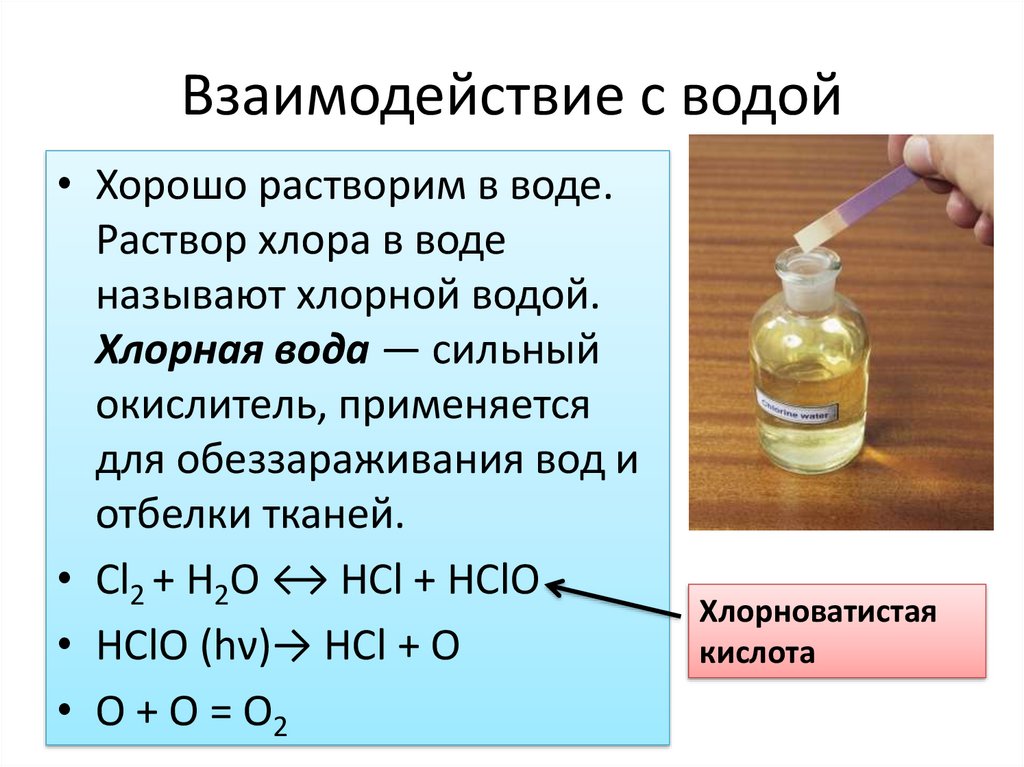
Взаимодействие с водой• Хорошо растворим в воде.
Раствор хлора в воде
называют хлорной водой.
Хлорная вода — сильный
окислитель, применяется
для обеззараживания вод и
отбелки тканей.
• Cl2 + H2O ↔ HCl + HClO
• HClO (hν)→ HCl + O
• O + O = O2
Хлорноватистая
кислота






 Химия
Химия








