Похожие презентации:
Водородный показатель
1. ПРЕЗЕНТАЦИЯ
По химииНа тему: «Водородный показатель»
2.
Среду водородного раствора можноохарактеризовать концентрацией ионов
водорода Н+ или гидроксид-ионов ОН+
Существует три типа среды:
• Нейтральная
• Кислотная
• Щелочная
3. Нейтральная-
НейтральнаяЭто среда, в которой концентрация ионовводорода равна концентрации
гидроксид-ионов:
[H+]=[OH-]=10-7 моль/л
4. Кислотная-
КислотнаяЭто среда, в которой концентрация ионовводорода больше концентрации
гидроксид-ионов:
[H+]>[OH-], [H+]>10-7 моль/л
5. Щелочная-
ЩелочнаяЭто среда, в которой концентрация ионовводорода меньше концентрации
гидроксид-ионов:
[H+]<[OH-], [H+]< 10-7моль/л
6. Для характеристики сред растворов удобно использовать так называемый водородный показатель рн (пэ-аш), введённый датским
химиком Сёренсеном:р-начальная буква слова potenzматематическая степень, Н- химический
знак водорода.
Водородным показателем РН называется
отрицательный десятичный логарифм
концентрации ионов водорода.
РН=-lg[H+]
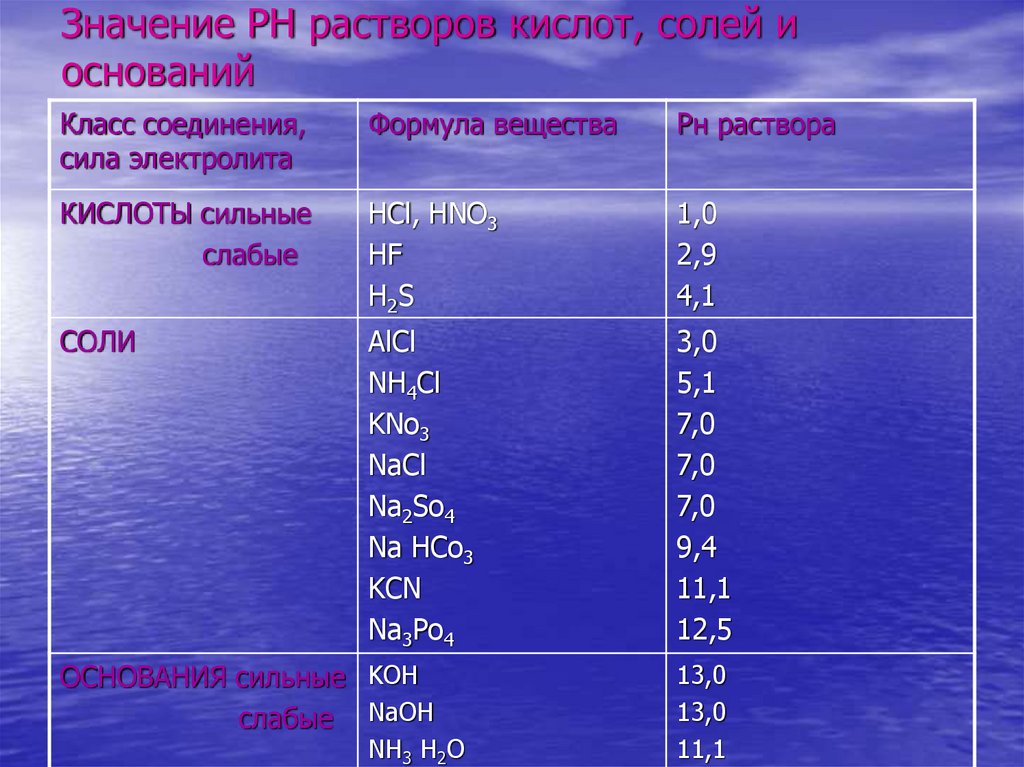
7. Значение РН растворов кислот, солей и оснований
Класс соединения,сила электролита
Формула вещества
Рн раствора
КИСЛОТЫ сильные
слабые
НCl, HNO3
HF
H2 S
1,0
2,9
4,1
СОЛИ
AlCl
NH4Cl
KNo3
NaCl
Na2So4
Na HCo3
KCN
Na3Po4
3,0
5,1
7,0
7,0
7,0
9,4
11,1
12,5
ОСНОВАНИЯ сильные KOH
слабые NaOH
NH3 H2O
13,0
13,0
11,1
8. Значение рн некоторых физиологических жидкостей
растворрН
КРОВЬ
7,3-7,4
Желудочный сок
0,9-1,5
Слюна
6,3-6,9
Моча
5,0-6,0
Пот
4,3-7,5
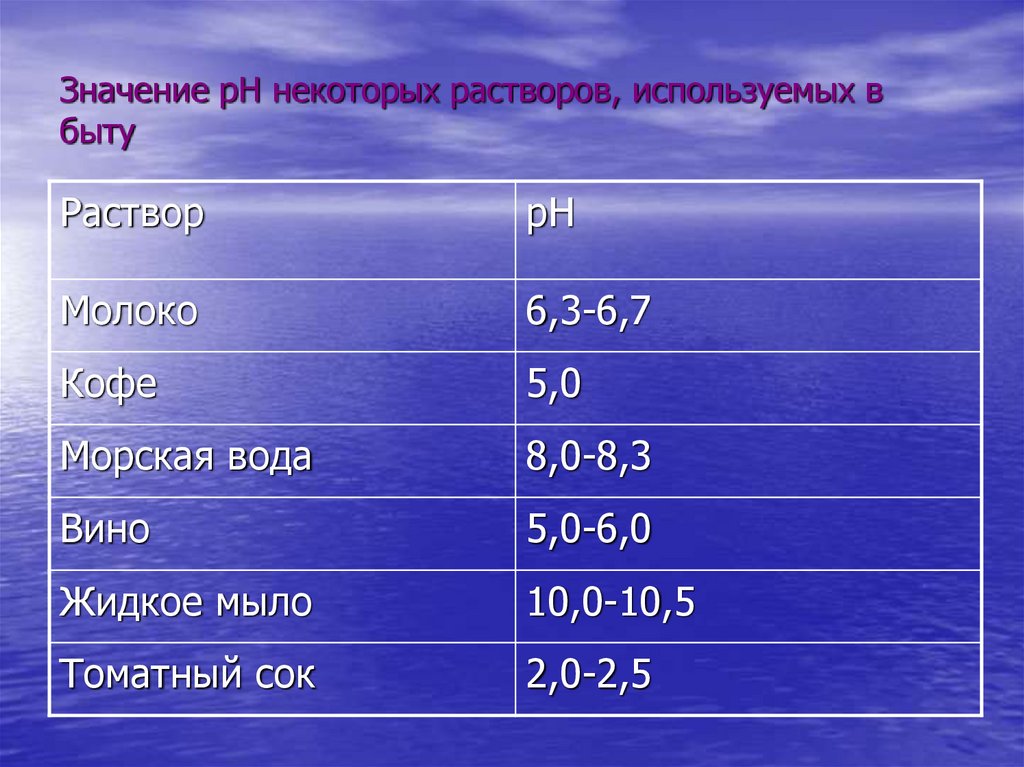
9. Значение рН некоторых растворов, используемых в быту
РастворрН
Молоко
6,3-6,7
Кофе
5,0
Морская вода
8,0-8,3
Вино
5,0-6,0
Жидкое мыло
10,0-10,5
Томатный сок
2,0-2,5







 Химия
Химия








