Похожие презентации:
Классификация химических реакций
1.
Классификацияхимических реакций
2.
Химическая реакция - процесспревращения одних веществ в другие,
отличающиеся от исходных составом
или строением
3.
Признаки химических реакцийo изменение цвета
o образование(растворение)
осадка
o изменение запаха
o выделение (поглощение)
энергии
o выделение газа
4.
Сущность химических процессовo Разрыв химических связей в реагентах.
o Возникновение новых связей в продуктах
реакции.
o Получение
готового
продукта,
возможность выделить его из общей
массы
веществ
и
дальнейшее
использование
5.
Типы химических реакцийo По числу и составу реагирующих веществ.
o По изменению степеней окисления
химических элементов, образующих
вещества.
o По тепловому эффекту.
o По агрегатному состоянию реагирующих
веществ.
o По участию катализатора.
o По направлению.
6.
Реакции, идущие с изменениемсостава вещества
oРеакции соединения
(присоединения)
oРеакции разложения
(отщепления)
oРеакции замещения
oРеакции обмена
7.
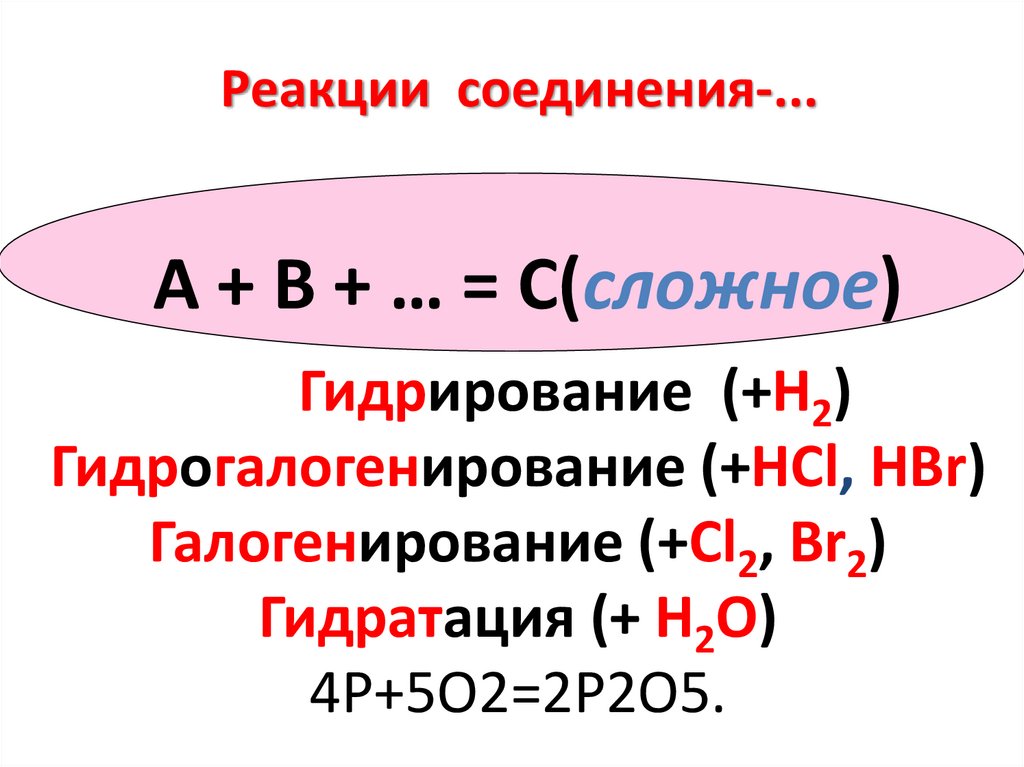
Реакции соединения-...А + В + … = С(сложное)
Гидрирование (+Н2)
Гидрогалогенирование (+HCl, HBr)
Галогенирование (+Cl2, Br2)
Гидратация (+ Н2О)
4P+5O2=2P2O5.
8.
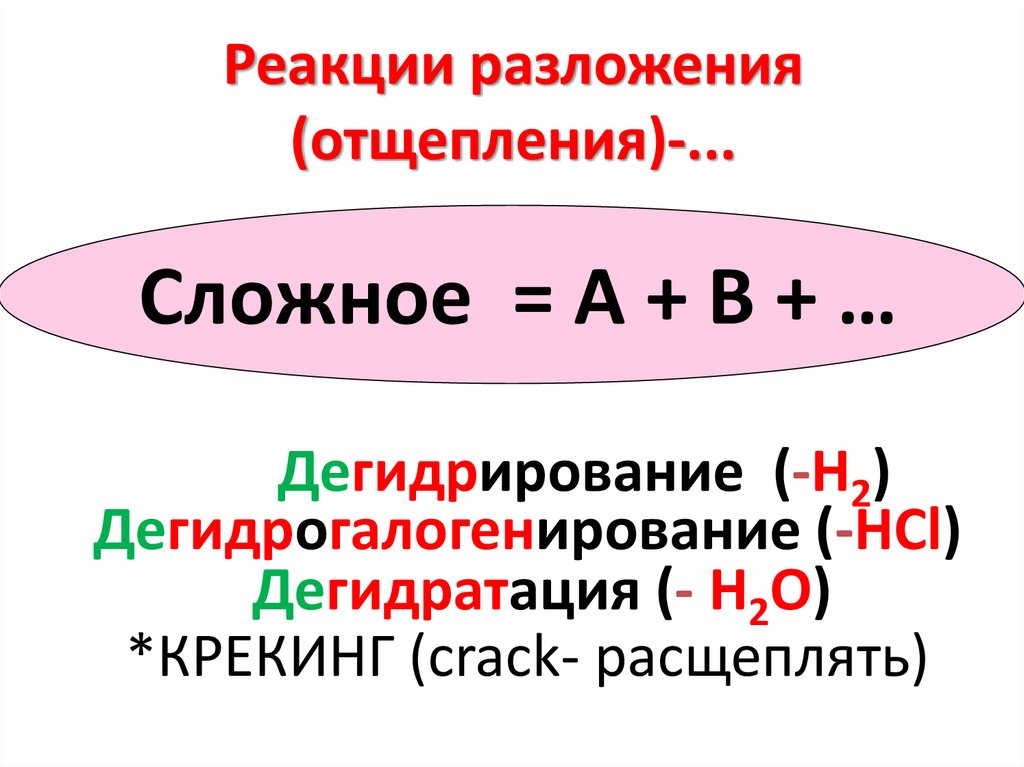
Реакции разложения(отщепления)-...
Сложное = А + В + …
Дегидрирование (-Н2)
Дегидрогалогенирование (-HCl)
Дегидратация (- Н2О)
*КРЕКИНГ (crack- расщеплять)
9.
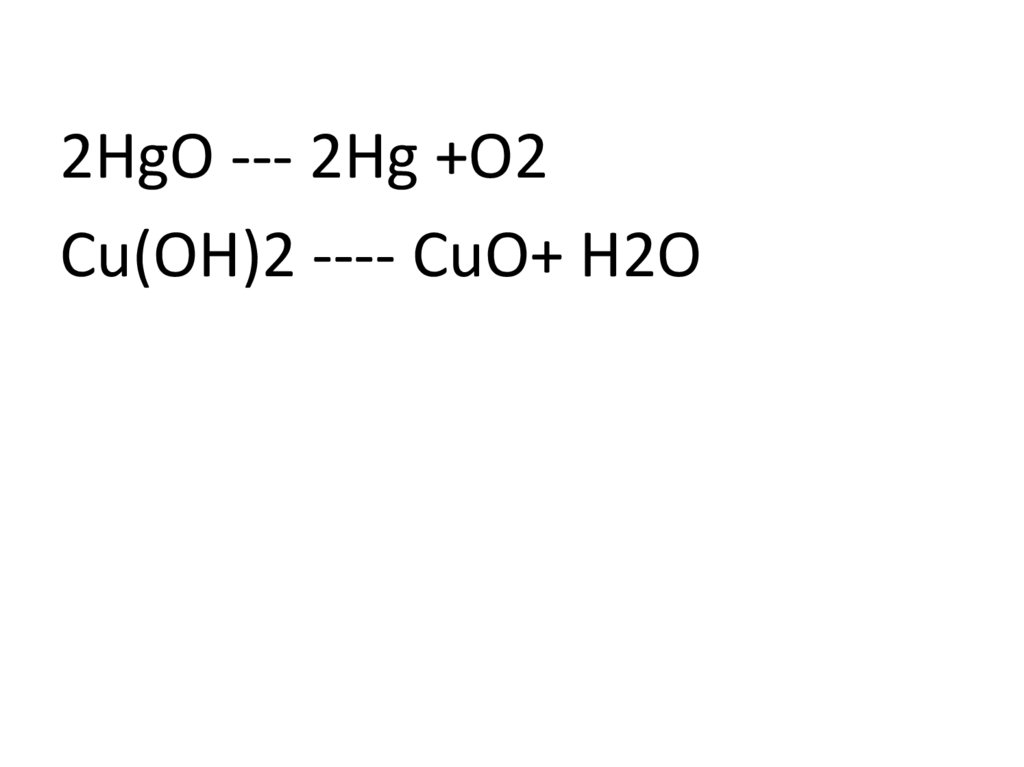
2HgO --- 2Hg +O2Cu(OH)2 ---- CuO+ H2O
10.
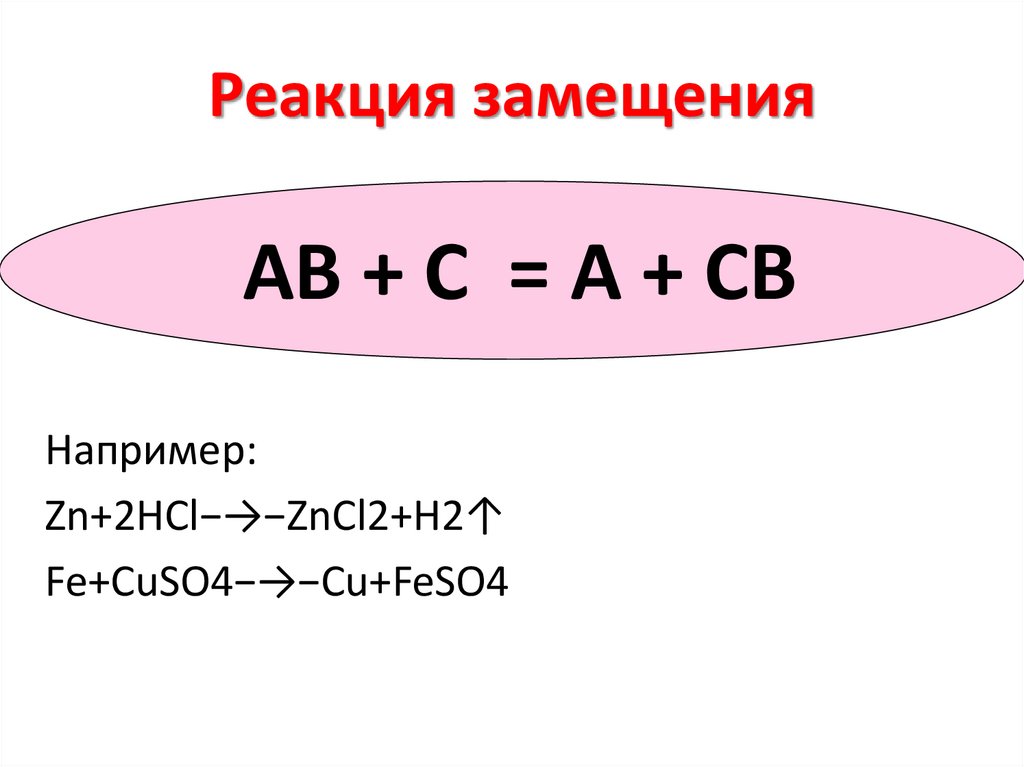
Реакция замещенияAB + C = А + CВ
Например:
Zn+2HCl−→−ZnCl2+H2↑
Fe+CuSO4−→−Cu+FeSO4
11.
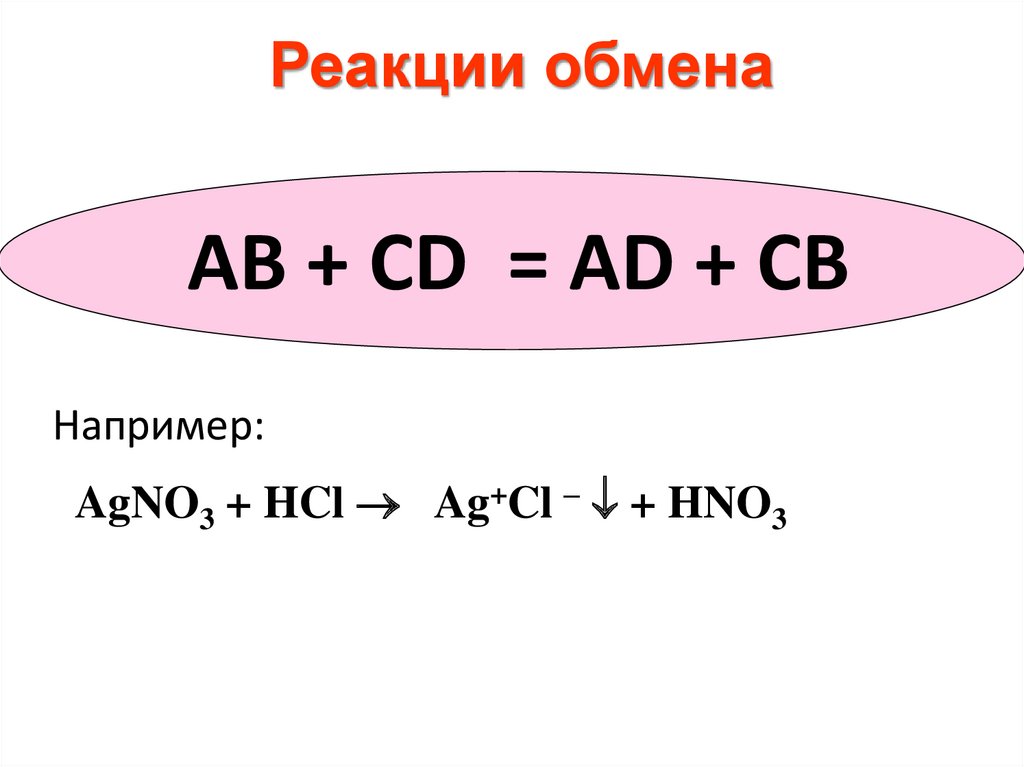
Реакции обменаAB + CD = АD + CВ
Например:
AgNO3 + HCl Ag+Cl – + HNO3
12.
Условия протекания реакций обменамежду растворами (правило Бертолле):
1) выпадение осадка (нерастворимого
вещества)
2) выделение газа
3) образование воды H2O
13.
NaOH + CuSO4---- Cu(OH)2 + Na2SO4CaCO3 ---- CaO + CO2 (разложения)
SO2+O2----SO3 ( соединения)
Fe2O3 +Al ----Al2O3 + Fe (замещения)
14.
По тепловому эффектуЭкзотермические реакции – реакции,
протекающие с выделением энергии во
внешнюю среду. К ним относятся почти все
реакции соединения.
Реакции горения, например:
4Р + 5О2 = 2Р2О5 + Q
15.
Эндотермические реакции:Эндотермические реакции – реакции, протекающие с
поглощением энергии во внешнюю среду. К ним относятся почти
все реакции разложения, например:
t
Обжиг известняка:
СаСО3 CaO + CO2 - Q
Количество выделенной или поглощенной в результате реакции
энергии называют тепловым эффектом реакции, а уравнение
химической реакции с указанием этого эффекта называют
термохимическим уравнением, например:
H2(г)+ Cl2(г) = 2HCl(г) + 92.3 кДж
N2(г) + O2(г) = 2NO – 90.4 кДж
16.
По изменению степени окисленияОкислительно-восстановительные реакции –
реакции, идущие с изменением степеней
окисления элементов. (OBP)
0
+1
+2
0
а) Mg + H2SO4 = MgSO4 + H2
0
0
+2
0
2Н + 2e¯ H2 – восстановление
+2 -2
б) 2Мg + O2 = 2MgO
0
Mg – 2e¯ Mg – окисление
+1
0
+2
Mg – 2e¯ Mg 2 – окисление
0
-2
O2 + 4e¯ 2O
1 восстановление
17.
Не окислительно-восстановительныереакции - реакции, идущие без изменения
степеней окисления элементов.
К ним относятся все реакции ионного обмена,
например:
Na2CO3 + 2HCl = 2NaCl + Н2СО3
многие реакции соединения :
Li2O + H2O = 2LiOH
а также многие реакции разложения:
t
2Fe(OH)3 Fe 2O3 + 3H2O
18.
По фазовому составуГетерогенные реакции – реакции, в которых
реагирующие вещества и продукты реакции находятся в разных
агрегатных состояниях (в разных фазах):
FeO(т) + СО(г) Fe(т) + СО2(г) + Q
2Al(т) + 3СuСl2 (р-р) = 3Сu(т) + 2AlCl3 (р-р)
CaC2(т) + 2H2O(ж) = C2H2 + Ca(OH)2(р-р)
Гомогенные
реакции
-
реакции, в которых
реагирующие вещества и продукты реакции находятся в одном
агрегатном состоянии (в одной фазе):
2С2Н6(г) + 7О2(г) 4СО2(г) + 6Н2О(г)
2 SO2(г) + O2(г) = 2SO3(г) +Q
H2(г) + F2(г) = 2HF(г)
19.
По использованию катализатораНекаталитические реакции - реакции, идущие без
участия катализатора:
t
2HgO 2Hg + O2
t
2Al + 6HCl 2AlCl3 + 3H2
Каталитические реакции
– реакции, идущие с
участием катализатора:
H2O
4Al + 3I2 2AlI3
t,MnO2
2KClO3 2KCl + 3O2
P,t
CO + NaOH H-CO-ONa
20.
По направлению:Необратимые реакции - протекают в данных
условиях только в одном направлении. К таким
реакциям можно отнести все реакции обмена,
сопровождающиеся образованием осадка, газа и
все реакции горения:
Горение пороха
21.
Обратимыереакции
в данных
условиях протекают одновременно в двух
противоположных направлениях. Таких
реакций подавляющее большинство.
Например:
2SO2 + O2 <=> 2SO3
N2 +3H2 <=> 2NH3

















 Химия
Химия








