Похожие презентации:
Аммиак. Соли аммония
1. Аммиак. Соли аммония.
2.
• Молекулярная формула• Электронная формула
Вид химической связи
Тип кристаллической решетки
Dвозд. =
Растворимость в воде ……
Запах ……
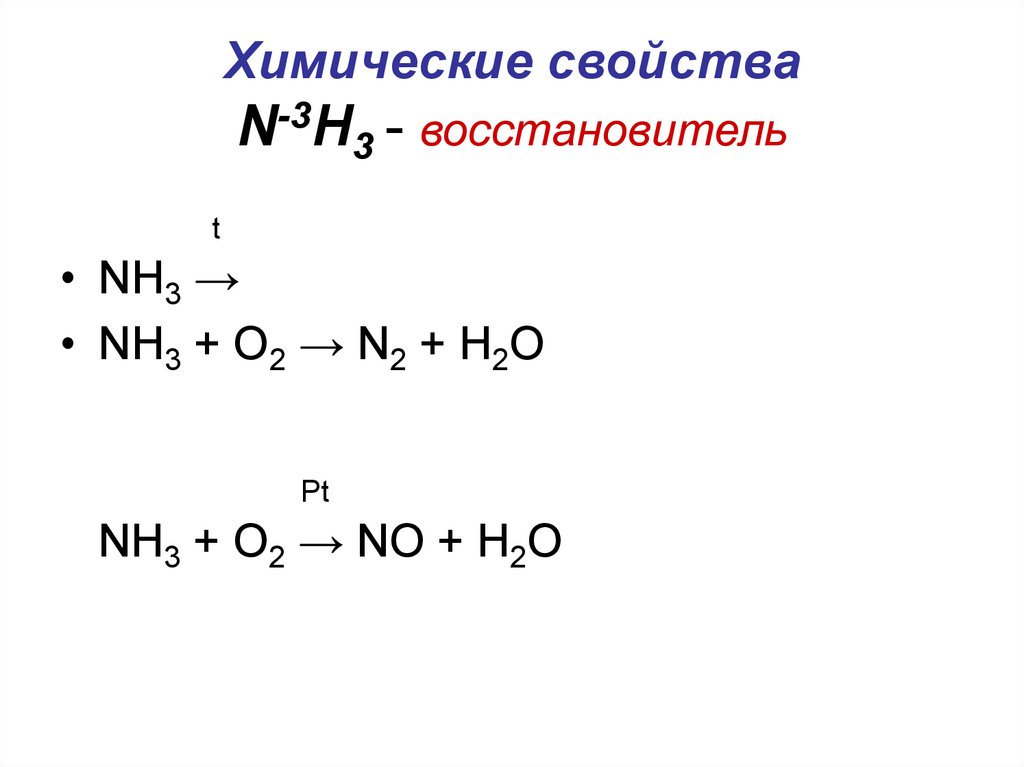
3. Химические свойства N-3H3 - восстановитель
t• NH3 →
• NH3 + O2 → N2 + H2O
Pt
NH3 + O2 → NO + H2O
4. Взаимодействие с водой
NH3 + HOH ↔H: N-δ: Н + Н+δ:О-δ: Н→
Н
H: N-δ: Н + Н+δ:Cl-δ→
Н
NH4+ - катион аммония
5. Получение аммиака в лаборатории
NH4Cl + Ca(OH)2 = CaCl2 + NH3↑+ H2O6. Соли аммония- сложные вещества, состоящие из ………………..
Закончите уравнение реакцииNH3 + H2SO4 =
Напишите уравнения реакций получения нитрата аммония
А)
Б)
7. Используя таблицу растворимости, сделайте вывод, как ведут себя соли аммония в воде
Общие свойства солей:а) взаимодействие с кислотами
(NH4)2CO3 + HCl =
б) взаимодействие с солями
(NH4)2SO4 + BaCl2 =
в ) взаимодействие с щелочами
NH4Cl + NaOH =
г) термическое разложение
NH4Cl → NH3↑+ HCl
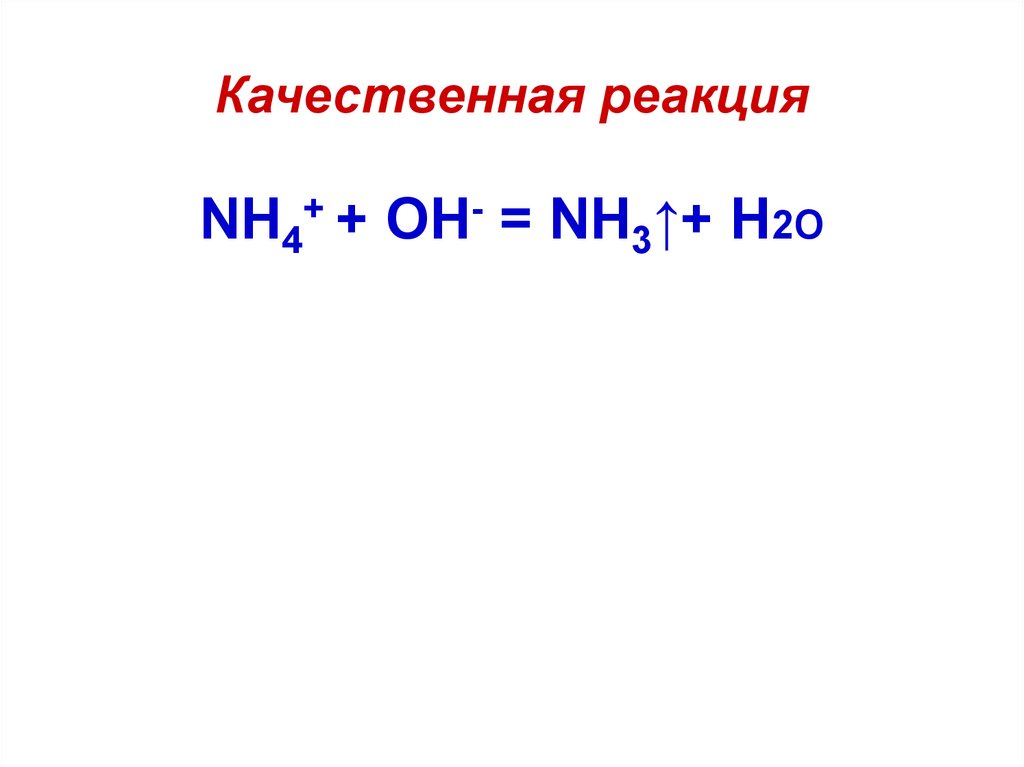
8. Качественная реакция
NH4+ + OH- = NH3↑+ H2О9. Проверь свои знания:
• Предложите вещества, соответствующие данной схеме иосуществите превращения
N0 ↔ N-3 → N+2 → N+4
• Запишите молекулярные и ионные уравнения реакций
следующих превращений:
NH3 → NH4Cl → NH4NO3 → NH3
• Какие свойства гидрокарбоната аммония
используются при добавлении его в тесто при
выпечке кондитерских изделий? Запишите
уравнение реакции
10. Задача:
• Вычислите массу и объем (н.у.)аммиака, который получится при
взаимодействии 20г хлорида аммония с
7,4г гидроксида кальция.









 Химия
Химия








