Похожие презентации:
Химические свойства карбокатионов
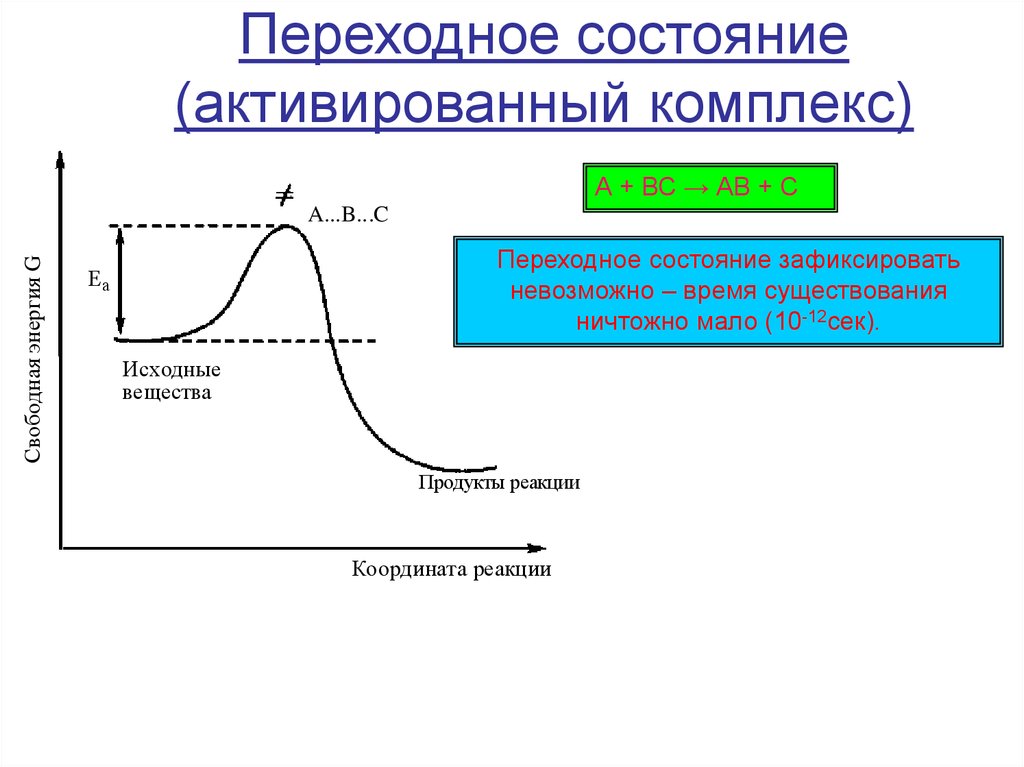
1. Переходное состояние (активированный комплекс)
А + ВС → АВ + ССвободная энергия G
A...B...C
Переходное состояние зафиксировать
невозможно – время существования
ничтожно мало (10-12сек).
Еа
Исходные
вещества
Продукты реакции
Координата реакции
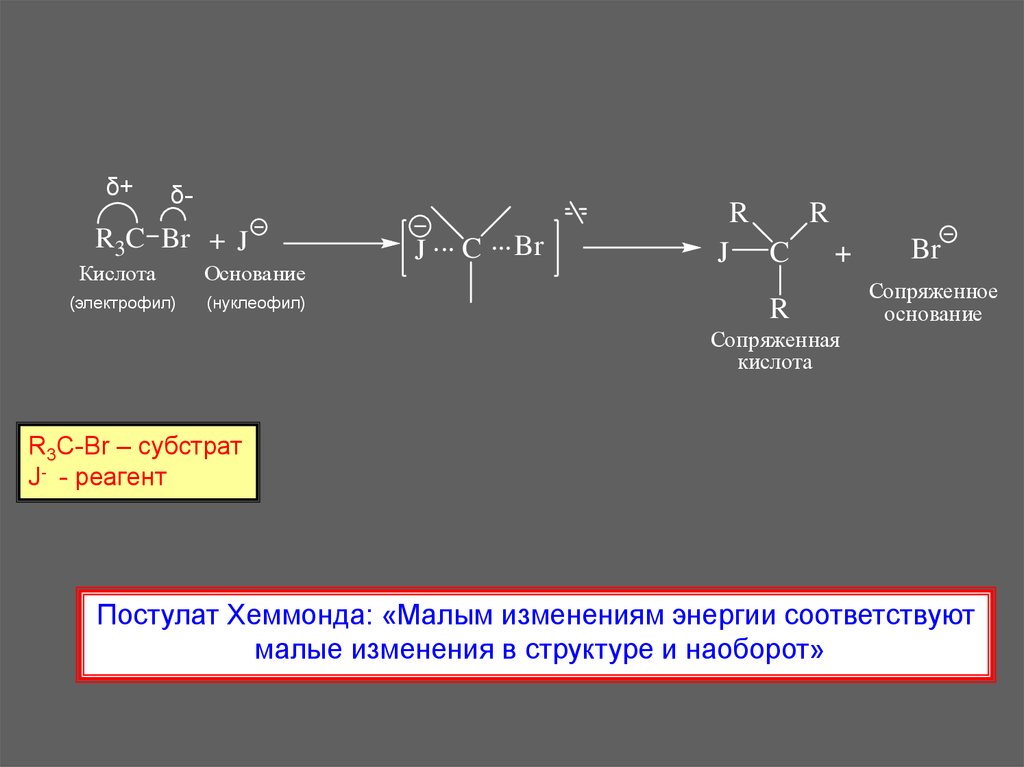
2.
δ+δ-
R3C Br + J
Кислота
(электрофил)
Основание
(нуклеофил)
J ... C ... Br
R
R
J C
+
R
Br
Сопряженное
основание
Сопряженная
кислота
R3C-Br – субстрат
J- - реагент
Постулат Хеммонда: «Малым изменениям энергии соответствуют
малые изменения в структуре и наоборот»
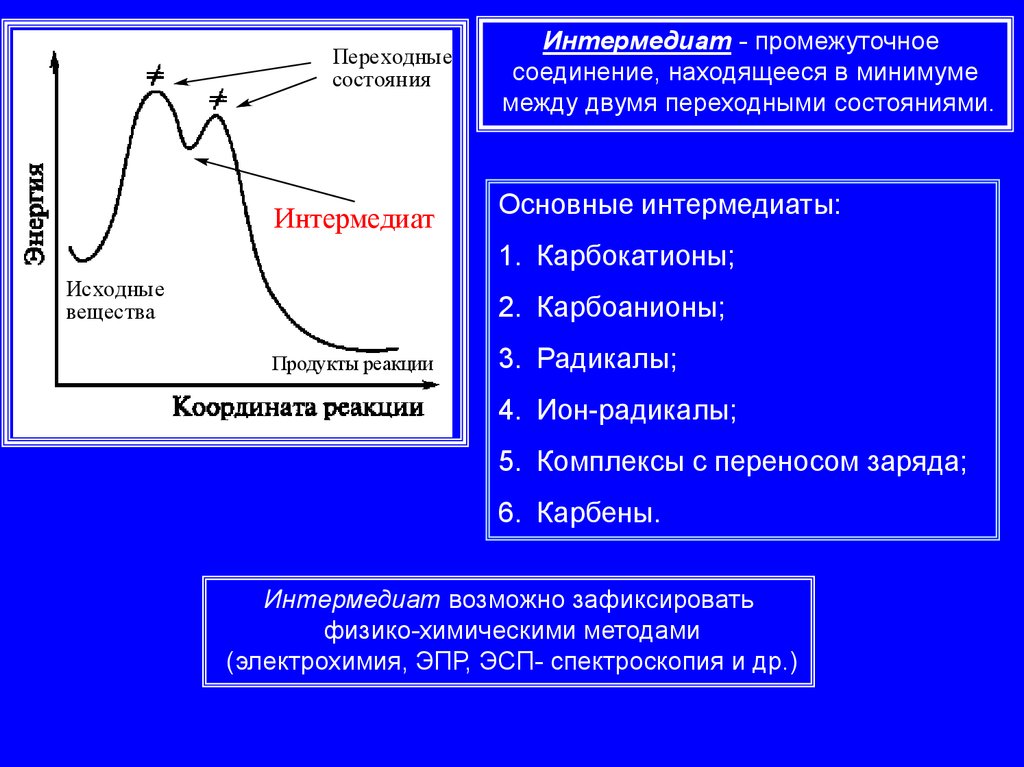
3.
Переходныесостояния
Интермедиат
Интермедиат - промежуточное
соединение, находящееся в минимуме
между двумя переходными состояниями.
Основные интермедиаты:
1. Карбокатионы;
Исходные
вещества
2. Карбоанионы;
Продукты реакции
3. Радикалы;
4. Ион-радикалы;
5. Комплексы с переносом заряда;
6. Карбены.
Интермедиат возможно зафиксировать
физико-химическими методами
(электрохимия, ЭПР, ЭСП- спектроскопия и др.)
4. Электронные эффекты
J – индуктивный эффект (эффект поля) – смещениеэлектронного облака вдоль σ – связи за счет
различия в значениях электроотрицательности
атомов.
-J:→
CH3 → Br
Заместители, притягивающие электроны, обладают
отрицательным индуктивным эффектом:
- J: -NH2; -OH; -SH; -NO2; -CF3; и т.д.
Заместители, отталкивающие электроны, обладают
положительным индуктивным эффектом:
+ J: -Alk (-CH3; -C2H5; -i-pro); -Na; -K; -Li … (CH3←Na)
Индуктивный эффект затухает вдоль поля
5. Мезомерный эффект (эффект сопряжения)
Мезомернымэффектом
(μ)
называется
эффект
перераспределения электронной плотности в молекуле,
происходящий с участием π-орбиталей (часто за счет
перекрывания π-связей c р-орбиталью).
+ μ вызывает повышение электронной плотности на реакционном центре
C
C
C
X
C
X
Донорные заместители: -NH2; -OH; SH; -Alk, -OCH3 …
+μ
- μ понижает электронную плотность на реакционном центре
C
C
C
Y
-μ
C
C
C Y
Акцепторные заместители: -NO2; -CF3;
- SO3H; -CN; -COOH …
6.
Индуктивный и мезомерный эффектыдействуют только в статичной
(НЕреагирующей) молекуле
В динамике имеют место
± J – индуктомерный эффект
± Е – электромерный эффект
Характеризуют поляризуемость молекулы
7. Резонанс
Резонанс- способ описания реальносуществующей делокализации
электронов.
Реальная молекула при чередовании
простых и двойных связей – резонансный гибрид предельных структур
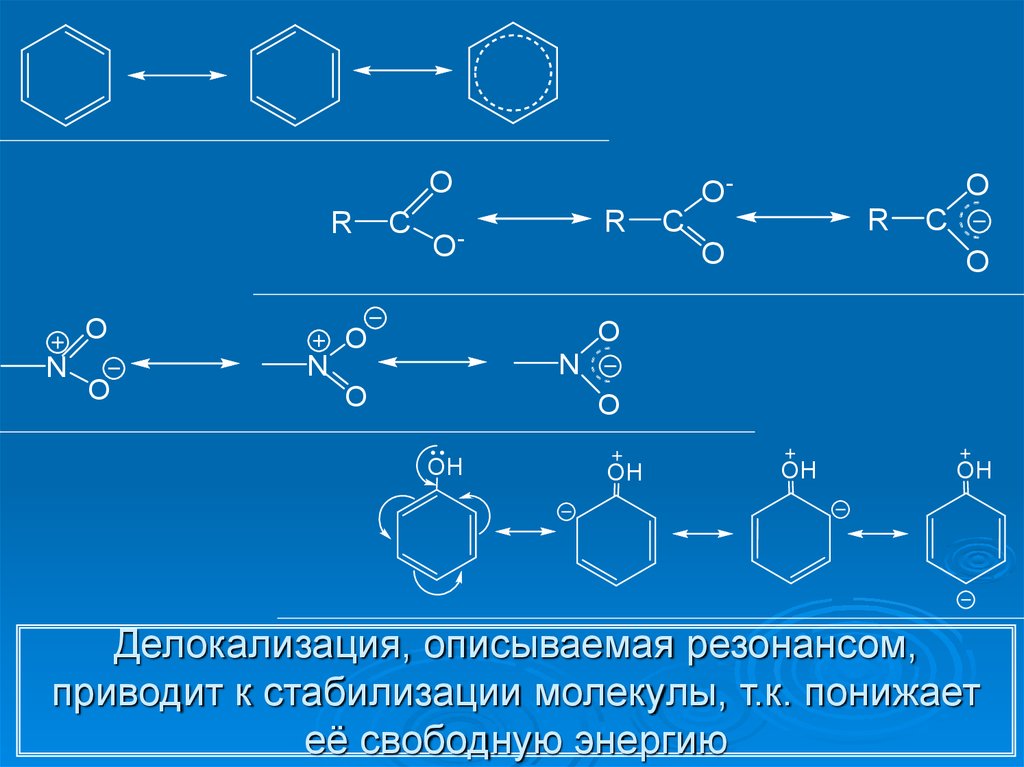
8. Делокализация, описываемая резонансом, приводит к стабилизации молекулы, т.к. понижает её свободную энергию
OR
O
N
O
C
O
OR
O-
R
C
O
C
O
O
O
N
N
O
O
OH
OH
OH
OH
Делокализация, описываемая резонансом,
приводит к стабилизации молекулы, т.к. понижает
её свободную энергию
9. Карбокатионы
Карбкатион – частица, в которой на атомеуглерода сосредоточен положительный заряд
(атом углерода имеет вакантную p-орбиталь)
C
- Сильная кислота Льюиса
SP2 конфигурация, плоский
(R+)
Существование карбокатионов подтверждено в
1928 методом ЯМР и ИК-спектроскопии
C
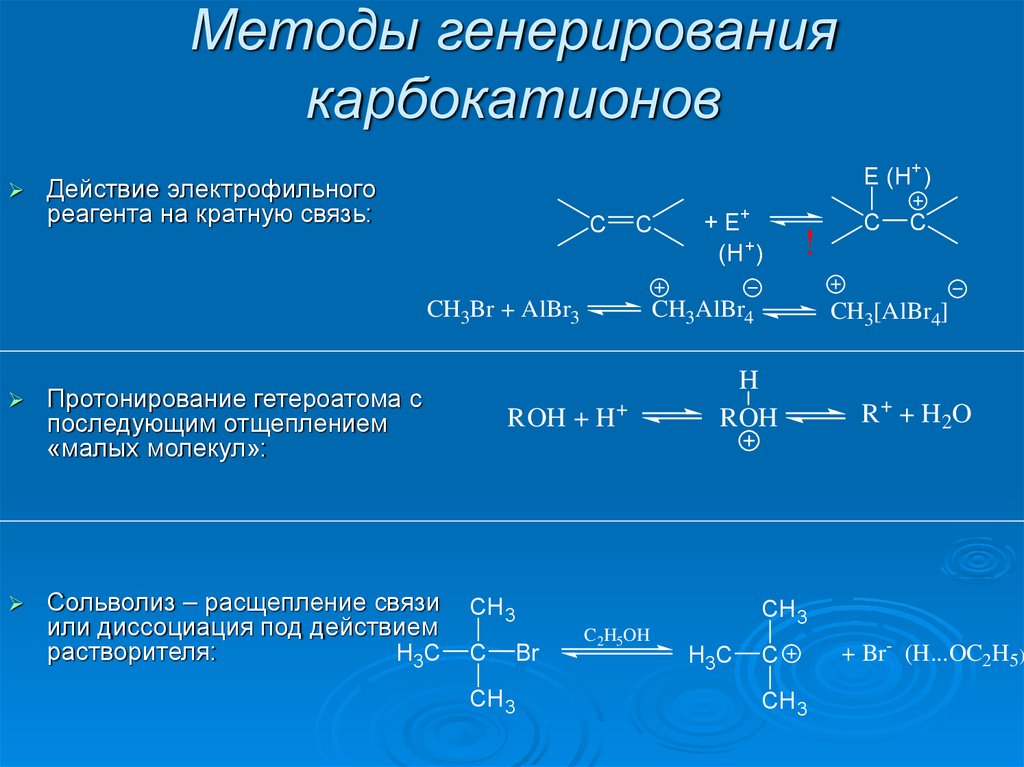
10. Методы генерирования карбокатионов
E (H+)Действие электрофильного
реагента на кратную связь:
C
C
CH3Br + AlBr3
Протонирование гетероатома с
последующим отщеплением
«малых молекул»:
Сольволиз – расщепление связи
или диссоциация под действием
растворителя:
H3C
+ E+
(H +)
CH3AlBr4
ROH + H +
CH 3
C
CH3[AlBr4]
H
ROH
CH 3
C
!
C
R + + H 2O
CH 3
Br
C2H5OH
H3C
C
CH 3
+ Br- (H...OC2H 5)
11.
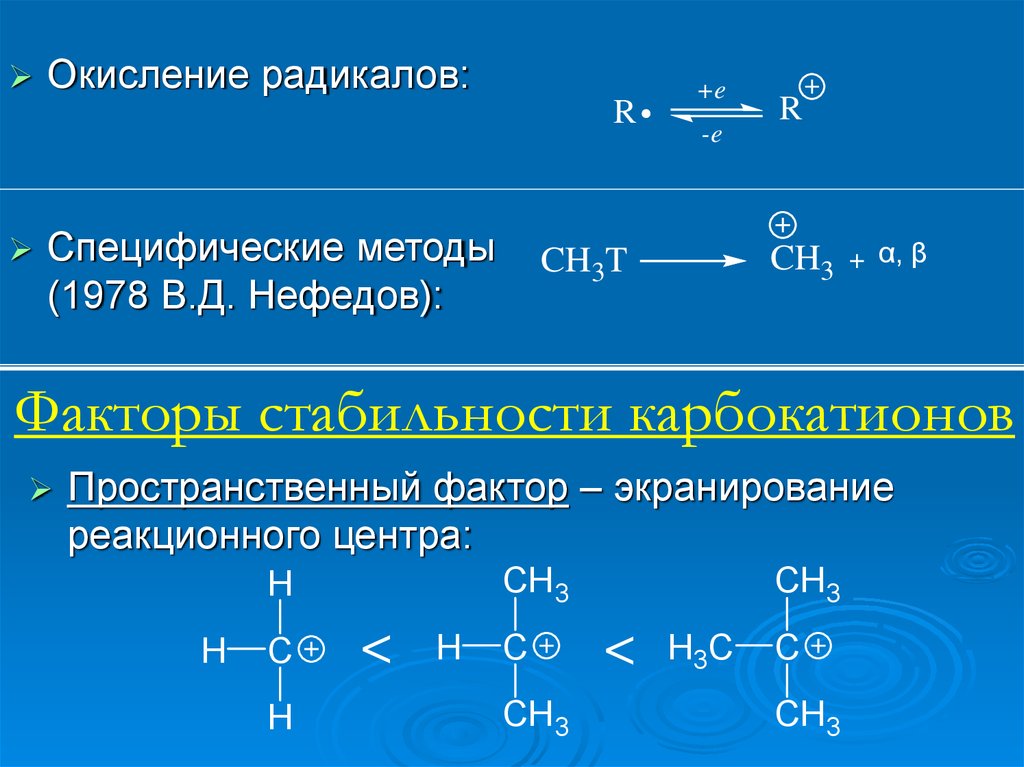
Окисление радикалов:R
Специфические методы
(1978 В.Д. Нефедов):
+e
-e
R
CH3
CH 3T
+ α, β
Факторы стабильности карбокатионов
Пространственный фактор – экранирование
реакционного центра:
CH 3
H
H
C
H
<
H
C
CH 3
CH 3
<
H3C
C
CH 3
12.
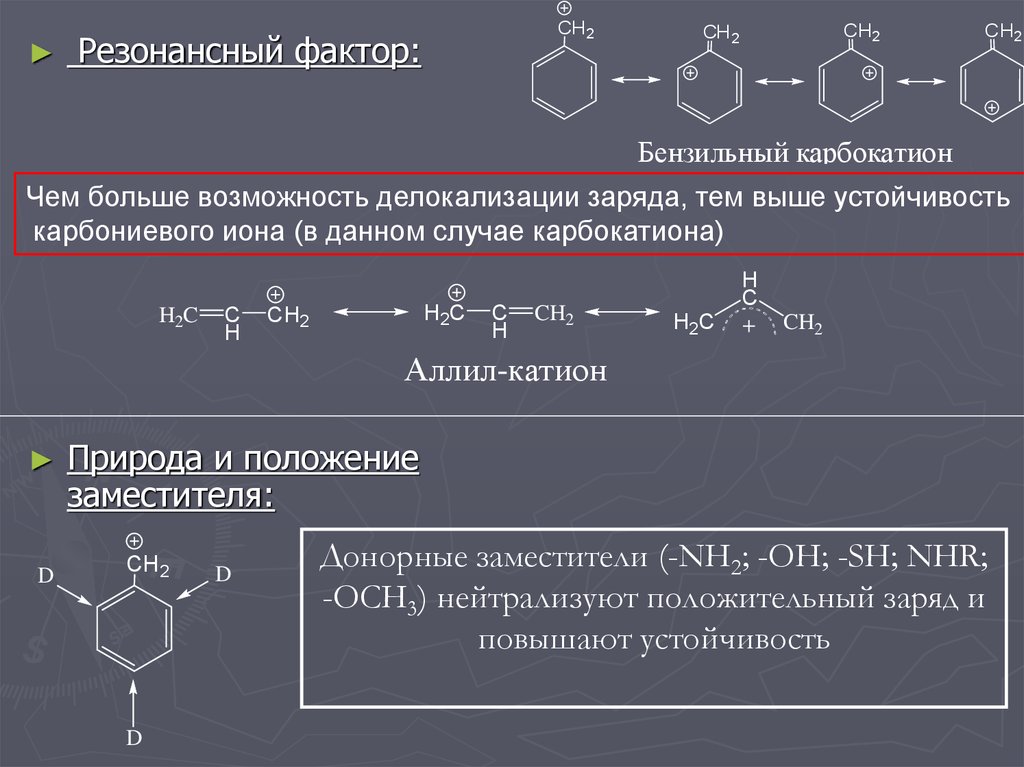
CH 2
Резонансный фактор:
CH2
CH 2
CH2
Бензильный карбокатион
Чем больше возможность делокализации заряда, тем выше устойчивость
карбониевого иона (в данном случае карбокатиона)
H2C
C
H
H2C
CH2
C
H
CH2
H
C
H2C
CH2
Аллил-катион
D
Природа и положение
заместителя:
CH 2
D
D
Донорные заместители (-NH2; -OH; -SH; NHR;
-OCH3) нейтрализуют положительный заряд и
повышают устойчивость
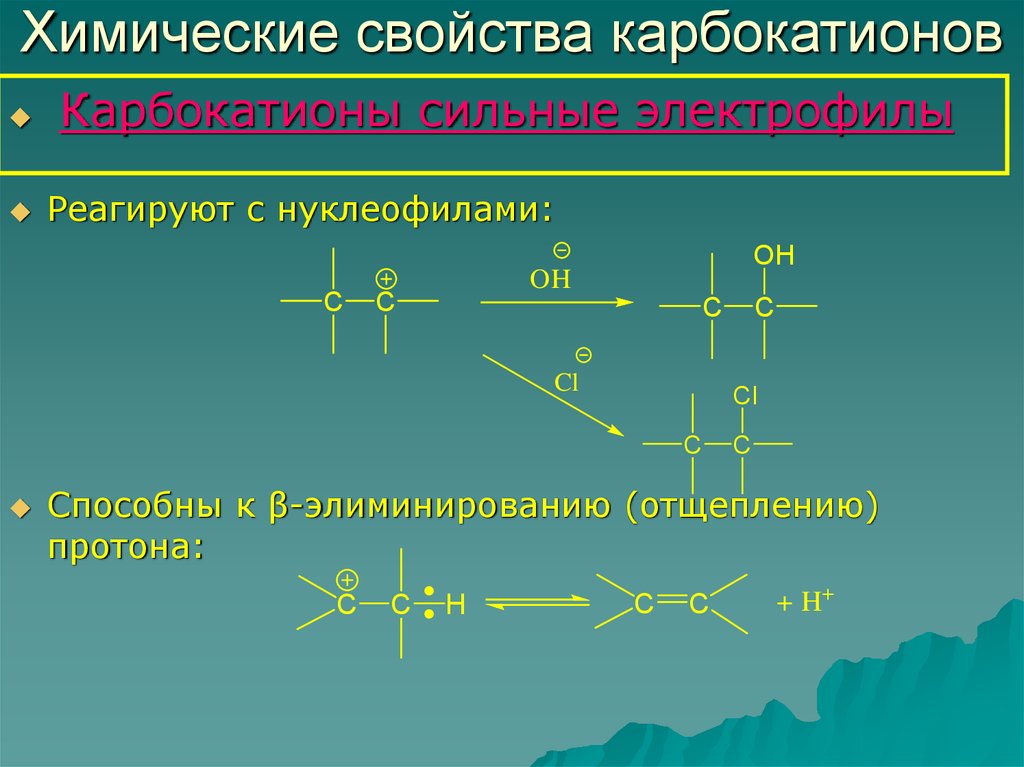
13. Химические свойства карбокатионов
Карбокатионы сильные электрофилыРеагируют с нуклеофилами:
C
OH
OH
C
C
Cl
Cl
C
C
C
Способны к β-элиминированию (отщеплению)
протона:
C
C
H
C
C
+ H+
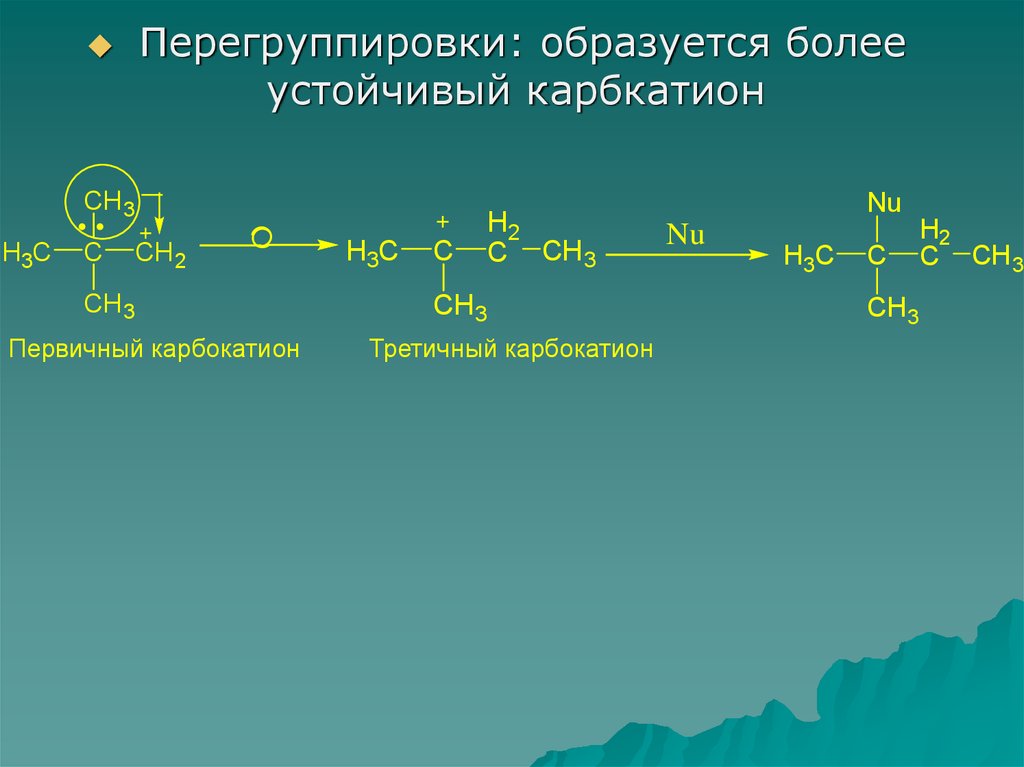
14.
Перегруппировки: образуется болееустойчивый карбкатион
CH 3
H3C
C
CH 2
CH 3
Первичный карбокатион
H3C
C
H2
C CH 3
CH 3
Третичный карбокатион
Nu
Nu
H3C
C
CH 3
H2
C CH 3





 Химия
Химия








