Похожие презентации:
Растворы. Типы растворов. Способы выражения концентрации растворов
1.
Растворы. Типырастворов. Способы
выражения концентрации
растворов.
2.
Раствор - это сложнаяравновесная химическая
система, образованная
растворителем, растворенным
веществом и продуктами их
взаимодействия.
3.
4.
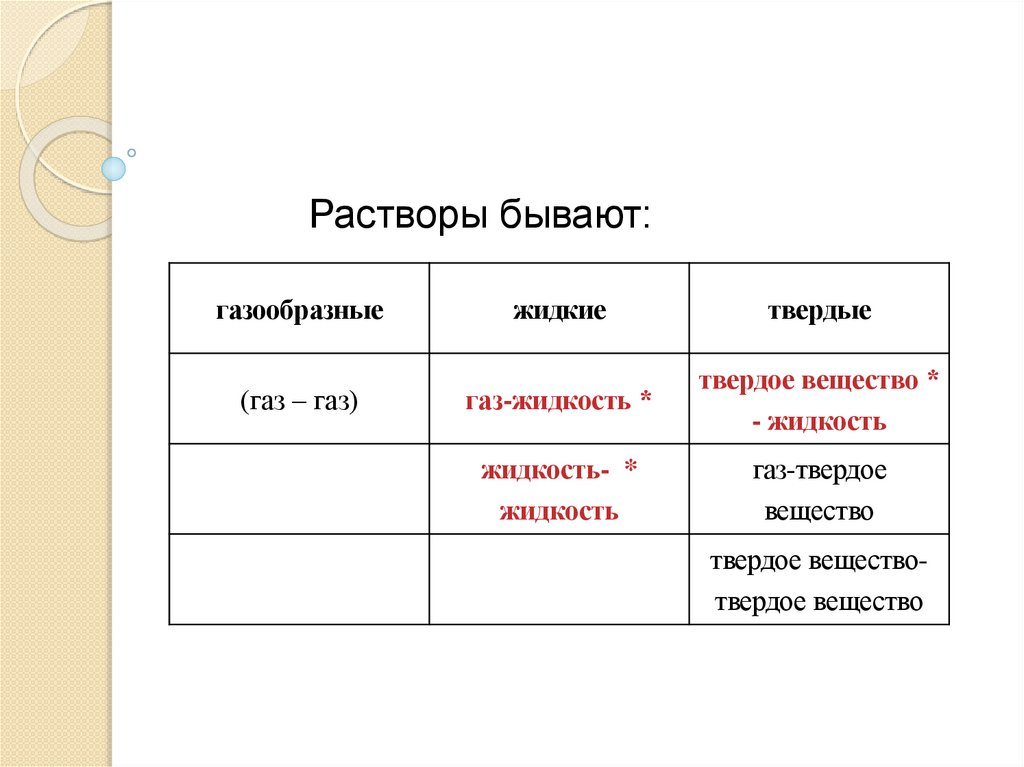
Растворы бывают:газообразные
жидкие
твердые
(газ – газ)
газ-жидкость *
твердое вещество *
- жидкость
жидкость- *
жидкость
газ-твердое
вещество
твердое веществотвердое вещество
5.
Параметры состоянияраствора - температура,
давление и концентрация.
6.
Процесс растворения состоит из:1)
фазового
перехода
(например,
кристалл-жидкость) и
2) процесса сольватации
Тогда:
Н = Нф.п.+ Нсольв.
S = S ф.п.+ S сольв
Нф.п обычно больше нуля (растворение
твердых веществ), но может быть близко к нулю
(газы в жидкостях).
7.
Если Н = 0 и V = 0, такойраствор называется идеальным.
Например, две жидкости,
молекулы которых неполярны и
схожи между собой (бензол и
толуол)
8.
Растворимость газов в жидкостях.Нф.п = 0. Следовательно Н 0,
растворение газа в жидкости - процесс
экзотермический, с ростом
температуры растворимость
уменьшается (принцип Ле Шателье).
Растворимость газов пропорциональна
их парциальным давлениям - закон
Генри.
9.
В разбавленных растворах Н 0 и V 0 .Они приближаются к идеальным
растворам. Частицы растворенного
вещества далеко друг от друга и
растворитель практически не меняет
своих свойств.
10.
1.Массовая доляОтношение массы растворенного
вещества к массе раствора, %
W
m раств.в ва
m раствора
100%
11.
2. Молярная концентрацияОтношение количества растворенного
вещества к объему раствора, моль/л
CM
V
m раств.в в а
M раств.в в а V
12.
3. Эквивалентная концентрация(нормальная концентрация)
Отношение массы растворенного
вещества к эквивалентной массе
растворенного вещества и объему
раствора, моль/л
CN
m раств.в в а
Э раств.в в а V
13.
4. Моляльная концентрация илимоляльность
Отношение количества
растворенного вещества к массе
растворителя, моль/кг
m раст ля
14.
где υ=m/Mmр-ля = mр-ра – mраств.в-ва













 Химия
Химия








