Похожие презентации:
Задачи и методы количественного анализа. Кислотно-основное титрование
1. ЛЕКЦИЯ 7 Задачи и методы количественного анализа. Кислотно-основное титрование
2. План
7.1 Общая характеристика методовколичественного анализа
7.2 Основные понятия объемного анализа
7.3 Классификация методов
титриметрического анализа
7.4 Обработка результатов титриметрического
анализа
7.5 Теоретические основы кислотно-основного
титрования
7.6 Кривые титрования
7.7 Применение метода кислотно-основного
титрования для медико-биологических
исследований
3. 7.1 Аналитическая химия – наука о методах определения качественного и количественного состава веществ и материалов,
идентификации иустановления структуры
химических соединений.
4. Методы количественного анализа: 1) химические (грави- и титриметрические) 2) инструмен- тальные (физические и
Методыколичественного анализа:
1) химические (грави- и
титриметрические)
2) инструментальные (физические и
физико-химические)
5. Гравиметрические методы по способу получения продукта реакции делят на Ø химиогравиметрические – измерение массы продукта
Гравиметрическиеметоды
по
способу
получения
продукта
реакции
делят
на
химиогравиметрические –
измерение
массы продукта хим.
реакции;
электрогравиметрические –
измерение
массы
продукта
электрохимической
реакции;
термогравиметрические –
измерение
массы
образца
при
термическом
воздействии.
6. 7.2
Титриметрические(объемные) методы анализа
основаны
на
измерении
количества
реагента
(R),
израсходованного
на
взаимодействие
с
определенным
веществом
(А):
7. Раствор с точно известной концентрацией называется титрантом или стандартным раствором. Титрование – это процесс постепен-ного
концентрацией называетсятитрантом или стандартным
раствором.
Титрование – это процесс
постепен-ного контролируемого
добавления титранта к
определенному объему раствора
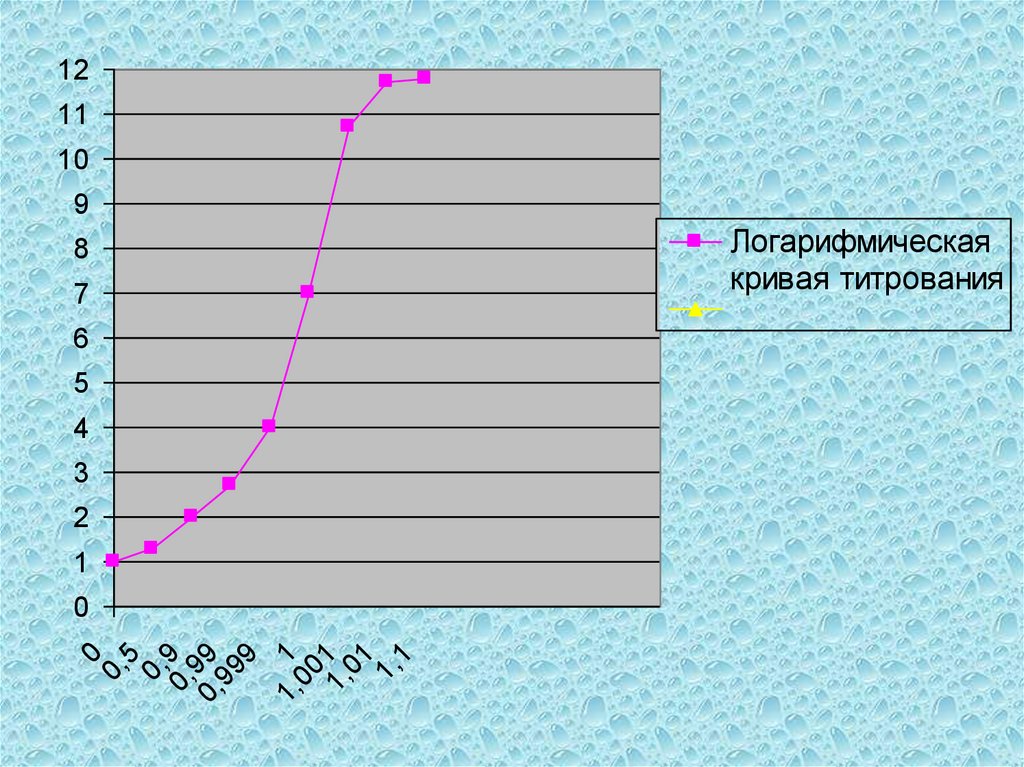
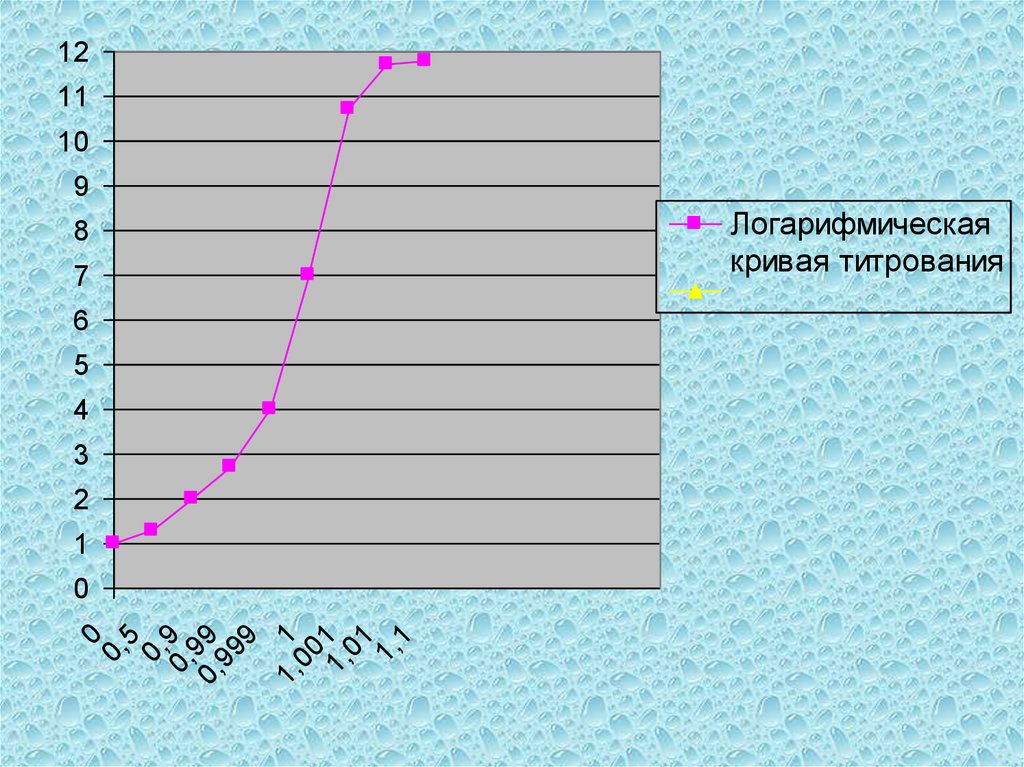
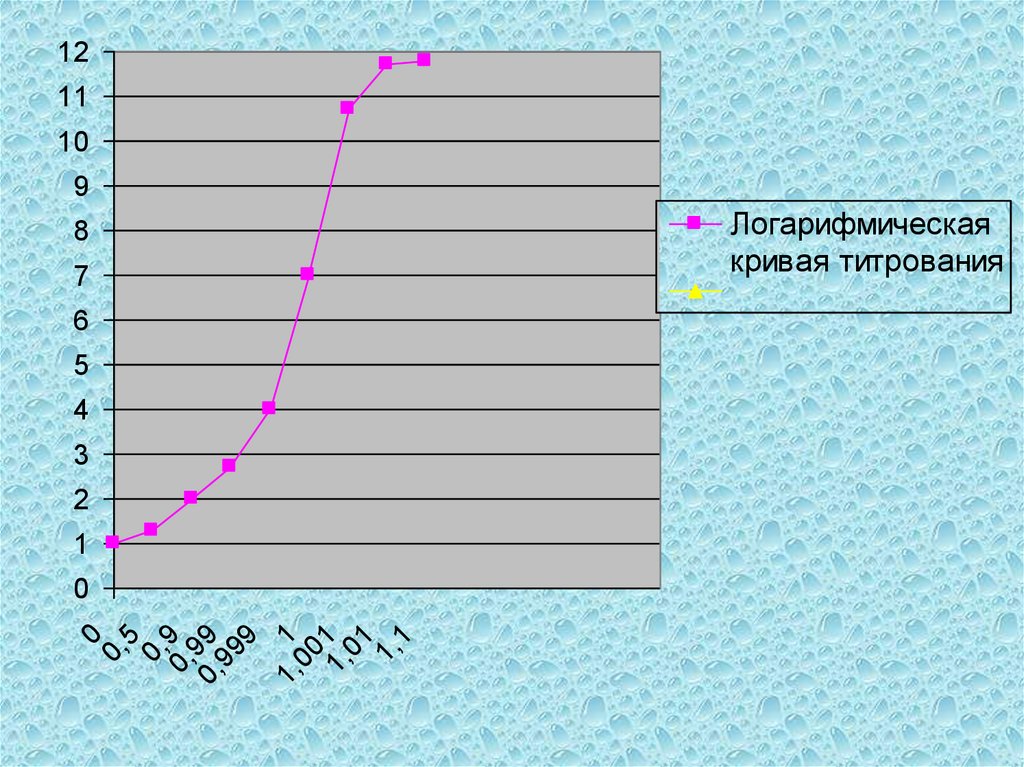
анализируемого вещества до
установления точки
эквивалентности.
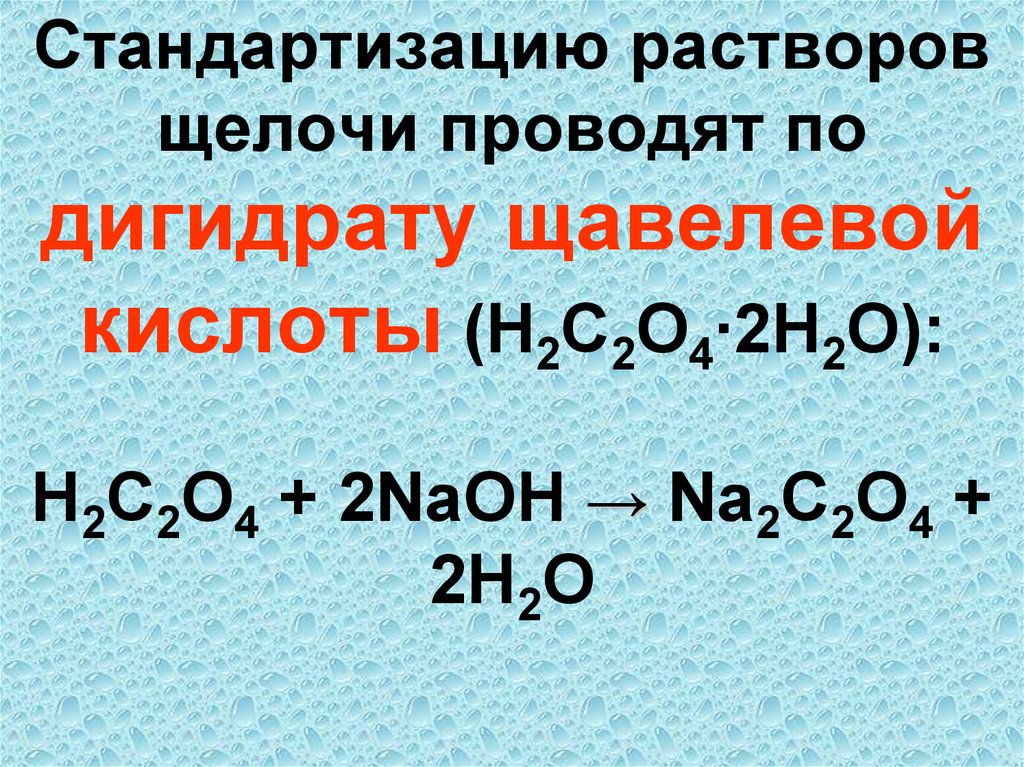
8. Точка эквивалентности – это момент завершения реакции между титрантом и анализируемым веществом, когда νэкв(R) = νэкв(А)
9. По способу приготовления различают первичные и вторичные стандартные растворы
10. Зная массу вещества (m) и объем полученного раствора (V), вычисляют его титр (Т): Т(Х) = m(Х)/V, г/мл
11. Требования, предъявляемые к первичным стандартам: 1) вещество должно быть химически чистым (содержание примесей не более
Требования,предъявляемые
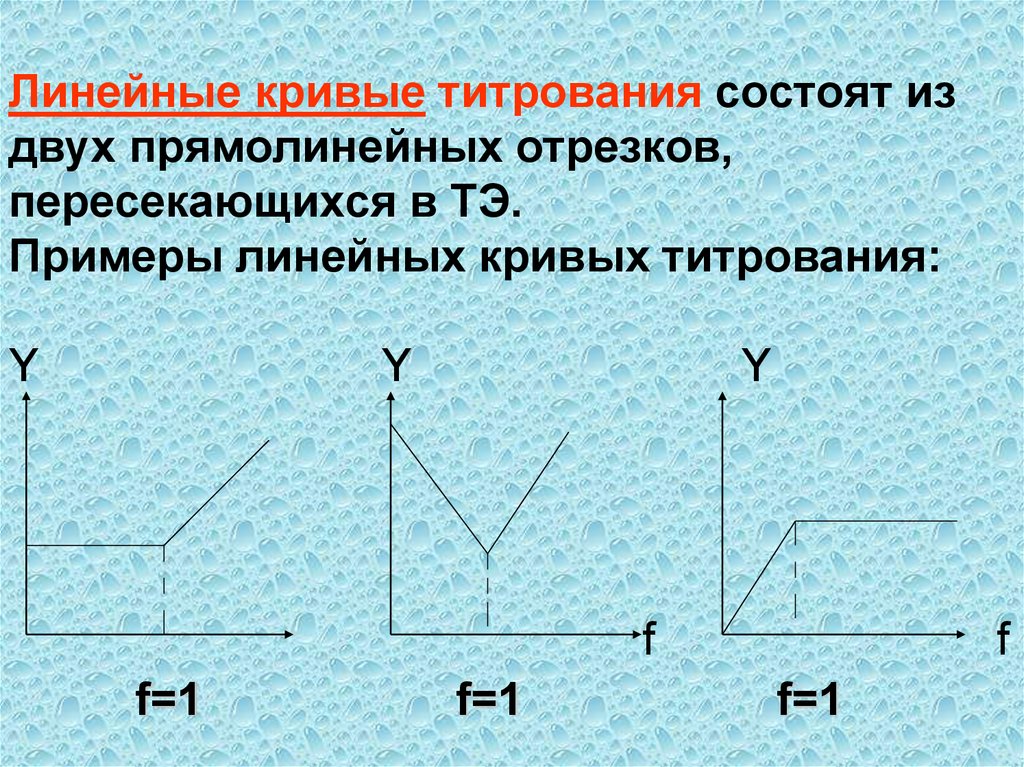
к
первичным
стандартам:
1)
вещество должно быть
химически
чистым
(содержание
примесей
не
более
0,05-0,1%);
2)
вещество должно строго
соответствовать
формуле;
12.
3) вещество должно бытьустойчивым при хранении, как
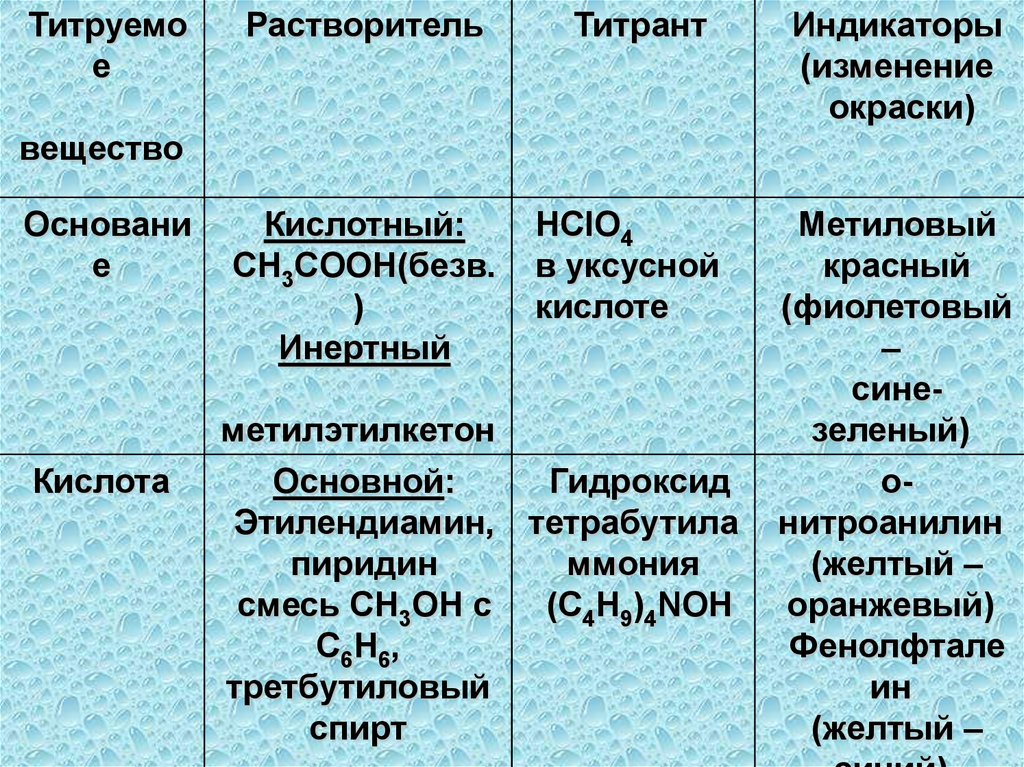
в твердом виде, так и в
растворе;
4) вещество должно
обладать по возможности
большой молекулярной
массой, чтобы уменьшить
погрешности при взвешивании.
13. Титр рабочего раствора рассчитывают следующим образом:
Cн ( J ) M Э ( J )T (J )
1000
14.
При массовых определенияхв большом количестве
проб в расчетах
используют титр по
определяемому
веществу. Это количество
г определяемого вещества,
эквивалентное 1 мл
стандартного раствора.
15. Например: T (AgNO3/Clˉ) = 0,0076 г/мл. Это означает, что 1 мл раствора AgNO3 соответствует 0,0076 г Clˉ. T (HCl/CaCO3) = 0,008
г/мл – 1мл раствора HCl реагирует с
0,008 г CaCO3.
16. Пример 1 Из 2,5 г натрий карбоната приготовлено 500 мл раствора. Рассчитайте для этого раствора нормальную концентрацию,титр и
титр по НСl.m( Na2CO3 ) 2,5
Т ( Na2CO3 )
0,005г / мл
V ( Na2CO3 ) 500
17.
1000 T ( Na2CO3 ) 1000 0,005С ( Na CO )
н
2 3
106 0,5
М э ( Na2CO3 )
0,0943 моль / л
C H ( Na2CO3 ) M э ( HCl )
Т ( Na CO / HCl )
2 3
1000
0,0943 36,5
0,0034г / мл
1000
18.
7.3I. По типу используемых реакций
Метод титрования, Подгрупп
тип реакции
ы
методов
1.Кислотноосновное,
р. нейтрализации:
Н+ + ОНˉ ↔ Н2О
Н3О+ + ОНˉ↔ 2 Н2О
Титрант
Ацидимет- HCl
рия
(H2SO4)
Алкалимет NaOH
-рия
(KOH)
Исследуе
-мые
вещества
Основани
я и соли
слабых
кислот.
Кислоты
и
соли
слабых
основани
19.
2.Оксидиметрическое, ОВРОх1 + Red2 ↔
Red1 + Ox2
Пермангана
KMnO4
-тометрия
Иодометри I ,Na S O
2
2 2 3
я
Дихромато- K2Cr2O7
метрия
KBrO3
Броматометрия
KIO3
Иодатометрия
Ce(SO4)2
Цериметри
NH4VO3
я
ВанадатоTiCl3
метрия
Титанометрия
Red, Ox
Ox, Red
Red
Red
Red
Red
Red
Ox
20.
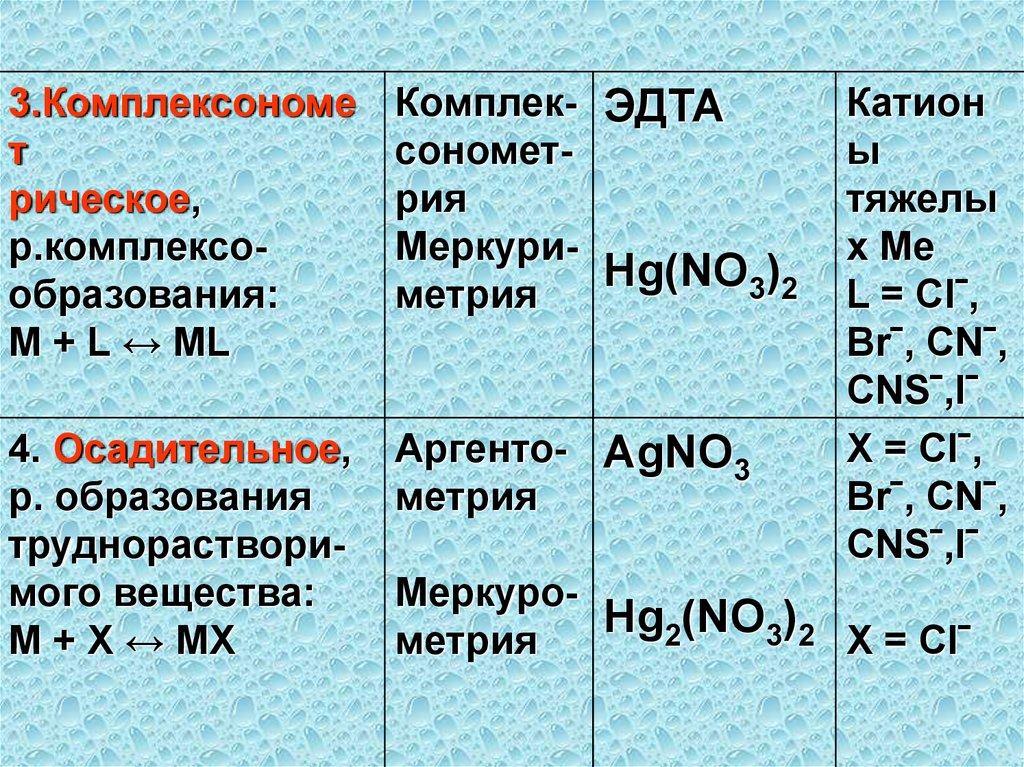
3.Комплексономет
рическое,
р.комплексообразования:
M + L ↔ ML
Комплек- ЭДТА
сонометрия
МеркуриHg(NO
)
3
2
метрия
4. Осадительное,
р. образования
труднорастворимого вещества:
М + Х ↔ МХ
Аргенто- AgNO3
метрия
Катион
ы
тяжелы
х Ме
L = Clˉ,
Brˉ, CNˉ,
CNSˉ,Iˉ
X = Clˉ,
Brˉ, CNˉ,
CNSˉ,Iˉ
МеркуроHg
(NO
)
2
3
2 X = Clˉ
метрия
21. Требования, предъявляемые к реакциям, используемым в титриметрическом анализе: 1. Реакция должна быть практически необратимой
(К > 108).2. Реакция должна протекать в
строгом соответствии с
уравнением реакции, без
побочных продуктов.
22. 3. Реакция должна протекать достаточно быстро. 4. Должен существовать надежный способ фиксирования точки эквивалентности (ТЭ).
23. Экспериментально конец титрования устанавливается по изменению цвета индикатора (химический метод) или физико-химическими
Экспериментально конецтитрования устанавливается по
изменению цвета индикатора
(химический метод) или физикохимическими методами
(потенциометрически, фотокалориметрически и т.д.). Эта точка, называемая конечной точкой титрования (КТТ), в общем случае не
совпадает с теоретически
рассчитанной ТЭ.
24.
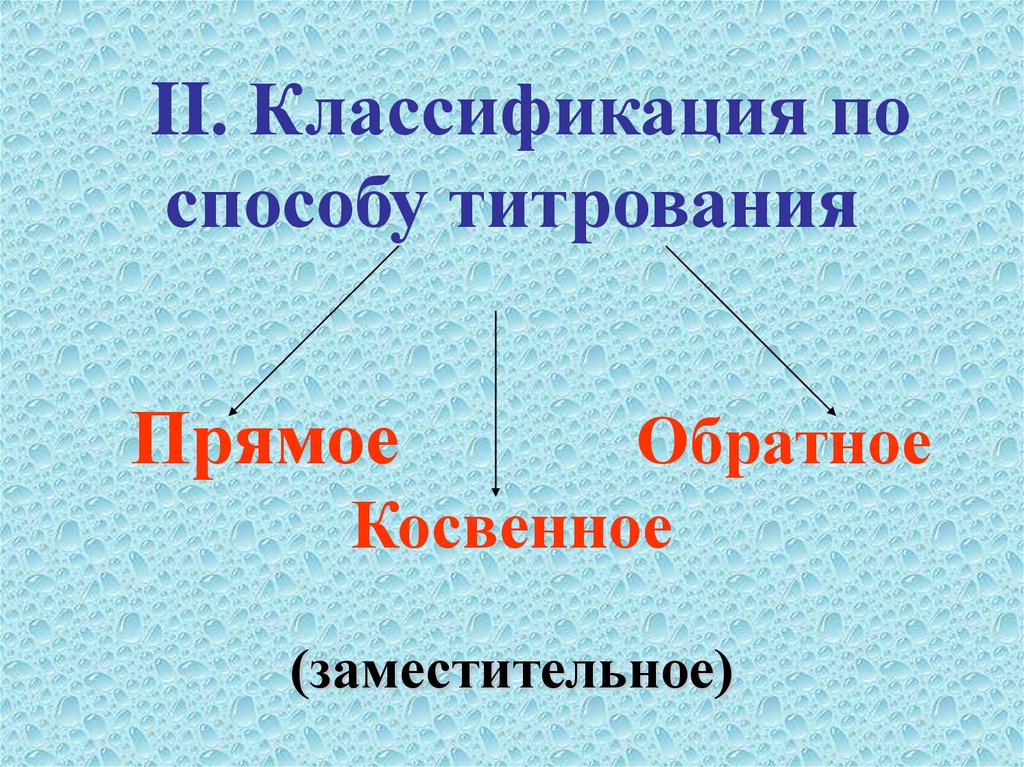
II. Классификация поспособу титрования
Прямое
Обратное
Косвенное
(заместительное)
25. Сущность прямого титрования заключается в постепенном прибавлении титранта непосред-ственно к раствору анализируемого вещества
Сущность прямого титрованиязаключается в постепенном
прибавлении титранта непосредственно к раствору
анализируемого вещества до
достижения точки
эквивалентности (ТЭ).
νэкв.(анал.в-ва) = νэкв. (титранта)
Сн(Х)V(Х) = Cн(Т)V(Т)
26. Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются побочные эффекты, можно использовать обратное
титрование.27. Его сущность заключается в добавлении к анализируемому раствору точно известного избытка титранта Т1 с Сн1 с последующим
определениемего остатка, не вступившего в
реакцию, с помощью второго
титранта Т2 с Сн2. Этот метод
часто называют титрованием
по остатку
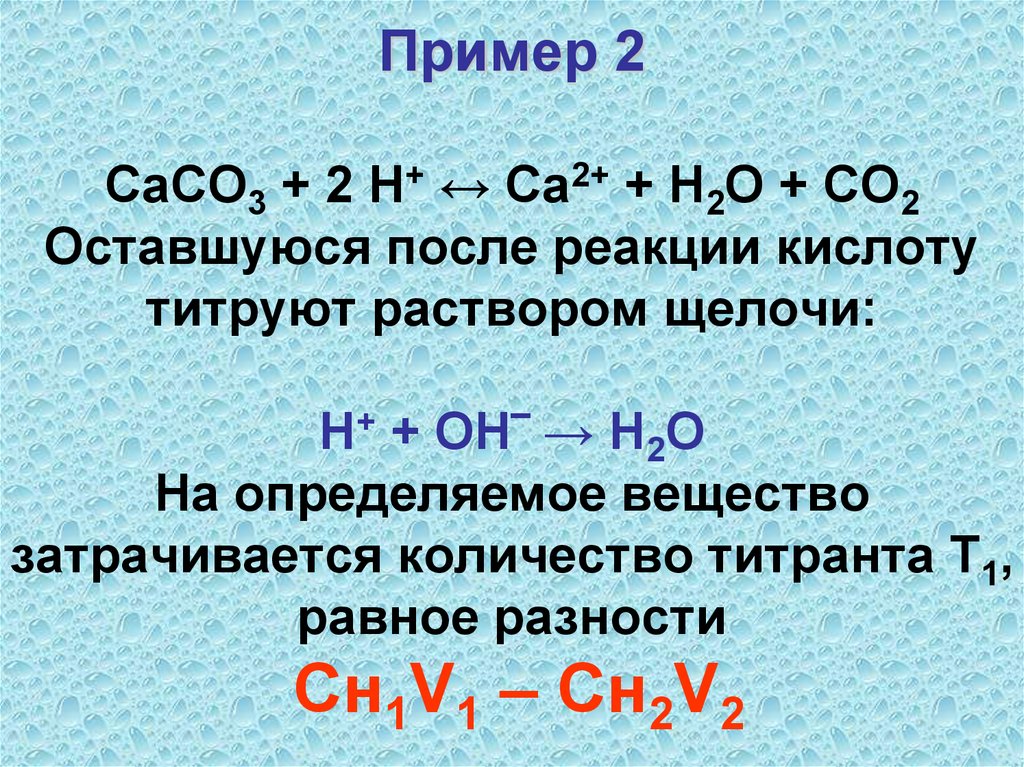
28. Пример 2 CaCO3 + 2 H+ ↔ Ca2+ + H2O + CO2 Оставшуюся после реакции кислоту титруют раствором щелочи: Н+ + ОН‾ → Н2О На
определяемое веществозатрачивается количество титранта Т1,
равное разности
Cн1V1 – Cн2V2
29. Пример 3 MnO2 + 2 Fe2+ + 4H+ → Mn2+ + 2 Fe3+ + 2 H2O Прямое титрование MnO2 FeSO4 невоз-можно из-за малой скорости реакции,
Пример 3MnO2 + 2 Fe2+ + 4H+ → Mn2+ + 2 Fe3+ + 2 H2O
Прямое титрование MnO2 FeSO4 невозможно из-за малой скорости реакции,
поэтому к навеске MnO2 добавляют
избыток раствора FeSO4 и нагревают до
полного завершения реакции. Непрореагировавший FeSO4 оттитровывают
стандартным раствором K2Cr2O7 (Т2):
Cr2O72‾ + 6 Fe2+ + 14H+→2Cr3+ + 6Fe3+ + 7H2O
30. Сущность косвенного титрования заключается в добавлении к анализируемому веществу избытка вспомогательного реагента,
вступающего с ним в реакцию,с последующим определением
продукта реакции подходящим
титрантом.
31. Например, в иодометрии взаимодействие дихромат- и тиосульфат-ионов протекает нестехиометрично, поэтому к раствору, содержащему
Cr2O72‾, добавляют KI,который реагирует с ним
стехиометрично:
32. Cr2O72‾ + 6I‾ + 14H+ → 2Cr3+ + 3I2+7H2O а затем образовавшийся I2 титруют S2O32‾ (натрия тиосульфатом): I2 + 2 S2O32‾ ↔ 2 I‾ +
Cr2O72‾ + 6I‾ + 14H+ → 2Cr3+ +3I2+7H2O
а затем образовавшийся
2‾
I2 титруют S2O3 (натрия
тиосульфатом):
2‾
2
I2 + 2 S2O3 ↔ 2 I‾ + S4O6 ‾
33. В этом случае по закону эквивалентов можно записать: νэкв.(Cr2O72‾) = νэкв.(I2) = νэкв.(S2O32‾) Cн·V (Cr2O72‾) = Cн·V (S2O32‾)
34. III. По способу проведения анализа: а) метод пипетирования заключа-ется в титровании равных порций исследуемого раствора
III. По способу проведенияанализа:
а) метод пипетирования заключается в титровании равных порций
исследуемого раствора (аликвот),
отбираемых пипеткой из мерной
колбы объемом V0, в которой растворена навеска исследуемого
вещества массой m.
35. Масса вещества в аликвоте (mA): mA = Cн · Vср.т · Mэ ·V0 ·10‾3/ Vх для прямого титрования Сн(А) = (Cн(Т)∙Vср.(Т))/V(A) ωA = mA
Масса вещества в аликвоте (mA):mA = Cн · Vср.т · Mэ ·V0
3
·10‾ /
для прямого титрования
Vх
Сн(А) = (Cн(Т)∙Vср.(Т))/V(A)
ωA = mA ∙ 100% / m
36. б) метод отдельных навесок заключается в том, что несколько близких по величине навесок анализируемого вещества массами m1, m2
и т.д.,растворяют в произвольных
объемах растворителя и
титруют получаемые при этом
растворы.
37. В этом случае количество вещества в каждой навеске равно CнVТ и
1 Cн1 VT 1 Cн2 VT 23
wA
M Э10
n m1
m2
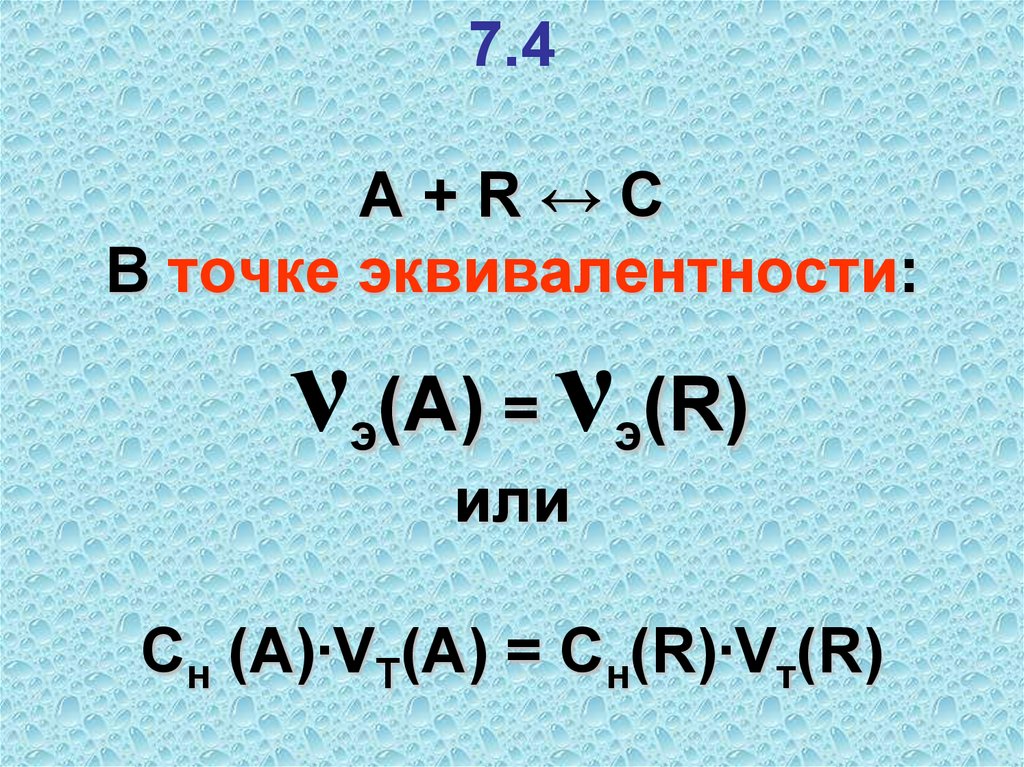
38. 7.4 A + R ↔ C В точке эквивалентности: νэ(А) = νэ(R) или Cн (А)∙VТ(А) = Cн(R)∙Vт(R)
7.4A+R↔C
В точке эквивалентности:
ν (А) = ν (R)
э
э
или
Cн (А)∙VТ(А) = Cн(R)∙Vт(R)
39. В точке эквивалентности объемы растворов обратно пропорциональны их нормальностям:
VT ( A) C н ( R)VT ( R) C н ( А)
40. Массу в аликвоте анализируемого вещества определяют так:
Сн ( R) VT ( R)m( A)
M ( A) f э ( А)
1000
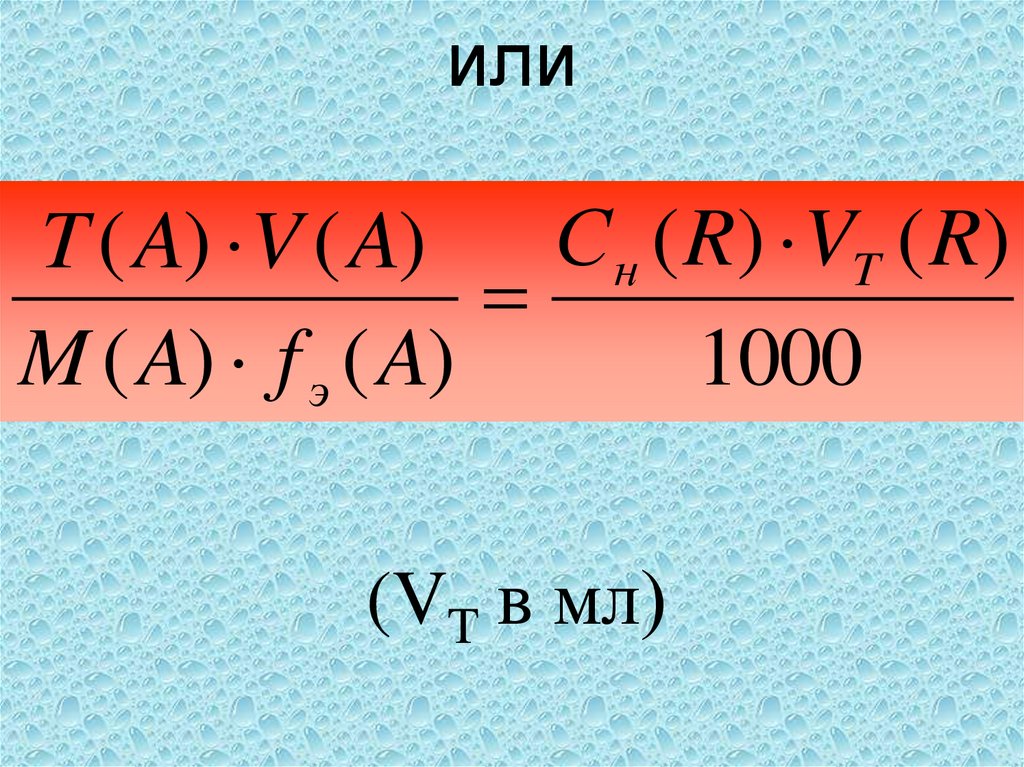
41. или
С н ( R) VT ( R)T ( A) V ( A)
M ( A) f э ( A)
1000
(VT в мл)
42. Эквивалентом называется некая реальная или условная частица, которая может присоединять или высвобождать один ион водорода в
кислотноосновных реакциях или одинэлектрон в окислительновосстановительных
реакциях.
43. Закон эквивалентов: вещества взаимодействуют друг с другом и образуются в результате химических реакций в количествах,
пропорциональных ихэквивалентам:
А+В→С+D
ν (A) = ν (B) = ν (C) = ν (D)
э
э
э
э
44. Соответственно массы (объемы) реагирующих веществ и продуктов их взаимодействия пропорциональны их эквивалентным массам
(объемам):m( A)
m( B )
m(C )
m( D )
M Э ( A) M Э ( B) M Э (С ) M Э ( D)
45. Если реакция протекает в газовой фазе, то для А(г) +В(г) → С(г) + Д(г) νэ(A) = νэ(B) = νэ(C) = νэ(D)
Если реакция протекает вгазовой фазе, то для
А(г) +В(г) → С(г) + Д(г)
νэ(A) = νэ(B) = νэ(C) =
ν (D)
э
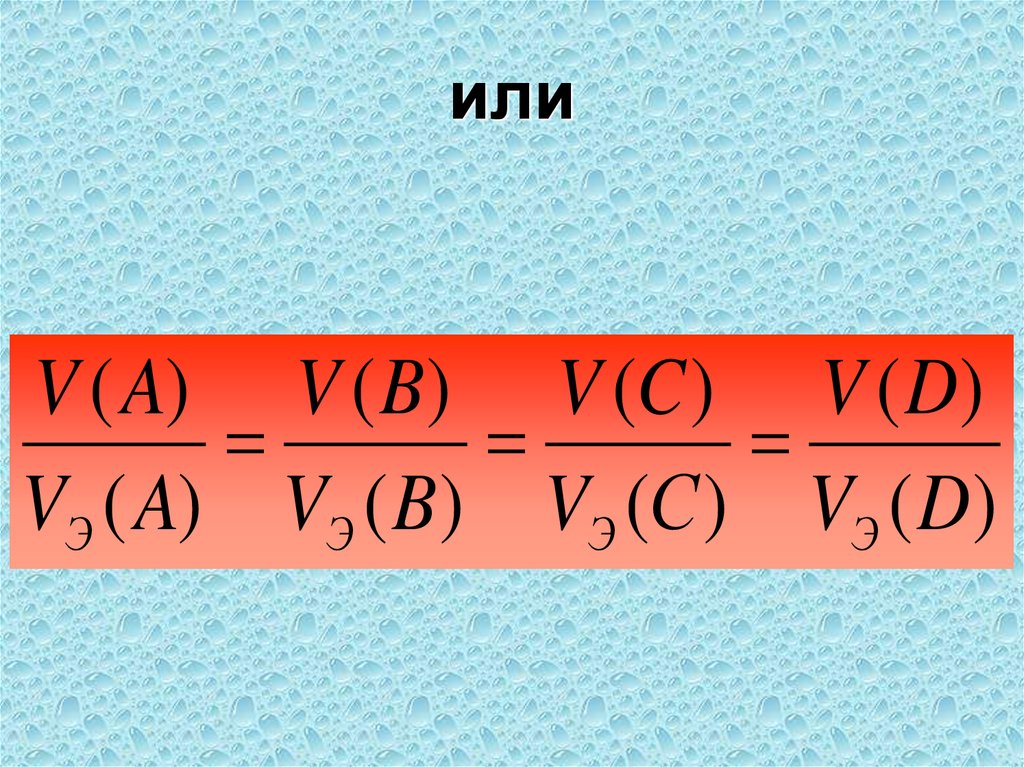
46. или
V ( A) V ( B) V (C ) V ( D)VЭ ( A) VЭ ( B) VЭ (С ) VЭ ( D)
47. Фактор эквивалентности fЭ(Х) – число, показывающее, какая доля реальной частицы вещества (Х) эквивалентна одному иону водорода
вданной кислотно-основной
реакции или одном электрону в
окислительновосстановительной реакции.
48. Это величина безразмерная: где Z – суммарный заряд обменивающихся в молекуле ионов для обменных реакций или число электронов,
принятыхили
отданных
молекулой (атомом) вещества
для ОВР.
1
fЭ
Z
49. одного и того же вещества может иметь разные значения в разных реакциях.
fЭ 1f Э одного и того же вещества
может иметь разные
значения в разных
реакциях.
M Э (Х ) M (X ) fЭ (Х )
50. Пример 4 Определить m(Na2CO3) в 250,00 мл раствора, если на титрование 25,00 мл этого раствора с индикатором метиловым
оранжевымизрасходовано 20,20 мл
раствора HCl с концентрацией
0,1010 моль/л
51. Na2CO3+2HCl → 2NaCl + H2O + +CO2↑ νэ(Na2CO3) = νэ(HCl) Cн (Na2CO3)∙VТ(Na2CO3) = Cн(HCl)∙VT(HCl)
Na2CO3+2HCl → 2NaCl + H2O ++CO2↑
ν (Na CO ) = ν (HCl)
э
2
3
э
Cн (Na2CO3)∙VТ(Na2CO3) =
Cн(HCl)∙VT(HCl)
52.
С ( Na 2 CO3 )н
C ( HCl ) V ( HCl )
н
T
20, 20 0,1010
25, 00
V ( Na 2 CO3 )
T
0, 0816моль / л
53.
m( Na2CO3 ) 1000Cн ( Na2CO3 )
M ( Na2CO3 ) f Э ( Na2CO3 ) V
m (Na2CO3) =
= Cн(Na2CO3)∙М(Na2CO3)∙fЭ∙V/1000 =
= 0,0816∙106∙0,5∙250/1000 =
= 1,081 г
54.
Пример 5 ( обратное титрование)2,000 г образца соли аммония
растворили в Н2О и получили 100,0 мл
раствора. К аликвоте полученного
раствора объемом 10,00 мл добавили
20,00 мл раствора КОН с концентрацией
0,0900 моль/л, и на титрование
непрореагировавшего избытка щелочи
пошло 8,55 мл соляной кислоты с
молярной концентрацией 0,1000 моль/л.
Рассчитайте ω(NH3) в образце.
55.
1) NH4X + KOH → NH3 + H2O + KX2) KOH + HCl → KCl + H2O
56.
По реакции 1:nэ1(KOH) = nэ(KOH) –
nэ2(KOH) = Cн(KOH)∙V(KOH) –
Cн2(KOH)∙V2(KOH)
По реакции 2:
Cн2(KOH)∙V2(KOH) =
= Cн (HCl)∙V(HCl)
57.
Cн ( HCl ) V ( HCl ) 8,55 0,1000V2 ( KOH )
9,5 мл
Cн ( KOH )
0,0900
По реакции 1:
Cн ( KOH ) V ( KOH ) m( NH 3 )
1000
Mэ( NH 3 )
58.
Cн ( KOH ) V ( KOH ) M Э ( NH 3 )m (NH3) =
1000
(20 0,09 9,5 0,09) 100 17
1000
0,16065г
0,16065
( NH 3 )
100% 8,03%
2
59. 7.5 В основе метода реакция нейтрализации: Н3О+ + ОН‾ ↔ 2 Н2О Согласно протолитической теории: АН + В ↔ А‾ + ВН+ к-та1 осн2
7.5В основе метода реакция
нейтрализации:
Н3О+ + ОН‾ ↔ 2 Н2О
Согласно протолитической
теории:
+
АН + В ↔ А‾ + ВН
к-та1 осн2 осн1 к-та2
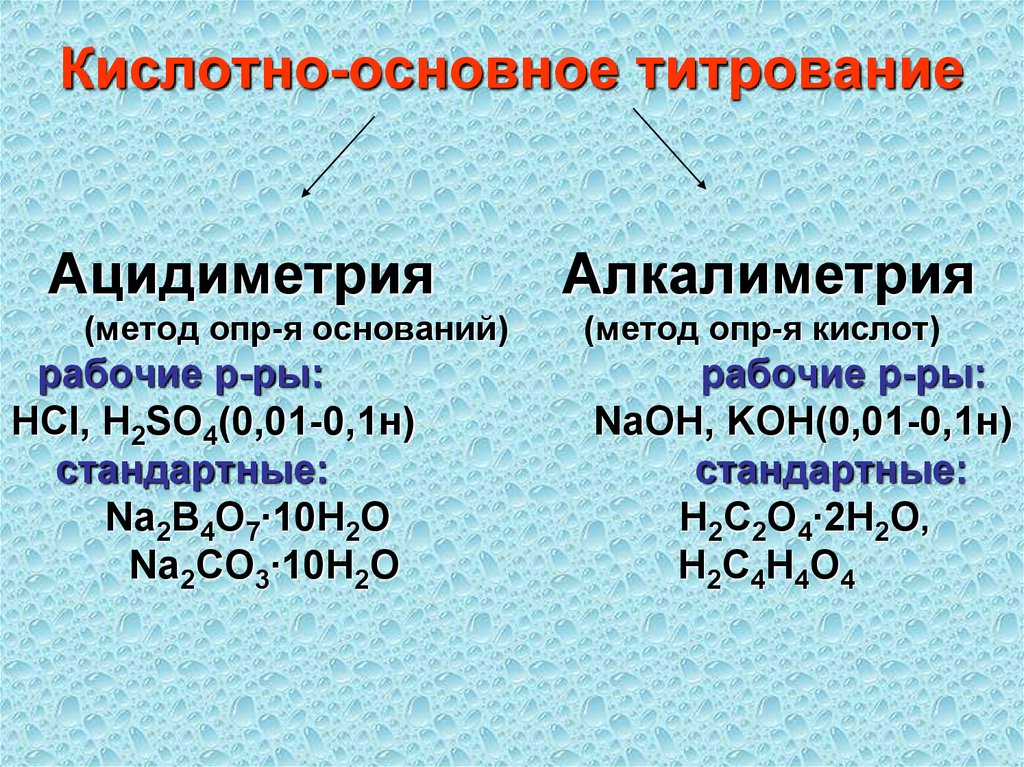
60. Кислотно-основное титрование Ацидиметрия Алкалиметрия (метод опр-я оснований) (метод опр-я кислот) рабочие р-ры: рабочие р-ры:
Кислотно-основное титрованиеАцидиметрия
(метод опр-я оснований)
рабочие р-ры:
HCl, H2SO4(0,01-0,1н)
стандартные:
Na2B4O7∙10H2O
Na2CO3∙10H2O
Алкалиметрия
(метод опр-я кислот)
рабочие р-ры:
NaOH, KOH(0,01-0,1н)
стандартные:
Н2С2О4∙2Н2О,
Н2С4H4О4
61. Ацидиметрию применяют для определения сильных и слабых оснований и некоторых солей слабых кислот, например, NaOH, NH4OH,
аминов, анилина,Na2CO3, NaHCO3 и т.д.
62. Алкалиметрию – для определения сильных и слабых кислот и некоторых солей слабых оснований: HCl, H3BO3, CH3COOH, фенолов,
солянокислыхсолей очень слабых
органических оснований
63. При кислотно-основном титровании реакция среды в момент эквивалентности может быть нейтральной, кислой или щелочной в
зависимости отприроды кислоты и основания.
1) HCl + NaOH ↔ NaCl + H2O
H+ + OH‾ ↔ H2O
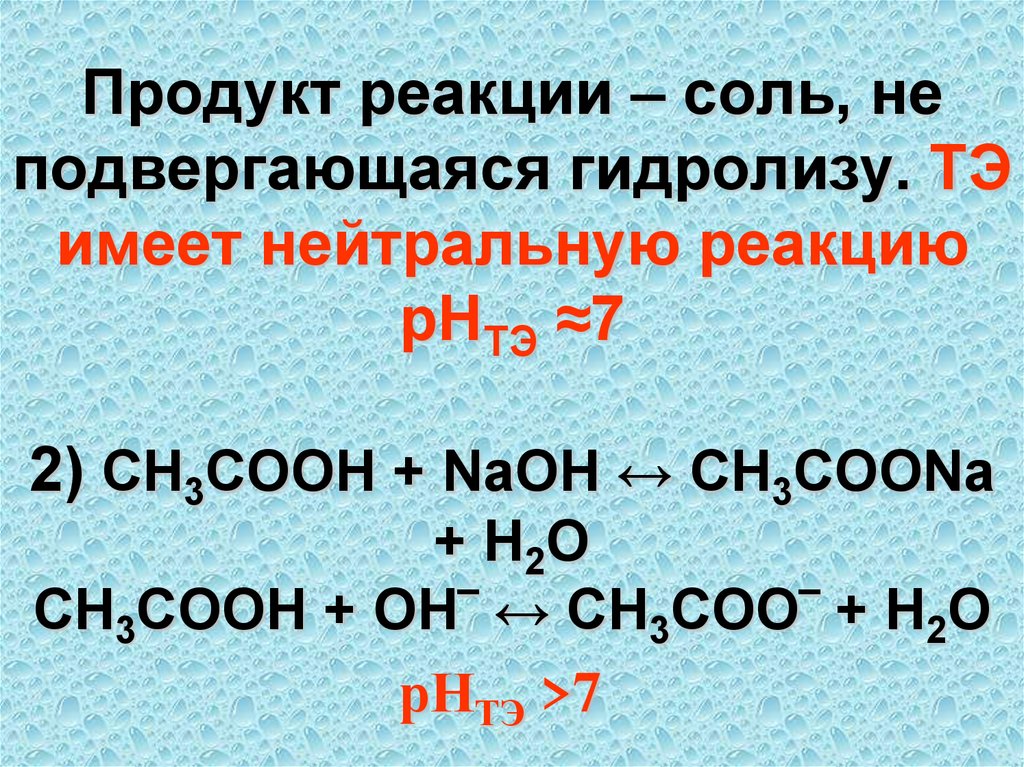
64. Продукт реакции – соль, не подвергающаяся гидролизу. ТЭ имеет нейтральную реакцию рНТЭ ≈7 2) CH3COOH + NaOH ↔ CH3COONa + H2O
CH3COOH + OH‾ ↔ CH3COO‾ + H2OрНТЭ >7
65.
3) NН4ОН + НСl↔NН4Сl + Н2ОNН4ОН + Н+ ↔ NН4+ + Н2О
рНТЭ < 7
1) Nа2СО3+НСl↔NаНСО3+ NаСl
рНТЭ 8,34
2) NаНСО3 + НСl ↔ NаСl + Н2О +
СО2
рНТЭ 4
66.
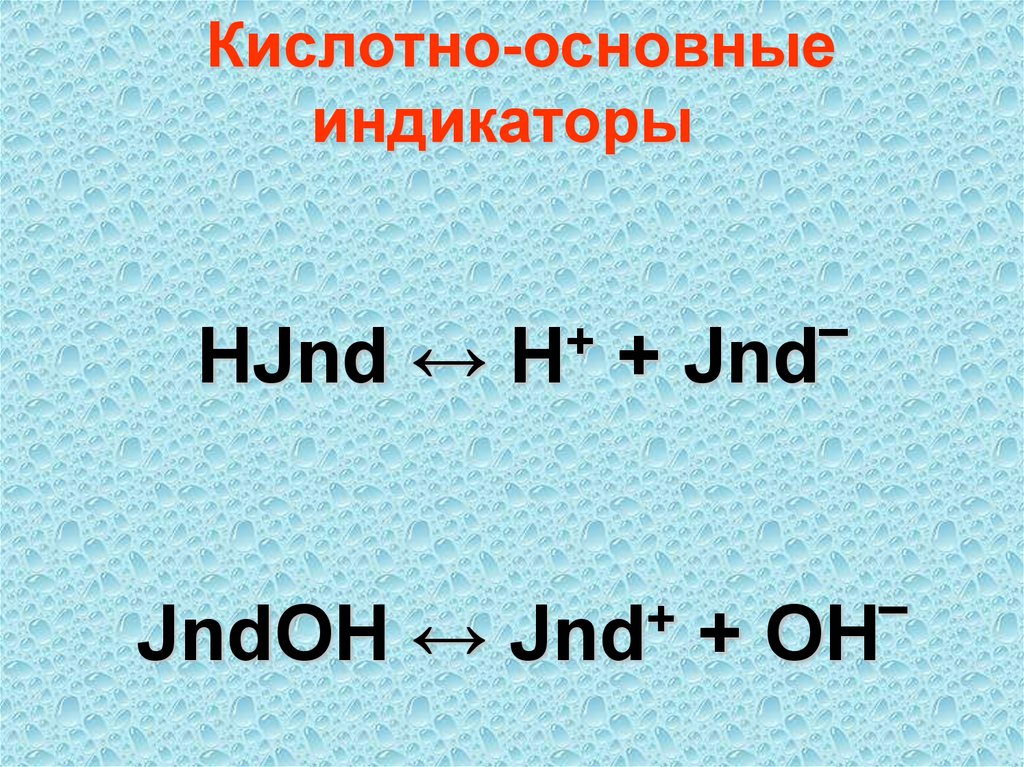
Кислотно-основныеиндикаторы
HJnd ↔
JndOH ↔
+
H
+ Jnd‾
+
Jnd
+ OH‾
67. Важной характеристикой индикаторов является показатель индикатора рКинд = –lg Кинд. Для метилоранжа рКинд = 3,7. Область
значений рН, вкоторой становится заметным
изменение окраски индикатора,
называется интервалом перехода
индикатора
рН рК инд 1
68. Для метилоранжа интервал перехода индикатора равен ≈ 3-5. рН = 1-3 – красный рН = 3-5 – красно-оранжевый рН = 5-14 – желтый
Для метилоранжаинтервал перехода
индикатора равен ≈ 3-5.
рН = 1-3 – красный
рН = 3-5 – краснооранжевый
рН = 5-14 – желтый
69. Второй важной характеристикой индикаторов служит показатель титрования (рТ). рТ – это оптимальное значение рН титруемого
раствора, при которомнаблюдается наиболее резкое
изменение окраски индикатора,
свидетельствующее об
окончании титрования.
70. рТ экспериментально находится в середине интервала перехода и близок по величине к рКинд. Например, для метилоранжа: рН =
3,1–4,4;рТ = 3,75
3,1 4,4
рТ
3,75
2
71. Показатель титрования выбранного индикатора должен лежать в пределах скачка рН на кривой титрования.
72. При титровании сильной кислоты сильным основанием применяют метилоранж и фенолфталеин. При титровании слабого основания сильной
кислотой –метилоранж, слабой кислоты
сильным основанием –
фенолфталеин.
73.
1211
10
9
8
7
6
5
4
3
2
1
0
0,
5
0,
0, 9
0, 99
99
9
1, 1
00
1, 1
01
1,
1
0
Логарифмическая
кривая титрования
74. Стандартизация титрантов в методе нейтрализации Стандартные растворы сильных кислот и щелочей нельзя приготовить сразу по
точнойнавеске или точному объему из
более концентрированного
раствора. Поэтому сначала
готовят растворы
приблизительной концентрации, а
затем их стандартизируют.
75. Для растворов кислот используют либо буру (Na2B4O7∙10H2O): Na2B4O7+2HCl+5H2O→4H3BO3+2NaCl либо соду (Na2CO3∙10H2O): Na2CO3+
2HCl → 2NaCl +H2O +CO2↑76. Стандартизацию растворов щелочи проводят по дигидрату щавелевой кислоты (H2C2O4∙2H2O): H2C2O4 + 2NaOH → Na2C2O4 + 2H2O
77. По результатам титрования рассчитывают нормальность и титр приготовленных рабочих растворов.
рассчитываютнормальность и титр
приготовленных рабочих
растворов.
С н (буры) V (буры)
С н ( HCl )
V ( HCl )
C н ( HCl ) M э ( HCl )
T ( HCl )
1000
78.
7.6В процессе титрования
изменяются равновесные
концентрации вещества,
титранта и продуктов реакции.
При этом пропорционально
концентрациям этих веществ
изменяются свойства раствора.
79. График зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта от состава раствора
в процессетитрования называется
кривой титрования.
80.
При построении кривыхтитрования по оси абсцисс
обычно откладывают объем
добавляемого титранта (VT) или
степень оттитрованности (f)
VT
f
V0
В ТЭ f = 1 (или 100%), до ТЭ f<1, а
после f>1.
81. Линейные кривые титрования состоят из двух прямолинейных отрезков, пересекающихся в ТЭ. Примеры линейных кривых титрования: Y Y
Yf
f=1
f=1
f
f=1
82. Логарифмические кривые титрования имеют S-образную форму. На кривых имеется область резкого изменения рассчитываемого или
Логарифмические кривыетитрования имеют Sобразную форму. На кривых
имеется область резкого
изменения рассчитываемого
или измеряемого параметра
(вблизи ТЭ), которое
называется «скачком
титрования».
83.
1211
10
9
8
7
6
5
4
3
2
1
0
0,
5
0,
0, 9
0, 99
99
9
1, 1
00
1, 1
01
1,
1
0
Логарифмическая
кривая титрования
84. При визуальном обнаружении ТЭ используют индикаторы. Индикаторы – это вещества, окраска которых изменяется при определенном
значениипараметра.
85.
Кривую титрования можноохарактеризовать крутизной,
которая является мерой
чувствительности и точности
титрования.
рН
V
где η – индекс крутизны, который
максимальное значение имеет в
ТЭ.
86. Титрование сильной кислоты сильным основанием До ТЭ значение рН определяется только ионами водорода за счет неоттитрованной
сильнойкислоты, поскольку другими
источниками (автопротолиз воды;
углекислота, поглощенная из
воздуха) можно пренебречь.
87. Для расчета водородного показателя(рН) можно пользоваться формулой:
рН lg c0 lg( 1 f )88. После ТЭ значение рН определяется избытком добавленного титранта – сильного основания по формуле:
рН рКW lg cT lg( f 1)89. В ТЭ значение рН определяется ионами водорода, поступающими за счет автопротолиза воды (если считать, что СО2 не поглощается),
по формуле:рН 1 / 2 рК W
90. Пример 6 Пусть 10,0 мл (V0) 0,10 М HCl (C0) титруют 0,10 М (CТ) NaOH. Допустим, что ионная сила близка к нулю. Можно пренебречь
такжеизменением объема. Ионы Na+ и
Cl‾ не влияют на кислотноосновное равновесие.
91.
VTf
V0
0
0,50
0,90
0,99
0,999
1,000
1,001
1,01
1,10
рНСостав
раствор определя
ющий
а
HCl, H2O
HCl, H2O
HCl, H2O
HCl, H2O
HCl, H2O
H2O
NaOH, H2O
NaOH, H2O
NaOH, H2O
Формула
расчета рН
компонен
т
рН lg c0 lg( 1 f )
HCl
HCl
HCl
HCl
HCl
H2O
NaOH
NaOH
NaOH
pH 1 / 2 pK W
рН pКW lg cT lg( f 1)
Зна
чение
рН
1,0
1,3
2,0
3,0
4,0
7,0
10,0
11,0
12,0
92.
1211
10
9
8
7
6
5
4
3
2
1
0
0,
5
0,
0, 9
0, 99
99
9
1, 1
00
1, 1
01
1,
1
0
Логарифмическая
кривая титрования
93. 1) ТЭ в этом случае совпадает с точкой нейтральности (рН 7); 2) вблизи ТЭ наблюдается резкий скачок рН. Его величина зависит от
концентрации титруемогораствора и титранта, а так же от
температуры (t). С увеличением
концентрации реагентов величина
скачка рН на кривой титрования
растет, а при их понижении
уменьшается;
94. 3) для фиксирования ТЭ пригоден любой индикатор, интервал перехода окраски которого, лежит в пределах скачка рН. 4) с
увеличениемтемпературы величина
скачка рН на кривой
титрования уменьшается
95. Найдем значения рН, учитывая изменения объема по формулам:
c0V0 cT VTV0
[ A]
c0 (1 f )
V0 VT
V0 VT
[T]=
VT cT VT (TЭ ) cT
V0 VТ
cT ( f 1)
VT (TЭ )
V0 VT
96. Как видно, разница в значениях рН с учетом и без учета изменения объема, при титровании достигает 0,3 единицы рН.
f0
рН 1,0
0,90
0,99 0,999 1,0 1,001 1,01 1,10
2,3
3,3
4,3
7,0
9,7
10,7 11,7
97. Индекс крутизны кривой вблизи ТЭ велик. Для f в интервале 0,999–1,001:
рН6,0
300
V
(1,001 0,999) 10
98. Для от 0,99 до 1,00
Дляf
от 0,99 до 1,00
7,0
70
(1,00 0,99) 10
Кривая титрования
симметрична относительно ТЭ,
которая совпадает с точкой
нейтральности.
99. 7.7 Определение очень слабых кислот и оснований (с К < 10‾8 ) и смесей электролитов с близкими константами в водной среде
7.7Определение очень слабых
кислот и оснований (с К <
10‾8 ) и смесей электролитов
с близкими константами в
водной среде
проблематично, т.к. скачок
рН очень мал и трудно
подобрать индикатор.
100. В этом случае используют метод усиления или ослабления донорно-акцепторной способности электролитов в неводных средах или
В этом случае используютметод усиления или
ослабления донорноакцепторной способности
электролитов в неводных
средах или смешанных
водно-органических средах.
101.
Титруемое
Растворитель
Титрант
Индикаторы
(изменение
окраски)
вещество
Основани
е
Кислота
Кислотный:
CH3COOH(безв.
)
Инертный
HClO4
в уксусной
кислоте
метилэтилкетон
Основной:
Гидроксид
Этилендиамин, тетрабутила
пиридин
ммония
смесь СН3ОН с
(C4H9)4NOH
С6Н6,
третбутиловый
спирт
Метиловый
красный
(фиолетовый
–
синезеленый)
онитроанилин
(желтый –
оранжевый)
Фенолфтале
ин
(желтый –
102.
Благодарим завнимание!












































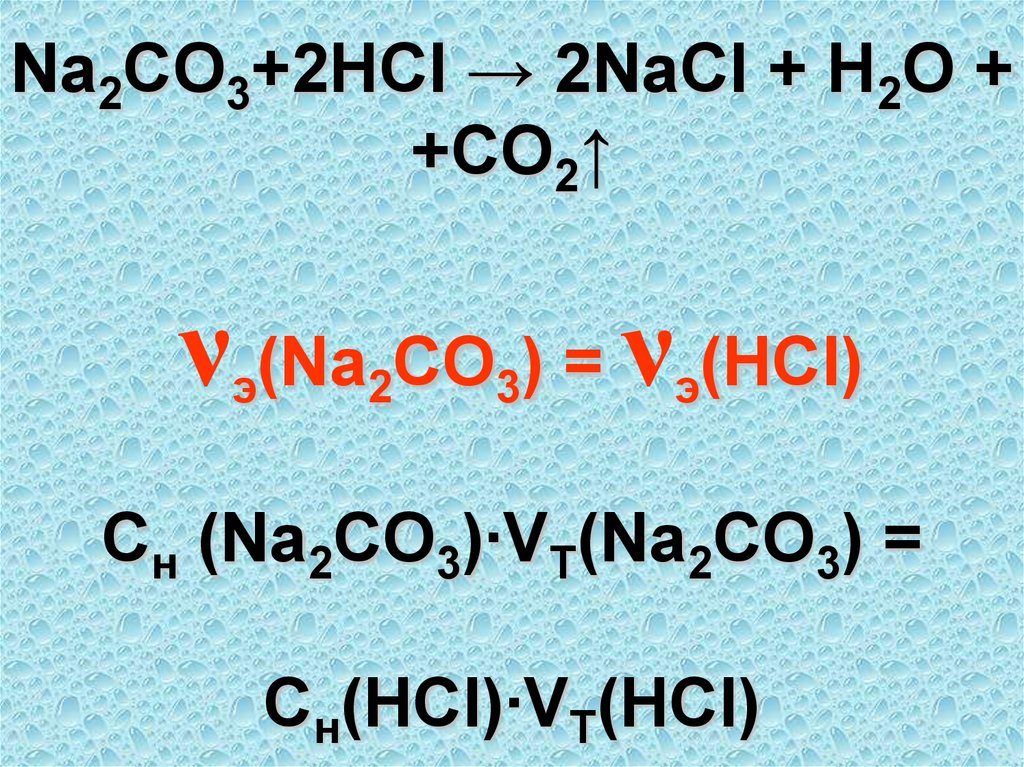
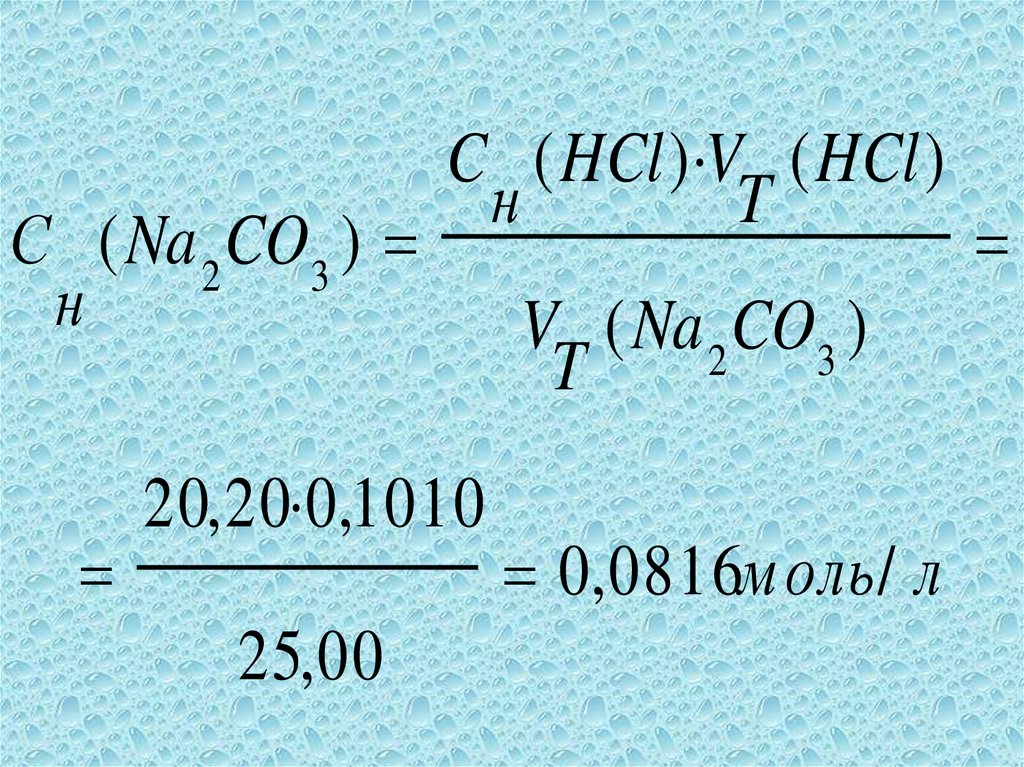
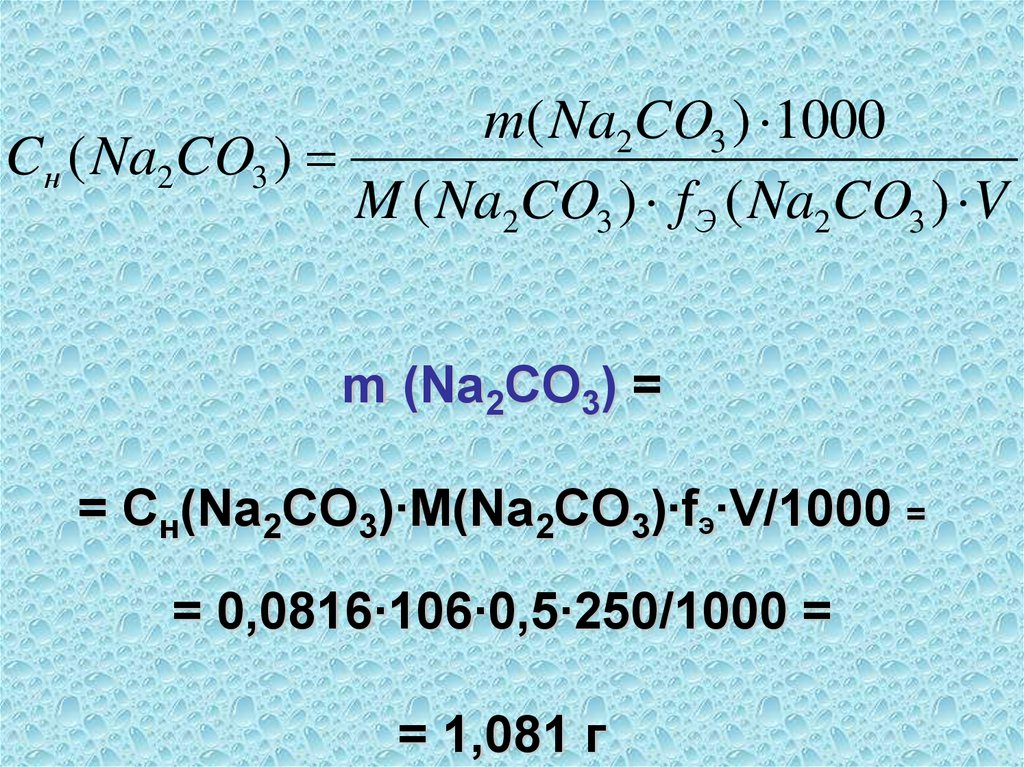

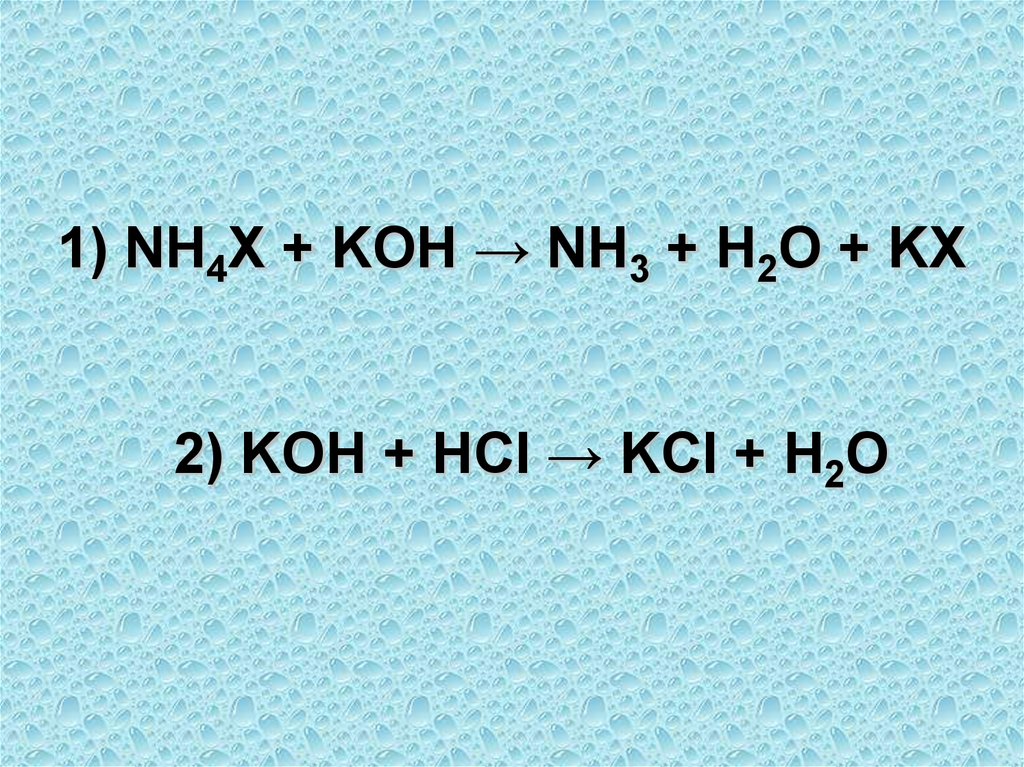






































 Химия
Химия








