Похожие презентации:
Введение в титриметрический анализ. Кислотно-основное титрование
1. ВВЕДЕНИЕ В ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ лектор – проф. Васюк С. А. 2016
2. План
1. Титриметрические методы2. Классификация титриметрических методов анализа
3. Титрованные (стандартные) растворы
4. Способы и методы титрования
5. Сущность кислотно-основного титрования
6. Первичные стандарты метода кислотно-основного
титрования
7. рН-индикаторы
8. Способы подбора индикаторов
3. Закон эквивалентов
СМэ1 ∙ V1 = СМэ2 ∙ V2где СМэ – молярная концентрация эквивалента;
V – объем.
,
4.
Фактор эквивалентности fэ2NaOH + H2СO3 ↔ Na2СO3 + 2H2O
fэ(H2СO3) = ½.
NaOH + H2СO3 ↔ NaНСO3 + H2O
fэ(H2СO3) = 1.
5.
Молярной массой эквивалента вещества называютмассу одного моля эквивалента этого вещества, равную
произведению фактора эквивалентности на молярную
массу вещества.
Мэ = fэ ∙ М
Мэ(H2СO3) = fэ(H2СO3) ∙ М(H2СO3) = 1/2 ∙ 106,0 = 53,00 г/моль;
Мэ(H2СO3) = fэ(H2СO3) ∙ М(H2СO3) = 1 ∙ 106,0 = 106,0 г/моль.
6. Классификация титриметрических методов анализа
1. Кислотно-основное титрование – основано нареакции переноса ионов водорода от одной
реагирующей частицы к другой в растворе:
НА + В ↔ ВН+ + Аацидиметрию (ацидиметрическое титрование) –
определение веществ титрованием стандартным
раствором кислоты (Н3О+);
алкалиметрию (алкалиметрическое титрование) –
определение веществ титрованием стандартным
раствором сильного основания (ОН-);
протолитометрию (титрование в неводных средах).
7.
2. Окислительно-восстановительноетитрование (редокс-метрия) – основано на
реакции переноса электронов от восстановителя к
окислителю:
Ох1 + Red2 ↔ Red1 + Ox2
оксидиметрические методы (титрование раствором
окислителя): перманганатометрия, иодатометрия,
дихроматометрия, бромо- и броматометрия,
цериметрия, йодхлорметрия и др.;
редуктометрические методы (титрование раствором
восстановителя): аскорбинометрия, титанометрия,
феррометрия и др.
8.
3. Осадительное титрование – основано на реакцииобразования малорастворимых соединений:
nКm+ + mАn- ↔ КnАm
Различают: аргентометрию, меркурометрию,
тиоцианатометрию и др.
4. Комплексиметрическое титрование – основано
на реакции образования слабодиссоциирующего
растворимого комплекса:
М + nL ↔ [M(L)n]
Различают: комплексонометрию, меркуриметрию,
фториметрию.
9.
Способ приготовленного титраa
T
Vк
С МЭ
T
М Э
Т – титр раствора, г/мл;
а – масса навески вещества, г;
Vк – вместимость мерной колбы, мл;
СМэ – молярная концентрация эквивалента раствора;
Мэ' – миллимолярная масса эквивалента вещества.
10.
Способ установленного титраС МЭ
С М Э 1 V1
V
T С М Э М Э
11.
Навеску установочного вещества дляприготовления определенного объема V раствора с
молярной концентрацией СМ или молярной
концентрацией эквивалента СМэ рассчитывают по
формулам:
Для твердых веществ:
Для растворов:
a
a
С М Э Vк М Э
1000
С М Э Vк М Э 100
С% 1000
С% - процентная концентрация вещества в исходном
растворе.
12.
Прямое титрованиеCH3COOH + NaOH ↔ CH3COONa + H2O
13.
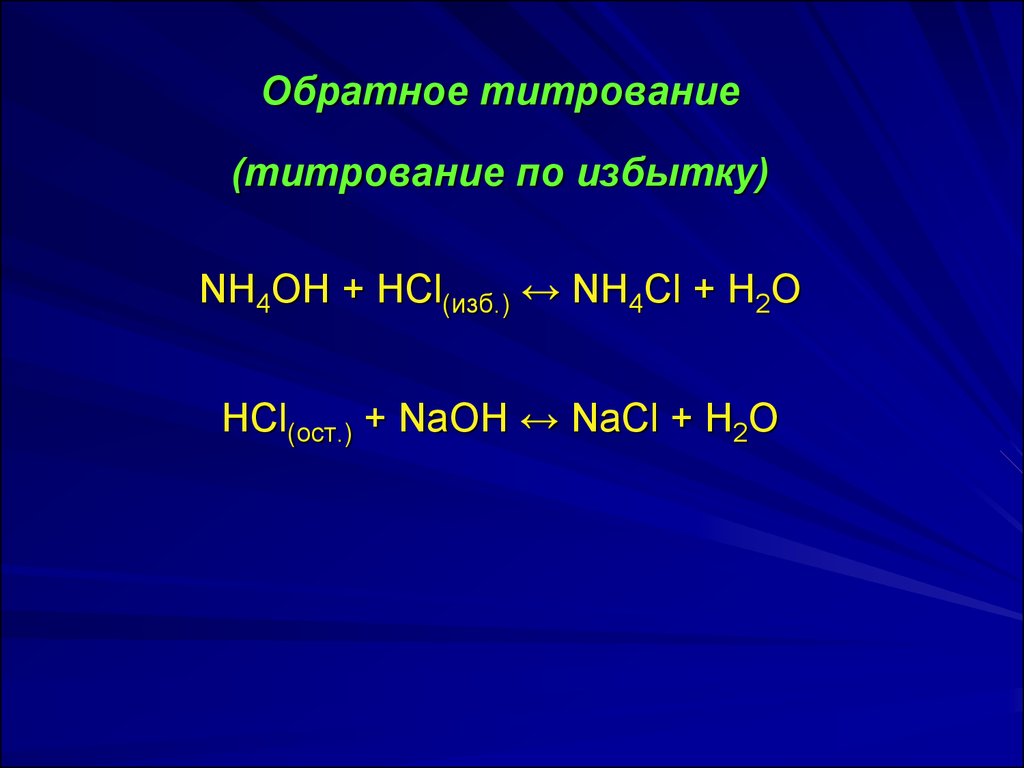
Обратное титрование(титрование по избытку)
NH4ОH + HCl(изб.) ↔ NH4Cl + H2O
HCl(ост.) + NaOH ↔ NaCl + H2O
14.
Заместительное титрованиеНапример, методом алкалиметрии способом
прямого титрования Н3PO4 титруется только по 1
и 2 ступеням. Для того, чтобы оттитровать Н3PO4
по 3 ступеням используют способ
заместительного титрования:
2H3PO4 + 3CaCl2(изб.) ⇄ Ca3(PO4)2↓ + 6HCl
HCl + NaOH ⇄ HCl + H2O
15.
Различают:метод пипетирования;
метод отдельных навесок.
16. Сущность кислотно-основного титрования
В основе метода кислотно-основного титрованиялежат реакции, связанные с переносом ионов
водорода между веществами, проявляющими
кислотно-основные свойства.
НА + В ↔ НВ+ + Аа1
b2
а2
b1
17.
Титранты метода КОТВ методе ацидиметрии в качестве титрантов применяют
0,01-1 М растворы кислот (HCl, H2SO4, HNO3, HClO4), в
методе алкалиметрии – 0,01-1 М растворы щелочей
(NaOH, KOH, Ba(OH)2).
18.
Тетраборат натрия декагидрат, бура (Na2B4O7 ∙10H2O)B4O72- + 2H+ + 5H2O ⇄ 4H3BO3
fэ (Na2B4O7 . 10H2O) = ½
индикатор – метиловый красный, метиловый оранжевый
19.
Карбонат натрия (Na2CO3)CO32- + 2H+ ⇄ H2CO3
fэ (Na2CO3) = ½
индикатор – метиловый красный, метиловый
оранжевый
CO32- + H+ ⇄ HCO3 –
fэ (Na2CO3) = 1
индикатор – фенолфталеин
20.
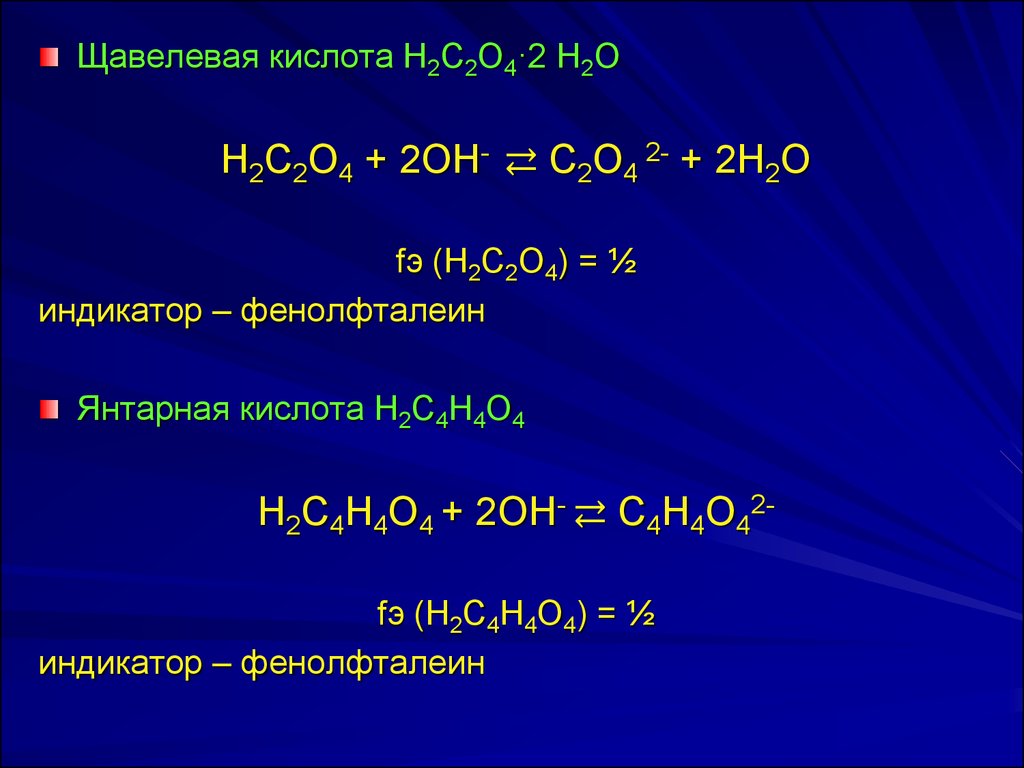
Щaвeлeвaя киcлотa H2C2O4·2 H2OH2C2O4 + 2OH- ⇄ C2O4 2- + 2H2О
fэ (H2C2O4) = ½
индикатор – фенолфталеин
Янтарная кислота H2C4H4O4
H2C4H4O4 + 2OH- ⇄ C4H4O42fэ (H2C4H4O4) = ½
индикатор – фенолфталеин
21.
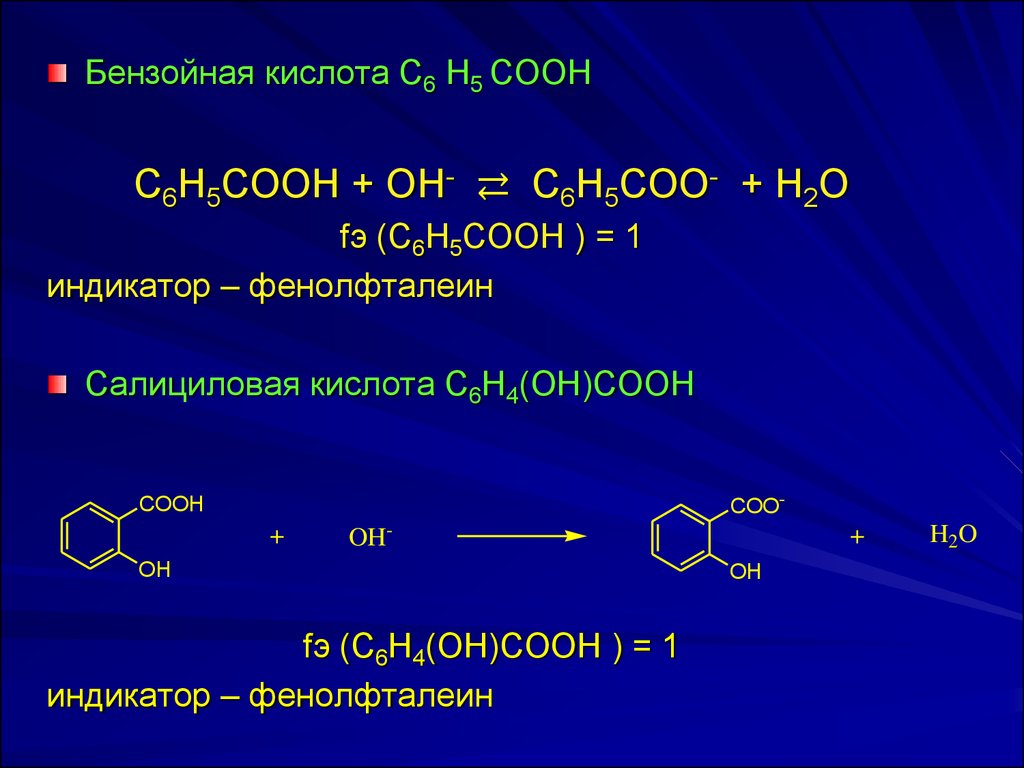
Бeнзoйнaя киcлoтa C6 H5 COOHC6H5COOH + OH- ⇄ C6Н5СОО- + H2О
fэ (C6H5COOH ) = 1
индикатор – фенолфталеин
Сaлицилoвaя киcлoтa C6H4(OH)COOH
COO-
COOH
+
OH-
OH
fэ (C6H4(ОН)COOH ) = 1
индикатор – фенолфталеин
+
OH
H2O
22.
HInd ⇄ H+ + Ind[Ind ]
pH pK a lg
[HInd]
1
pK a lg
10
10
pK a lg
1
∆рН = рКа ±1
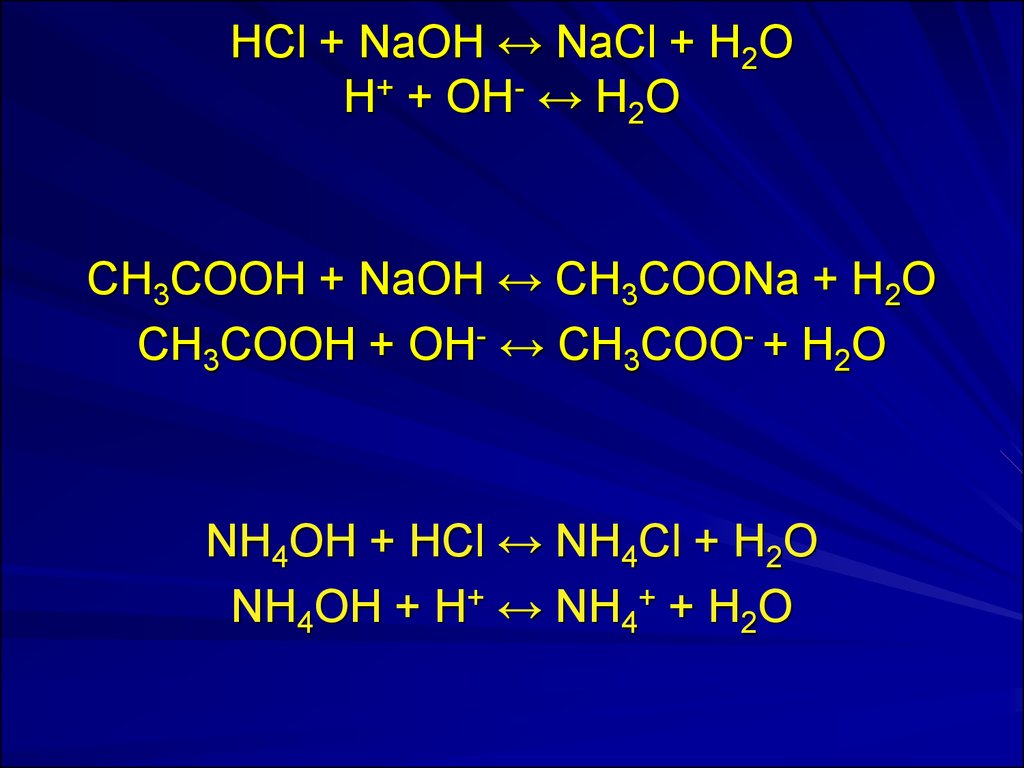
23. HCl + NaOH ↔ NaCl + H2O H+ + OH- ↔ H2O
CH3COOH + NaOH ↔ CH3COONa + H2OCH3COOH + OH- ↔ CH3COO- + H2O
NH4ОH + HCl ↔ NH4Cl + H2O
NH4ОH + H+ ↔ NH4+ + H2O
24.
Для построения кривой титрования рассчитывают:рН исходного раствора,
рН в момент полунейтрализации,
рН в начале скачка титрования (анализируемый
раствор недотитрован на 0,1%),
рН в точке эквивалентности,
рН в конце скачка титрования (анализируемый
раствор перетитрован на 0,1%).
25.
С визуальным фиксированием конечной точкититрования (КТТ) можно оттитровать вещества,
у которых Ка, Кb ≥ 5·10-8
26.
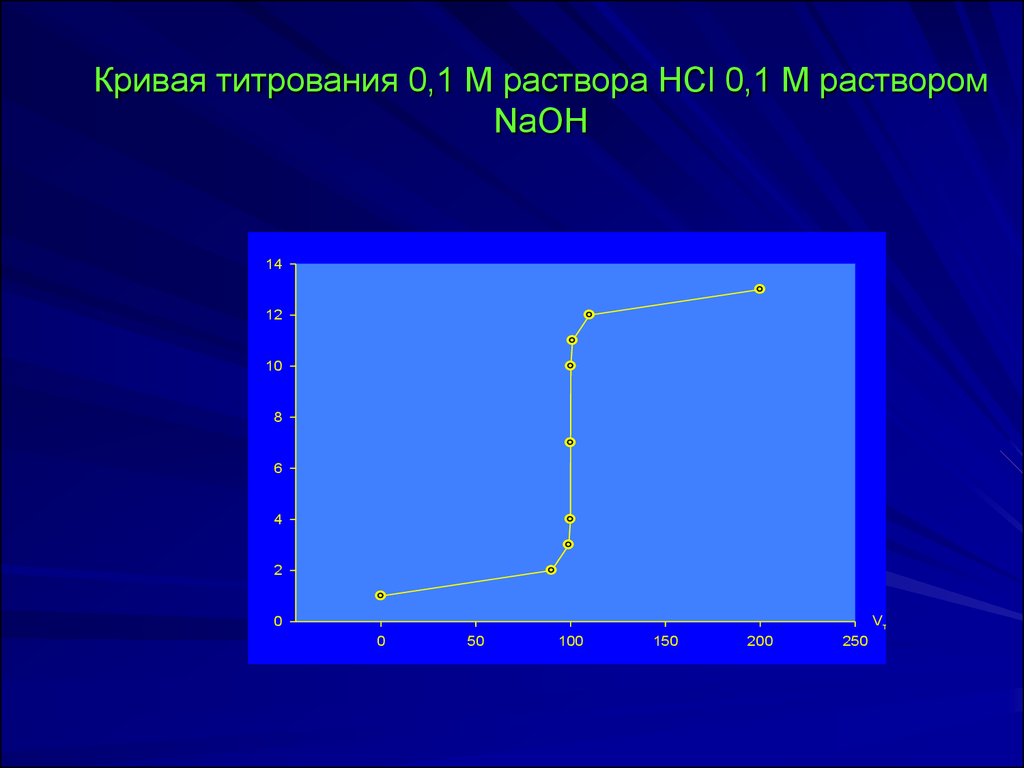
Кривая титрования 0,1 М раствора HCl 0,1 М растворомNaOH
14
12
10
8
6
4
2
Vт
0
0
50
100
150
200
250
27.
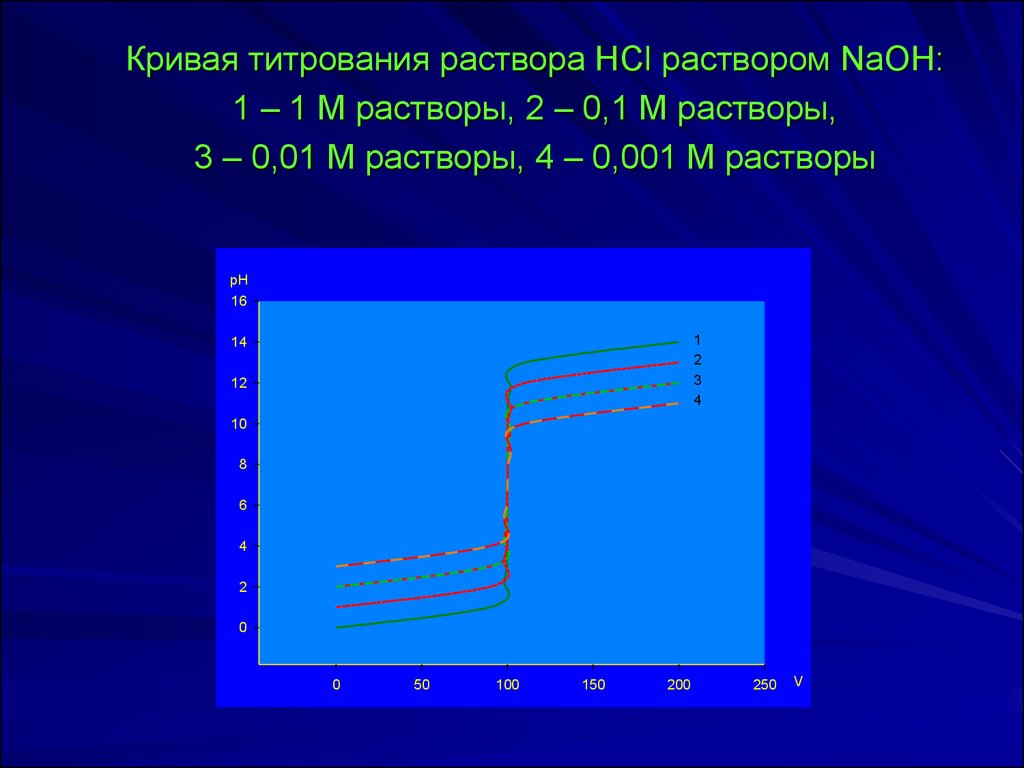
Кривая титрования раствора HCl раствором NaOH:1 – 1 М растворы, 2 – 0,1 М растворы,
3 – 0,01 М растворы, 4 – 0,001 М растворы
рН
16
1
2
3
4
14
12
10
8
6
4
2
0
0
50
100
150
200
250
V
28.
Кривая титрования 0,1 М раствора CH3COOH0,1 М раствором NaOH
рН
14
12
10
8
6
4
2
Vт
0
50
100
150
200
250
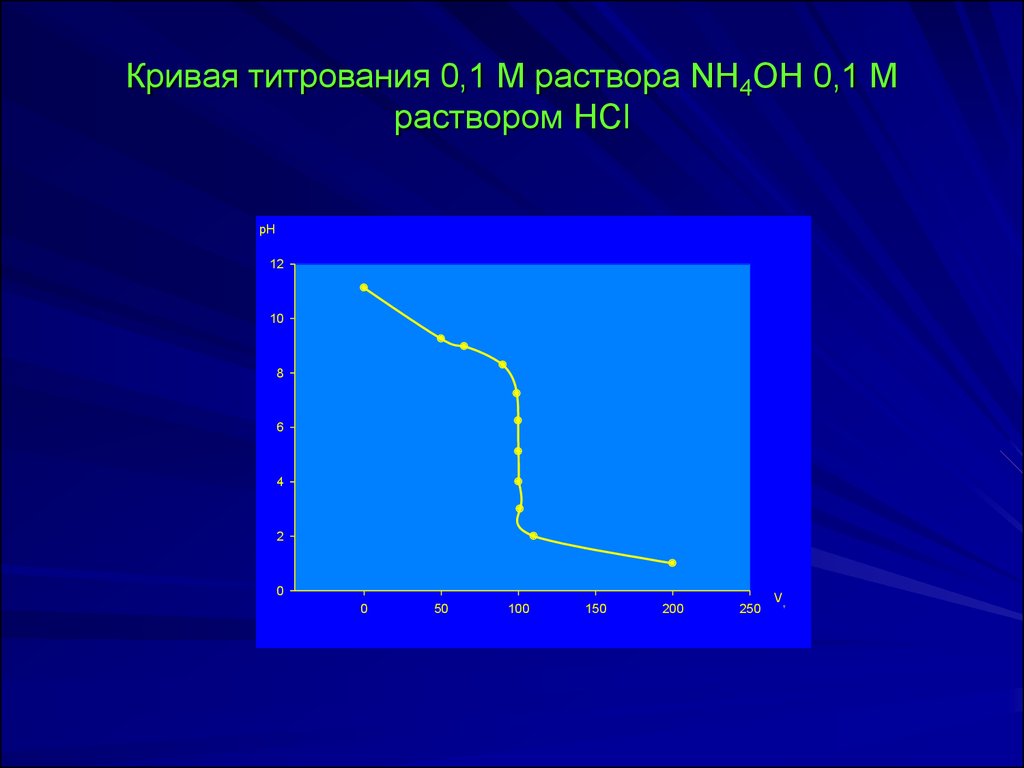
29. Кривая титрования 0,1 М раствора NH4OH 0,1 М раствором HCl
рН12
10
8
6
4
2
0
0
50
100
150
200
250
Vт






















 Химия
Химия








