Похожие презентации:
Титриметрический метод анализа
1. Титриметрический метод анализа
12.
Количество моль эквивалента добавленногореагента R
n[fэкв (R)]
Количество моль определяемого компонента Х
n[fэкв (Х)]
Условие эквивалентности:
n[fэкв (R)] = n[fэкв (Х)]
2
3. Закон эквивалентности
растворы одинаковой концентрацииэквивалентов взаимодействуют в равных
объёмах
3
4.
45.
56. Требования к реакциям в титриметрии
67.
78. Кривая титрования
график зависимости параметра системы, связанного сконцентрацией определяемого вещества, титранта или
продукта реакции, от состава раствора в процессе титрования.
По оси ординат – C, lgC, Е, I; по оси абсцисс – Vт или f (γ) –
степень оттитрованности.
8
9. Кривая титрования
СвойствоТЭ
Скачок титрования
f
9
10. Первичные и вторичные стандарты
Первичные стандартные вещества должны отвечать рядутребований:
• Быть химически чистыми, строго соответствовать химической
формуле;
• Иметь определенный состав и не изменять его на воздухе при
комнатной температуре;
• Иметь достаточно большую эквивалентную массу, чтобы уменьшить
влияние неизбежной погрешности взвешивания;
• Реакция между определяемым веществом и титрантом должна
протекать быстро и стехиометрично;
• Хорошо растворяться в воде или подходящем органическом
растворителе.
Примеры: Na2B4O7∙10H2O, Na2CO3, H2C2O4∙2H2O, С6Н5СООН,
H2C4H4O4 (янтарная кислота), K2Cr2O7, CaCO3, ZnO, KBrO3, NaCl.
Примеры вторичных стандартов: NaOH, HCl, H2SO4, KOH, KMnO4,
Na2S2O3 и др.
10
11. Методы титриметрического анализа
1112.
Способы титрования12
13. Прямое титрование
1314. Обратное титрование
n[fэкв (Х)] = n[fэкв (R)] - n[fэкв(R/)]14
15. Титрование заместителя
1516.
Кислотно-основноетитрование
HA + B ↔
+
HB
+
A
16
17. Индикаторы КОТ
1718. Метиловый оранжевый
1819. Фенолфталеин
1920. Показатель титрования
рТ – показатель титрованиярН = рКа
20
21. Кривые титрования слабой и сильной кислот сильным основанием
pHpH
фф
фф
мо
мо
f
f
21
22. Комплексонометрическое титрование
2223.
Комплексонометрическое титрование– метод количественного анализа, основанный на
аналитическом использовании реакций
комплексообразования ионов металлов с
полидентатными хелатообразующими
органическими аналитическими реагентами –
комплексонами.
23
24. Комплексоны
Комплексон I – нитрилотриуксусная кислотаКомплексон II – этилендиаминтетрауксусная
кислота (ЭДТУ)
24
25. Комплексоны
Комплексон III – двунатриевая сольэтилендиаминтетрауксусной кислоты (ЭДТА)
25
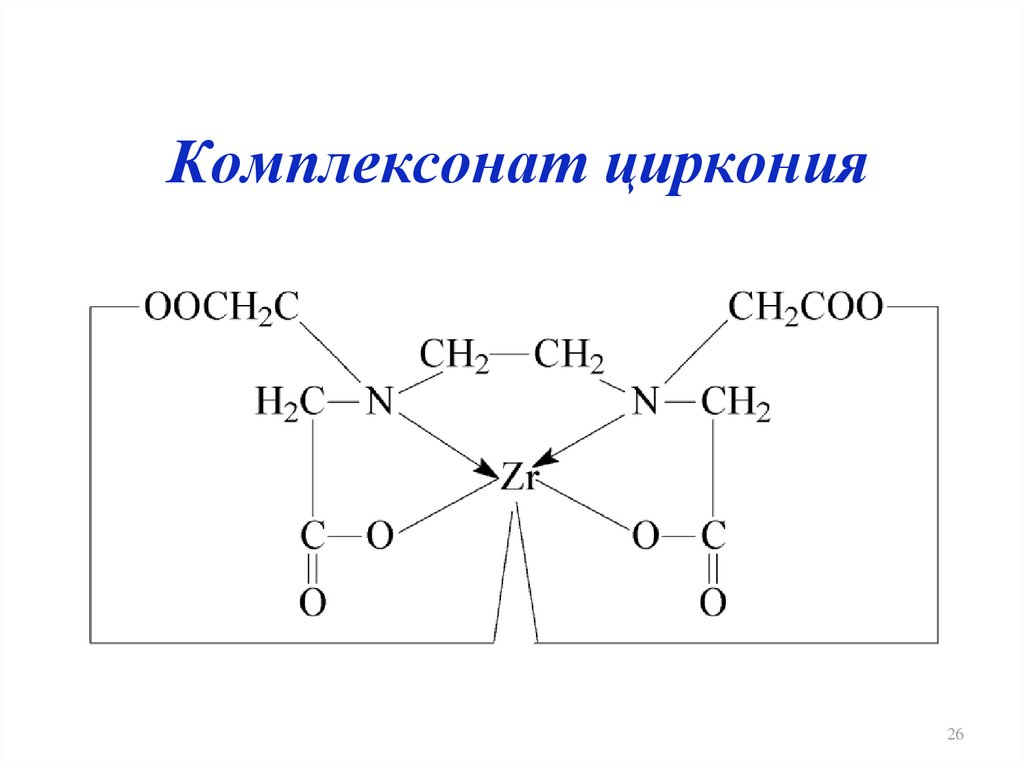
26. Комплексонат циркония
2627. Приемы повышения избирательности комплексонометрического титрования
Селективность комплексонометрического титрованияобеспечивается:
1) в результате предварительного разделения ионов
определяемого иона и мешающих ионов различными
методами (осаждение, экстракция, ионный обмен и др.);
2)
выбором
оптимальных
условий
титрования:
регулирование рН среды и подбор подходящего
маскирующего агента.
27
28.
Металлохромные индикаторы28
29. натриевая соль 3-окси-4-[(1-окси-2-нафтил)азо]-7-нитронафталин-1-сульфокислоты
ЭХЧТЭриохромовый черный Т
натриевая соль 3-окси-4-[(1-окси-2-нафтил)азо]-7нитронафталин-1-сульфокислоты
29
30.
3031.
ПАРПАН
31
32. Мурексид
Аммонийная соль пурпурной кислоты32
33. натриевая соль 3,3/-бис-[N,N-ди-(карбоксиметил)-аминометил]-о-крезолсульфофталеина
Ксиленоловый оранжевыйнатриевая соль 3,3/-бис-[N,N-ди-(карбоксиметил)аминометил]-о-крезолсульфофталеина
33
34. Окислительно-восстановительное титрование
Окислительновосстановительноетитрование
34
35. Перманганатометрия
MnO4- + 8H3O+ + 5ē ↔ Mn2+ + 12H2O,MnO4- + 4H3O+ + 3ē ↔ MnO2 ↓ + 6H2O.
E MnO4
E
Mn2
0
MnO4
Mn 2
0,058
lg
5
aMnO aH8 O
4
3
aMn 2
В качестве первичных стандартов для
стандартизации раствора KMnO4 используют
H2C2O4∙2Н2О, Na2C2O4, оксид мышьяка (III), соль
Мора ((NH4)2[Fe(SO4)2]·6H2O), желтую кровяную
соль K4[Fe(CN)6], Fe особой чистоты и др.
35
36. Дихроматометрия
Cr2O72- + 14H3O+ + 6ē ↔ 2[Cr(H2O)6]3+ + 9H2O0/
Cr2O7 2
E
E
2 Cr ( H 2O )63
0
Cr2O7 2
aCr O 2 a14
H O
0,058
3
lg 22 7
6
a[Cr ( H O ) ]3
2 Cr ( H O ) 3
2
6
2
6
3С + 2K2Cr2O7 + 8H2SO4 + 16H2O ↔ 3CO2 ↑ +
2[Cr(H2O)6]2(SO4)3 + 2K2SO4,
K2Cr2O7 + 6FeSO4 + 7H2SO4 + 5H2O ↔
[Cr(H2O)6]2(SO4)3 + 3Fe2(SO4)3 + K2SO4.
36
37. Индикаторы
3738. Церийметрия
(NH4)2[Ce(NO3)6]Первичные стандарты: As2O3, Na2C2O4, Fe
В качестве индикатора используют ферроин, а
также нитроферроин.
38
39. Ферроин
3940. Броматометрия
BrO3- + 6H+ + 6ē = Br- + 3H2OC6H5OH + 3Br2 = C6H2Br3OH + 3H+ + 3BrBr
+ 2H+ + 2Br-
+2Br2
N
N
OH
Br
OH
40
41. Йодометрия
I2 + 2ē ↔ 2I-E
0
I2
0,56 B
2I
0
I 3
0,545 B
E
3I
I2 + 2OH- ↔ IO- + I- + H2O
4I- + O2 + 4H3O+ ↔ 2I2 + 6H2O
41
42. Йодометрия
As2O3 ↓ + 6NaOH + H2O ↔ 2Na3[AsO(OH)4]I2 + 2S2O3- ↔ 2I- + S4O62-
42
43. Значащие цифры
В числах 0,12 и 0,012 находится по двезначащие цифры.
В числах 106 и 0,0106 находится по три
значащих цифры.
43
44.
Наименьшие разряды числовых значенийрезультата измерений и погрешности должны
быть одинаковы: 20,56 0,25 или 2,1 0,1.
44
45. Правила округления
1. результат 3,2800 при погрешности 0,001округляют до 3,280;
2. число 267 245 при сохранении четырех
значащих цифр должно быть округлено до 267
200; число 165,245 до165,2;
3. 14597 14600; 123,58 124.
45
46. Правила вычислений с участием приближенных значений
Сложение или вычитание4,462 + 2,38 + 1,17273 - 1,0262 = 6,99
Умножение или деление
0,5643
0,023
25
46
47.
Правила вычислений с участиемприближенных значений
Возведение в степень
0,0172 = 0,00029
Извлечение корня
0,00234 0,0484
47



























![натриевая соль 3-окси-4-[(1-окси-2-нафтил)азо]-7-нитронафталин-1-сульфокислоты натриевая соль 3-окси-4-[(1-окси-2-нафтил)азо]-7-нитронафталин-1-сульфокислоты](https://cf2.ppt-online.org/files2/slide/k/k12sLycdj6iUmBOKFGznNulCEratV78gSMRZTe/slide-28.jpg)



![натриевая соль 3,3/-бис-[N,N-ди-(карбоксиметил)-аминометил]-о-крезолсульфофталеина натриевая соль 3,3/-бис-[N,N-ди-(карбоксиметил)-аминометил]-о-крезолсульфофталеина](https://cf2.ppt-online.org/files2/slide/k/k12sLycdj6iUmBOKFGznNulCEratV78gSMRZTe/slide-32.jpg)














 Химия
Химия








