Похожие презентации:
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
1. ТЕМА 6 Теоретические основы каталитических процессов переработки нефтегазового сырья
ОпределениеКлассификация катализа,
катализаторов и каталитических
процессов нефте-, газопереработки
Механизмы каталитических реакций
применительно к процессам нефте-,
газопереработки
1
2. Определение
Катализ — многостадийный физико-химическийпроцесс избирательного изменения механизма и
скорости термодинамически возможных химических
реакций веществом - катализатором, образующим с
участниками реакций промежуточные химические
соединения.
Из этого определения следует, что:
катализатор не влияет на равновесие реакций;
катализатор ускоряет реакции избирательно, а не
универсально.
2
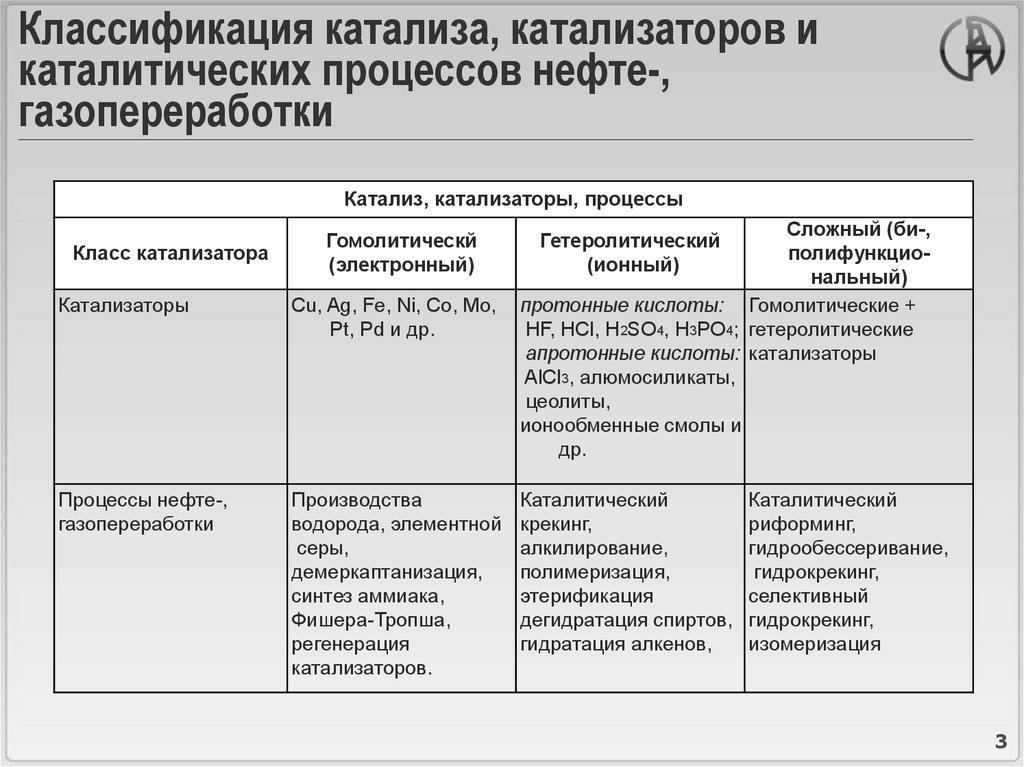
3. Классификация катализа, катализаторов и каталитических процессов нефте-, газопереработки
Катализ, катализаторы, процессыКласс катализатора
Гомолитическй
(электронный)
Катализаторы
Cu, Ag, Fe, Ni, Co, Mo,
Pt, Pd и др.
Процессы нефте-,
газопереработки
Производства
водорода, элементной
серы,
демеркаптанизация,
синтез аммиака,
Фишера-Тропша,
регенерация
катализаторов.
Сложный (би-,
полифункциональный)
протонные кислоты: Гомолитические +
HF, HCl, H2SO4, H3PO4; гетеролитические
апротонные кислоты: катализаторы
AlCl3, алюмосиликаты,
цеолиты,
ионообменные смолы и
др.
Гетеролитический
(ионный)
Каталитический
крекинг,
алкилирование,
полимеризация,
этерификация
дегидратация спиртов,
гидратация алкенов,
Каталитический
риформинг,
гидрообессеривание,
гидрокрекинг,
селективный
гидрокрекинг,
изомеризация
3
4. Механизмы каталитических реакций применительно к процессам нефте-, газопереработки
I Ионный катализа) каталитический крекинг
термолиз сырья с образованием алкенов
R-CH2-CH2-CH3
термолиз
- H2
R-CH2-CH=CH2
образование карбкатионов
Карбкатионы – органические (углеводородные) ионы с положительным
зарядом, локализованным на атоме углерода с четным числом (в отличие от
радикала) электронов. Гидрид-ионы (изотоп) H+ - единственный ион без
электронной оболочки с исключительно малым диаметром иона, обладает
высокой реакционной способностью.
4
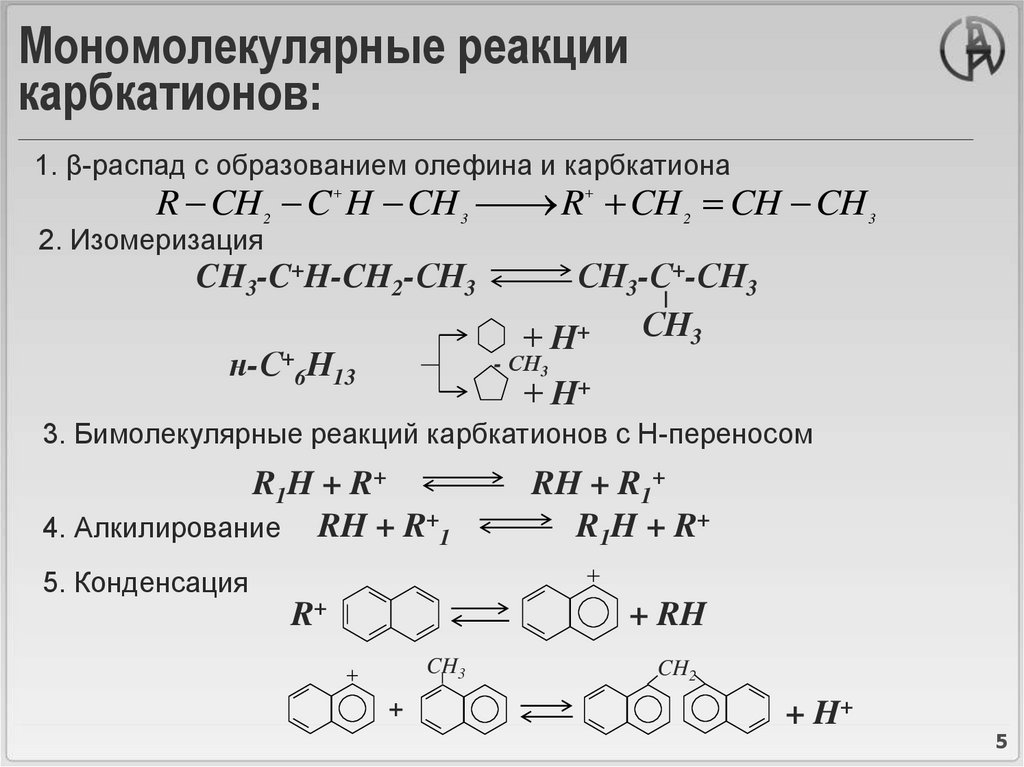
5. Мономолекулярные реакции карбкатионов:
1. β-распад с образованием олефина и карбкатионаR CH C H CH
R CH CH CH
2
3
2. Изомеризация
CH3-C+H-CH2-СН3
н-С+6Н13
2
3
СН3-С+-СН3
+ Н+ СН3
- СН3
+ Н+
3. Бимолекулярные реакций карбкатионов с Н-переносом
R1H + R+
4. Алкилирование RH + R+1
RH + R1+
R1H + R+
5. Конденсация
R+
+ RH
CH3
+
CH2
+ H+
5
6. I Ионный катализ б) Алкилирование бутилена с изобутаном
1. Образование цепи:н-С4Н8 + Н+
н-С+4Н9
2. Продолжение цепи:
н-С+4Н9 + (СН3)3СН
(СН3)3С+ + н-С4Н8
i-C+8H17 + (СН3)3СН
н-С4Н10 + (СН3)3С+
i-C+8H17
i-C8H18 + (CH3)3C+
3. Обрыв цепи:
R+ + A-
RA
6
7. I Ионный катализ в) Этирификация изобутилена метанолом
(СН3)2 – С = СН2 + Н+(СН3)3С+
(СН3)3 С+ + СН3ОН
(СН3)3-С+-ОН-СН3
(СН3)3-С+-ОН-СН3
(СН3)3-С-О-СН3 + Н+
7
8. II Гомолитический (электронный, окислительно-восстановительный) катализ
1. Паровая конверсия метанаХимизм реакций паровой конверсии углеводородов.
СnHm + nH2O
СO + H2O
n CO + (n+0,5m) H2 – Q,
CO2 + H2 + Q2
Механизм катализа.
Реакции
окисления-восстановления
и
карбидированиягазификации катализатора (Ni).
1. Z + H 2 O
Z(H2O)
Z(O) + H2,
2. Z + CH4
3. Z(O) + CH4
4. Z(O) + CO
5. Z(C) + H2O
6. Z(C) + CO2
7. Z(C) + Z(O)
Z(CH4)
Z(C) + 2H2,
Z + CO + 2H2,
Z + CO2,
Z + CO + H2,
Z + 2CO,
Z + CO.
8
9. II Гомолитический (электронный, окислительно-восстановительный) катализ
2. Окислительная демеркаптанизация сжиженныхгазов
Химизм реакций.
2RSH + 0,5 O2
RSSR + H2O
Катализатором и растворителем является NaOH, следовательно
реакция протекает по бифункциональному, гомолитическому,
основному катализу с образованием карбониона:
1. NaOH
2. RSH + OH-
Na+ + OH-,
RSH…OH
3. RSH + RS-
RS-SRH,
4. RS-SRH
RSSR + OH-.
RS- + H2O,
9
10. III Бифункциональный катализ
а) Каталитический риформинг бензиновн-С7Н16
м.ц.
-2Н2
н-С7Н12
к.ц.
Н+
СН3
к.ц.
н-С7+Н13 циклиз.
к.ц.
СН3
-Н+
СН3
м.ц
-2Н2
б) Каталитическая изомеризация С4-С5 алканов
н-С5Н12
м.ц.
-2Н2
н-С5Н10
к.ц.
Н+
к.ц.
н-С5Н11 изомериз.
i-C+5H11
к.ц.
-Н+
i-C5H10
м.ц
+Н2
i-C5H12
в) Гидрообессеривание серосодержащих углеводородов
Ni + H2 м.ц.
Mo + RSH м.ц.
Mo (S) + 2H
Ni (H2) адс.
Mo (RSH) адс.
м.ц.
Mo + H2S
Ni + 2H
Mo (S) + RH
г) Гидрокрекинг углеводородного сырья
м.ц.
м.ц.
1. R-CH2-CH2- CH3 -Н R-CH2-CH=CH2 +Н+ R-CH2-C+H-CH3
2
2. Реакции β-распада, изомеризации, Н-переноса, алкилирования
каркатиона и др.
3.
R+
+ H2
м.ц.
RH + H+
10








 Химия
Химия








