Похожие презентации:
Методы получения органических галогенидов
1. МЕТОДЫ ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ ГАЛОГЕНИДОВ
•Галогенирование аренов•Галогенирование алканов и в боковую цепь
аренов
•Синтез
галогенидов
из
непредельных
соединений
•Галогенирование
альдегидов,
кетонов
и
карбоновых кислот
•Замена гидроксильных групп в спиртах, фенолах
и карбоновых кислот
•Замещение одних атомов галогена на другие
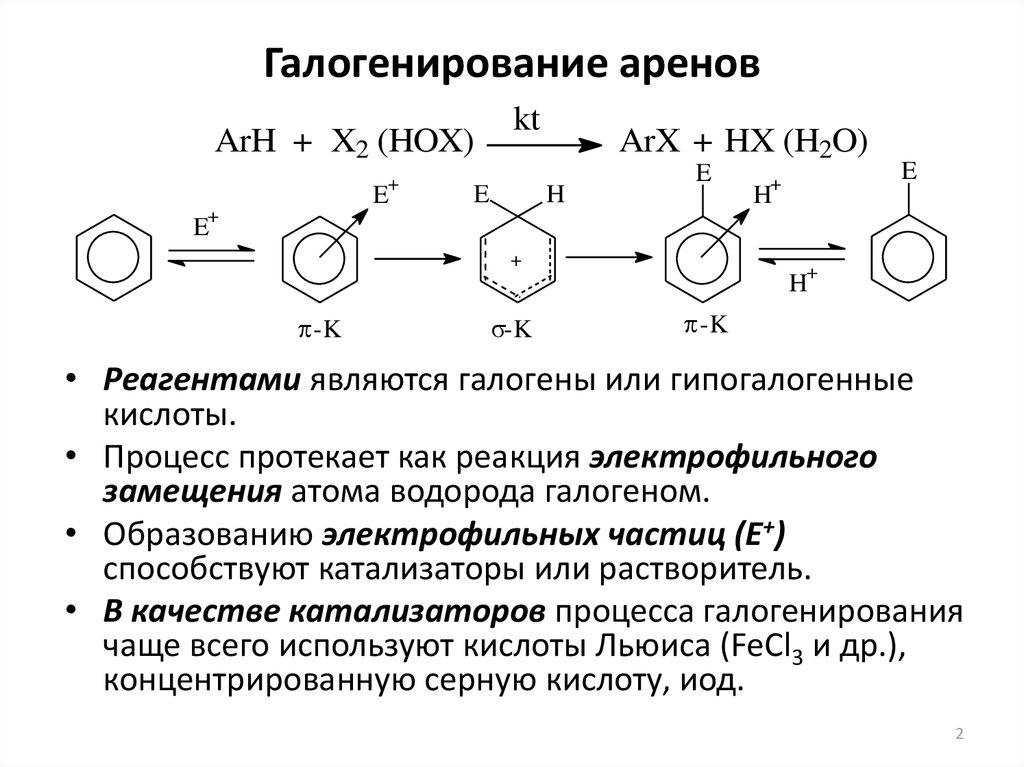
2. Галогенирование аренов
ArH + X2 (HOX)+
E
kt
E
ArX + HX (H2O)
H
E
+
E
H
+
E
+
+
H
-K
-K
-K
• Реагентами являются галогены или гипогалогенные
кислоты.
• Процесс протекает как реакция электрофильного
замещения атома водорода галогеном.
• Образованию электрофильных частиц (Е+)
способствуют катализаторы или растворитель.
• В качестве катализаторов процесса галогенирования
чаще всего используют кислоты Льюиса (FeCl3 и др.),
концентрированную серную кислоту, иод.
2
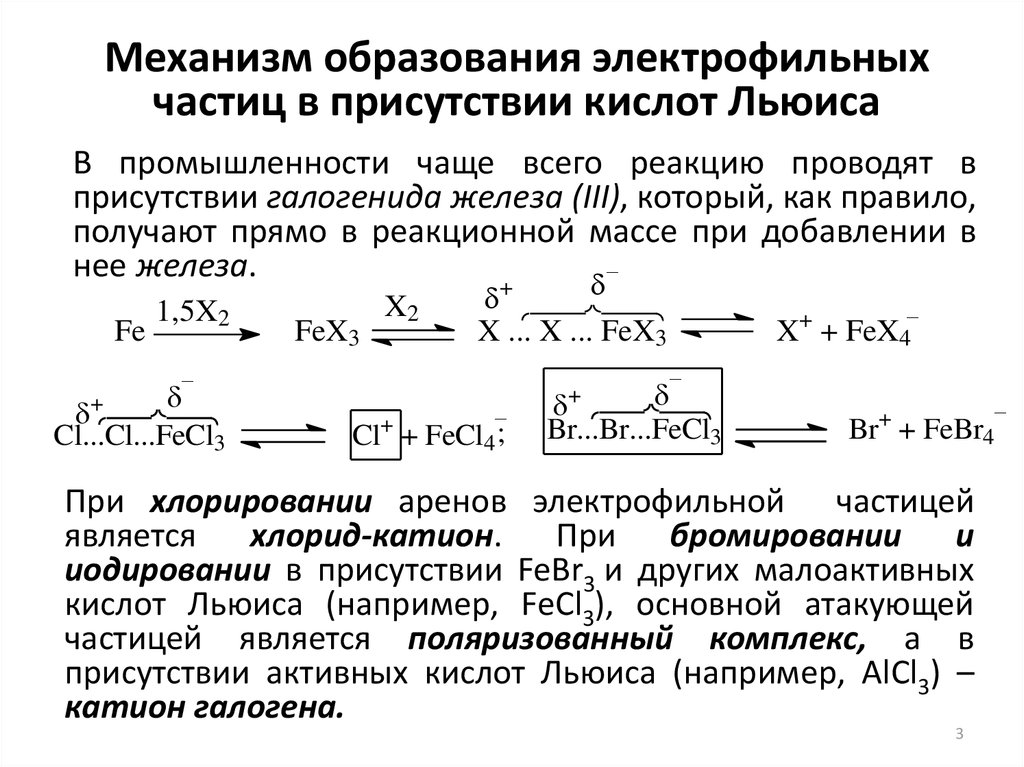
3. Механизм образования электрофильных частиц в присутствии кислот Льюиса
В промышленности чаще всего реакцию проводят вприсутствии галогенида железа (III), который, как правило,
получают прямо в реакционной массе при добавлении в
нее железа.
–
Fe
1,5X2
FeX3
X2
+
X ... X ... FeX3
–
+
Cl...Cl...FeCl3
+
Cl +
–
FeCl4 ;
–
X+ + FeX4
–
Br...Br...FeCl3
+
+
Br +
–
FeBr4
При хлорировании аренов электрофильной частицей
является
хлорид-катион.
При
бромировании
и
иодировании в присутствии FeBr3 и других малоактивных
кислот Льюиса (например, FeСl3), основной атакующей
частицей является поляризованный комплекс, а в
присутствии активных кислот Льюиса (например, AlСl3) –
катион галогена.
3
4. Механизм образования электрофильных частиц в присутствии H2SO4 и I2
Катализ серной кислотой:Cl + HSO4 + HCl
+
HOHlg
–
+
H2SO4 + Cl2
H3O
+
+
HlgOH2
Hlg + H2O
H2O
Катализ иодом:
I2 + Cl2
2ICl
+
Cl–
I
Cl2
+
Cl
ICl
• арены хлорируются при использовании каталитических
количеств иода, так как образуется катион Сl+;
•Арены иодируются при соотношениях близких к
эквимолекулярным , в этом случае образуется I+.
4
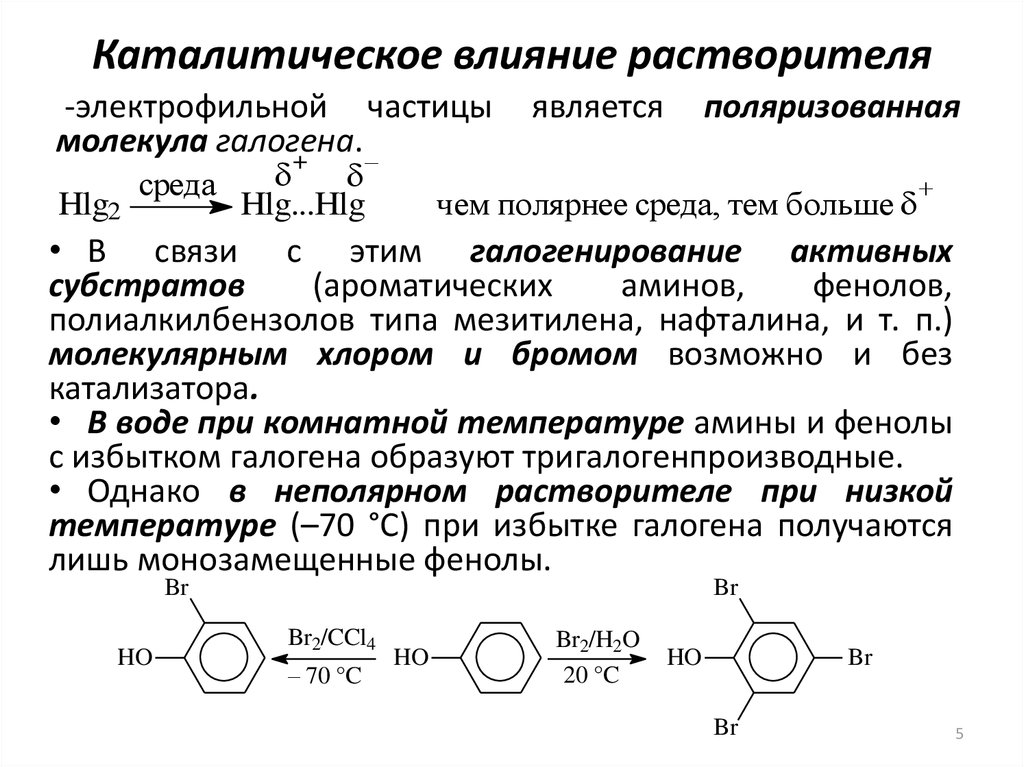
5. Каталитическое влияние растворителя
-электрофильной частицымолекула галогена.
+
–
среда
Hlg2
Hlg...Hlg
является
поляризованная
чем полярнее среда, тем больше
+
• В связи с этим галогенирование активных
субстратов
(ароматических
аминов,
фенолов,
полиалкилбензолов типа мезитилена, нафталина, и т. п.)
молекулярным хлором и бромом возможно и без
катализатора.
• В воде при комнатной температуре амины и фенолы
с избытком галогена образуют тригалогенпроизводные.
• Однако в неполярном растворителе при низкой
температуре (–70 °С) при избытке галогена получаются
лишь монозамещенные фенолы.
Br
HO
Br
Br2/CCl4
– 70 °C
HO
Br2/H2O
20 °C
HO
Br
Br
5
6. Направление и скорость реакции галогенирования аренов а также выход целевого продукта
зависят от (см.лекции):• строения субстрата (устойчивости комплекса),
• природы галогена,
• правильного выбора катализатора,
• а также от других технологических
факторов - кислотности среды, растворителя,
температуры и концентрации реагентов.
6
7. Влияние строения субстрата (устойчивости s-комплекса) и кислотности среды
Влияние строения субстрата (устойчивости-комплекса) и кислотности среды
• В реакциях SE скорость уменьшается: фуран >
нафталин > бензол
• Влияние заместителей в аренах на скорость
галогенирования проявляется сильнее, чем в других
реакциях электрофильного замещения. Ниже приведены
относительные скорости бромирования производных
бензола формулы PhZ:
Z= OH > OCH3 > NHAc > CH3 > H > Cl > NO2
1011
109
108
102
1
0,1 10-6
• Кислотность среды при галогенировании аминов,
фенолов и некоторых других соединений может ускорять
или замедлять реакцию и влиять на её направление:
- Ar-O- > Ar-OH;
- Ar-NH2 >> Ar-NH3+ и изменяется направление реакции
7
8. Активность электрофильной частицы
- очень зависит от галогена и катализатора.• Природа галогена настолько сильно влияет, что
практическое значение имеют в основном хлорирование
и бромирование.
• Прямое фторирование не используется вследствие
очень высокой экзотермичности процесса.
• Иодирование обратимо, идет медленно и требует
активации. Поэтому его часто проводят в присутствии
окислителей, которые смещают равновесие в сторону
образования продукта. Возможно, они окисляют также
молекулярный иод до I+, увеличивая его электрофильность
и скорость реакции:
ArH + I2
2HI + [O]
ArI + HI
I2 + H2O или I2 + [O]
+
–2
2I + O
8
9. Влияние технологических факторов
• Удачный подбор катализатора может обеспечить нетолько высокую скорость, но и селективность процесса.
• Растворитель влияет на скорость реакции, не только
активируя галоген, но и сольватируя субстрат и
промежуточные соединения (теория Хьюза-Ингольда).
При его выборе необходимо учитывать технологические
соображения (токсичность, взрыво-, пожароопасность,
агрессивность и т.д.). Так, наличие воды при
галогенировании аренов приводит к образованию
галогеноводородной кислоты, которая вызывает сильную
коррозию оборудования.
• Температура галогенирования арена, как и в других
процессах,
увеличивает
скорость
реакции.
(температурный коэффициент 2—3).
• Особенности технологии гетеролитического (аренов) и
гомолитического (алканов и в боковую цепь) галогенирования
(самостоятельно)
9
10. Технология хлорирования аренов в безводной среде
• Подготовка хлора – обезвоживание (H2SO4).• Подготовка жидкого сырья - обезвоживание (CaCl2 и
др. реагенты, азеотропная отгонка воды).
• Особенности хлораторов :
развитая теплообменная поверхность;
устройство для диспергирования хлора (барботеры,
турбинные мешалки, в том числе всасывающие);
защита от кислой коррозии;
устройства для размещения катализатора (полки, решетки
и т. п.).
• Обработка продуктов хлорирования
(фракционирование) и др.методы разделения веществ.
• Очистка отходящих газов (конденсационный и
сорбционный методы возврата субстрата, улавливание
хлороводорода)
10
11. Технология бромирования аренов
• Подготовка брома – используют товарный бром илипосле перегонки
• Подготовка субстрата (арена) – осушка, как при
хлорировании.
• Броматоры – не нужна развитая теплообменная
поверхность, быстроходные мешалки, устройства
диспергирования брома. Для защиты от коррозии их
обычно эмалируют или используют никелевые вставки.
• Способы загрузки брома – проблема (жидкий,
растворы, бромо-воздушные смеси).
• Регенерация брома (окисление растворов бромида
натрия хлором и гипохлоритом натрия)
2HBr + 2NaOH
– H2O
2NaBr + 2HCl + NaOCl
Cl2
2NaBr
Br2
– NaCl
Br2 + 3NaCl + H2O
11
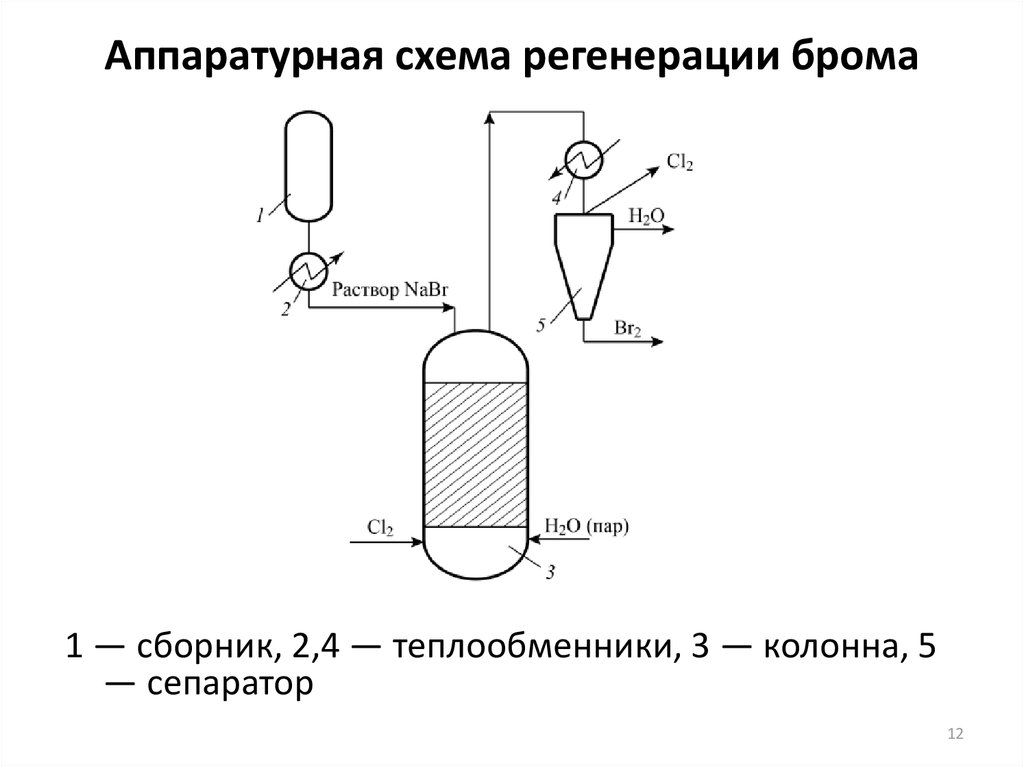
12. Аппаратурная схема регенерации брома
1 — сборник, 2,4 — теплообменники, 3 — колонна, 5— сепаратор
12
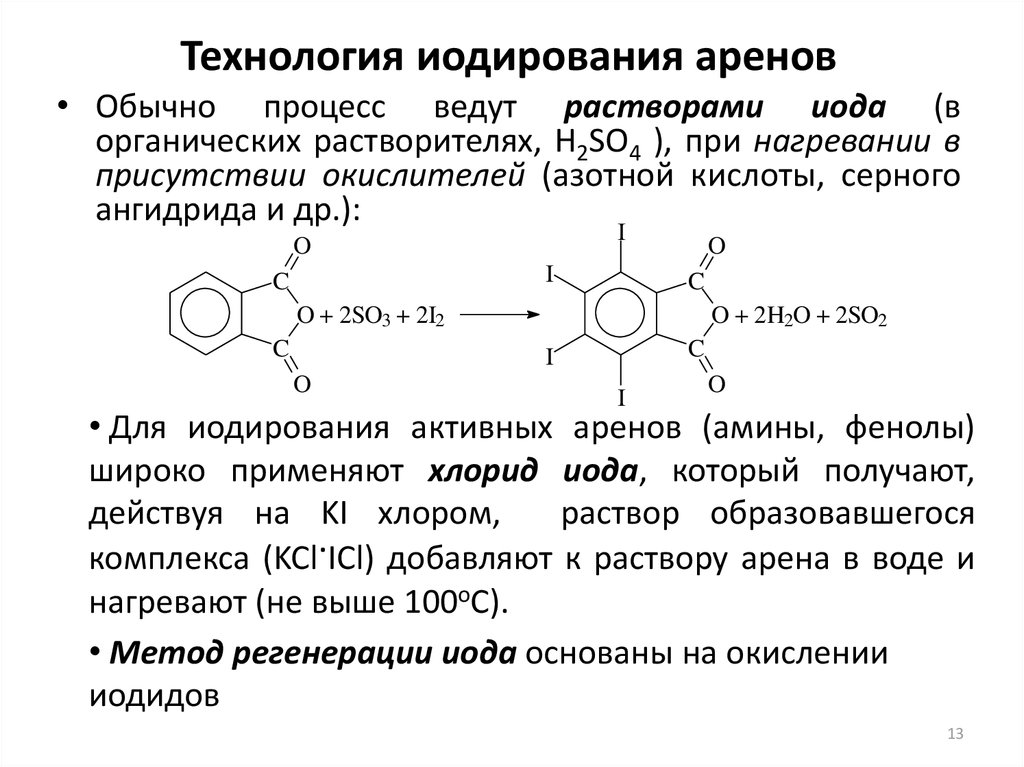
13. Технология иодирования аренов
• Обычно процесс ведут растворами иода (ворганических растворителях, H2SO4 ), при нагревании в
присутствии окислителей (азотной кислоты, серного
ангидрида и др.):
I
O
I
C
O
C
O + 2SO3 + 2I2
C
O + 2H2O + 2SO2
C
I
O
I
O
• Для иодирования активных аренов (амины, фенолы)
широко применяют хлорид иода, который получают,
действуя на KI хлором,
раствор образовавшегося
комплекса (KCl.ICl) добавляют к раствору арена в воде и
нагревают (не выше 100оС).
• Метод регенерации иода основаны на окислении
иодидов
13
14. Галогенирование алканов и в боковую цепь аренов (SR)
hRH + Hlg2
RHlg + HHlg
h , t, R
X2
2X
CH4 X
HX
CH3
X2
CH3X
X
CH4
HX
CH3 – и т.д. – зарождение
и рост цепи
• Тепловой
эффект
реакций
фторирования,
хлорирования, бромирования и иодирования алканов
соответственно около 460, 105, 32, –50 кДж/моль. Поэтому
используют лишь хлорирование и бромирование.
• Иодирование алканов иодом не идет, даже при
специальном инициировании реакции.
• Реакционная способность субстрата и направление
реакции определяется стабильностью образующихся
радикалов.
• Стабильность радикалов уменьшается в ряду
бензильный, аллильный >> третичный > вторичный >
первичный > метильный >> винильный, фенильный.
14
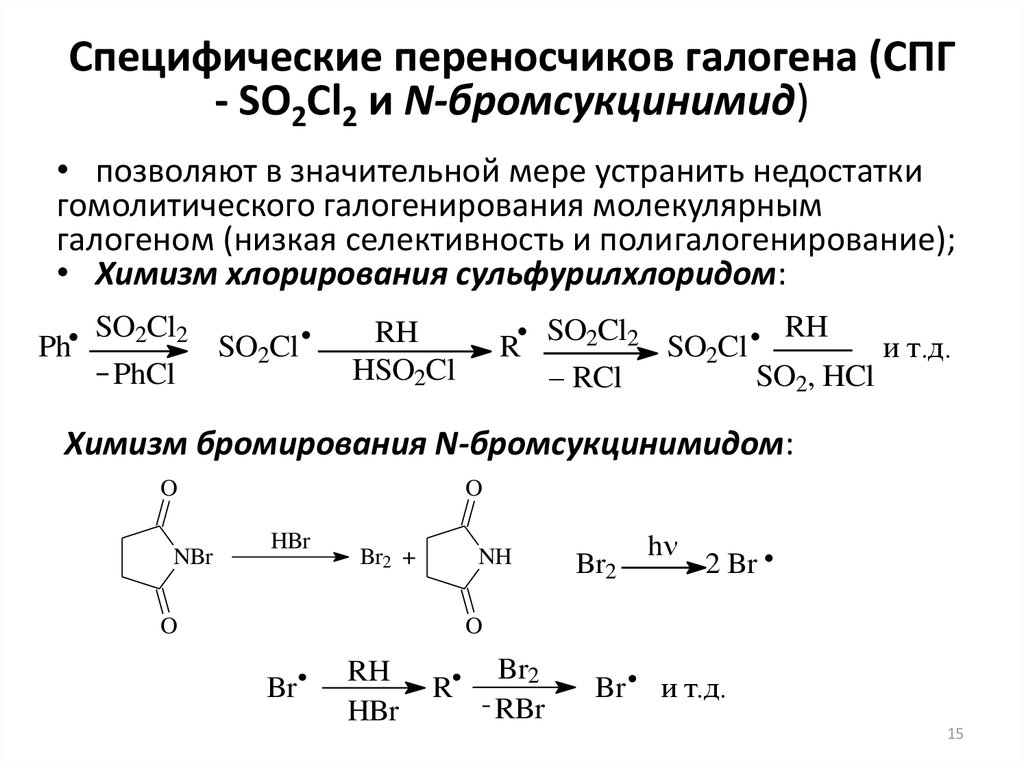
15. Специфические переносчиков галогена (СПГ - SO2Cl2 и N-бромсукцинимид)
• позволяют в значительной мере устранить недостаткигомолитического галогенирования молекулярным
галогеном (низкая селективность и полигалогенирование);
• Химизм хлорирования сульфурилхлоридом:
Ph
SO2Cl2
PhCl
SO2Cl
RH
HSO2Cl
R
SO2Cl2
– RCl
SO2Cl
RH
и т.д.
SO2, HCl
Химизм бромирования N-бромсукцинимидом:
O
NBr
O
HBr
Br2 +
NH
O
Br2
h
2 Br
O
Br
RH
HBr
R
Br2
RBr
Br
и т.д.
15
16. Особенности технологии гомолитического галогенирования
• Гомолитическое галогенирование идет в газовой и вжидкой фазе. При этом необходимо учитывать полярность
и поляризуемость растворителя.
• Жидкофазный процесс, как правило, проводят при
температуре кипения реакционной массы (до 180—
200 °С), избыточное тепло отводится в обратном
холодильнике. Перемешивание за счет кипения и
барботирования хлора.
• Для
инициирования
применяют
погружные
специальные лампы с УФ излучением.
• Необходимо учитывать ингибирующее действия
примесей (кислорода и др.) и катализаторов
гетеролитического галогенирования, например, железа.
Аппаратура должна быть изготовлена из освинцованной
стали,
эмалированного
чугуна,
кислотостойких
неметаллических материалов или стекла.
16
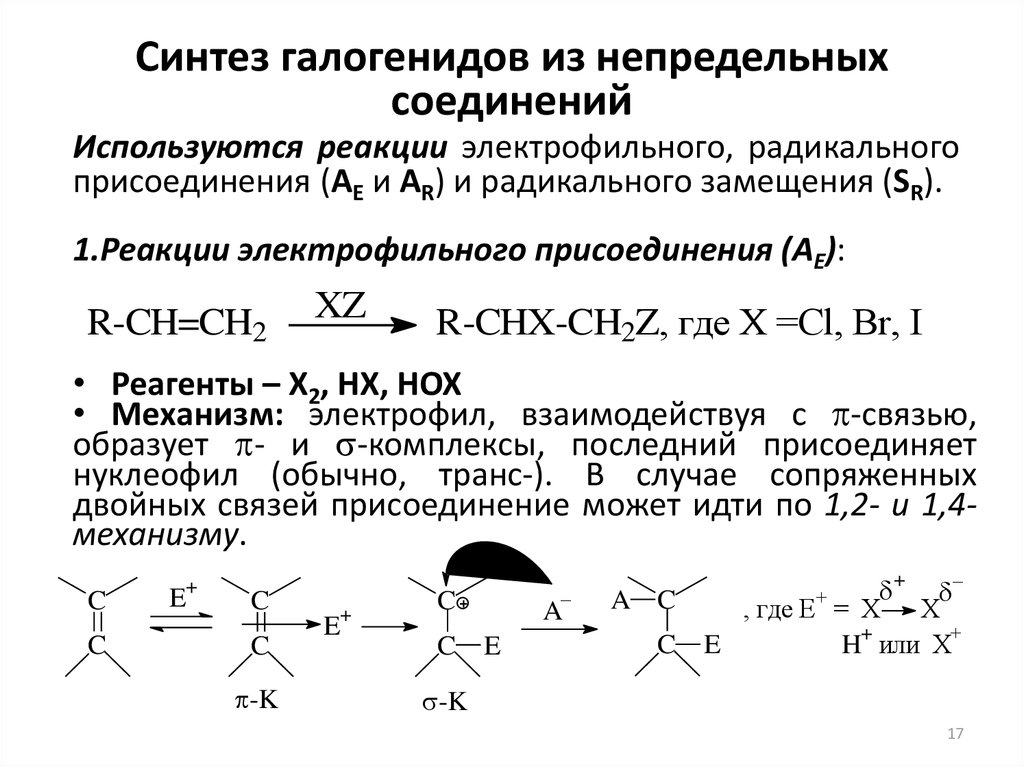
17. Синтез галогенидов из непредельных соединений
Используются реакции электрофильного, радикальногоприсоединения (AE и AR) и радикального замещения (SR).
1.Реакции электрофильного присоединения (AE):
R-CH=CH2
XZ
R-CHX-CH2Z, где Х =Cl, Br, I
• Реагенты – X2, HX, HOX
• Механизм: электрофил, взаимодействуя с -связью,
образует - и -комплексы, последний присоединяет
нуклеофил (обычно, транс-). В случае сопряженных
двойных связей присоединение может идти по 1,2- и 1,4механизму.
C
C
+
E
C
C
-K
+
E
–
C
C
A
E
A C
C
–
+
, где E = X X
+
+
E
H или X
+
-K
17
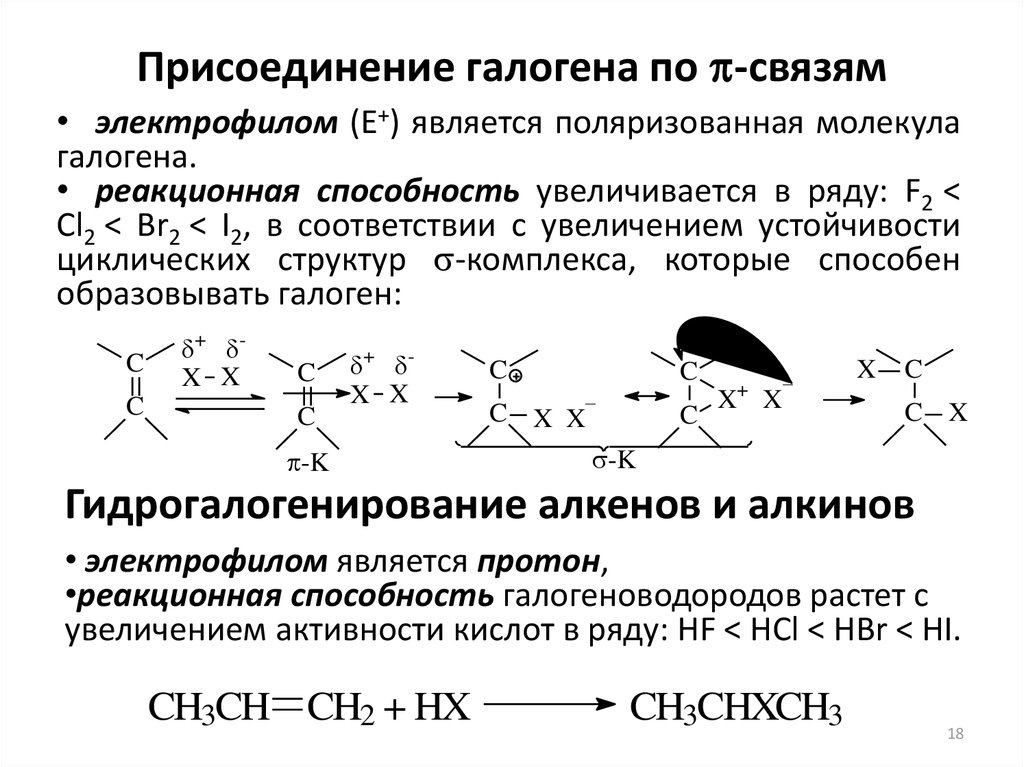
18. Присоединение галогена по p-связям
Присоединение галогена по -связям• электрофилом (Е+) является поляризованная молекула
галогена.
• реакционная способность увеличивается в ряду: F2 <
Cl2 < Br2 < I2, в соответствии с увеличением устойчивости
циклических структур -комплекса, которые способен
образовывать галоген:
C
C
+ X X
C
C
+ X X
-K
C
C
C X X–
C
+
–
X X
X
C
C X
-K
Гидрогалогенирование алкенов и алкинов
• электрофилом является протон,
•реакционная способность галогеноводородов растет с
увеличением активности кислот в ряду: HF < HCl < HBr < HI.
CH3CH CH2 + HX
CH3CHXCH3
18
19. Гипогалогенирование алкенов
• электрофилом(Е+)
является
поляризованные
молекулы HOX, X2 или Х+; образуются галогенгидрины:
CH3CH CH2 + HOX
CH2
CH2
Cl
+
–
Cl
+
Cl
CH2
CH3CH(OH)CHX
–
Cl
CH2
+
–H
Cl
+
–
– Cl
CH2
CH2
CH2
OH
Cl
CH2
H2O
+OH2
CH2
Cl
CH2
• Эта реакция является одним из доказательств
механизма AЕ. Изменяя вторую стадию можно получать:
NaCl, H2O
Br2 +
CH2
NaI, H2O
CH2
NaNO2, H2O
CH2Br
CH2Cl
CH2Br
CH2I
CH2Br
CH2NO2
19
20. Реакционная способность субстрата и направление реакции
- в наибольшей степени зависят от стабильности катиона( -комплекса), которая уменьшается в ряду:
+
+
+
+
+
+
+
+
+
PhC , C=C-C >> R3C > R2CH > R-CH2 > CH3 >> C=C , Ph (Ar )
Поэтому скорость реакции ниже приведенных соединений
с галогеном в одинаковых условиях увеличивается в ряду:
а) этилен (1) < пропилен (2) < изобутилен (5,5) <
тетраметилэтилен (14)
Индукционный эффект радикала повышает стабильность
катиона, поэтому пропилен в 2 раза, изобутилен — в 5,5, а
тетраметилэтилен в 14 раз активнее этилена.
б) ацетилены << алкены << сопряженные диены
Правило Марковникова (уметь доказывать)
20
21. 2.Гомолитическое присоединение (AR) галогенов и галогеноводорода
- Идет при соответствующем инициировании (свет, нагрев,пероксиды) протекает по цепному механизму (AR ):
HBr/H2O2
R-CH CH Br
R-CH=CH X2,h R-CHX-CH X
2
2
HX ( X2 )
C C
X
2
R (h )
- RH(RX)
2
X
X–X
X C C или HX X C C X (H) + X
-Реакционная активность субстрата и направление
реакции зависят от стабильности образующихся
алкильных радикалов, которая изменяется аналогично
устойчивости катионов.
- Уметь объяснять перекисный эффект Караша
3.Гомолитическое
галогенирование
алкенов
(SR)
(самостоятельно)
21
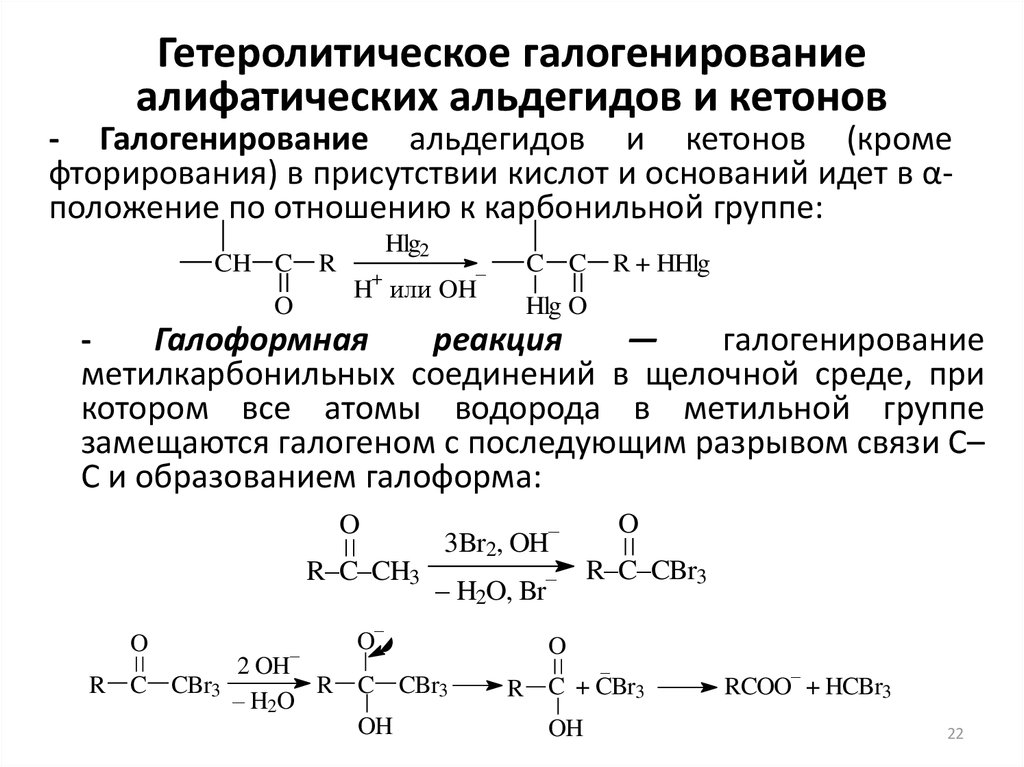
22. Гетеролитическое галогенирование алифатических альдегидов и кетонов
- Галогенирование альдегидов и кетонов (кромефторирования) в присутствии кислот и оснований идет в αположение по отношению к карбонильной группе:
CH C
O
R
Hlg2
–
+
H или OH
C C
R + HHlg
Hlg O
Галоформная
реакция
—
галогенирование
метилкарбонильных соединений в щелочной среде, при
котором все атомы водорода в метильной группе
замещаются галогеном с последующим разрывом связи С–
С и образованием галоформа:
O
R–C–CH3
O
R C CBr3
–
– H2O, Br
–
–
O
–
3Br2, OH
O
2 OH
R C CBr3
– H2O
OH
R–C–CBr3
O
–
R C + CBr3
OH
–
RCOO + HCBr3
22
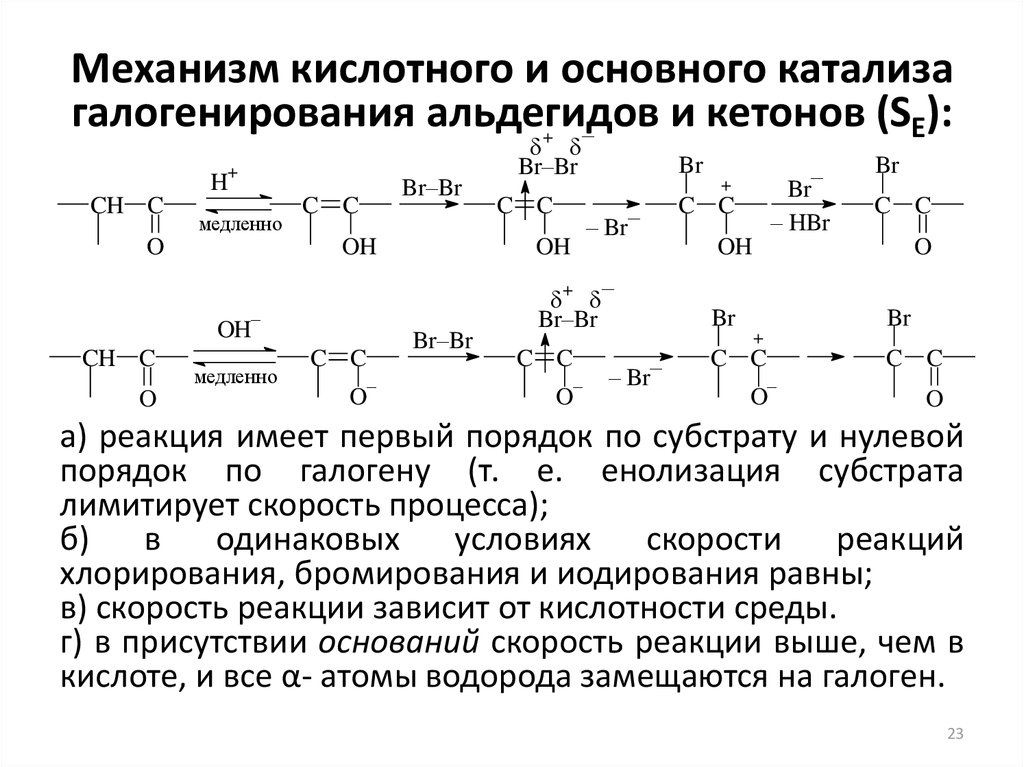
23. Механизм кислотного и основного катализа галогенирования альдегидов и кетонов (SE):
–+
+
H
CH C
медленно
O
Br–Br
C C
OH
Br–Br
C C
OH
–
CH C
O
медленно
Br–Br
C C
–
O
Br–Br
C C
–
O
–
Br
– HBr
+
– Br–
+
OH
Br
C C
Br
C C
OH
O
–
Br
Br
+
– Br–
C C
C C
–
O
O
а) реакция имеет первый порядок по субстрату и нулевой
порядок по галогену (т. е. енолизация субстрата
лимитирует скорость процесса);
б)
в
одинаковых
условиях
скорости
реакций
хлорирования, бромирования и иодирования равны;
в) скорость реакции зависит от кислотности среды.
г) в присутствии оснований скорость реакции выше, чем в
кислоте, и все α- атомы водорода замещаются на галоген.
23
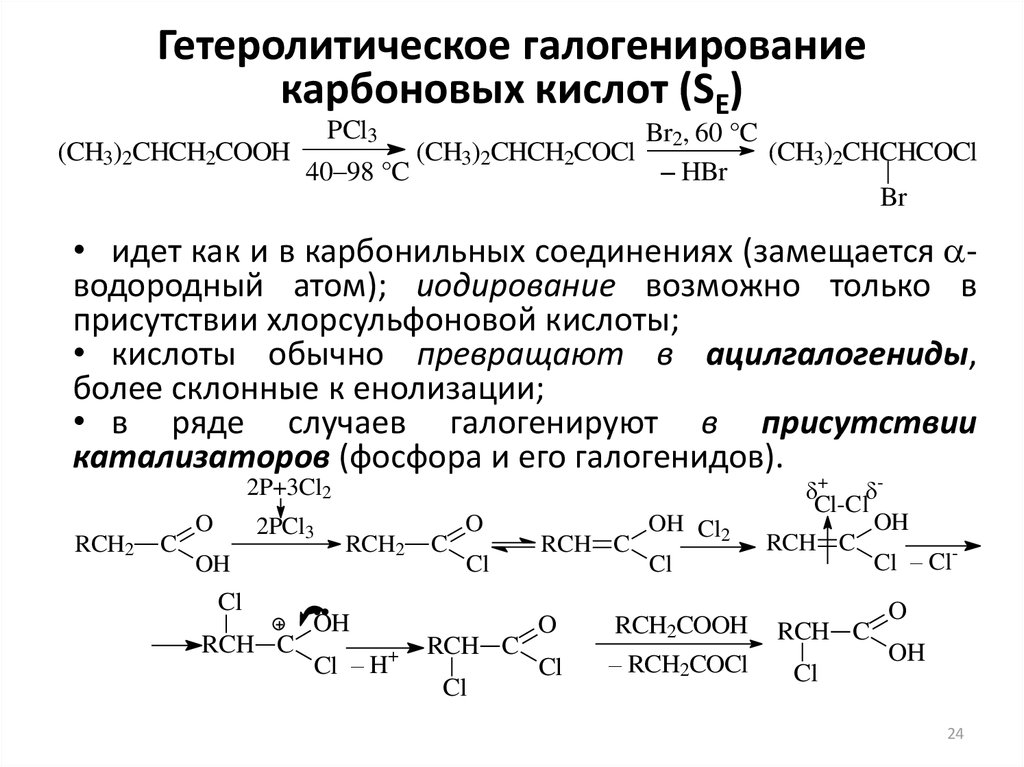
24. Гетеролитическое галогенирование карбоновых кислот (SE)
(CH3)2CHCH2COOHPCl3
40–98 °C
(CH3)2CHCH2COCl
Br2, 60 °C
(CH3)2CHCHCOCl
– HBr
Br
• идет как и в карбонильных соединениях (замещается aводородный атом); иодирование возможно только в
присутствии хлорсульфоновой кислоты;
• кислоты обычно превращают в ацилгалогениды,
более склонные к енолизации;
• в ряде случаев галогенируют в присутствии
катализаторов (фосфора и его галогенидов).
2P+3Cl2
RCH2
C
O
2PCl3
OH
Cl
RCH C
RCH2
OH
Cl – H+
C
O
Cl
RCH C
Cl
RCH C
OH Cl2
Cl
O
RCH2COOH
Cl
– RCH2COCl
+
Cl-Cl
OH
RCH C
Cl – Cl-
RCH C
Cl
O
OH
24
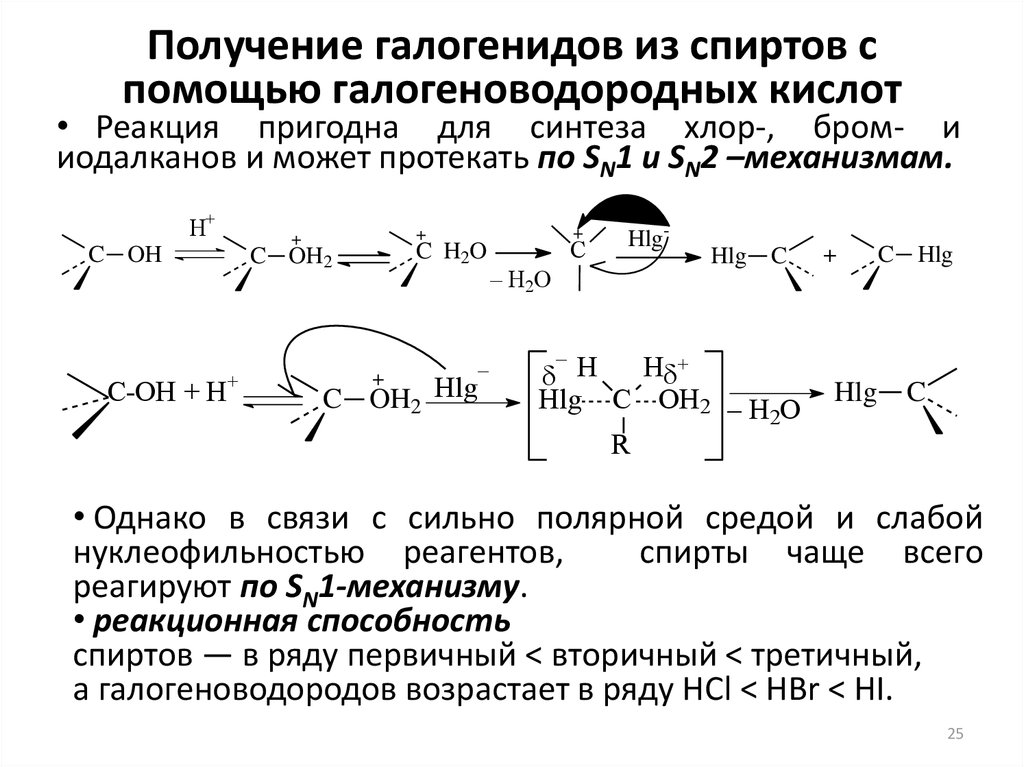
25. Получение галогенидов из спиртов с помощью галогеноводородных кислот
• Реакция пригодна для синтеза хлор-, бром- ииодалканов и может протекать по SN1 и SN2 –механизмам.
H+
C OH
C-OH + H+
+
+
+
C H2O
C OH2
+
–
C OH2 Hlg
C
– H2O
Hlg-
Hlg
C
–
H
H
Hlg C OH2 – H O
2
R
+
Hlg
C Hlg
C
• Однако в связи с сильно полярной средой и слабой
нуклеофильностью реагентов,
спирты чаще всего
реагируют по SN1-механизму.
• реакционная способность
спиртов — в ряду первичный < вторичный < третичный,
а галогеноводородов возрастает в ряду HCl < HBr < HI.
25
26. Реакция спиртов с галогеноводородами
R-OH + HXR-X + H2O (X=I, Br, Cl)
• С избытком концентрированного раствора HI легко
реагируют все спирты,
• с бромоводородной кислотой - вторичные и
третичные,
• с хлороводородной – только третичные.
• В случае менее активных первичных и вторичных
спиртов реакцию ведут в присутствии серной
кислоты, хлорида цинка и др. катализаторов, иногда
при высоких температурах под давлением.
• Процесс
в
ряде
случаев
сопровождается
перегруппировкой углеродного скелета (механизм
SN1), что является недостатком метода. В этих
случаях лучше использовать галогениды фосфора и
тионилхлорид.
26
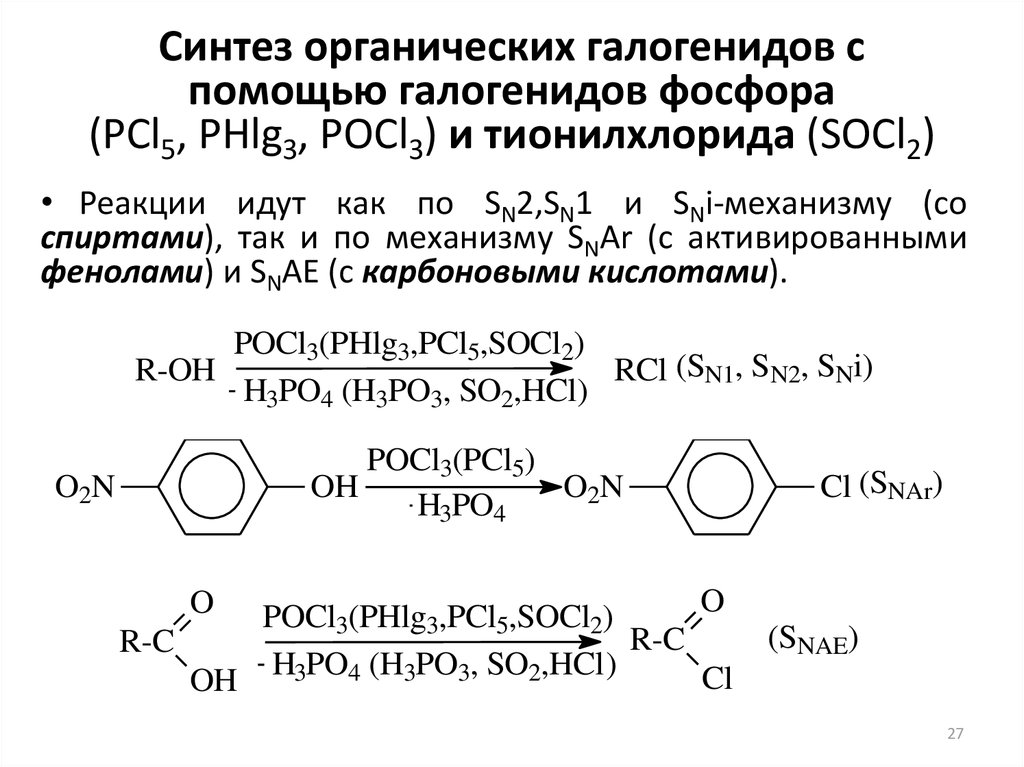
27. Синтез органических галогенидов с помощью галогенидов фосфора (PCl5, PHlg3, POCl3) и тионилхлорида (SOCl2)
• Реакции идут как по SN2,SN1 и SNi-механизму (соспиртами), так и по механизму SNAr (с активированными
фенолами) и SNAE (с карбоновыми кислотами).
POCl3(PHlg3,PCl5,SOCl2)
R-OH
RCl (SN1, SN2, SNi)
H3PO4 (H3PO3, SO2,HCl)
POCl3(PCl5)
OH
O2N
H3PO4
O2N
O
POCl3(PHlg3,PCl5,SOCl2)
R-C
R-C
Cl
OH H3PO4 (H3PO3, SO2,HCl)
Cl (SNAr)
O
(SNAE)
27
28. Синтез органических галогенидов с помощью PCl5, PHlg3, POCl3
• Во всех случаях гидроксил предварительно ацилируетсяс образованием хорошо уходящей группы:
–
POX3 (PX3, PX5)
RCH2–OH
RCH2–O–POX2 X
RCH2X
– HX
– HOPOX2
• Катализаторы:
вещества основного характера или
кислоты (пиридиновый азот ускоряет как реакцию
ацилирования ОН-группы, так и замену эфирной группы
на галоген).
• Ацилгалогениды этим методом получают тогда, когда
продукт реакции можно экстрагировать органическим
растворителем или выделить перегонкой из реакционной
массы. Чтобы ускорить образование хорошо уходящей
группы используют соли карбоновых кислот.
28
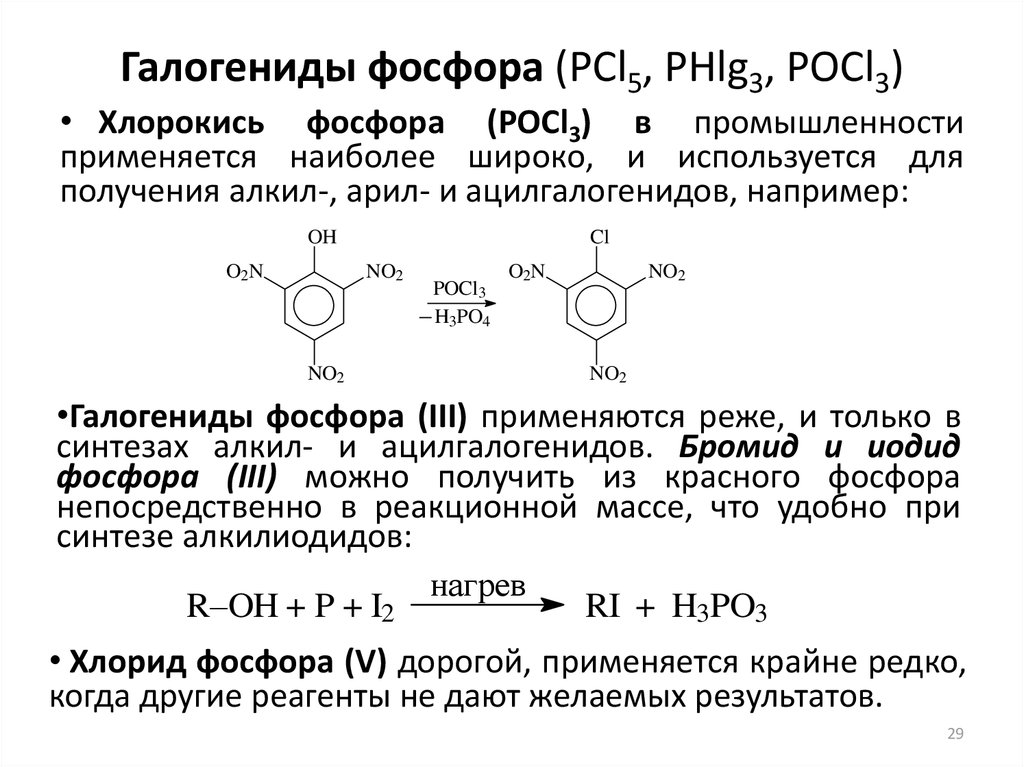
29. Галогениды фосфора (PCl5, PHlg3, POCl3)
• Хлорокись фосфора (POCl3) в промышленностиприменяется наиболее широко, и используется для
получения алкил-, арил- и ацилгалогенидов, например:
OH
O2N
Cl
NO2
NO2
POCl3
H3PO4
O2N
NO2
NO2
•Галогениды фосфора (III) применяются реже, и только в
синтезах алкил- и ацилгалогенидов. Бромид и иодид
фосфора (III) можно получить из красного фосфора
непосредственно в реакционной массе, что удобно при
синтезе алкилиодидов:
нагрев
R–OH + P + I2
RI + H3PO3
• Хлорид фосфора (V) дорогой, применяется крайне редко,
когда другие реагенты не дают желаемых результатов.
29
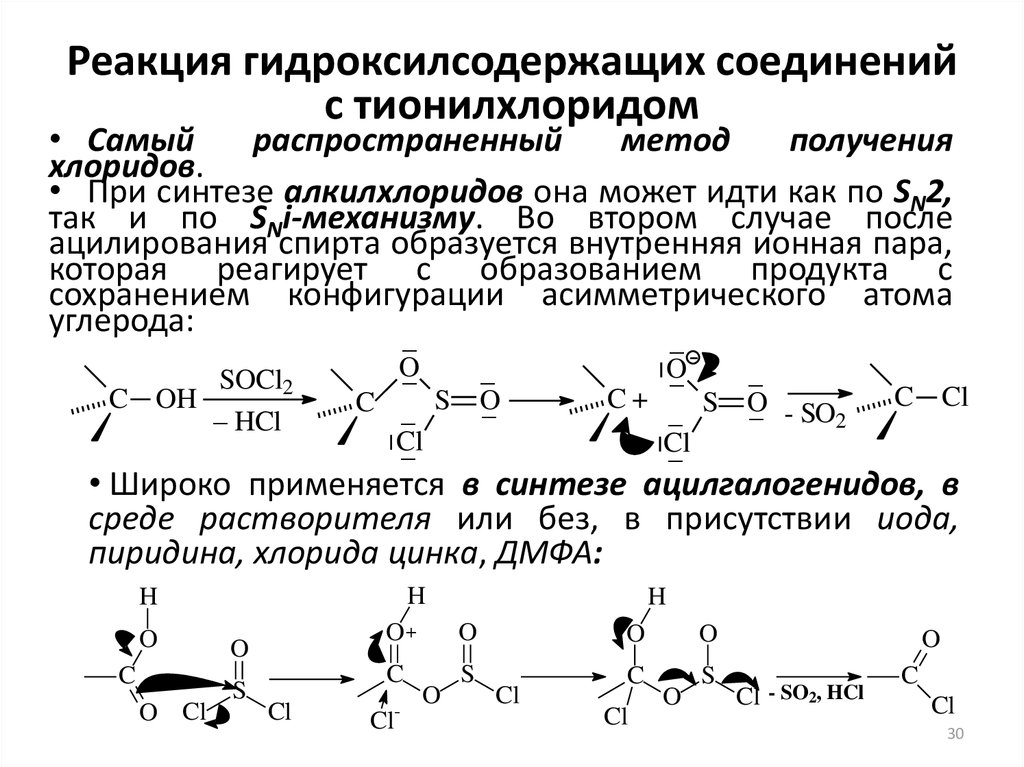
30. Реакция гидроксилсодержащих соединений с тионилхлоридом
• Cамыйраспространенный
метод
получения
хлоридов.
• При синтезе алкилхлоридов она может идти как по SN2,
так и по SNi-механизму. Во втором случае после
ацилирования спирта образуется внутренняя ионная пара,
которая реагирует с образованием продукта с
сохранением конфигурации асимметрического атома
углерода:
C OH
SOCl2
– HCl
–
O
–
S
C
–
Cl
–
–
O
–
–
O
–
C+
S
–
Cl
–
–
O - SO
–
2
C Cl
• Широко применяется в синтезе ацилгалогенидов, в
среде растворителя или без, в присутствии иода,
пиридина, хлорида цинка, ДМФА:
H
H
O
C
O Cl
O
S
Cl
H
O+
O
C
S
Cl-
O
O
Cl
C
Cl
O
O
S
O
Cl - SO2, HCl
C
Cl
30















 Химия
Химия








