Похожие презентации:
Пероральные антикоагулянты в реальной клинической практике
1. Пероральные антикоагулянты в реальной клинической практике
ПЕРОРАЛЬНЫЕАНТИКОАГУЛЯНТЫ
В РЕАЛЬНОЙ
КЛИНИЧЕСКОЙ ПРАКТИКЕ
Кузнецова Т.Ю.
Петрозаводск, 7 октября 2015 г.
2. Актуальность
• 2012 г. – от инсульта в мире умерло 6,7 млн. чел.• 12% всех смертей
• инсульт – 5 млн. инвалидов ежегодно
• ФП – увеличивает риск инсульта в 5 раз
• От 1,5% у лиц в возрасте 50-59 лет до 23,5% для возраста 8089 лет.
World Health Organization. The top 10 causes of death (Fact sheet no 310). 2014.
http://www.who.int/mediacentre/factsheets/fs310/en/index.html (6 January 2015,
date last accessed).
World Heart Federation. The global burden of stroke. 2014. http://www.
world-heart-federation.org/cardiovascular-health/stroke/ (6 January 2015, date
last accessed).
3. Рекомендации ЕОК 2010, 2012, Рекомендации РКО 2012
4. Практическое руководство по применению антикоагулянтов «не-антагонистов витамина К» у больных с неклапанной ФП
5. Определение «неклапанная» ФП
• Отсутствие искусственного механического клапана• Отсутствие умеренного и/или тяжелого митрального
стеноза
• Пациенты с другими «клапанными проблемами»
включались в исследования с НОАК
6. «Клапанные» показания и противопоказания для НОАК
ВозможныПротиво
показаны
Механический искусственный
клапан
+
Умеренный и тяжелый МС
+
Другие легкие и умеренные
пороки
+
Тяжелый аортальный стеноз
+ (данные ограничены,
большинство оперируются)
Биопротез
+ (кроме первых трех
месяцев)
PTAV, TAVI
+ (нет проспективных
исследований, комбин. с АТП)
Реконструкция митрального
клапана
+ (кроме 3-6 мес. После
операции)
ГКМП
+ (нет проспективных данных)
7. Принятие решения о начале антикоагулянтной терапии НОАК – «новые оральные антикоагулянты»
1. Показания для антикоагулянтов – шкала2.
3.
4.
5.
6.
CHA2DS2VASc
Варфарин или НОАК? – согласно Рекомендациям
Возраст, вес
Сопутствующая патология
Принимаемые препараты по другим показаниям
Оценка СКФ
8. Принятие решения о начале НОАК
1. Показания для антикоагулянтов – шкалаCHA2DS2VASc
2.
3.
4.
5.
6.
Варфарин или НОАК? – согласно Рекомендациям
Возраст, вес
Сопутствующая патология
Принимаемые препараты по другим показаниям
Оценка СКФ
9. Шкала оценки риска ТЭ при ФП CHA2DS2-VASc
C (CHF)ХСН/дисфункция ЛЖ
1
H (Hypertension)
АГ
1
A (age)
Возраст ≥ 75 лет
2
D (diabetes mellitus)
СД
1
S (stroke)
Инсульт/ТИА/ТЭ
2
V (vascular)
Сосудистые заболевания (инфаркт,
атеросклероз)
1
A (age)
Возраст 65-74
1
Sс (Sex category)
Пол (женский)
1
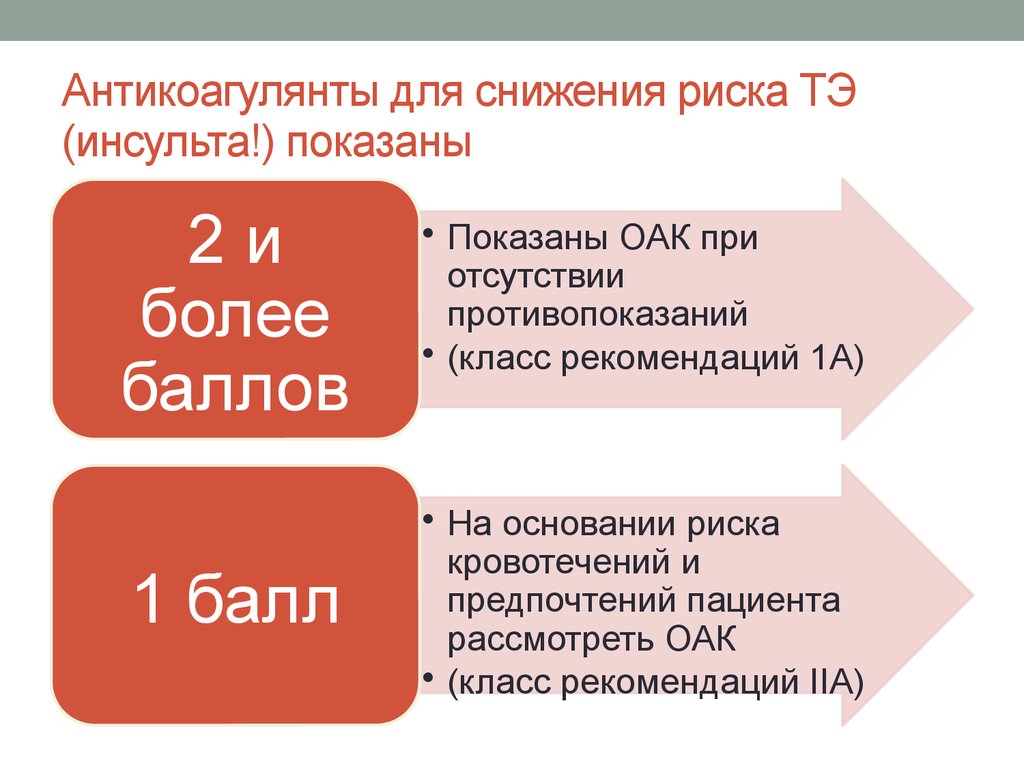
10. Антикоагулянты для снижения риска ТЭ (инсульта!) показаны
2иболее
баллов
• Показаны ОАК при
отсутствии
противопоказаний
• (класс рекомендаций 1А)
1 балл
• На основании риска
кровотечений и
предпочтений пациента
рассмотреть ОАК
• (класс рекомендаций IIА)
11. Шкала риска кровотечений
HA
S
B
баллы
1
1 или 2
3 и более баллов
– риск высокий1 !!
Инсульт
АГ > 160 мм рт. ст.
(Abnormal) Нарушение функции
печени и почек (1 балл на каждое)
Кровотечения или
предрасположенность
1
Высокий риск1
1
1 или 2
– не значит, что
9
нельзя применять Максимум
ОАК!!!
L
E
D
Лабильное МНО
Возраст более 65
Лекарства (аспирин, НПВС) или
алкоголь (1 балл на каждое)
12. Принятие решения о начале НОАК
1.Показания для антикоагулянтов – шкала CHA2DS2VASc
2. Варфарин или НОАК? – согласно
Рекомендациям
3.
4.
5.
6.
Возраст, вес
Сопутствующая патология
Принимаемые препараты по другим показаниям
Оценка СКФ
13. Варфарин
• Доказанный эффект сниженияриска ТЭ осложнений
Наиболее управляемое
действие (при условии четкого
контроля МНО)
Длительное действие
Доступный, дешевый
НО
• Необходимость частого контроля
МНО
• Взаимодействия (лекарства,
продукты)
• Комплаентность?
Мета-анализы Hart,
1999, 2007
• 18 исследований
• 3000 больных ФП
• Применение варфарина
снижает ОР всех
инсультов на 64%
• Абсолютное ежегодное
снижение риска – 2,7% в
год
• Снижение смертности
на 26%
14. Выбор НОАК
ДабигатранАпиксабан
Ривароксабан
Механизм
Прямой
ингибитор
тромбина
Ингибитор Ха
фактора
Ингибитор Ха
фактора
Дозировки
150 мг 2 раза
110 мг 2 раза
5 мг 2 раза
2,5 мг 2 раза
20 мг однократно
15 мг однократно
15. Предпочтения новым, а не варфарину, если:
На фоне варфарина невозможноподдержать МНО 2-3 из-за трудностей
или побочных эффектов
• Класс рекомендаций 1В
Можно начать с НОАК вместо варфарина,
т.к. они лучше, основываясь на их
совокупном клиническом преимуществе
• Класс рекомендаций IIа, А
16. Принятие решения о начале НОАК
1.2.
Показания для антикоагулянтов – шкала CHA2DS2VASc
Варфарин или НОАК? – согласно Рекомендациям
3. Возраст, вес
4. Сопутствующая патология
5. Принимаемые препараты по другим
показаниям
6. Оценка СКФ
17.
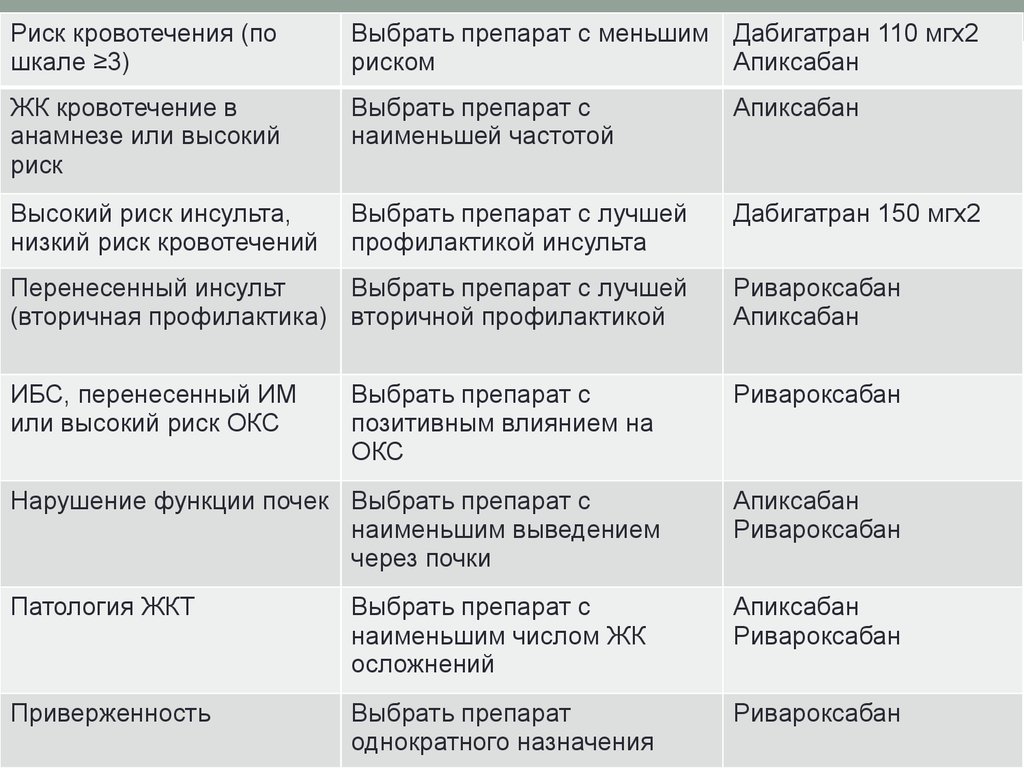
Риск кровотечения (пошкале ≥3)
Выбрать препарат с меньшим Дабигатран 110 мгх2
риском
Апиксабан
ЖК кровотечение в
анамнезе или высокий
риск
Выбрать препарат с
наименьшей частотой
Апиксабан
Высокий риск инсульта,
низкий риск кровотечений
Выбрать препарат с лучшей
профилактикой инсульта
Дабигатран 150 мгх2
Перенесенный инсульт
Выбрать препарат с лучшей
(вторичная профилактика) вторичной профилактикой
Ривароксабан
Апиксабан
ИБС, перенесенный ИМ
или высокий риск ОКС
Выбрать препарат с
позитивным влиянием на
ОКС
Ривароксабан
Нарушение функции почек Выбрать препарат с
наименьшим выведением
через почки
Апиксабан
Ривароксабан
Патология ЖКТ
Выбрать препарат с
наименьшим числом ЖК
осложнений
Апиксабан
Ривароксабан
Приверженность
Выбрать препарат
однократного назначения
Ривароксабан
18. Единая «карта больного, принимающего НОАК»
19. Единая карта
• ФИО, возраст• Адрес
• Препарат, доза, время
приема, связь с приемом
пищи
• Показания и дата старта
терапии
• Антитромботические
препараты – какие, по каким
показаниям, дата
старт/стоп
• ФИО врача,
координирующего прием
НОАК
• Телефон врача или клиники
20. Визиты (планируемые и незапланированные)
• Дата• Место
• Назначения
21. Необходимо контролировать
• Комплаентность• Тромбоэмболические
события
• Кровотечения
• Другие побочные
эффекты
• Другие лекарственные
препараты, их
взаимодействие
• Лабораторный контроль:
креатинин сыв., СКФ, Нв,
АЛАТ, АСАТ
22. Инструкция для пациента
• Следуйте указаниям• Не останавливайте прием
без согласования с
врачом
• Нет препарата – нет
защиты от инсульта!
• Не добавляйте другой
препарат без
согласования
• Предупредите
стоматолога, хирурга и
т.д.
23. Как определить антикоагулянтный эффект?
ДабигатранАпиксабан
Ривароксабан
Пик в плазме
Через 2 часа
Через 1-4 часа
Через 2-4 часа
Длительность
в плазме
12 часов
12 часов
24 часа
Протромбино
вое время
Не применяется
М.б. удлинено, но не М.б. удлинено, но не
изучено влияние на изучено влияние на
кровотечение
кровотечение
МНО
Не применяется
Не применяется
Не применяется
АЧТВ
>2-х ВГН м.б.
риском кровотеч.
Не применяется
Не применяется
dTT diluted
thrombin time
> 200ng/ml ≥65s
м.б. риском
кровот.
Не применяется
Не применяется
ECT ecarine
clotting time
≥3-х ВГН м.б.
риском кровотеч.
Не применяется
Не применяется
ACT activated
clotting time
Не внедрено в
практику
Не применяется
Не применяется
Рутинно не применяются!
24. Всасывание и метаболизм НОАК
25. Принятие решения о начале НОАК
1.2.
Показания для антикоагулянтов – шкала CHA2DS2VASc
Варфарин или НОАК? – согласно Рекомендациям
3. Возраст, вес
4. Сопутствующая патология
5. Принимаемые препараты по другим
показаниям
6. Оценка СКФ
26. Влияют на уровень НОАК в плазме
ДабигатранАпиксабан
Ривароксабан
Амиодарон
+12-60%
Нет данных
Незначительно
Аторвастатин
+18%
Нет данных
Не влияет
Макролиды
+15-20%
Нет данных
+30-54%
Рифампицин
-66%
-54%
-50%
Противогрибковые
+140-150%
+100%
+160%
Карбамазепин,
фенобарбатал
-66%
-54%
-50%
Возраст более 75
лет
Вес менее 60 кг
Дисфункция почек
Другие факторы,
повышающие риск
кровотечения
осторожно
Антитромбоцитарные препараты, НПВС, ГКС, анамнез ГДК,
недавняя операция, тромбоцитопения, HAS-BLED 3 и более
Не применять совместно
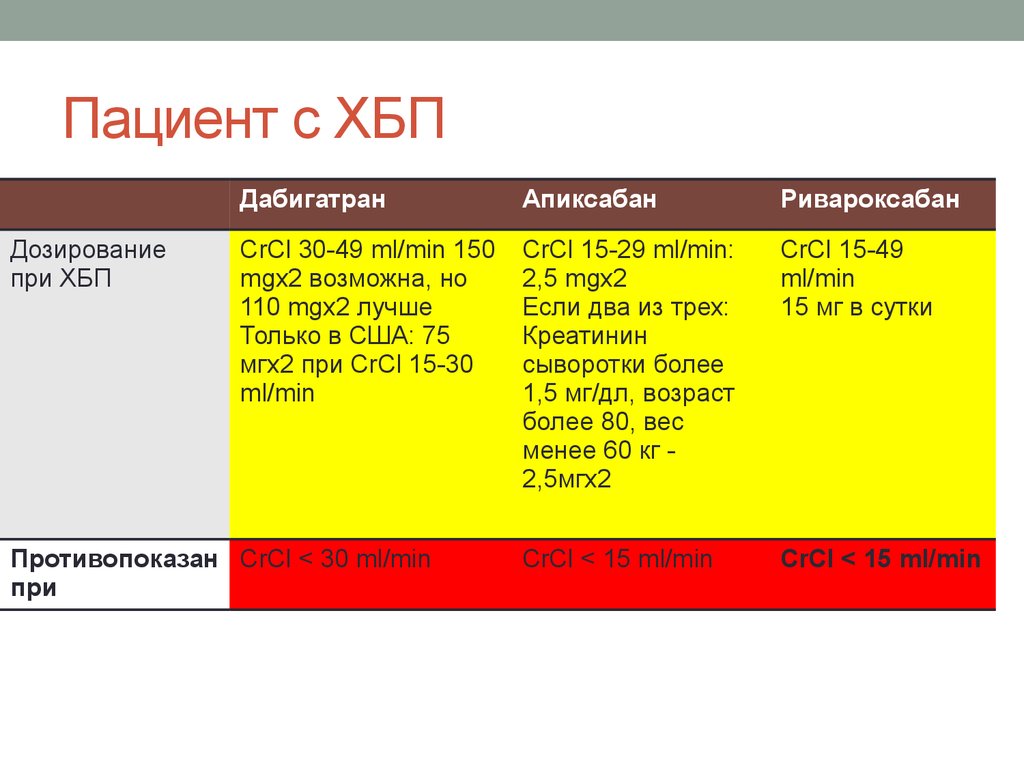
27. Пациент с ХБП
Дозированиепри ХБП
Дабигатран
Апиксабан
Ривароксабан
CrCl 30-49 ml/min 150
mgx2 возможна, но
110 mgx2 лучше
Только в США: 75
мгх2 при CrCl 15-30
ml/min
CrCl 15-29 ml/min:
2,5 mgx2
Если два из трех:
Креатинин
сыворотки более
1,5 мг/дл, возраст
более 80, вес
менее 60 кг 2,5мгх2
CrCl 15-49
ml/min
15 мг в сутки
CrCl < 15 ml/min
CrCl < 15 ml/min
Противопоказан CrCl < 30 ml/min
при
28. Улучшение приверженности
• Обучение пациента• Вовлечение членов семьи
• Обеспечение грамотного наблюдения за пациентом
• Создание базы данных для мониторирования
результатов
• Технологические приспособления (электронные
устройства-напоминания)
• Режим дозирования
• Учесть желание пациента контролировать МНО
29. Исправление «ошибок»
ОшибкаИсправление
Пропустил прием
При режиме двойного приема в сутки – можно принять в
течение 6 часов от пропущенной дозы
При режиме однократного приема – в течение 12 часов
Двойная доза
При режиме двойного приема - пропустить следующий
прием, начать обычный режим через 24 часа
При однократном приеме – на следующий день начать
обычный прием
Не помню,
принимал или нет
При режиме двойного приема – начать обычный прием
через 12 часов
При однократном приеме – зависит от степени риска
инсульта и кровотечения – или принять в этот день, или
на следующий
Передозировка
В зависимости от количества принятых дополнительно
таблеток – госпитализация и мониторирование
30. Кровотечение на фоне НОАК
КровотечениеКровотечение на фоне НОАК
Легкое – пропустить следующую дозу
Умеренное - механическая компрессия, хирургическая,
эндоскопическая, коллоиды, Эр, Тр, СЗП
Жизнеугрожающее - VII фактор, концентрат
протромбинового комплекса
31. Кровотечение на фоне НОАК
ДабигатранНе
Спросить, когда принимал
жизнеугрожа перед этим, в какой дозе
ющее
Следить за гемостазом 12-24
часа при нормальной функции
почек (при CrCl 50-80 – 36
часов, 30-50 – 48 часов, менее
30 - более 48 ч)
Поддерживать диурез
Локальный гемостаз
Коллоиды (при необходимости)
Эритромасса (при
необходимости)
Тромбоконцентрат (Тр <60 г/л)
СЗП
Тронексамовая кислота
Десмопрессин (коагулопатия)
Рассмотреть диализ
Ксабаны
Спросить, когда принимал
перед этим, в какой дозе
Следить за гемостазом 12-24
часа
Локальный гемостаз
Коллоиды (при необходимости)
Эритромасса (при
необходимости)
Тромбоконцентрат (Тр <60 г/л)
СЗП
Тронексамовая кислота
Десмопрессин (коагулопатия)
32. Кровотечение на фоне НОАК
Жизнеугрожающее
Дабигатран
Ксабаны
Все вышеперечисленное
Концентрат протромбинового
комплекса
Активированный концентрат
протромбинового комплекса
Активированный VII фактор
Идаруцизумаб 5 г в/в
Все вышеперечисленное
Концентрат протромбинового
комплекса
Активированный концентрат
протромбинового комплекса
Активированный VII фактор
33. Несмотря на рекомендации
• 38% больных ФП с риском инсульта «2 и болеебаллов» по CHADS2 не применяют АК
Kakkar AK, et al. Risk profiles and antithrombotic treatment of
patients newly diagnosed with atrial fibrillation at risk of stroke:
perspectives from the international, observational, prospective
GARFIELD Registry. PLoS One 2013;8:e63479.
34. ОАК в клинической практике
35. Пациенты, получающие ОАК при ФП
36. Отделение ОНМК РБ им. В.А. Баранова
2014 год176 больных с кардиоэмболическим
инсультом
27% всех ишемических инсультов
Зав. отделением А.А. Васьков,
Данные регистра А.С. Новицкая
37. Причины отсутствия широкого внедрения в практику Рекомендаций по ФП
• Несвоевременная диагностика ФП (мало используется Холтеровскоемониторирование)
Отсутствие длительного контроля для диагностики пароксизмальной ФП
Неправильная оценка (отсутствие оценки) риска тромбоэмболий
Отсутствие осознанного понимания Рекомендаций
Боязнь кровотечений, неправильное толкование шкалы риска кровотечений
Отсутствует опыт применения ОАК
Короткий срок внедрения новых ОАК, путаница в особенностях каждого препарата,
усугубляется различными маркетинговыми подходами от производителей
Часто используются в средствах массовой информации не результаты
клинических исследований, а результаты одиночных наблюдений из практики
Высокая стоимость новых антикоагулянтов
Ограничения, прописанные в инструкции одного препарата, рассматриваются в
качестве показаний для новых антикоагулянтов
что не согласуется с более широким методическим рекомендациям
Административные барьеры, связанные с отсутствием новых антикоагулянтов в
стандартах
38.
Работает ли препарат вконкретных условиях для
определенной цели?
Определенная группа
населения по критериям
Жесткость режима
дозирования
Жесткость соблюдения
режима
Ограничено время
наблюдения
Работает ли препарат в
более широкой популяции в
обычных условиях?
Широкая популяция,
демографические,
клинические особенности
Могут измениться по какимлибо клиническим
обстоятельствам
Неопределенно долго
39. Пациент с ФП в РФ (поликлиника)
48% старше 75 летСредняя сумма
баллов по
HAS-BLED 3±1
Средняя сумма
баллов по
CHA2DS2VASc
5±1,6
93% сочетается с
АГ, ИБС, ХСН
Среднее число СС
диагнозов - 4
Среднее
количество
принимаемых
препаратов по ССЗ
более 3
ХБП 47%
Исследование «Рекваза», М.М. Лукьянов, С.А. Бойцов, С.С. Якушин, др.
40. Анализ по данным страховых кампаний >250 000 пациентов, принимавших дабигатран и варфарин
Анализ по данным страховых кампаний >250 000 пациентов,принимавших дабигатран и варфарин
Clinical practice (N>250 000 patients)
RE-LY®
(N>18 000)
FDA Medicare
study
(N>134 000)1
US Dept of
Defense
database
(N>25 000)2
2 US insurance
databases
(N>38 000)3
Danish
observational
studies
(N>21 000)4,5
US insurance
database
(N>64 000)6
In the USA, the licensed doses for Pradaxa ® are:
150 mg BID and 75 mg BID for the prevention of stroke
and systemic embolism in adult patients with NVAF
1. Graham et al. Circulation 2015; 2. Villines et al. Circulation
2014; 3. Seeger et al. Circulation 2014; 4. Larsen et al. Am J
Med 2014a; 5. Larsen et al. Am J Med 2014b; 6.
Lauffenburger et al. J Am Heart Assoc 2015
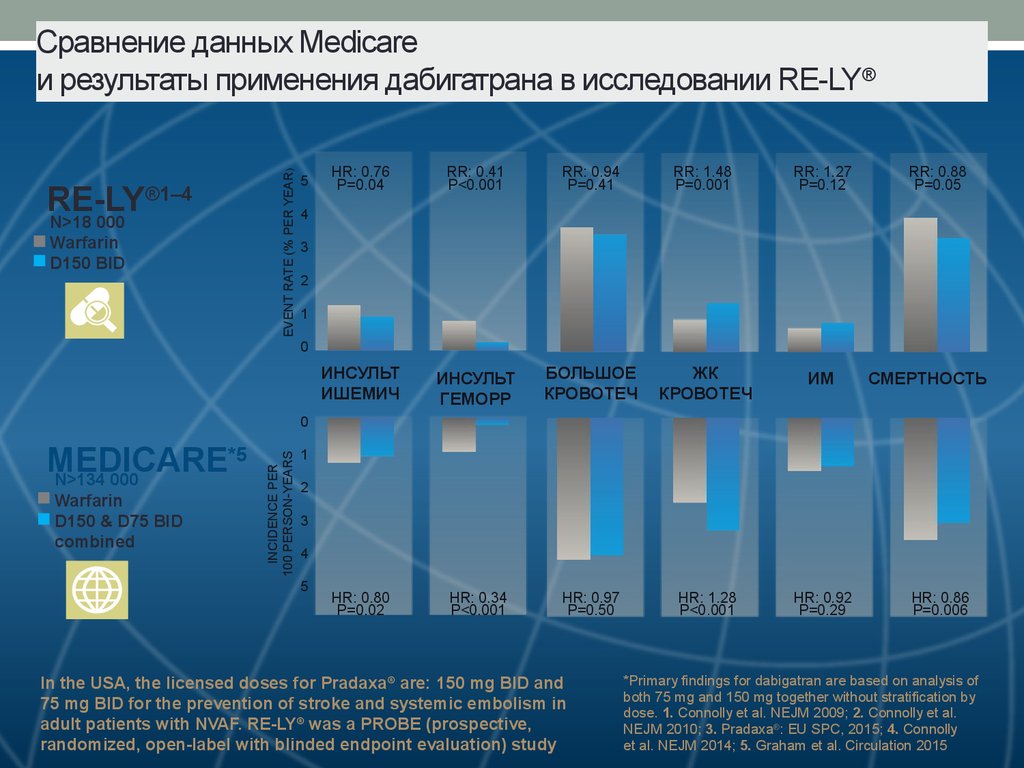
41. Сравнение данных Medicare и результаты применения дабигатрана в исследовании RE-LY®
®1–4RE-LY
N>18 000
Warfarin
D150 BID
EVENT RATE (% PER YEAR)
Сравнение данных Medicare
и результаты применения дабигатрана в исследовании RE-LY®
5
HR: 0.76
P=0.04
RR: 0.41
P<0.001
RR: 0.94
P=0.41
RR: 1.48
P=0.001
RR: 1.27
P=0.12
ИНСУЛЬТ
ИШЕМИЧ
ИНСУЛЬТ
ГЕМОРР
БОЛЬШОЕ
КРОВОТЕЧ
ЖК
КРОВОТЕЧ
ИМ
HR: 0.80
P=0.02
HR: 0.34
P<0.001
HR: 0.97
P=0.50
HR: 1.28
P<0.001
HR: 0.92
P=0.29
RR: 0.88
P=0.05
4
3
2
1
0
СМЕРТНОСТЬ
*5
MEDICARE
N>134 000
Warfarin
D150 & D75 BID
combined
INCIDENCE PER
100 PERSON-YEARS
0
1
2
3
4
5
In the USA, the licensed doses for Pradaxa ® are: 150 mg BID and
75 mg BID for the prevention of stroke and systemic embolism in
adult patients with NVAF. RE-LY® was a PROBE (prospective,
randomized, open-label with blinded endpoint evaluation) study
HR: 0.86
P=0.006
*Primary findings for dabigatran are based on analysis of
both 75 mg and 150 mg together without stratification by
dose. 1. Connolly et al. NEJM 2009; 2. Connolly et al.
NEJM 2010; 3. Pradaxa®: EU SPC, 2015; 4. Connolly
et al. NEJM 2014; 5. Graham et al. Circulation 2015
42. База данных DoD и исследование RE-LY®
®1–4RE-LY
N>18 000
Warfarin
D150 BID
EVENT RATE (% PER YEAR)
База данных DoD и исследование RE-LY®
5
HR: 0.64
P<0.001
HR: 0.76
P=0.04
инсульт
Иш
ИНСУЛЬТ
HR: 0.73
P=0.03
HR: 0.84
P=0.25
RR: 0.41
P<0.001
RR: 0.94
P=0.41
RR: 1.27
P=0.12
ГЕМОРР
ИНСУЛЬТ
БОЛЬШОЕ
КРОВОТЕЧ
им
HR: 0.49
P=0.004
HR: 0.87
P=0.09
HR: 0.65
P=0.02
RR: 0.88
P=0.05
4
3
2
1
0
Warfarin
D150 & D75 BID
combined
0
INCIDENCE PER
100 PERSON-YEARS
*5
DoD
N>25 000
СМЕРТНОСТЬ
1
2
3
4
5
In the USA, the licensed doses for Pradaxa ® are: 150 mg BID and
75 mg BID for the prevention of stroke and systemic embolism in
adult patients with NVAF. RE-LY® was a PROBE (prospective,
randomized, open-label with blinded endpoint evaluation) study
HR: 0.64
P<0.0001
*Primary findings for dabigatran are based on analysis of
both 75 mg and150 mg together without stratification by
dose. 1. Connolly et al. NEJM 2009; 2. Connolly et al.
NEJM 2010; 3. Pradaxa®: EU SPC, 2015; 4. Connolly et al.
NEJM 2014; 5. Villines et al. Circulation 2014
43. База данных US Health Insurance
®1–4RE-LY
N>18 000
Warfarin
D150 BID
EVENT RATE (% PER YEAR)
База данных US Health Insurance
HR: 0.64
P<0.001
HR: 0.76
P=0.04
ИНСУЛЬТ
ИШ
ИНСУЛЬТ
RR: 0.41
P<0.001
RR: 0.94
P=0.41
RR: 1.27
P=0.12
RR: 1.48
P=0.001
БОЛЬШОЕ
КРОВОТЕЧ
ИМ
ЖК
КРОВОТЕЧ
HR: 0.89
(0.57–1.38)
HR: 0.97
(0.79–1.18)
5
4
3
2
1
0
Warfarin
D150 & D75 BID
combined
0
INCIDENCE PER
100 PERSON-YEARS
US Health
*5
Insurance
N>38 000
ГЕМОРР
ИНСУЛЬТ
1
2
3
4
5
6
HR: 0.77
(0.54–1.09)
HR: 0.92
(0.62–1.35)
HR: 0.31
(0.17–0.54)
In the USA, the licensed doses for Pradaxa ® are: 150 mg BID and
75 mg BID for the prevention of stroke and systemic embolism in
adult patients with NVAF. RE-LY® was a PROBE (prospective,
randomized, open-label with blinded endpoint evaluation) study
HR: 0.75
(0.65–0.87)
*Primary findings for dabigatran are based on analysis of
both 75 mg and 150 mg together without stratification by
dose. 1. Connolly et al. NEJM 2009; 2. Connolly et al. NEJM
2010; 3. Pradaxa®: EU SPC, 2015; 4. Connolly et al. NEJM
2014; 5. Seeger et al. Circulation 2014
44. Кровотечения, включая внутричерепное кровоизлияние
Dabigatran 110 mg BIDHR* (95% CI)
Любое
Any
Большое
Фатальное
Major
ЖК
ВЧ
Fatal
0.72 (0.59–0.88)
0.93 (0.74–1.16)
0.52 (0.28–0.95)
GI
0.50 (0.27–0.94)
Любое
ICH
Большое
Dabigatran Фатальное
150 mg BID
ЖК
Any
ВЧ
Major
Fatal
GI
0.30 (0.17–0.54)
0.68 (0.55–0.84)
Favours dabigatran
0.10
0.50 1.00
Favours warfarin
2.00
VKA-naïve stratum
5.00
0.67 (0.53–0.85)
0.70 (0.33–1.52)
1.45 (0.84–2.50)
*HR adjusted for: age, components of CHA 2DS2-VASc, HAS-BLED, months since August 2011
ICH
0.33
Larsen et al. Am J Med 2014a
(0.17–0.66)
45. RE-VOLUTION® - исследовательская программа
Primary VTE preventionПрофилактика
ВТЭ
Primary prevention of stroke in
Профилактика
patientsинсульта
with AF при ФП
Study of patients
with ACS*
Пациенты
с ОКС
Primary stroke prevention in patients
with mechanical heart valves**
Вторичная профилактика
Stroke prevention in ESUS
инсульта
Лечение
острого
Acute VTE treatment
венозного тромбоза
Secondary VTE prevention
Профилактика
ВТЭ
Specific
reversal agent
антидот
*Phase II; **Dabigatran is contraindicated in patients with prosthetic heart valves requiring anticoagulant treatment
ACS, acute coronary syndrome; ESUS, embolic stroke of undetermined source
45
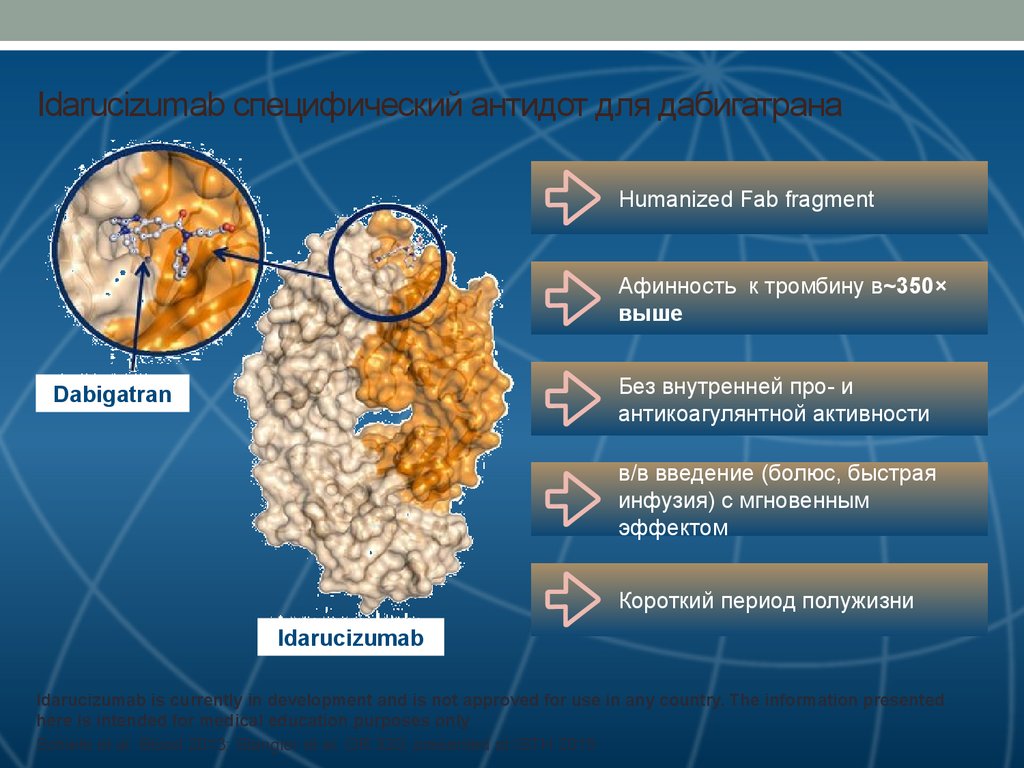
46. Idarucizumab специфический антидот для дабигатрана
Humanized Fab fragmentАфинность к тромбину в~350×
выше
Без внутренней про- и
антикоагулянтной активности
Dabigatran
в/в введение (болюс, быстрая
инфузия) с мгновенным
эффектом
Короткий период полужизни
Idarucizumab
Idarucizumab is currently in development and is not approved for use in any country. The information presented
here is intended for medical education purposes only
Schiele et al. Blood 2013; Stangier et al. OR 320; presented at ISTH 2015
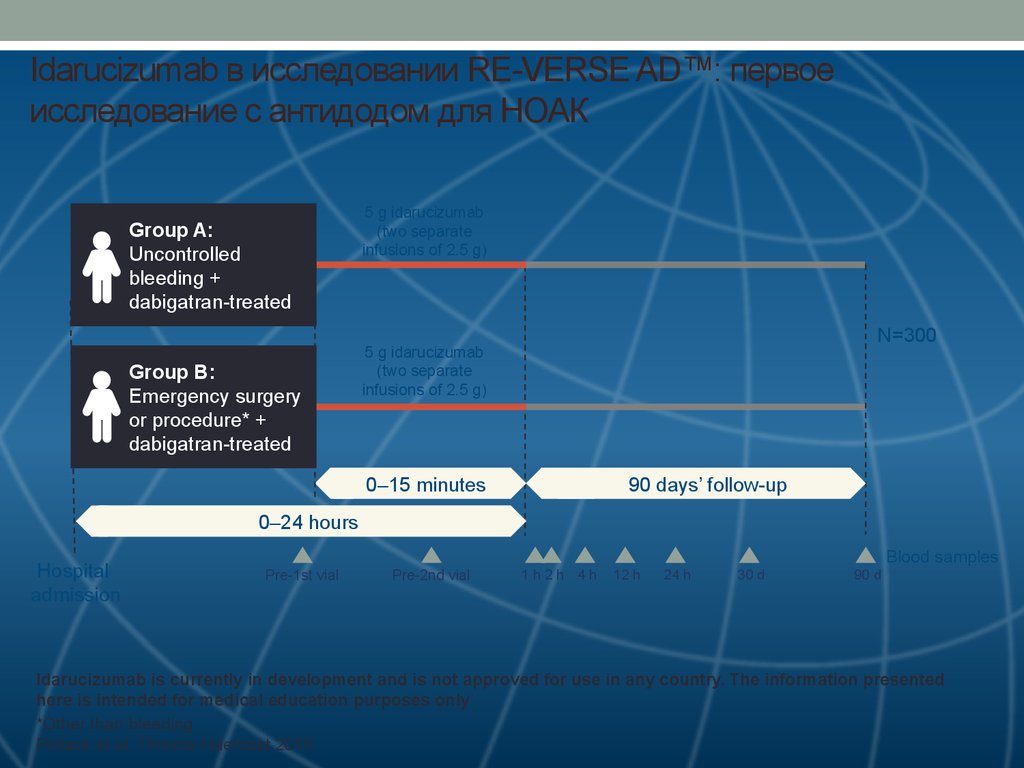
47. Idarucizumab в исследовании RE-VERSE AD™: первое исследование с антидодом для НОАК
Group A:Uncontrolled
bleeding +
dabigatran-treated
Group B:
Emergency surgery
or procedure* +
dabigatran-treated
5 g idarucizumab
(two separate
infusions of 2.5 g)
N=300
5 g idarucizumab
(two separate
infusions of 2.5 g)
0–15 minutes
90 days’ follow-up
0–24 hours
Hospital
admission
Blood samples
Pre-1st vial
Pre-2nd vial
1h2h 4h
12 h
24 h
30 d
90 d
Idarucizumab is currently in development and is not approved for use in any country. The information presented
here is intended for medical education purposes only
*Other than bleeding
Pollack et al. Thromb Haemost 2015
48. Рекомендации ЕОК 2010, 2012, Рекомендации РКО 2012
49. внедрить рекомендации по ведению больного с ФП в реальную клиническую практику!!!
ВНЕДРИТЬ РЕКОМЕНДАЦИИ ПОВЕДЕНИЮ БОЛЬНОГО С ФП В
РЕАЛЬНУЮ КЛИНИЧЕСКУЮ
ПРАКТИКУ!!!
50.
51.
инр
фа
р
ва
ан
б
а
с
апик
бан
а
с
к
ро
рива
даби
гатра
н
ТРОМБ













































 Медицина
Медицина








