Похожие презентации:
Алкены и Алкины
1.
1ViTa_Chem&Bio
2.
2Преподаватель: Червонная Татьяна Артемовна, КубГУ
ViTa_Chem&Bio
ViTa_Chem&Bio
Алканы
3.
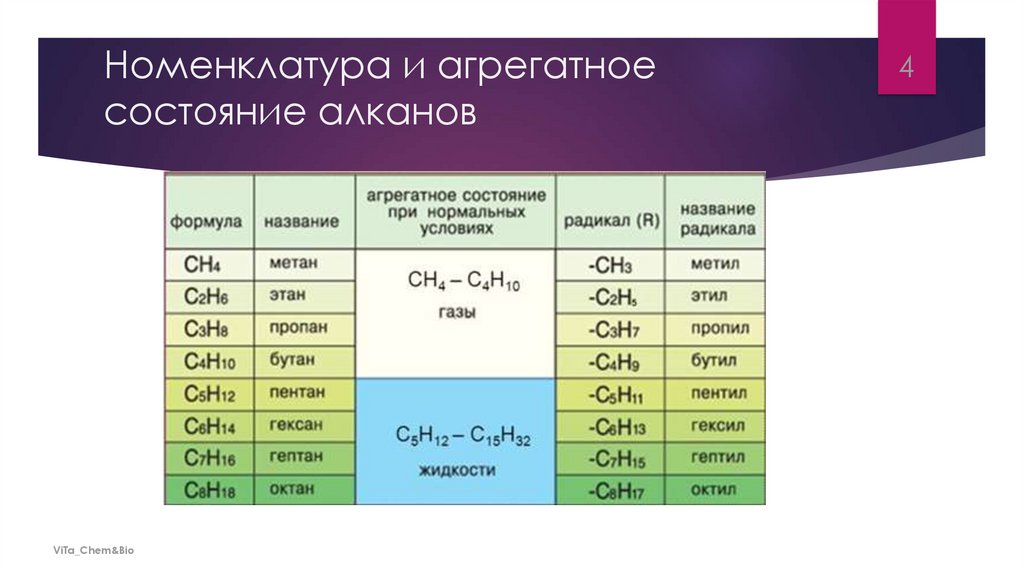
3Алканы
Алканы - органические ациклические соединения. состоящие из
атомов химических элементов углерода и водорода и имеющие в
молекулах только одинарные углерод-углеродные связи (-связи)
парафины;
насыщенные углеводороды;
предельные углеводороды.
ViTa_Chem&Bio
4.
Номенклатура и агрегатноесостояние алканов
ViTa_Chem&Bio
4
5.
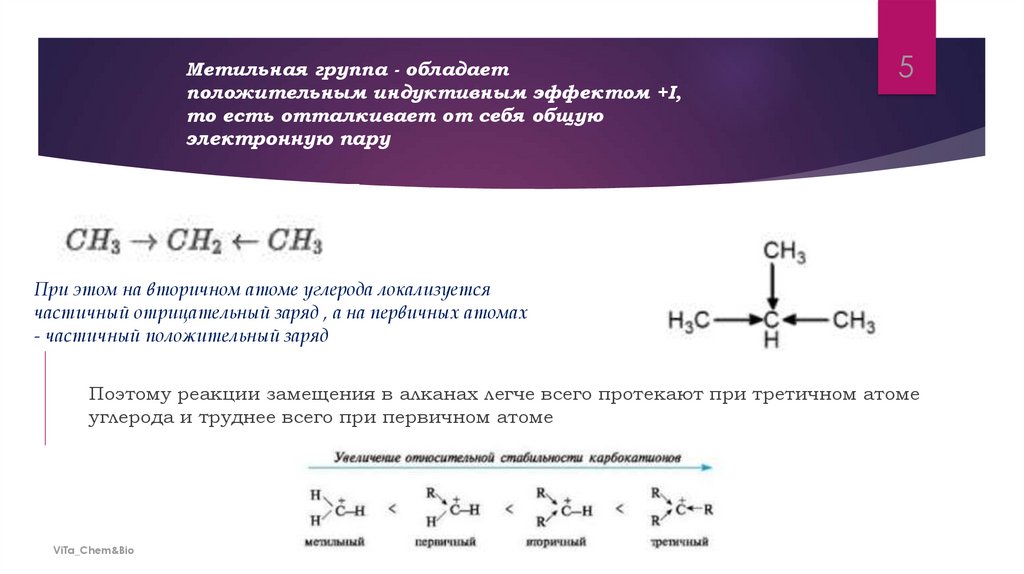
Метильная группа - обладаетположительным индуктивным эффектом +I,
то есть отталкивает от себя общую
электронную пару
5
При этом на вторичном атоме углерода локализуется
частичный отрицательный заряд , а на первичных атомах
- частичный положительный заряд
Поэтому реакции замещения в алканах легче всего протекают при третичном атоме
углерода и труднее всего при первичном атоме
ViTa_Chem&Bio
6.
6ViTa_Chem&Bio
Алкены и Алкины
7.
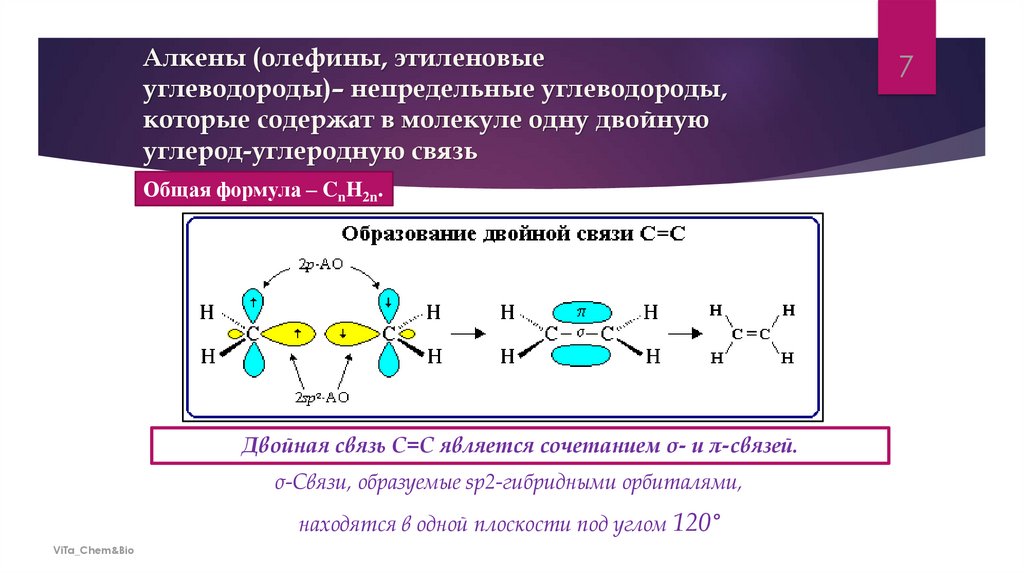
Алкены (олефины, этиленовыеуглеводороды)– непредельные углеводороды,
которые содержат в молекуле одну двойную
углерод-углеродную связь
Общая формула – CnH2n.
Двойная связь C=C является сочетанием σ- и π-связей.
σ-Связи, образуемые sp2-гибридными орбиталями,
находятся в одной плоскости под углом 120°
ViTa_Chem&Bio
7
8.
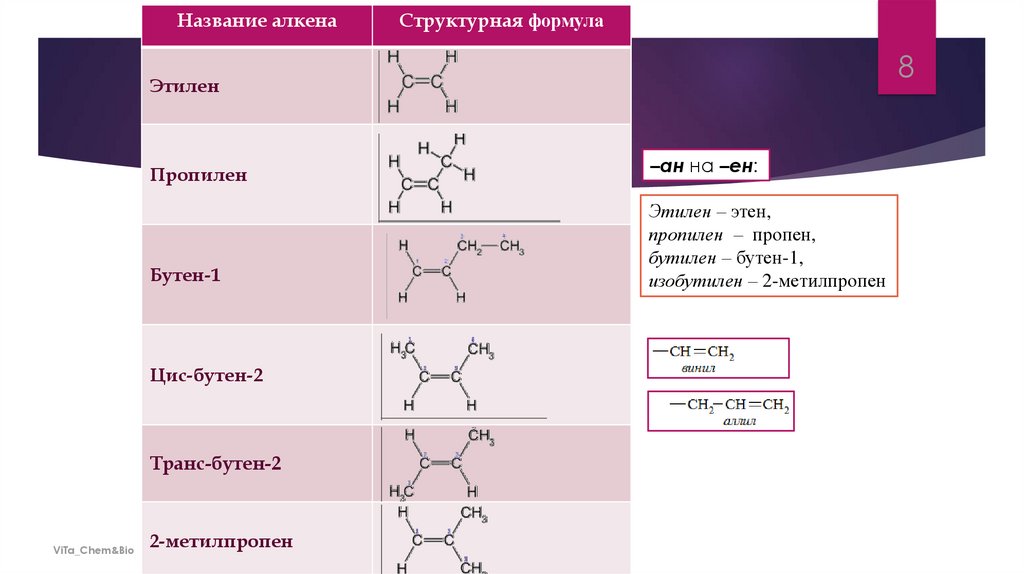
Название алкенаСтруктурная формула
8
Этилен
Пропилен
Бутен-1
Цис-бутен-2
Транс-бутен-2
ViTa_Chem&Bio
2-метилпропен
–ан на –ен:
Этилен – этен,
пропилен – пропен,
бутилен – бутен-1,
изобутилен – 2-метилпропен
9.
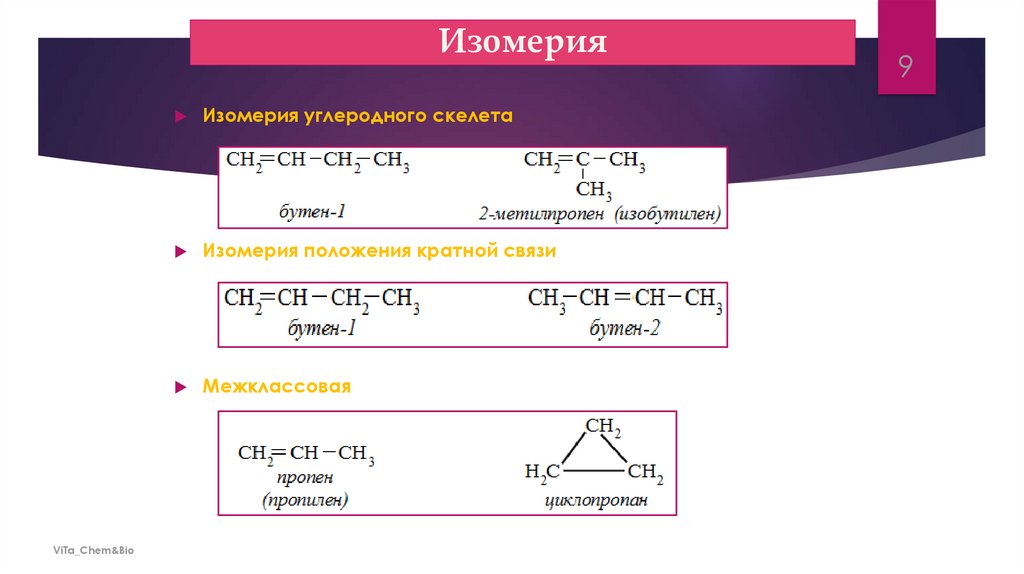
ИзомерияViTa_Chem&Bio
Изомерия углеродного скелета
Изомерия положения кратной связи
Межклассовая
9
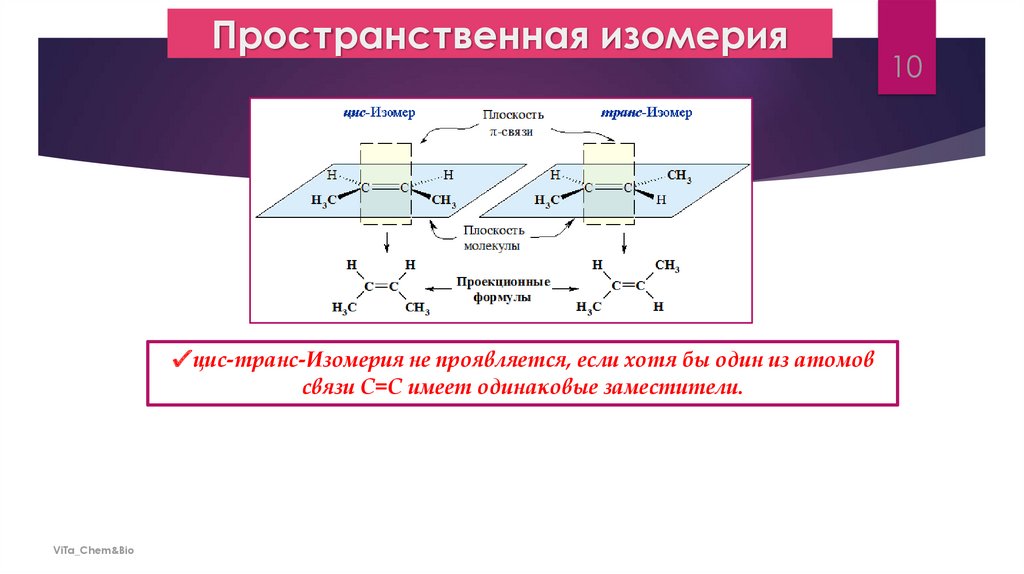
10.
Пространственная изомерия✔ цис-транс-Изомерия не проявляется, если хотя бы один из атомов
связи С=С имеет одинаковые заместители.
ViTa_Chem&Bio
10
11.
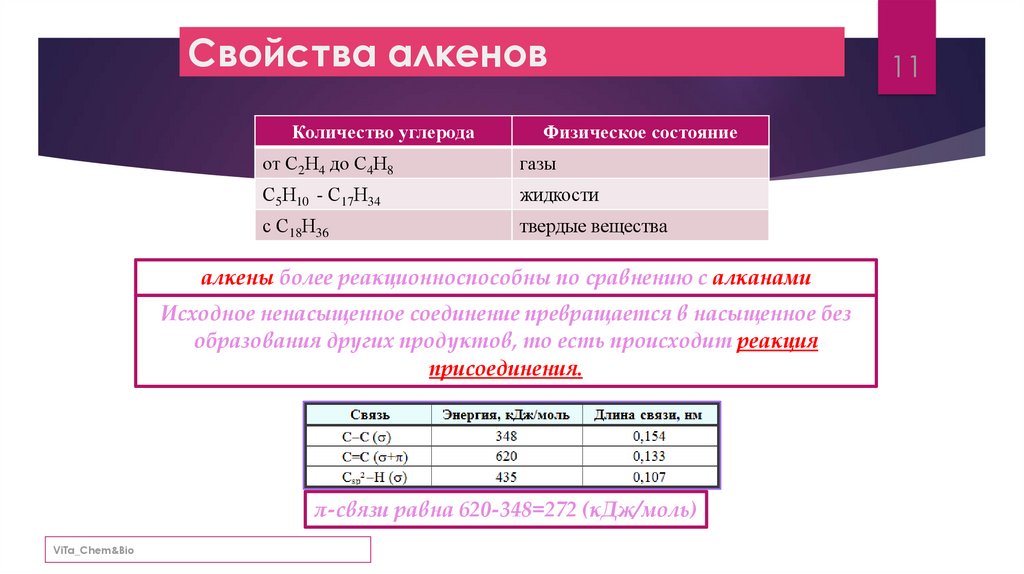
Свойства алкеновКоличество углерода
Физическое состояние
от С2Н4 до С4Н8
газы
С5Н10 - С17Н34
жидкости
с С18Н36
твердые вещества
алкены более реакционноспособны по сравнению с алканами
Исходное ненасыщенное соединение превращается в насыщенное без
образования других продуктов, то есть происходит реакция
присоединения.
π-связи равна 620-348=272 (кДж/моль)
ViTa_Chem&Bio
11
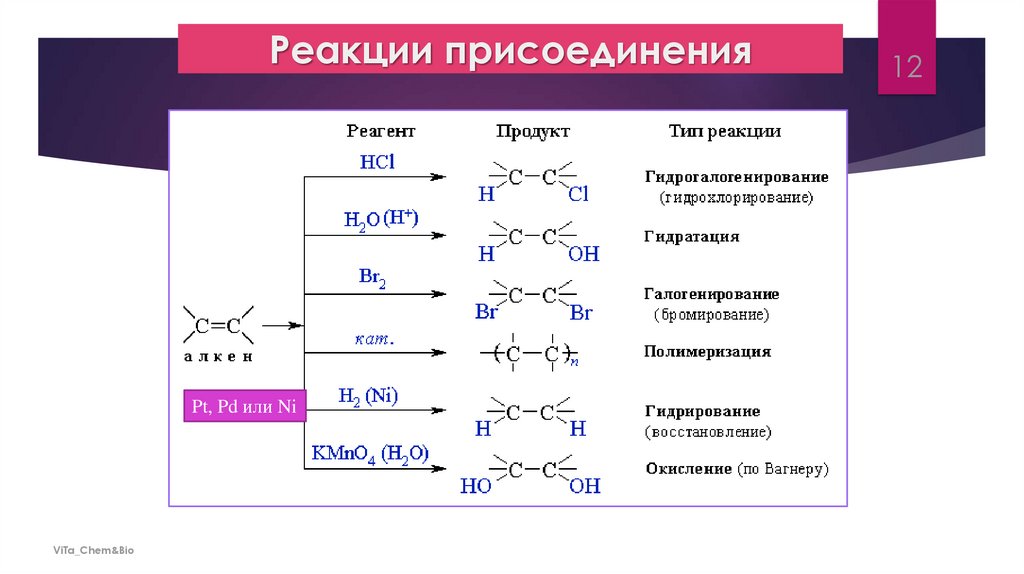
12.
Реакции присоединенияPt, Pd или Ni
ViTa_Chem&Bio
12
13.
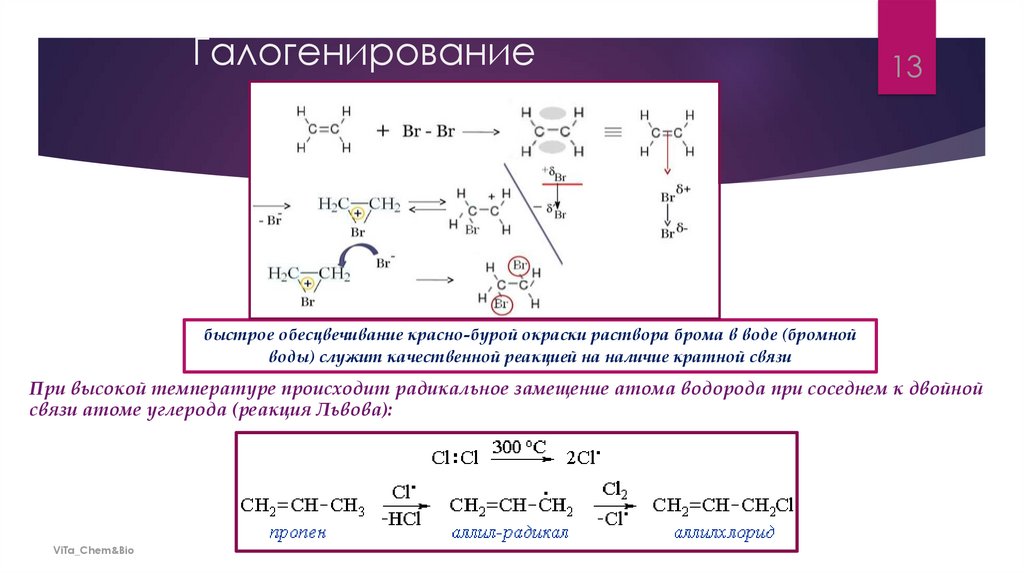
Галогенирование13
быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной
воды) служит качественной реакцией на наличие кратной связи
При высокой температуре происходит радикальное замещение атома водорода при соседнем к двойной
связи атоме углерода (реакция Львова):
ViTa_Chem&Bio
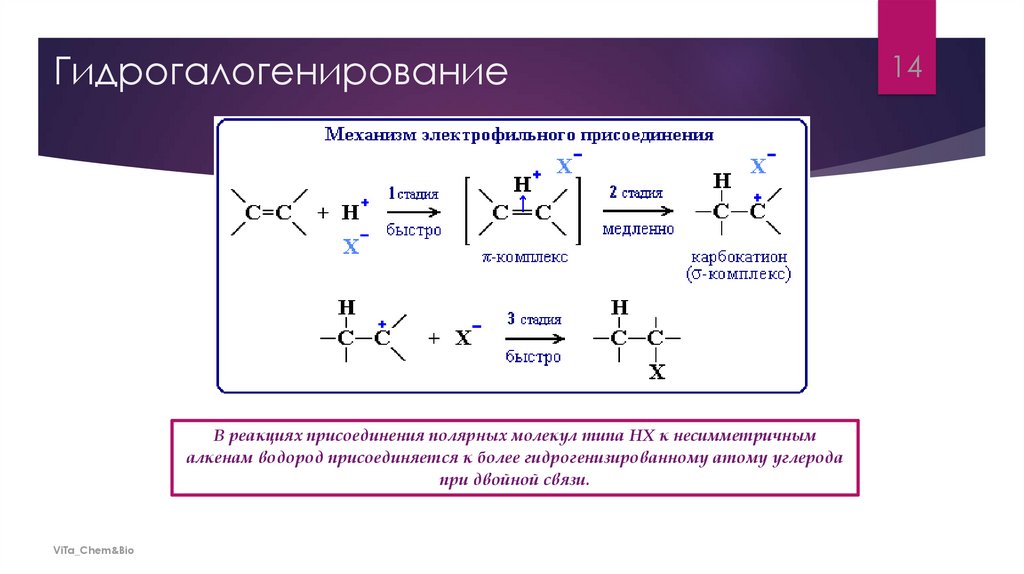
14.
ГидрогалогенированиеВ реакциях присоединения полярных молекул типа НХ к несимметричным
алкенам водород присоединяется к более гидрогенизированному атому углерода
при двойной связи.
ViTa_Chem&Bio
14
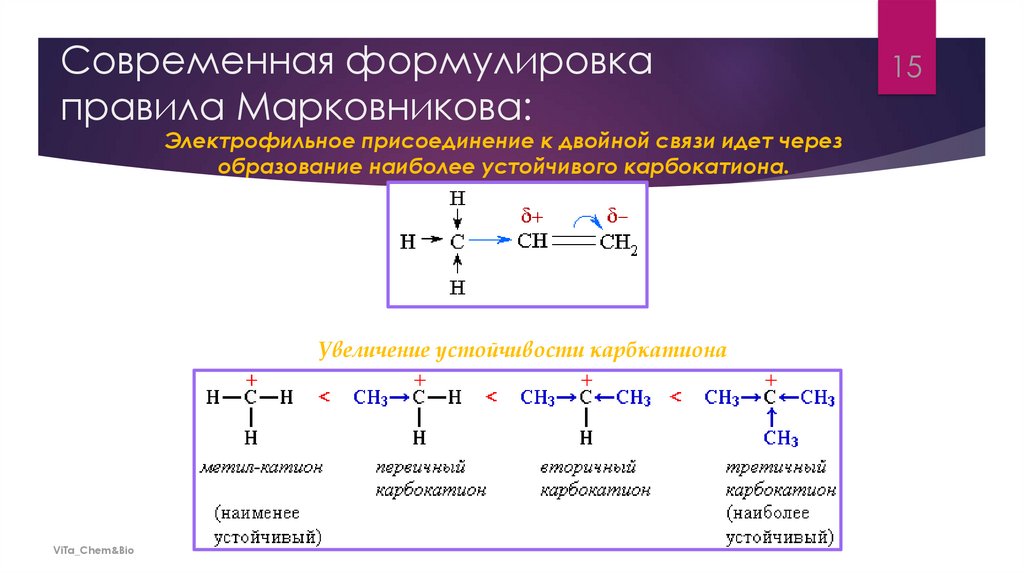
15.
Современная формулировкаправила Марковникова:
Электрофильное присоединение к двойной связи идет через
образование наиболее устойчивого карбокатиона.
Увеличение устойчивости карбкатиона
ViTa_Chem&Bio
15
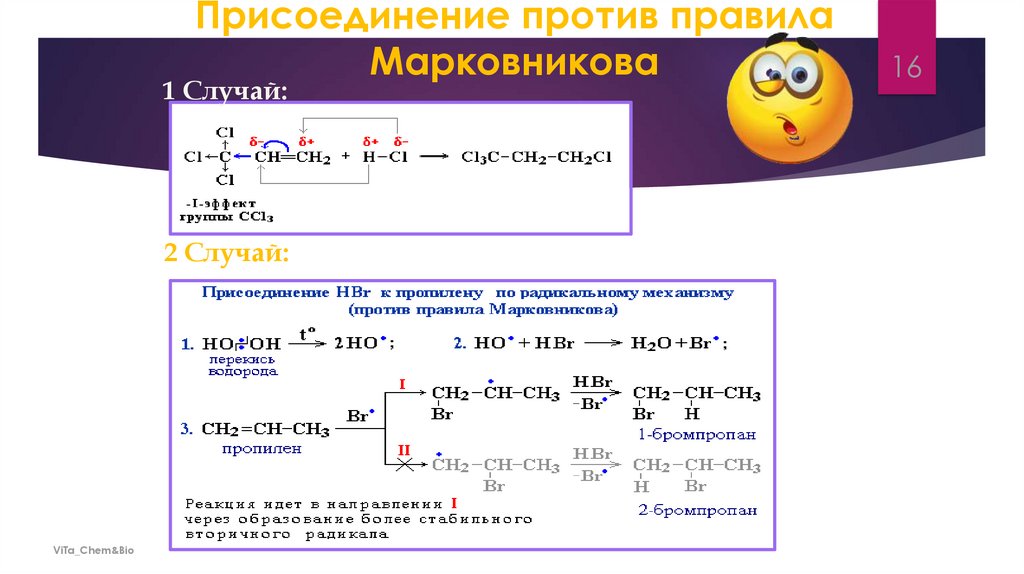
16.
Присоединение против правилаМарковникова
1 Случай:
2 Случай:
ViTa_Chem&Bio
16
17.
Гидратация17
Общий вид:
Механизм реакции:
Несимметричные алкены – присоединение воды по правилу Марковникова!
ViTa_Chem&Bio
18.
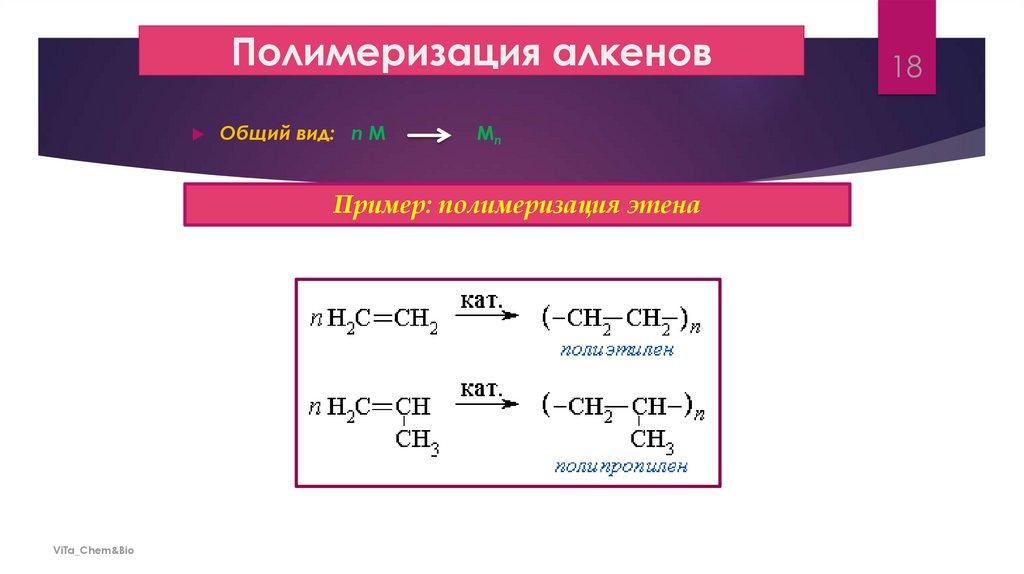
Полимеризация алкеновОбщий вид: n M
Mn
Пример: полимеризация этена
ViTa_Chem&Bio
18
19.
Реакции окисления алкенов-
19
мягкое окисление, при котором разрывается π-связь и сохраняется углеродный скелет
молекулы
- жёсткое окисление с разрывом как π-, так и σ-связей С=С, приводящее к разрушению
углеродного скелета.
1. Реакция Вагнера – мягкое окисление: водная среда
3CH =CH + 2KMnO + 4H O
2
2
4
2
3 HO–CH –CH –OH + 2KOH + 2MnO ↓
2
2
2
2. Жесткое окисление: кислая среда, кипящий перманганат калия
5CH3CH=C(CH3)CH3 + 6KMnO4 + 9H2SO4 → 5CH3COOH + 5(CH3)2CO + 6MnSO4 + 3K2SO4 + 9H2O
ViTa_Chem&Bio
20.
ЗАПОМНИТЬ ПРОСТО!Реакция Вагнера (холодный раствор, нейтр.среда)
Нагревание, нейтр.среда
Жёсткое окисление: нагревание, кислая среда
ViTa_Chem&Bio
20
21.
Каталитическое окисление21
1 случай:
2 случай:
• Полное окисление (горение):
2С H + 3nO
С H + 3O
n
2n
2
ViTa_Chem&Bio
2
4
2
2nCO + 2nH O + Q
2CO + 2H O + Q
2
2
2
2
22.
22Изомеризация алкенов
В зависимости от условий задачи!
Обращаем внимание на следующий продукт реакции в цепочке!!!
ViTa_Chem&Bio
23.
Получение алкенов23
Крекинг алканов:
• Отщепление (элиминирование) двух атомов или групп атомов от
соседних атомов углерода с образованием между ними p-связи.
ViTa_Chem&Bio
24.
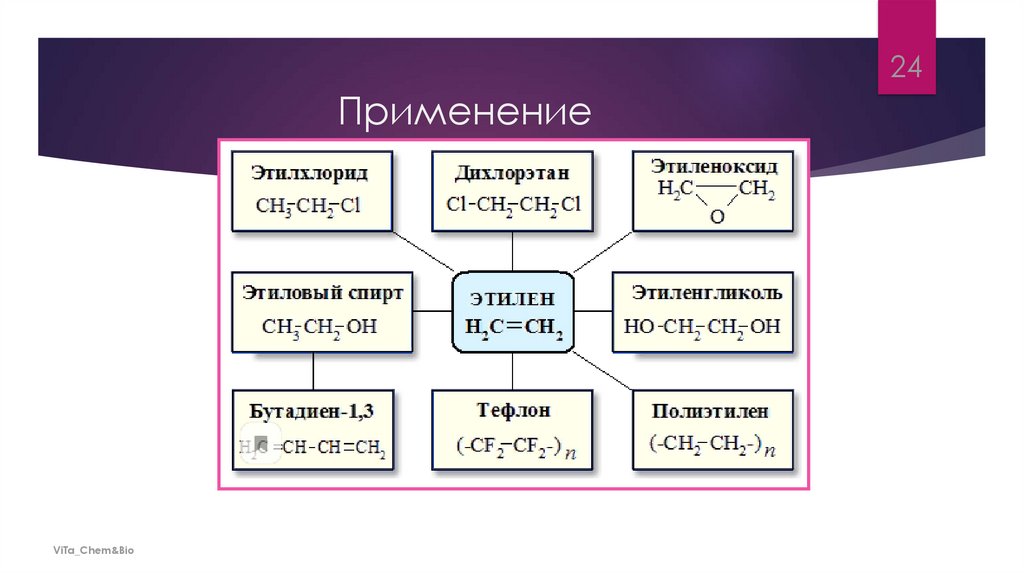
24Применение
ViTa_Chem&Bio
25.
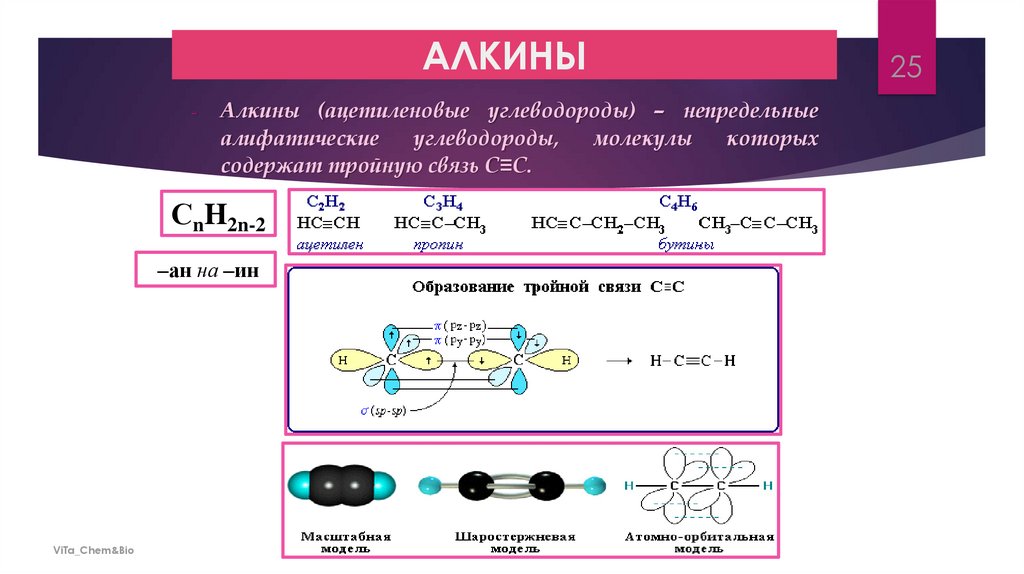
АЛКИНЫ-
Алкины (ацетиленовые углеводороды) – непредельные
алифатические
углеводороды,
молекулы
которых
содержат тройную связь C≡C.
СnH2n-2
–ан на –ин
ViTa_Chem&Bio
25
26.
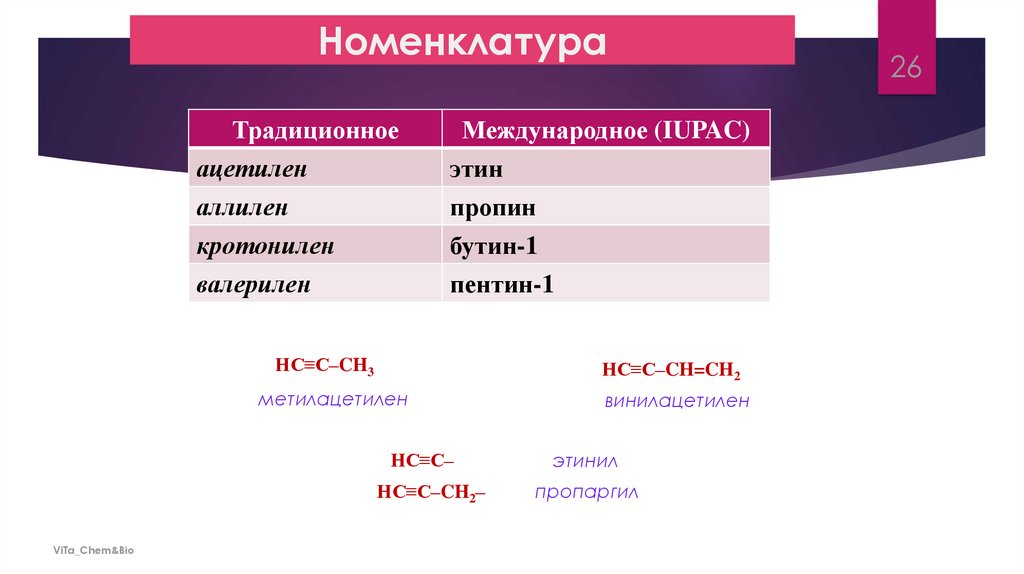
НоменклатураТрадиционное
Международное (IUPAC)
ацетилен
аллилен
кротонилен
этин
пропин
бутин-1
валерилен
пентин-1
HC≡C–CH3
HC≡C–CH=CH2
метилацетилен
HC≡C–
HC≡C–CH2–
ViTa_Chem&Bio
винилацетилен
этинил
пропаргил
26
27.
Изомерия алкиновИзомерия положения тройной связи, начиная с С4Н6
Изомерия углеродного скелета, начиная с С5Н8
Межклассовая изомерия с алкадиенами и циклоалкенами,
начиная с С4Н6
Пространственная изомерия
Отличия в свойствах алкинов и алкенов определяются
следующими факторами.
реакции электрофильного присоединения к алкинам протекают медленнее,
чем к алкенам
алкины с концевой тройной связью R–С≡С–H (алкины-1) проявляют
кислотные свойства и способны, вступая в реакции с металлами,
образовывать соли
ViTa_Chem&Bio
27
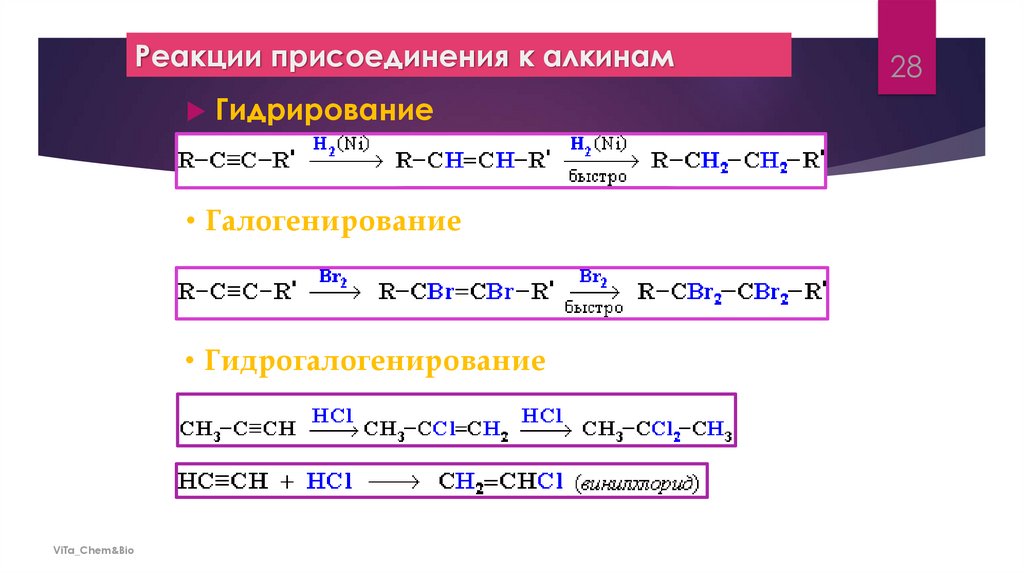
28.
Реакции присоединения к алкинамГидрирование
• Галогенирование
• Гидрогалогенирование
ViTa_Chem&Bio
28
29.
Гидратация (реакция Кучерова)Виниловый спирт
Уксусный альдегид
В случае несимметричного строения
Ацетон
ViTa_Chem&Bio
29
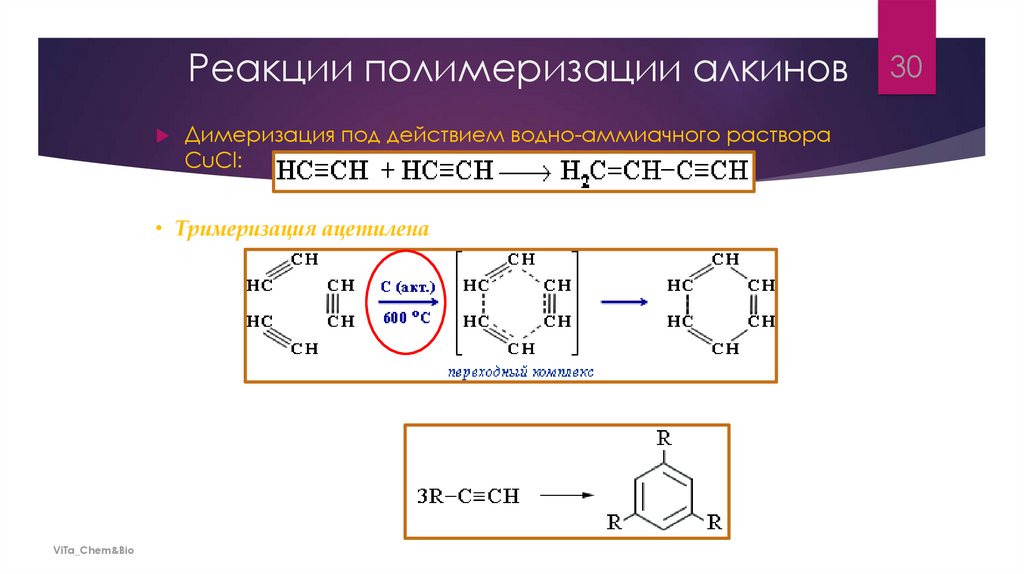
30.
Реакции полимеризации алкиновДимеризация под действием водно-аммиачного раствора
CuCl:
• Тримеризация ацетилена
ViTa_Chem&Bio
30
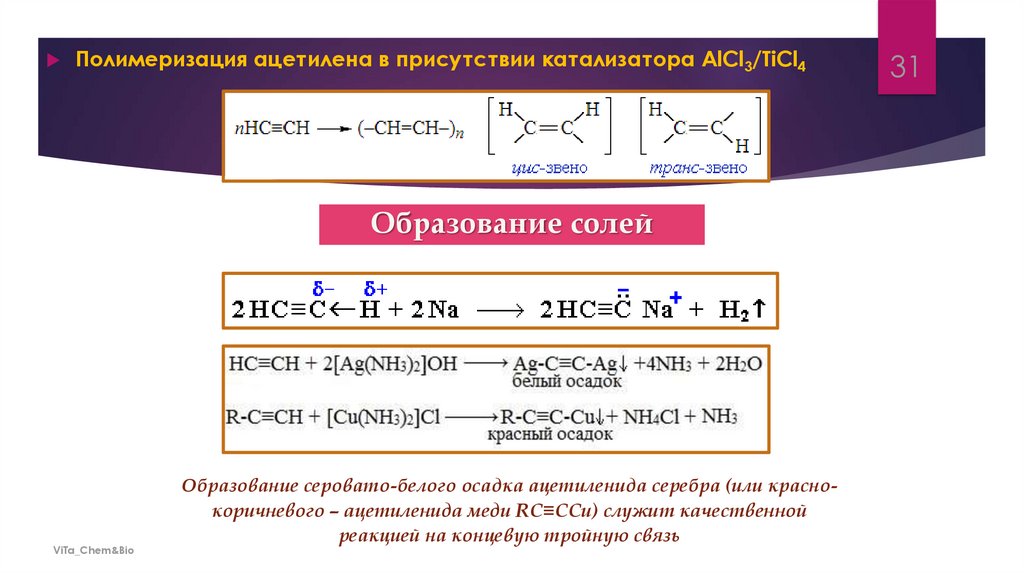
31.
Полимеризация ацетилена в присутствии катализатора AlCl3/TiCl4Образование солей
ViTa_Chem&Bio
Образование серовато-белого осадка ацетиленида серебра (или краснокоричневого – ацетиленида меди RC≡CCu) служит качественной
реакцией на концевую тройную связь
31
32.
А что же с ними делать дальше???Разрушить кислотой, например!
И помни!!!
Если нет свободного водорода!!!!
ViTa_Chem&Bio
32
33.
ОКИСЛЕНИЕ ПЕРМАНГАНАТОМ КАЛИЯВ водной и щелочной среде:
3СН≡СН + 8KMnO4 → 3K2C2O4 + 8MnO2↓ + 2KOH + 2H2O
Оксалат калия
Либо образуется щавелевая кислота
В кислой среде:
5СН3С≡С-СН2СН3 + 6KMnO4 + 9H2SO4 →
5CH3COOH + 5CH3CH2COOH+ 6MnSO4 + 3K2SO4 + 4H2O
Горение:
ViTa_Chem&Bio
33
34.
Получение алкинов34
Пиролиз метана:
• Пиролиз этана или этилена:
• Гидролиз карбида кальция:
CaO + 3C
• А также:
ViTa_Chem&Bio
CaC + CO
2
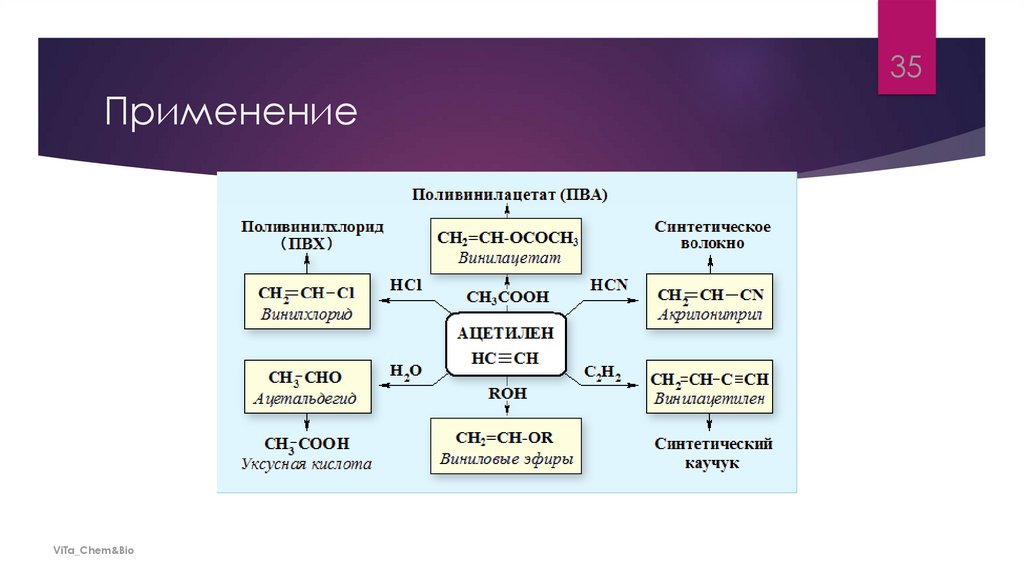
35.
35Применение
ViTa_Chem&Bio















 Химия
Химия








