Похожие презентации:
Типы химических реакций
1.
2.
Классификация неорганических реакций посоставу превращающихся веществ
Тип реакции
Примеры
Реакция соединения: X + Y → Zслож.
Из нескольких веществ образуется одно
сложное вещество.
2Na + Cl2 = 2NaCl
Na2O + H2O = 2NaOH
Реакция разложения: Zслож. → X + Y + …
Из одного сложного вещества образуется
несколько (более) простых.
2NH3 = N2 + 3H2
Cu(OH)2 = CuO + H2O
Реакция замещения: ABсл. + Cпр.→ ACсл. + Bпр.
Из сложного и простого веществ образуются
новое сложное и новое простое вещество.
CuCl2 + Zn = ZnCl2 + Cu
2KBr + Cl2 = 2KCl + Br2
Реакция обмена: ABсл. + CDсл.→ ADсл. + BСсл.
Два сложных вещества обмениваются
составными частями.
Na2S + FeCl2 = FeS + 2NaCl (РИО)
KOH + HCl = KCl + H2O (нейтрализация)
Na2S + H2O ⇄ NaHS + NaOH (гидролиз)
3.
Классификация органических реакций похарактеру изменений в молекуле
Тип реакции
Примеры
Реакция присоединения: реагент
присоединяется по кратным
связям
CH2=CH2 + H2 = CH3–CH3
гидрирование
CH≡CH + H2O = CH3–CHO
гидратация
CH2=CH2 + Br2 = CH2Br–CH2Br
галогенирование
CH2=CH2 + HBr = CH3–CH2Br
гидрогалогенирование
nCH2=CH2 = (–CH2–CH2–)n
полимеризация
Реакция разложения – органическое
вещество разлагается на несколько
других веществ.
С8H18 = C4H10 + C4H8
крекинг
(–CH(С6H5)–CH2–)n = nC6H5–CH=CH2
деполимеризация
4.
Классификация органических реакций похарактеру изменений в молекуле
Тип реакции
Примеры
Реакция замещения: атом или
группа атомов замещают атом
или группу атомов
CH3–CH2Br + NaOH = CH3–CH2OH + NaBr
щелочной гидролиз галогеналканов
CH4 + Cl2 = CH3Cl + HCl
галогенирование (алканов и аренов)
C6H6 + HO–NO2 = C6H5NO2 + H2O
нитрование (алканов и аренов)
C6H6 + CH3Cl = C6H5–CH3 + HCl
алкилирование аренов
CH3OH + HCOOH ⇄ HCOOCH3 + H2O
этерификация
Реакция изомеризации – вещество
изменяет структуру без изменения
состава
CH3–CH2–CH2–CH3 = CH3–CH(CH3)–CH3
изомеризация алканов
5.
Классификация органических реакций похарактеру изменений в молекуле
Тип реакции
Примеры
Реакция отщепления или
элиминирования: от двух атомов
углерода отщепляются атомы
или группы атомов, за счет чего
образуется дополнительная С-С
связь.
CH3–CH2Br + NaOH = CH2=CH2 + NaBr + H2O
дегидрогалогенирование
CH3–CH2OH = CH2=CH2 + H2O
дегидратация
CH2Br–CH2Br + Zn = ZnBr2 + CH2=CH2
дегалогенирование
CH3–CH3 = H2 + CH2=CH2
дегидрирование
Реакция окисления
Реакция поликонденсации
CH4 + 2O2 = CO2 + 2H2O полное
CH3CHO + Ag2O = CH3COOH + 2Ag неполное
Синтез фенолформальдегидной
смолы…
6.
Каталитические и некаталитические реакцииС неорганическими веществами
Fe
N2 + 3H2 = 2NH3
V2O5
2SO2 + O2 = 2SO3
MnO2
2H2O2 = 2H2O+ O2
MnO2
2KClO3 = 2KCl + 3O2
Pt
4NH3 + 5O2 = 4NO + 6H2O
С органическими веществами
• Реакции гидрирования/дегидрирования
• Реакции гидратации непредельных УВ
• Дегидратация спиртов
• Изомеризация алканов
• Полимеризация
• Реакция Лебедева
• Крекинг
• Этерификация
• Замещение в ароматическом кольце
Реакции с синтез-газом, например:
• Окисление кислородом, если из
органического вещества образуется
органическое вещество:
CO + 2H2 = CH3OH
2CH2=CH2 + O2 = 2CH3CHO
кат.
кат.
7.
Эндотермические и экзотермические реакцииЭкзотермические реакции
протекают с выделением
тепла (+Q)
Эндотермические реакции
протекают с поглощением
тепла (–Q)
• Почти все реакции соединения:
• Почти все реакции горения:
N2 + O2 = 2NO – Q
H2 + I2 = 2HI – Q
CH4 + 2O2 = CO2 + 2H2O
Почти все реакции разложения:
• Реакция нейтрализации:
CaCO3 = CaO + CO2
2Fe + 3Cl2 = 2FeCl3
!!!
NaOH + HCl = NaCl + H2O
2Al(OH)3 = Al2O3 + 3H2O
2Na + 2H2O = 2NaOH + H2
(к экзотермическим относятся
реакции разложения нитратов,
хлоратов, дихромата аммония)
• Реакция метана с Cl2 и Br2 :
Реакция обратимого гидролиза:
CH4 + Cl2 = CH3Cl + HCl
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
• Реакции активных Me с водой:
8.
Окислительно-восстановительные и неокислительно-восстановительные реакции
Окислительно-восстановительными (или ОВР) называются реакции, которые
протекают с изменением степеней окисления элементов: есть элемент,
который ее повышает, и есть элемент, который ее понижает.
+1 -2 +1
+1 -1
+1
-1
+1 -2
0
+1 -2
+1 -2 +1
NaOH + HCl = NaCl + H2O
0
2Na + 2H2О = 2NaOH + H2
Это не ОВР
Это ОВР!
Будьте бдительны! Даже простейшие реакции с органическими
веществами могут относиться к ОВР.
-4 +1
0
-2 +1 -1
+1 -1
СH4 + Cl2 = CH3Cl + HCl
9.
Обратимые и необратимые реакцииОбратимые реакции протекают
при данных условиях в двух
направлениях (⇄)
Необратимые реакции протекают
при данных условиях только в
одном направлении (=)
N2 + 3H2 ⇄ 2NH3
2SO2 + O2 ⇄ 2SO3
• Почти все реакции горения:
• Гидрирование – дегидрирование
C2H4 + H2 ⇄ C2H6
Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH
H2 + I2 ⇄ 2HI
N2 + O2 ⇄ 2NO
• Гидратация – дегидратация
С2H4 + H2O ⇄ C2H5OH
• Этерификация
CH3OH + HCOOH ⇄ HCOOCH3 + H2O
• Обратимый гидролиз солей
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
CH4 + 2O2 = CO2 + 2H2O
• Реакции ионного обмена, если
образуется слабый электролит или
неэлектролит:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
…
10.
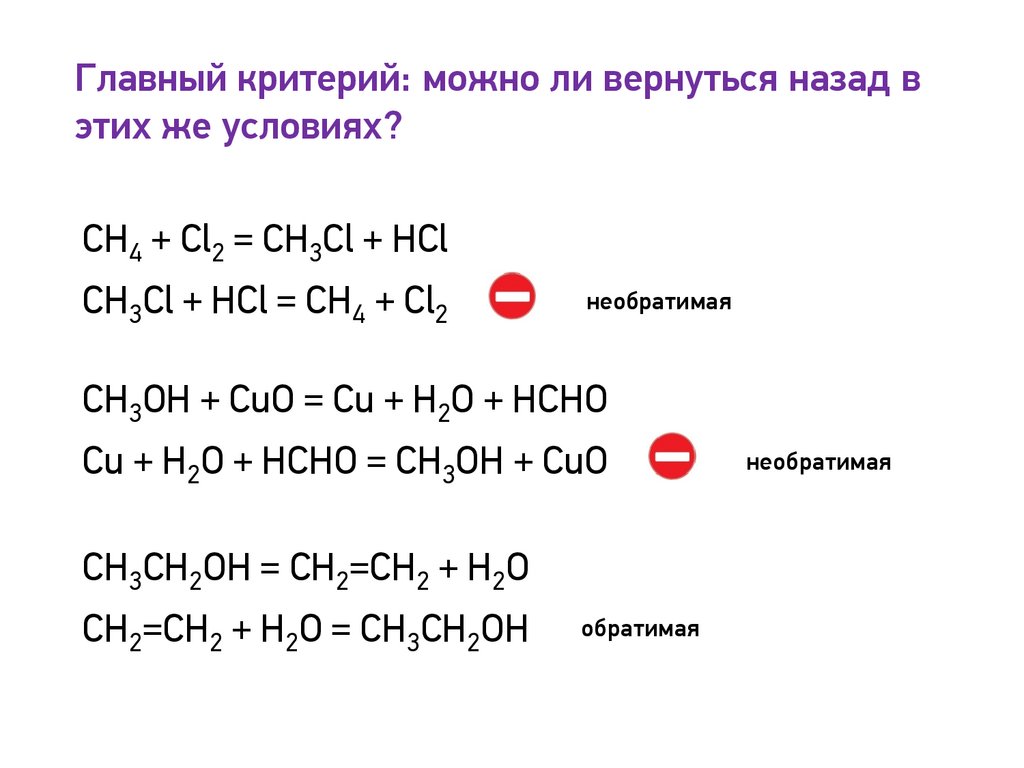
Главный критерий: можно ли вернуться назад вэтих же условиях?
СH4 + Cl2 = CH3Cl + HCl
CH3Cl + HCl = СH4 + Cl2
необратимая
CH3OH + CuO = Cu + H2O + HCHO
Cu + H2O + HCHO = CH3OH + CuO
CH3СH2OH = CH2=CH2 + H2O
CH2=CH2 + H2O = CH3СH2OH
обратимая
необратимая
11.
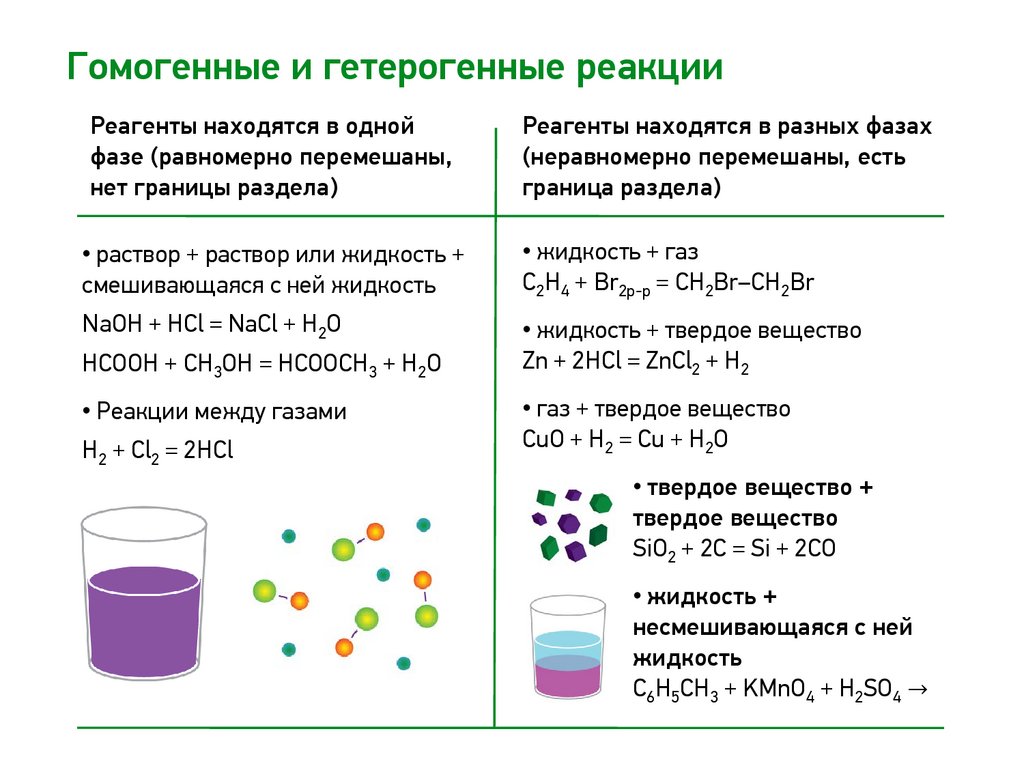
Гомогенные и гетерогенные реакцииРеагенты находятся в одной
фазе (равномерно перемешаны,
нет границы раздела)
Реагенты находятся в разных фазах
(неравномерно перемешаны, есть
граница раздела)
• раствор + раствор или жидкость +
смешивающаяся с ней жидкость
• жидкость + газ
C2H4 + Br2р-р = СH2Br–CH2Br
NaOH + HCl = NaCl + H2O
• жидкость + твердое вещество
Zn + 2HCl = ZnCl2 + H2
HCOOH + CH3OH = HCOOCH3 + H2O
• Реакции между газами
H2 + Cl2 = 2HCl
• газ + твердое вещество
CuO + H2 = Cu + H2O
• твердое вещество +
твердое вещество
SiO2 + 2C = Si + 2CO
• жидкость +
несмешивающаяся с ней
жидкость
C6H5CH3 + KMnO4 + H2SO4 →
12.
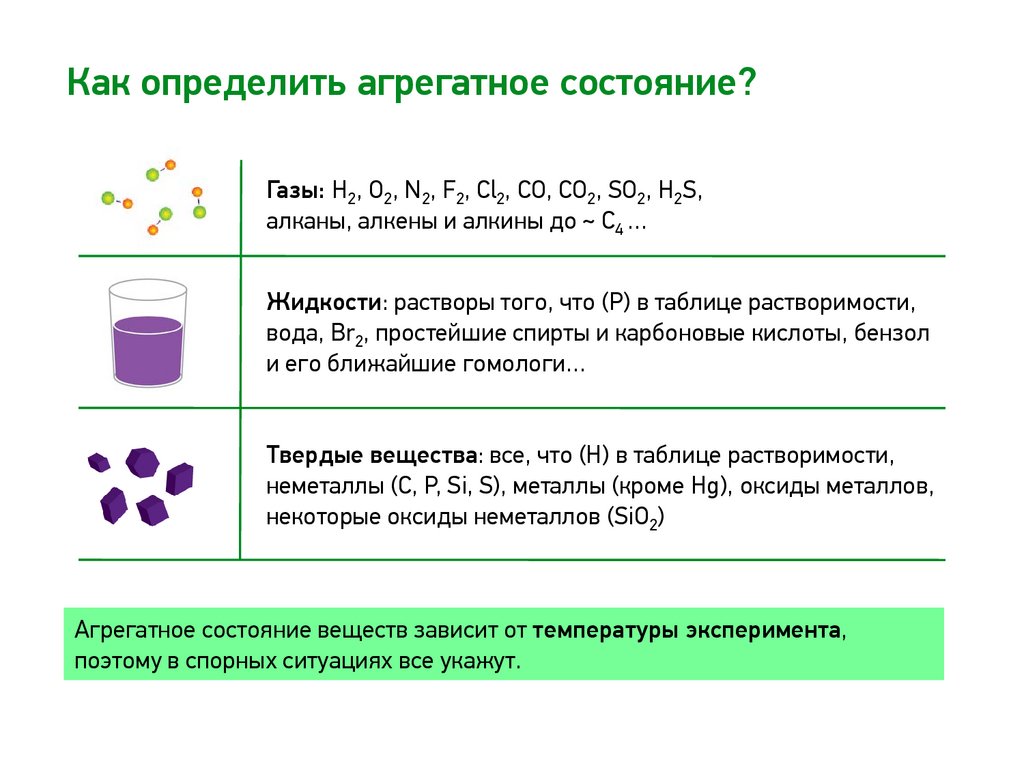
Как определить агрегатное состояние?Газы: H2, O2, N2, F2, Cl2, CO, CO2, SO2, H2S,
алканы, алкены и алкины до ~ С4 …
Жидкости: растворы того, что (Р) в таблице растворимости,
вода, Br2, простейшие спирты и карбоновые кислоты, бензол
и его ближайшие гомологи…
Твердые вещества: все, что (Н) в таблице растворимости,
неметаллы (С, P, Si, S), металлы (кроме Hg), оксиды металлов,
некоторые оксиды неметаллов (SiO2)
Агрегатное состояние веществ зависит от температуры эксперимента,
поэтому в спорных ситуациях все укажут.
13.
Тест по теме "Типы химических реакций"1. Из предложенного перечня типов реакций выберите все типы реакций, к которым
можно отнести взаимодействие серы и кислорода.
1. ) эндотермическая
2) гетерогенная
3) реакция соединения
4 ) каталитическая
5) окислительно-восстановительная
2. Из предложенного перечня выберите все окислительно-восстановительные
реакции.
1) термолиз гидроксида меди (II)
2) пиролиз метана
3) электролиз раствора хлорида калия
4) сгорание фосфора в хлоре
5) гидратация оксида серы (VI)
3. Из предложенного перечня схем реакций выберите все схемы,
соответствующие эндотермическим реакциям.
1) Al(OH)3 →
2) CH4 + O2 →
3) N2 + O2 →
4) NaOH + H2SO4 →
5) Na + H2O →
14.
4. Из предложенного перечня реакций выберите все каталитические реакции:1) синтез аммиака из простых веществ
2) горение серы
3) гидрирование пропилена
4) термолиз хлората калия
5) обжиг пирита
5. Из предложенного перечня выберите все схемы, которые соответствуют
реакциям замещения:
1) Na2O + H2O →
2) C2H4 + Br2 →
3) CuO + H2 →
4) CuBr2 + Cl2 →
5) C2H5OH + HCl →
6. Из предложенного перечня выберите все реакции, которые являются
одновременно экзотермическими и реакциями соединения:
1) NaOH + HCl →
2) Ca + H2O →
3) N2 + O2 →
4) Fe + Cl2 →
5) K2O + H2O →
15.
7. Из предложенного перечня выберите все вещества, термическое разложениекоторых относится к окислительно-восстановительным реакциям:
1) гидрокарбонат калия
2) перманганат калия
3) карбонат магния
4) нитрит аммония
5) гидроксид алюминия
8. Выберите все пары веществ, между которыми протекает
окислительно-восстановительная реакция.
1) хромат калия и ацетат серебра
2) сероводород и бромная вода
3) оксид азота (IV) и вода
4) оксид меди (II) и азотная кислота (конц.)
5) оксид меди (II) и иодоводород
9. Из предложенного перечня типов реакций выберите все типы реакции, к которым
можно отнести взаимодействие фенола и бромной воды.
1) присоединения
2) гидрогалогенирования
3) замещения
4) нейтрализации
5) окислительно-восстановительная
16.
10. Из предложенного перечня веществ выберите все вещества, которые вступаютс бромоводородом в реакцию замещения. 1) цинк
2) хлор
3) гидроксид натрия
4) метанол
5) нитрат серебра
11. Из предложенного перечня веществ выберите все типы реакций, к которым
можно отнести реакцию термического разложения гидроксида меди (II).
1) необратимая
2) окислительно-восстановительная
3) некаталитическая
4) эндотермическая
5) экзотермическая
12. Из предложенного перечня выберите все вещества, взаимодействие которых с
концентрированной бромоводородной кислотой относится к
окислительно-восстановительным реакциям:
1) гидрокарбонат аммония
2) оксид марганца (IV)
3) железо
4) аммиак
5) хлор
17.
13. Из предложенного реакций выберите все реакции присоединения: 1)нитрование бензола
2) гидрирование ацетилена
3) гидрохлорирование этина
4) гидратация пропена
5) хлорирование этана
14. Из предложенного перечня реакций выберите все обратимые реакции:
1) Na2CO3 + H2O = NaOH + NaHCO3
2) Zn + 2HCl = H2 + ZnCl2
3) BaCl2 + H2SO4 = BaSO4 + 2HCl
4) C2H4 + H2 = C2H6
5) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
15.Выберите все вещества, термическое разложение которых относится к
окислительно-восстановительным реакциям:
1) оксид ртути (II)
2) дихромат аммония
3) гидрокарбонат метиламмония
4) метан
5) гидроксид меди (II)
18.
16. Из предложенного перечня выберите схемы всех реакцийионного обмена:
1) Cr(OH)3 + HNO3 →
2) CH3Cl + KOH →
3) Zn + CH3COOH →
4) Na2O + H2O →
5) HCOOH + Ca(OH)2 →
17. Из предложенного перечня выберите все обратимые реакции:
1) гидрирование этилена
2) горение метана
3) гидролиз карбида кальция
4) щелочной гидролиз этилацетата
5) синтез аммиака из простых веществ
18. Из предложенного перечня выберите все вещества, которые
могут вступать в реакцию гидролиза:
1) полипептид
2) этилформиат
CuSO4 + Fe = FeSO4 + Cu
3) этилен
KOH + MgCl2 = Mg(OH)2↓ + KCl
4) полистирол
5) сульфид алюминия
KClO3 = KCl + O2















 Химия
Химия








