Похожие презентации:
Классификация химических реакций
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ ПРОФЕССОРА В.Ф. ВОЙНО-ЯСЕНЕЦКОГО»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ
Тема: «Классификация
химических реакций»
Преподаватель: Агафонова Н.В.
2.
1. Понятие о химической реакции.2. Типы классификации химических
реакций.
3.
Химическиереакции − химические
процессы, в результате которых из
одних веществ образуются другие
отличающиеся от них по составу (или)
строению.
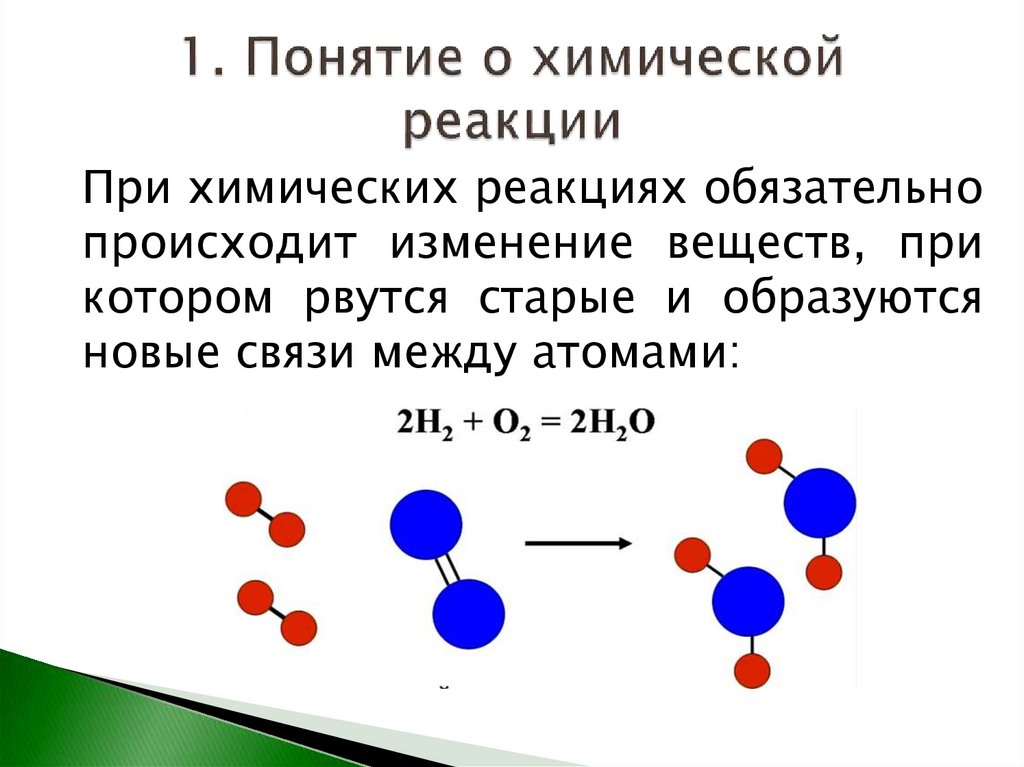
4.
При химических реакциях обязательнопроисходит изменение веществ, при
котором рвутся старые и образуются
новые связи между атомами:
5.
Признаки протекания химическихреакций:
Выделяется газ.
Выпадает осадок.
Происходит изменение окраски вещества.
Образуется вода.
Выделяется или поглощается тепло, свет.
6.
7.
Реакции, идущиебез изменения
качественного
состава вещества:
Реакции, идущие
с изменением
качественного
состава вещества:
аллотропизация,
разложения;
изомеризация.
соединения;
замещения;
обмена.
8.
1. Аллотропизация. В неорганической химии ктаким реакциям можно отнести процессы
получения
аллотропных
модификаций
одного химического элемента, например:
С (графит) <=> С (алмаз)
3О2 (кислород) <=> 2О3 (озон)
S (ромбическая) <=> S (пластическая)
9.
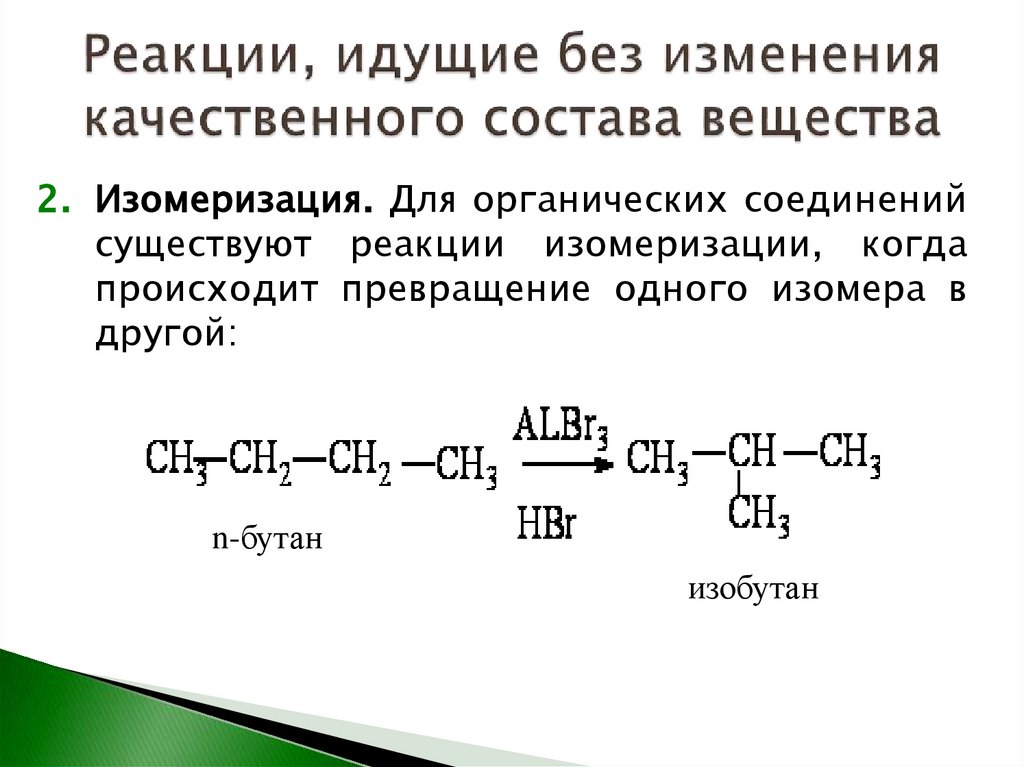
2. Изомеризация. Для органических соединенийсуществуют реакции изомеризации, когда
происходит превращение одного изомера в
другой:
n-бутан
изобутан
10.
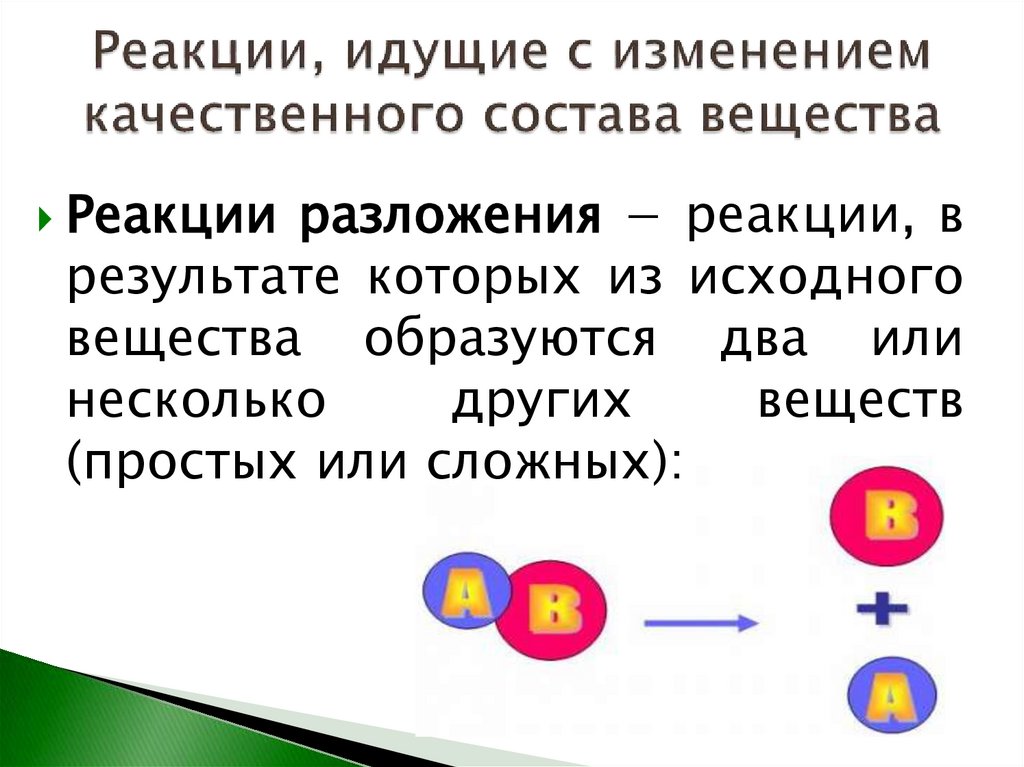
Реакции разложения − реакции, врезультате которых из исходного
вещества образуются два или
несколько
других
веществ
(простых или сложных):
11.
разложение карбоната кальция:СаСО → СаО + СО2↓
t
разложение перманганата калия:
2 KMnO4 → K2MnO4 + MnO2 + O2↑
разложение пероксида водорода:
2 Н2О2 →2Н2О + О2↑
12.
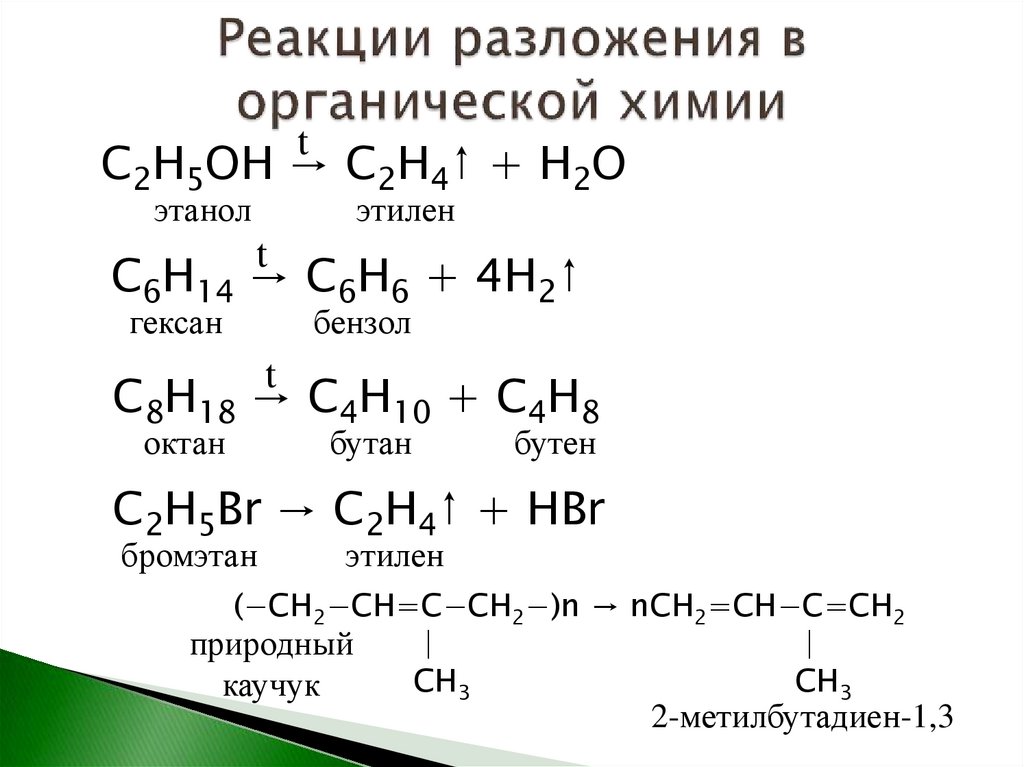
tС2Н5ОН → С2Н4↑ + Н2О
этанол
этилен
t
С6Н14 → С6Н6 + 4Н2↑
гексан
бензол
t
С8Н18 → С4Н10 + С4Н8
октан
бутан
бутен
С2Н5Br → C2H4↑ + HBr
бромэтан
этилен
(−CH2−CH=C−CH2−)n → nCH2=CH−C=CH2
.
|
|
природный
CH3
CH3
каучук
2-метилбутадиен-1,3
13.
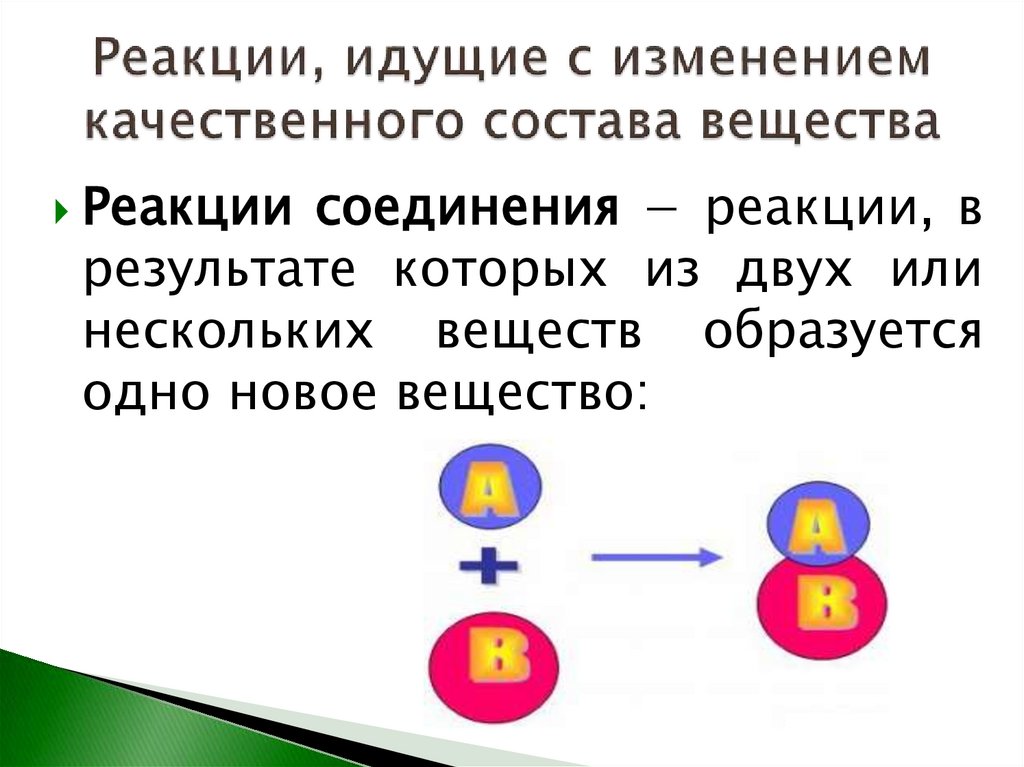
Реакции соединения − реакции, врезультате которых из двух или
нескольких веществ образуется
одно новое вещество:
14.
получение оксида серы (IV):S + O2 → SO2
получение оксида серы (VI):
2 SО2 + O2 →2 SO3
получение серной кислоты:
SO3 + Н2О → Н2SO4
получение оксида магния:
2 Mg + O2 →2 MgO
получение гидроксида бария:
BaO + H2O = Ba(OH)2
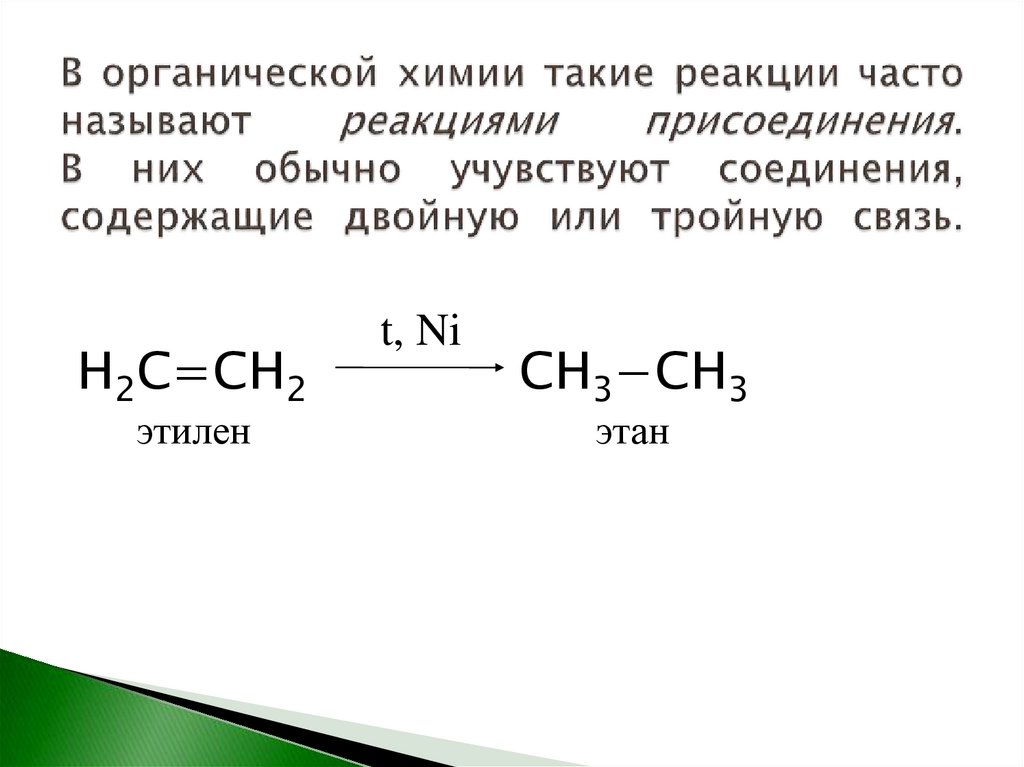
15.
Н2С=СН2этилен
t, Ni
СН3−СН3
этан
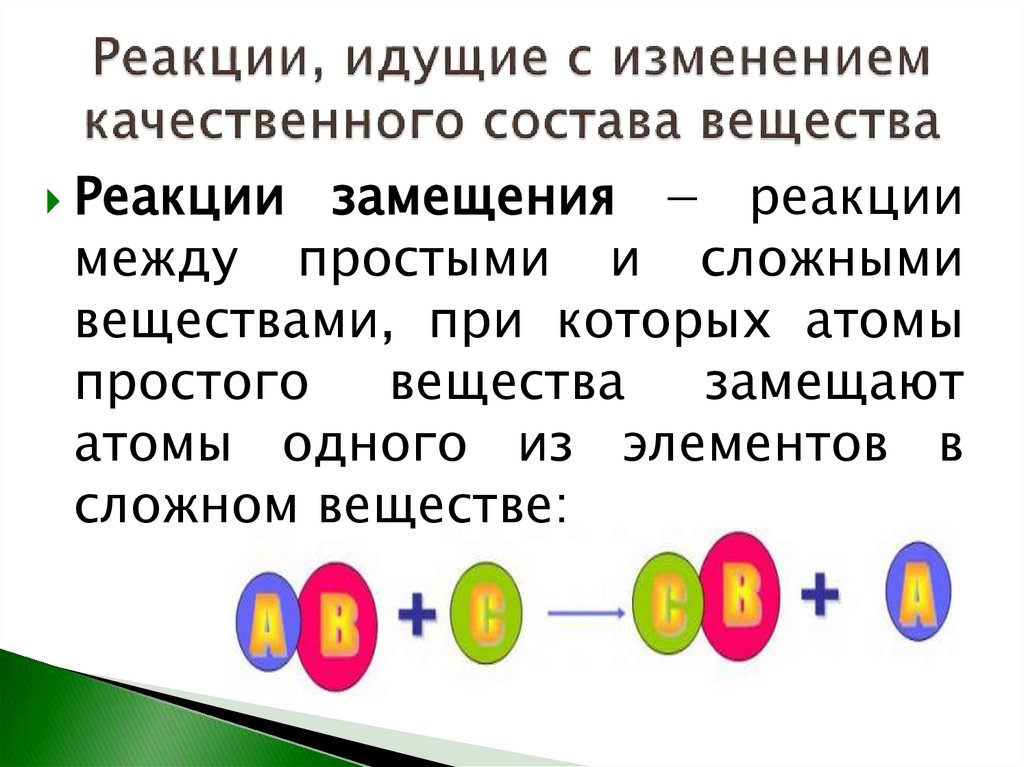
16.
Реакциизамещения − реакции
между простыми и сложными
веществами, при которых атомы
простого
вещества
замещают
атомы одного из элементов в
сложном веществе:
17.
взаимодействие щелочных ищелочноземельных металлов с
водой:
2Na + H2O →2 NaOH + H2↑
взаимодействие металлов с
кислотами:
Zn +2HCl → ZnCl2 + H2↑
взаимодействие металлов с солями:
Fe + CuSO4 → Cu + FeSO4
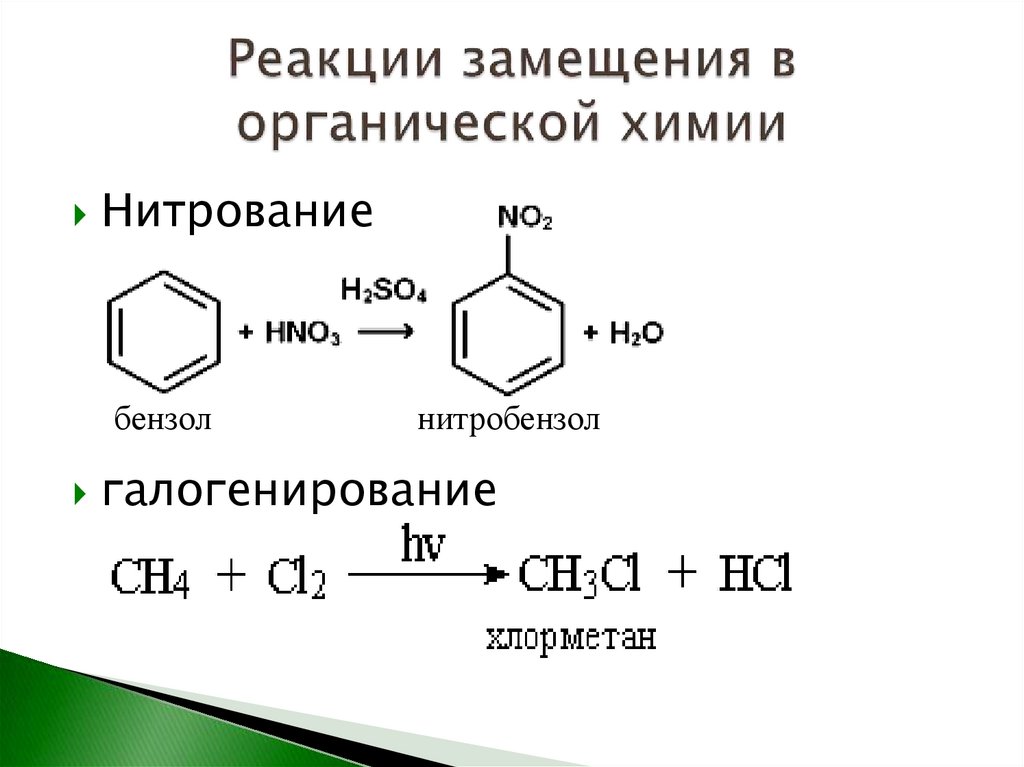
18.
Нитрованиебензол
нитробензол
галогенирование
19.
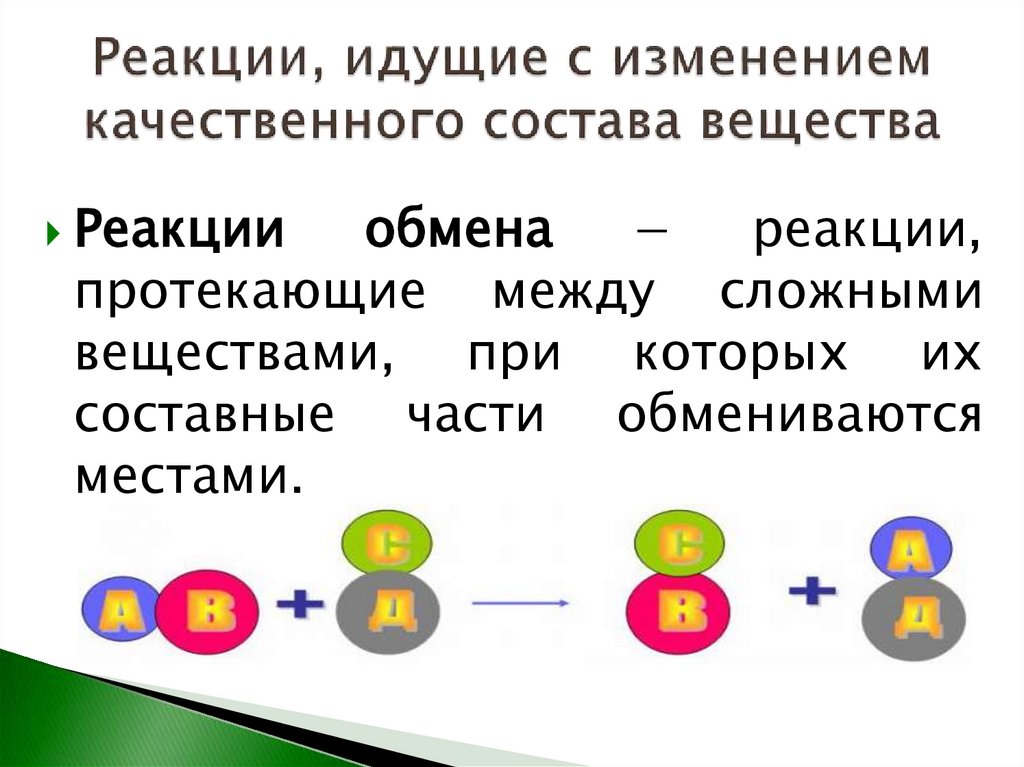
Реакцииобмена
−
реакции,
протекающие между сложными
веществами, при которых их
составные части обмениваются
местами.
20.
реакциянейтрализации,
идущая
с
образованием соли и воды:
NaOH + HNO3 → NaNO3 + H2O
OH- + H+ → H2O
KOH + HNO3 → KNO3 + H2O
реакция между щелочью и солью:
Ca(OH)2 +2 NH4Cl → CaCl2 +2NH3↑ + 2H2O
CuSO4 +2 NaOH → Na2SO4 + H2O
реакция между солью и кислотой:
FeS +2 HCl → FeCl2 + H2S↑
H2SO4 + BaCl2 → BaSO4↓ +2HCl
21.
Всехимические реакции подразделяются
на такие, в которых степени окисления не
изменяются (например, реакция обмена) и
на такие, в которых происходи изменение
степеней
окисления.
Их
называют
окислительно-восстановительными
реакциями. Ими могут быть реакции
разложения, соединения, замещения и
другие более сложные реакции.
22.
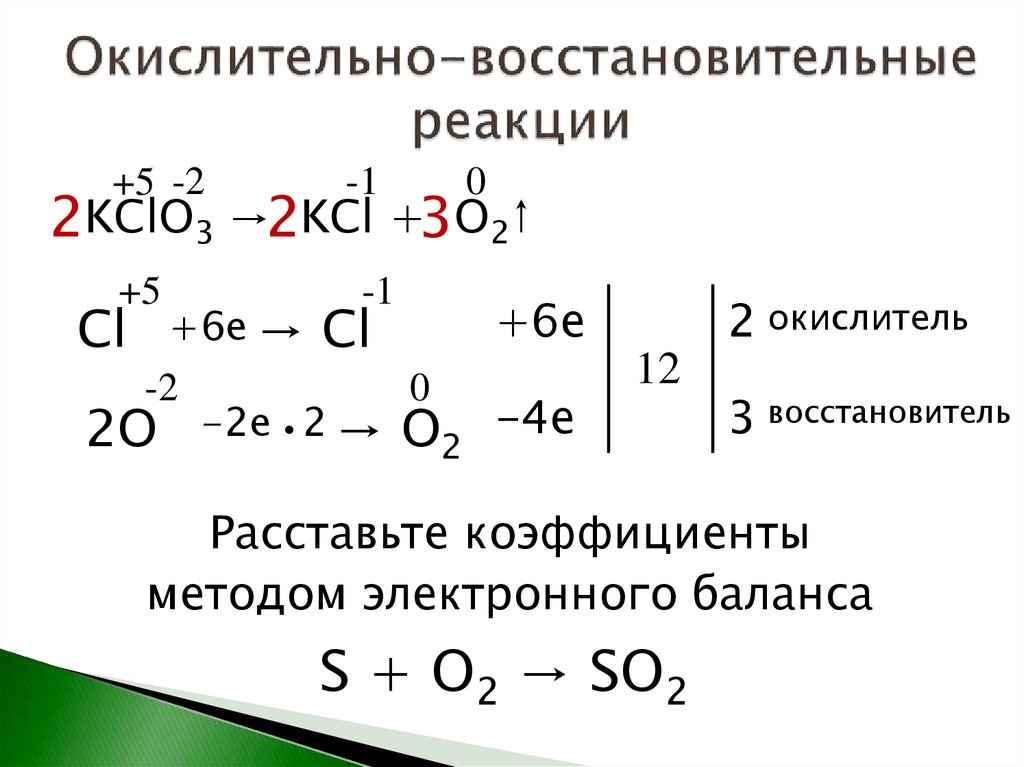
+5 -2-1
+5
-1
0
2KClO3 →2KCl +3O2↑
Cl
-2
2O
+6е
+6е → Сl
0
-2е 2 → O
2
-4е
2 окислитель
12
3 восстановитель
Расставьте коэффициенты
методом электронного баланса
S + O2 → SO2
23.
экзотермические,протекающие с
выделением тепла:
Почти все реакции
соединения.
Н2 + Cl → 2HCl + Q
исключения:
N2 + O2 → 2NO – Q
H2 + I2 → 2HI – Q
эндотермические,
протекающие с
поглощением
тепла:
Почти все реакции
разложения
СаСО3 → СаО +
СО2↑ – Q
24.
Количество поглощенной или выделеннойв результате реакции энергии называют
тепловым эффектом реакции, а уравнение
химической реакции с указанием этого
эффекта
называют
термохимическим
уравнением, например:
25.
необратимые − протекают практическидо конца, то есть до полного
израсходования одного из
реагирующих веществ. Протекают в
данных условиях только в одном
направлении:
NaCl + AgNO3 → NaNO3 + AgCl↓
C + O2 → CO2↑
2KClO3 →2KCl + 3O2↑
26.
обратимые− реакции, которые при
данных условиях протекают во взаимно
противоположных направлениях, то есть
не
идут
до
конца,
потому
что
одновременно происходят две реакции
− прямая (между исходными веществами)
и
обратная
(разложение
продукта
реакции):
N2 +3H2 ↔2NH3
2SO2 + O2 ↔2SO3
27.
Катализаторы− вещества, участвующие в
химической реакции и изменяющие ее
скорость и направление, но по окончании
реакции остаются неизменными качественно
и количественно.
28.
Каталитические − реакции, идущие сучастием катализатора.
2Н2О2 → 2Н2О + О2 (kat – MnO2)
3Al + 3I2 → 2AlI3 (kat − H2O)
Некаталитические – реакции, идущие без
участия катализатора.
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
2Al + 6HCl → 2AlCl3 + 3H2↑
29.
Гетерогенныереакции − реакции в
которых реагирующие вещества и
продукты реакции находятся в разных
агрегатных состояниях (в разных
фазах):
FeO(тв) + СО(г) → Fe(тв) + СО2(г) + Q
2Al(тв) + 3CuCl2(р-р) → 3Cu(тв) + 2AlCl3(р-р)
СаС2(тв) + 2Н2О(ж) → С2Н2↑ + Са(ОН)2(р-р)
30.
Гомогенныереакции − реакции, в
которых реагирующие вещества и
продукты реакции находятся в
одном агрегатном состоянии:
H2(г) + Cl2(г) → 2HCl(г)
NaOH(ж) + HCl(ж) = NaCl(ж) + H2O(ж)
31.
?Составьте
уравнение
реакции,
коэффициенты и определите тип
реакций:
расставьте
химических
1. Оксид азота (V) + вода → азотная кислота
2. Оксид натрия + вода → гидроксид натрия
3. Гидроксид железа (III) → оксид железа (III) + вода
4. Оксид лития + вода → гидроксид лития
5. Карбонат натрия + соляная кислота →
32.
?Расставьте
реакций
2
коэффициенты
в
уравнениях
2
4
2
2
2
33.
ЛитератураОсновная литература:
1. Габриелян, О. С. Химия. 10 класс. Базовый уровень : учебник / О. С.
Габриелян. - 4-е изд., стер. - М. : Дрофа, 2016. - 192 с.
Дополнительная литература:
1. Грандберг, И. И. Органическая химия : учеб. для бакалавров / И. И.
Грандберг, Н. Л. Нам. - 8-е изд. - М. : Юрайт , 2013. - 608 с
Электронные ресурсы:
1. ЭБС КрасГМУ «Colibris»
2. ЭБС Консультант студента ВУЗ
3. ЭБС Консультант студента Колледж
4. ЭМБ Консультант врача
5. ЭБС Айбукс
6. ЭБС Букап
7. ЭБС Лань
8. ЭБС Юрайт
9. СПС КонсультантПлюс
10. НЭБ eLibrary
33
34.
Спасибо за внимание34
























 Химия
Химия








