Похожие презентации:
Острые лейкозы
1.
ФГБОУ ВО «Ижевская государственная медицинская академия» МЗ РоссииКафедра факультетской терапии с курсами эндокринологии и гематологии
ОСТРЫЕ ЛЕЙКОЗЫ
Заслуженный врач России,
доктор медицинских наук,
профессор Е.Н.Никитин
Ижевск, 2021г.
2.
Гемобластозы– гетерогенная группа опухолей,
возникших из кроветворных клеток.
Они
делятся
на
лейкозы,
представляющие
собой
внутрикостномозговые
разрастания
опухолевых клеток, и на опухоли
внекостномозгового происхождения
(гематосаркомы, лимфоцитомы).
3.
Острыелейкозы
(ОЛ)
–
злокачественные
опухоли
крови
костномозгового
происхождения, возникающие в результате соматической
мутации на уровне клеток-предшественников гемопоэза,
характеризующиеся утратой способности опухолевых клеток к
дифференцировке, наличием признаков опухолевой прогрессии
и раннего системного метастазирования в кроветворные и
некроветворные
органы.
Патоморфологическим субстратом
ОЛ являются молодые
лейкозные (бластные) клетки, соответствующие родоначальным
элементам
одного
из
ростков
кроветворения.
Хронические
лейкозы
(ХЛ)
-
дифференцирующиеся опухоли системы крови, основной
субстрат которых
составляют морфологически зрелые и
созревающие клетки различных линий дифференцировки.
4.
Острые лейкозыОтносительно редкое заболевание – 3% от всех
злокачественных опухолей человека
Заболеваемость в среднем 5 случаев на 100.000
населения в год. В возрасте 30-50 лет – 2:100.000,
50-75 лет – 15-20:100.000
Взрослые – 75% всех случаев, дети – 25%
Среднее соотношение миелоидных и лимфоидных
форм - 6:1
В детском возрасте 80-90% всех острых лейкозовОЛЛ, у взрослых (после 40 лет) -80% составляют
случаи ОНЛЛ(ОМЛ)
Средний возраст при ОЛЛ – около 10 лет (пик
заболеваемости -3-4 года), при ОНЛЛ (ОМЛ) – 6065 лет
5.
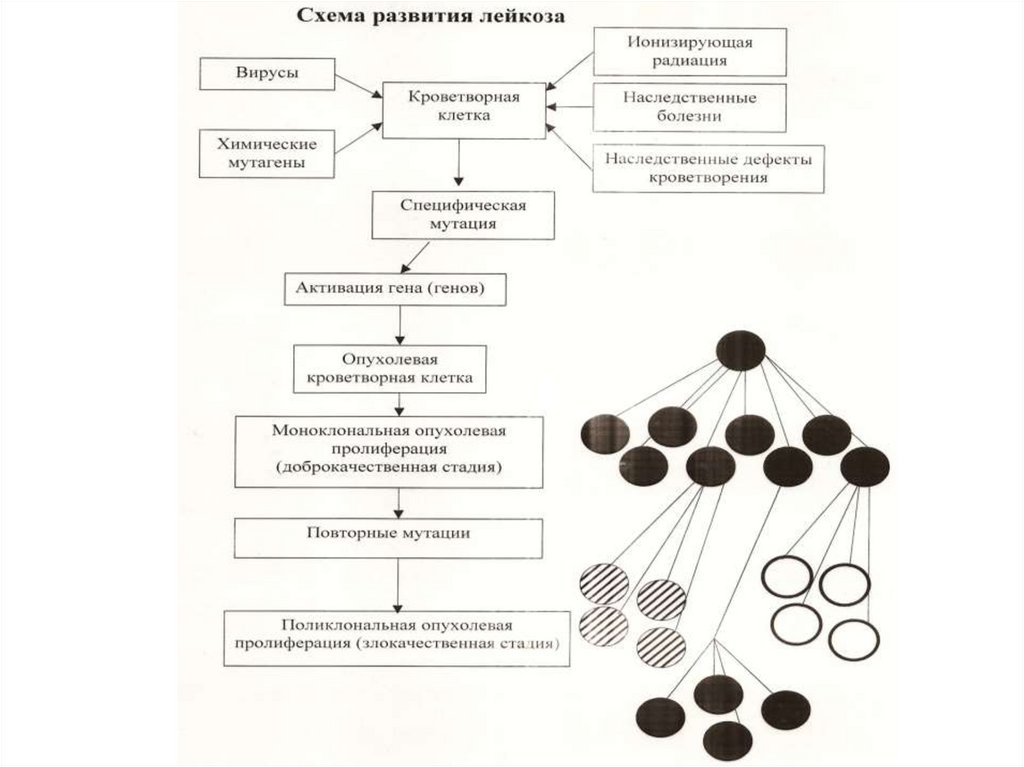
Этиология гемобластозов (1)Факторы онкогенеза:
Ионизирующая радиация (доза и мощность
облучения);
Химические мутагены:
цитостатики
(мустарген,
циклофосфан,
лейкеран, мелфалан, азатиоприн, метотрексат, 6меркаптопурин, этопозид, миелосан и др.);
- органические растворители (бензол);
- канцерогены загрязненной внешней среды;
Вирусная инфекция (вирус Эпштейна–Барр,
вирус Т –клеточной лимфомы человека -HTLV-1);
6.
Этиология гемобластозов (2)Факторы онкогенеза:
Наследственность:
наследственные болезни с хромосомными аномалиями
(синдромы
Дауна,
Клайнфельтера,
Фанкони,
Шерешевского-Тернера) и дефектами
иммунитета:
атаксия-телеангиоэктазия (болезнь Луи-Барр), синдром
Вискотта-Олдрича,
болезнь
Братона
(агаммаглобулинемия);
наследственная нейтропения;
этнические особенности (высока заболеваемость ХЛЛ
среди евреев и
литовцев, низка среди китайцев,
японцев и лиц тюркской этнической группы).
Наследуются не сами лейкозы, а генетические дефекты тех
клеток, из которых развивается опухоль.
7.
Патогенез гемобластозов (1)Гемобластозы имеют клоновое происхождение:
являются потомством одной первоначально
мутировавшей клетки.
Доказательства клоновой природы опухолевой
пролиферации:
Однородность опухолевых клеток по белковому синтезу
при парапротеинемических гемобластозах (миеломная
болезнь, макроглобулинемия Вальденстрема);
Исследования П. Фиалковым типов фермента Г-6-ФД в
клетках крови и фибробластах костного мозга и кожи у
мулаток, больных хроническими миелопролиферативными
опухолями и гетерозиготных по указанному ферменту;
8.
Патогенез гемобластозов (2)Кариотип опухолевых клеток обнаруживает у
одного и того же больного идентичные
хромосомные изменения: анеуплоидный и (или)
псевдодиплоидный (структурные перестройки по
типу транслокаций, делеций, инверсий и др.) наборы
хромосом. Например, выявление специфического
маркера – филадельфийской хромосомы – 22q –
[t (9;22)(q34;q11)] в клетках крови больных ХМЛ;
[t (15;17)(q22;q21)] при ОПЛ (М3-ОМЛ);
[t (8;21)(q22;q22)] при М2-ОМЛ.
9.
Патогенез гемобластозов (3)Генетические механизмы лейкозогенеза:
Ключевую роль в возникновении и развитии лейкозов играют
хромосомные перестройки клеток, лежащие в основе изменений
функций генов, продукты которых (белки) в норме осуществляют
регулирование пролиферации, дифференцировки и апоптоза клеток
Характерные для гемобластозов хромосомные аномалии транслокации – ведут к образованию химерных генов (например,
bcr/abl при ХМЛ, PML/RAR-альфа при ОПЛ или RUNXI/RUNXITI при
ОМЛ) и/или активации протоонкогенов (продукции активных
онкопротеинов).
Эти функционально измененные гены могут кодировать
ростовые факторы, рецепторы ростовых факторов, сигнальные
молекулы, протеинкиназы, транскрипционные факторы, нарушая
жизненно важные процессы в клетке и способствуя формированию
опухоли.
Хромосомные делеции сопровождаются инактивацией геновсупрессоров опухолевого роста (в частности, ген Р53).
10.
Патогенез гемобластозов (4)Срыв механизма апоптоза в онкогенезе:
Блокада
клеточной гибели и придание
мутировавшим клеткам «бессмертия» (например,
повышение
активности
гена
bcl-2
в
центрофолликулярной
лимфоме
с
t(14;18),
активация гена abl в химерном гене bcr-abl при
хроническом миелолейкозезе с t(9;22).
Нарастание степени злокачественности опухоли
за счет появления мутантного по гену Р53 субклона,
не чувствительного к противоопухолевой терапии;
11.
Общие закономерностиопухолевой прогрессии (1)
Гемобластозы проходят 2 стадии: моноклоновую
(доброкачественную)
и
поликлоновую
(злокачественную);
Угнетение нормальных ростков кроветворения;
Закономерна смена дифференцированных клеток,
составляющих опухоль, при хронических лейкозах и
лимфомах
бластными
клетками,
определяющими
развитие либо бластного (острого) лейкоза, либо
лимфосаркомы;
Иммуноглобулинсекретирующая
лимфатическая
или
плазматическая опухоль может потерять способность к
секреции,
что
сопровождается
качественными
изменениями поведения опухоли и обычно ее бластной
трансформацией;
12.
Общие закономерностиопухолевой прогрессии (2)
Опухолевые клетки, прежде всего бласты, могут терять
ферментную специфичность цитоплазматических включений
и
становиться
морфологически
и
цитохимически
неидентифицируемыми;
Форма ядра и цитоплазмы бластных клеток претерпевают
скачкообразные или постепенные изменения от круглой к
неправильной и большей по площади;
Все
внекостномозговые
гемобластозы
способны
лейкемизироваться, то есть метастазировать в костный мозг;
Метастазы гемобластозов вне органов кроветворения
отражают появление нового, адаптированного к данной
ткани субклона;
Появление резистентности опухоли к ранее эффективному
цитостатическому лечению означает качественно новый этап
ее развития.
13.
14.
Острые миелоидные лейкозы (ОМЛ) и родственные новообразования(классификация ВОЗ, 2016г.) (1)
ОМЛ с повторяющимися генетическими аномалиями
•ОМЛ с t(8;21)(q22;q22); RUNX1- RUNX1T1;
•ОМЛ с inv(16)(p13.1q22) или t(16;16)(q13.1;q22); CBFB-MYH11;
•ОПЛ с t(15;17)(q22;q12); PML-RARA;
•ОМЛ с t(9;11)(q22;q23); MLLT3-MLL;
•ОМЛ с t(6;9)(q23;q34); DEK-NUP214;
•ОМЛ с inv(3)(q21;q26.2) или t(3;3)(q21;q26.2); RPN1-EVI1;
•ОМЛ (мегакариобластный) с t(1;22)(q13;q13); RBM15-MKL1;
Предварительная форма:
• ОМЛ с BCR/ABL1;
ОМЛ с мутированным геном NPM1;
• ОМЛ с биаллельными мутациями CEBPA;
• Предварительная форма: ОМЛ с мутированным RUNX1.
ОМЛ с изменениями, связанными с миелодисплазией
Миелоидные новообразования, связанные с терапией
ОМЛ, неуточненные
• ОМЛ с минимальными признаками дифференцировки
• ОМЛ без признаков созревания
• ОМЛ с признаками созревания
• Острый миеломонобластный лейкоз
• Острый монобластный/моноцитарный лейкоз
• Острый эритромиелоз (истинный эритроидный лейкоз)
• Острый мегакариобластный лейкоз
• Острый базофильный лейкоз
• Острый панмиелоз с миелофиброзом (син.: острый миелофиброз; острый миелосклероз)
15.
Острые миелоидные лейкозы (ОМЛ) и родственныеновообразования (классификация ВОЗ, 2016г.) (2)
Миелоидная саркома (син.: экстрамедуллярная
миелоидная опухоль; гранулоцитарная саркома; хлорома)
Миелоидные опухоли, связанные с синдромом Дауна
• Транзиторный аномальный миелопоэз (син.: транзиторное МПЗ)
• Миелоидный лейкоз, связанный с синдромом Дауна
Опухоль из бластных плазмоцитоидных дендритных клеток
Острые лейкозы неопределенной линии дифференцировки
• Острый недифференцированный лейкоз
• Острый лейкоз со смешанным фенотипом с t(9;22)(q34;q11.2); BCR-ABL1+
• Острый лейкоз со смешанным фенотипом с t(v;11q23); с перестройкой КМТ2А
• Острый лейкоз со смешанным фенотипом, В/миелоидный, неуточненный
• Острый лейкоз со смешанным фенотипом, T/миелоидный, неуточненный
16.
Острые лимфобластные лейкозы (классификация ВОЗ, 2016г.)B- лимфобластный лейкоз/лимфома (острый лимфобластный лейкоз из
предшественников В-клеток - синоним
• B-лимфобластный лейкоз/лимфома, без специфических характеристик (NOS – not otherwise
specified)
• B-лимфобластный лейкоз/лимфома с повторяющимися хромосомными аномалиями
– B-лимфобластный лейкоз/лимфома с t(9:22) (q34;q11.2); BCR/ABL1;
– B-лимфобластный лейкоз/лимфома с t(v;11q23.3); KMT2A rearranged;
– B-лимфобластный лейкоз/лимфома с t(12;21)(p13.2;q22.1); ETV6-RUNX1;
– B-лимфобластный лейкоз/лимфома с гипердиплоидией ;
– B-лимфобластный лейкоз/лимфома с гиподиплоидией (гиподиплоидный ОЛЛ);
– B-лимфобластный лейкоз/лимфома с t(5;14)(q31.1;q32.3); IL3-IGH;
– B-лимфобластный лейкоз/лимфома с t(1;19)(q23;p13.3); TCF3/PBX1;
– B-лимфобластный лейкоз/лимфома, BCR-ABL1-подобный (BCR-ABL1-like);
– B-лимфобластный лейкоз/лимфома с iAMP21.
T -лимфобластный лейкоз/лимфома (син.: острый лимфобластный лейкоз из
предшественников Т- клеток)
– из ранних предшественников Т-лимфобластный лейкоз/лимфома;
– NK-клеточный лимфобластный лейкоз/лимфома.
17.
Диагностика острых лейкозовГиперпластический синдром;
Синдром опухолевой интоксикации;
Анемический синдром;
Геморрагический синдром;
Гематологический синдром;
Морфологическое исследование аспирата костного
мозга (обнаружение при ОМЛ более 20% бластных
клеток, при ОЛЛ – более 25% бластов;
Верификация варианта острого лейкоза с применением
цитохимических, иммунологических, цитогенетических
и молекулярно-генетических методов исследования
опухолевых бластных клеток;
Исследование ликвора для исключения нейролейкоза.
18.
Гиперпластический синдромГиперпластический синдром (синдром лейкемической
пролиферации) обусловлен опухолевым ростом как в
костном мозге, так и вне его (метастазирование):
- увеличение селезенки, печени, лимфатических узлов
(периферические, в средостении, брюшной полости) и
миндалин;
- поражения кожи (кожные лейкозные инфильтраты неспецифическая гемодермия или лейкемиды), мозговых
оболочек (нейролейкоз или нейролейкемия), почек,
миокарда и легких, костей;
- поражение полости рта (гиперплазия, разрыхленность
десен, язвенно-некротический стоматит и др.)
19.
• Синдром опухолевой интоксикации - снижениемассы тела, лихорадка, потливость, выраженная
слабость
• Анемический синдром – бледность кожи и
слизистых оболочек, общая слабость, утомляемость,
одышка, тахикардия
• Геморрагический синдром - возникновение от
мелкоточечных и мелкопятнистых единичных или
редких высыпаний на коже и слизистых оболочках
до обширных кровоизлияний и профузных
кровотечений (носовые, маточные, почечные,
желудочно-кишечные и пр.).
20.
Гематологический синдром при остром лейкозеАнемия обычно нормохромная, нормоцитарная : гемоглобин в пределах 50-110 г/л, а
число эритроцитов – 1,4-3,5·1012/л. Редко анемия гиперхромно-макроцитарная. В
ряде случаев содержание эритроцитов и гемоглобина значительно снижаются,
соответственно, до 0,9·1012/л и 30 г/л. СОЭ чаще увеличена или в норме – 8-82 мм/ч.
Количество ретикулоцитов составляет 0-36 ‰,.
Типична тромбоцитопения (15-110·109/л), она может доходить до очень низких
значений (0-3·109/л).
Количество лейкоцитов варьирует в очень широких пределах: от лейкопении
(1,0·109/л) до выраженного гиперлейкоцитоза (150·109/л), в среднем на уровне 1520·109/л. Типично появление в крови бластных клеток, содержание которых
колеблется от единичных до 90-97%. В лейкемической фазе болезни (при выходе
лейкозных бластов из костного мозга в кровь) характерно снижение содержания
зрелых гранулоцитов (нейтрофилов, эозинофилов, базофилов), моноцитов,
лимфоцитов с полным отсутствием или реже единичным присутствием
промежуточных (созревающих) форм лейкоцитов (лейкемический «провал» в
формуле между молодыми бластными и зрелыми клетками).
При дебюте болезни с алейкемической фазы заболевания (при отсутствии лейкозных
бластов в крови и наличии их в костном мозге) в гемограмме может быть
парциальная (одно- или двухростковая) цитопения или даже выраженная
панцитопения (анемия, лейкопения с гранулоцитопенией, тромбоцитопения).
В мазке крови в ряде случаев встречаются единичные эритрокариоциты.
21.
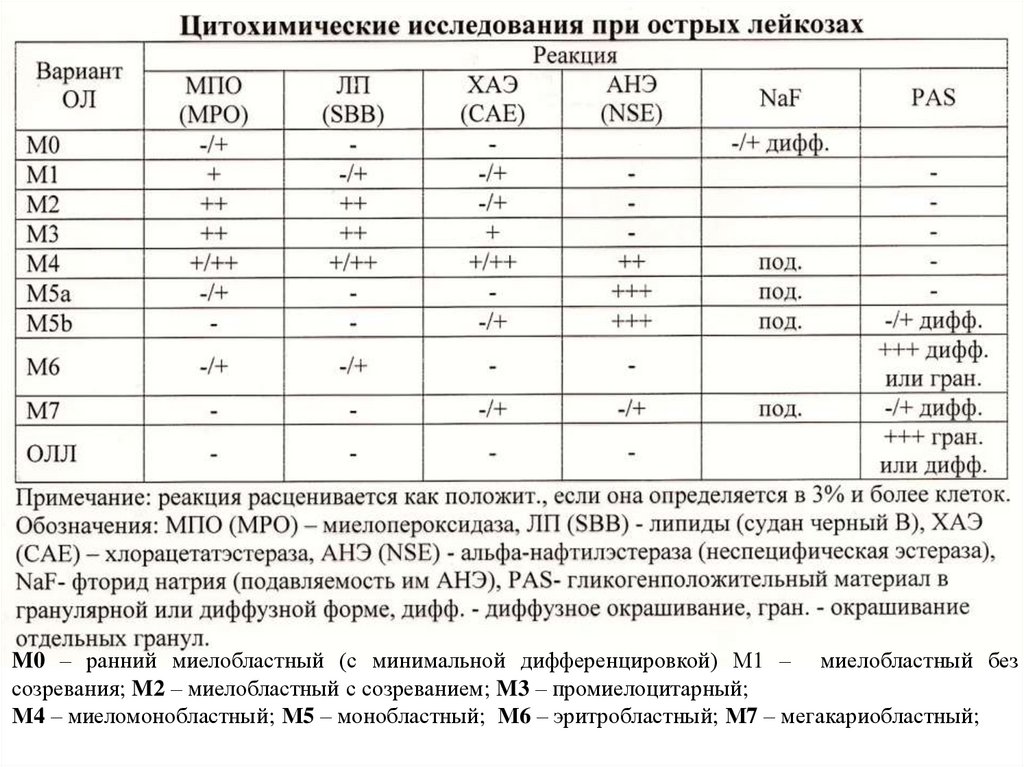
Цитохимическое исследование опухолевыхбластных клеток костного мозга и /или крови
Цитохимические реакции на:
миелопероксидазу;
липиды (судан черный);
хлорацетатэстеразу (специфическую эстеразу);
альфа-нафтилацетатэстеразу (неспецифическую
эстеразу)с добавлением фторида натрия и без;
Гликоген (ШИК - реакция).
22.
M0 – ранний миелобластный (с минимальной дифференцировкой) М1 – миелобластный безсозревания; M2 – миелобластный с созреванием; M3 – промиелоцитарный;
М4 – миеломонобластный; М5 – монобластный; М6 – эритробластный; М7 – мегакариобластный;
23.
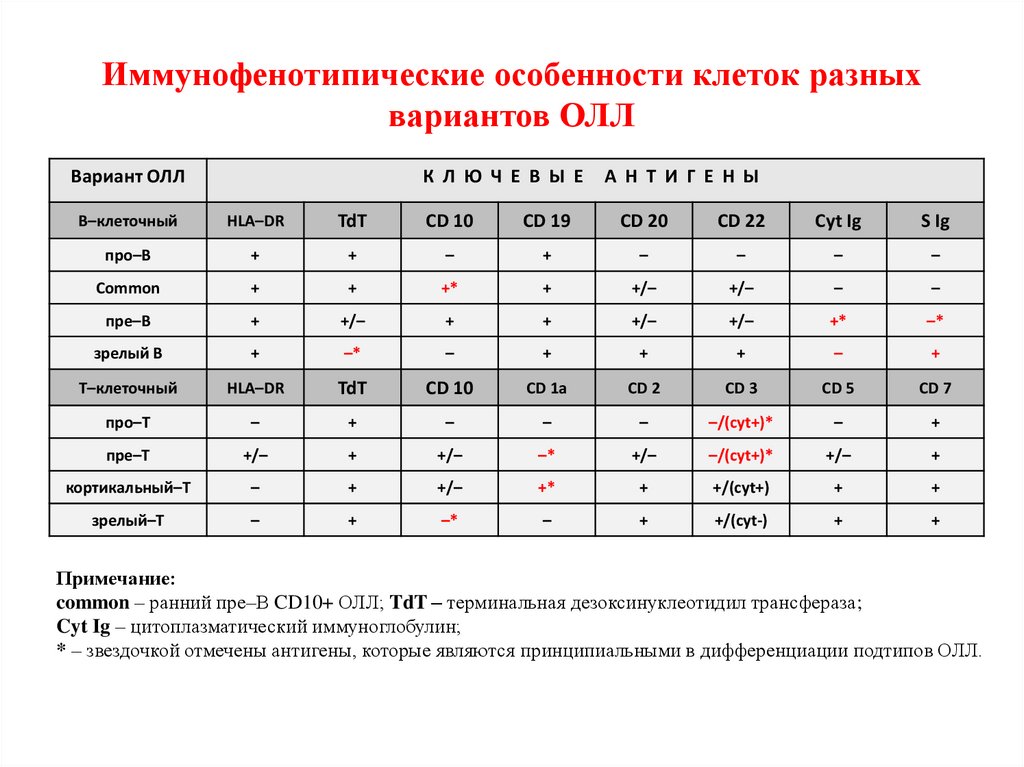
Иммунофенотипирование опухолевых клеток методомпроточной цитофлуориметрии
Антигены, специфичные для В-лимфобластов – CD10+, CD19+,
CD79а+, сyCD22+, sCD22+, CD24+, РАХ+, TdT+, возможна
экспрессия CD34+, CD20+. Ключевые маркеры для диагностики
В-ОЛЛ: CD19+, CD79a+ и /или cyCD22+;
Антигены, специфичные для Т-лимфобластов – CD1а+, CD2+,
CD3+, CD4+, CD5+, CD7+, CD8+, CD34+. Ключевые маркеры для
диагностики Т-ОЛЛ: cyCD3+ и CD7+ ;
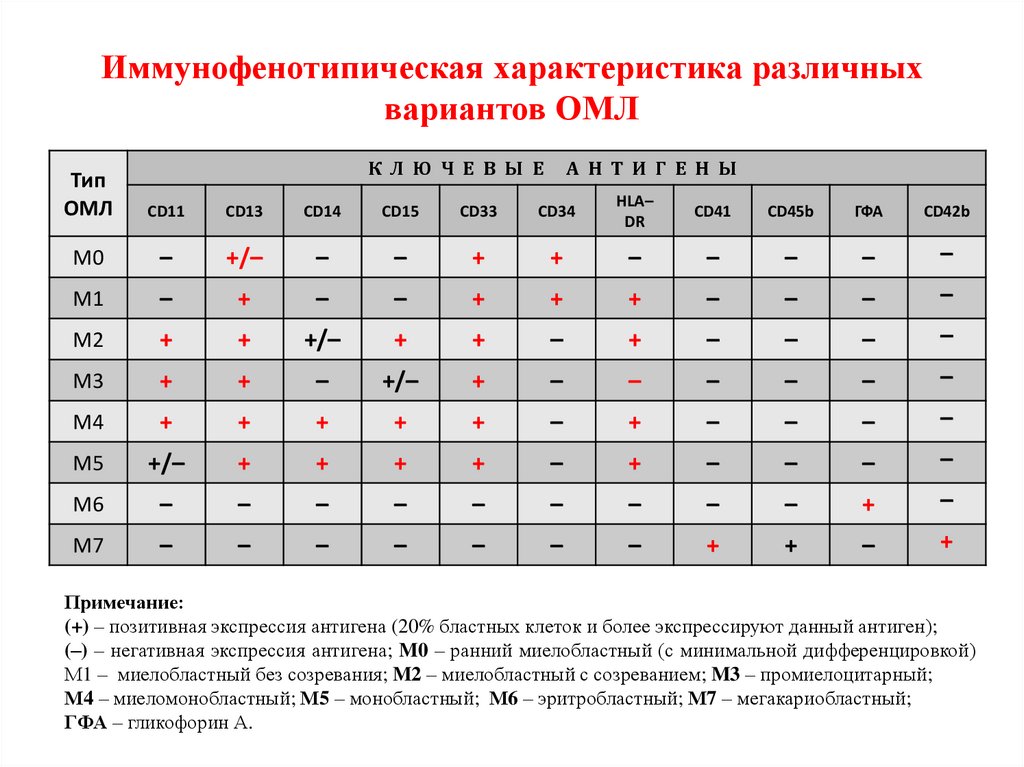
Исследуемая панель для ОМЛ должна включать следующие
маркеры: СD34, СD13, СD33, СD41, СD61, СD14, CD15, CD56,
СD11в, HLA-DR, внутриклеточная MПO. Дополнительно должны
исследоваться лимфоидные маркеры CD7, CD2, CD3 (в
цитоплазме), СD4, CD79a, СD19, CD22. В 20% случаев ОМЛ
имеется коэкспрессия лимфоидных маркеров (например, CD7,
CD19, CD2).
24.
Иммунофенотипические особенности клеток разныхвариантов ОЛЛ
Вариант ОЛЛ
К Л Ю Ч Е В Ы Е
А Н Т И Г Е Н Ы
В–клеточный
HLA–DR
TdT
CD 10
CD 19
CD 20
CD 22
Cyt Ig
S Ig
про–В
+
+
–
+
–
–
–
–
Common
+
+
+*
+
+/–
+/–
–
–
пре–В
+
+/–
+
+
+/–
+/–
+*
–*
зрелый В
+
–*
–
+
+
+
–
+
Т–клеточный
HLA–DR
TdT
CD 10
CD 1a
CD 2
CD 3
CD 5
CD 7
про–Т
–
+
–
–
–
–/(cyt+)*
–
+
пре–Т
+/–
+
+/–
–*
+/–
–/(cyt+)*
+/–
+
кортикальный–Т
–
+
+/–
+*
+
+/(cyt+)
+
+
зрелый–Т
–
+
–*
–
+
+/(cyt-)
+
+
Примечание:
common – ранний пре–В CD10+ ОЛЛ; TdT – терминальная дезоксинуклеотидил трансфераза;
Cyt Ig – цитоплазматический иммуноглобулин;
* – звездочкой отмечены антигены, которые являются принципиальными в дифференциации подтипов ОЛЛ.
25.
Иммунофенотипическая характеристика различныхвариантов ОМЛ
К Л Ю Ч Е В Ы Е
А Н Т И Г Е Н Ы
Тип
ОМЛ
CD11
CD13
CD14
CD15
CD33
CD34
HLA–
DR
CD41
CD45b
ГФА
CD42b
M0
–
+/–
–
–
+
+
–
–
–
–
–
M1
–
+
–
–
+
+
+
–
–
–
–
M2
+
+
+/–
+
+
–
+
–
–
–
–
M3
+
+
–
+/–
+
–
–
–
–
–
–
M4
+
+
+
+
+
–
+
–
–
–
–
M5
+/–
+
+
+
+
–
+
–
–
–
–
M6
–
–
–
–
–
–
–
–
–
+
–
M7
–
–
–
–
–
–
–
+
+
–
+
Примечание:
(+) – позитивная экспрессия антигена (20% бластных клеток и более экспрессируют данный антиген);
(–) – негативная экспрессия антигена; M0 – ранний миелобластный (с минимальной дифференцировкой)
М1 – миелобластный без созревания; M2 – миелобластный с созреванием; M3 – промиелоцитарный;
М4 – миеломонобластный; М5 – монобластный; М6 – эритробластный; М7 – мегакариобластный;
ГФА – гликофорин А.
26.
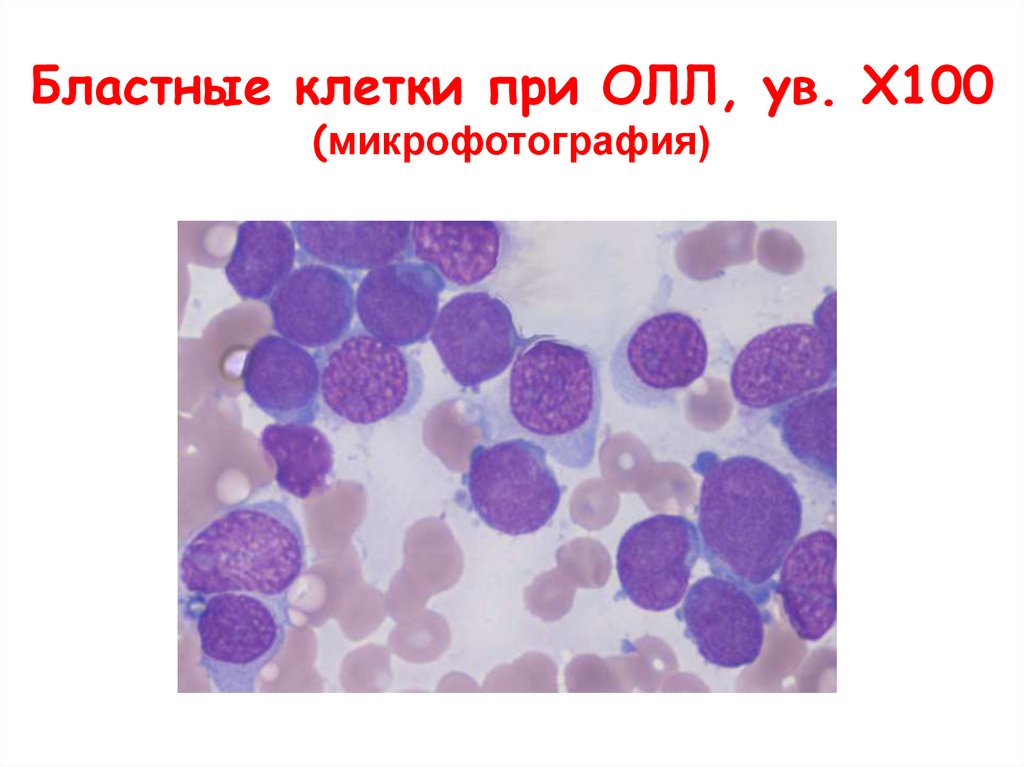
Бластные клетки при ОЛЛ, ув. Х100(микрофотография)
27.
Бластные клетки при ОПЛ(микрофотография)
28.
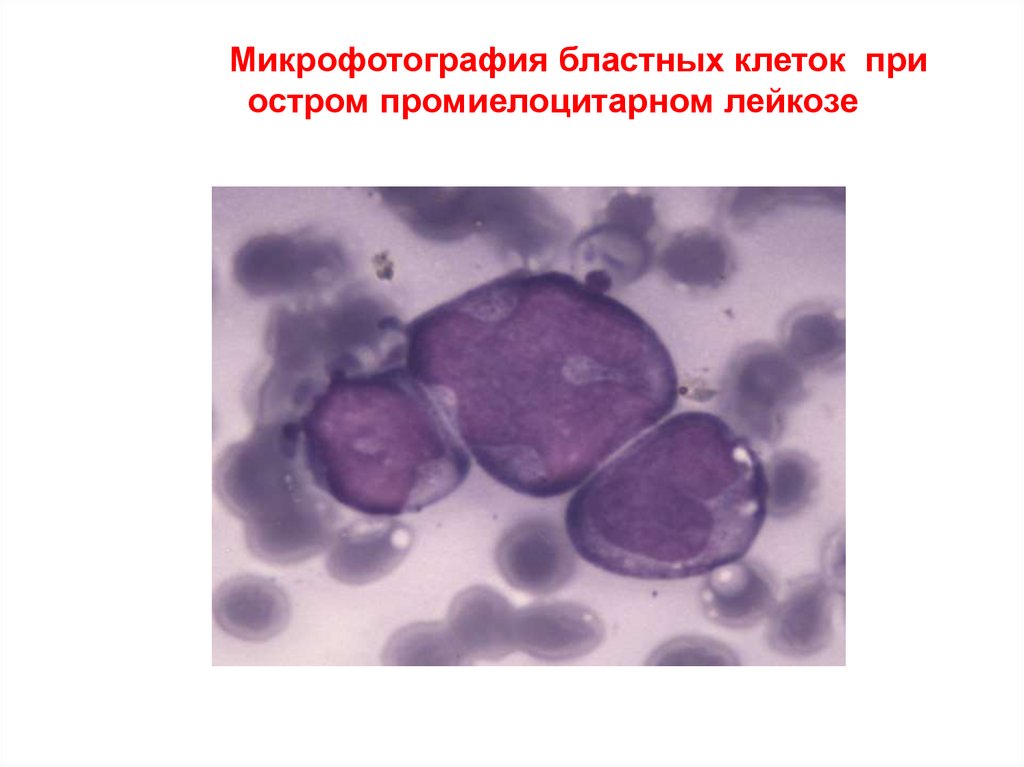
Микрофотография бластных клеток приостром промиелоцитарном лейкозе
29.
Микрофотография мазка крови приостром миеломонобластном лейкозе
30.
Показана резко положительная реакция нанафтилацетатэстеразу в бластной клетке при
ОММнЛ
31.
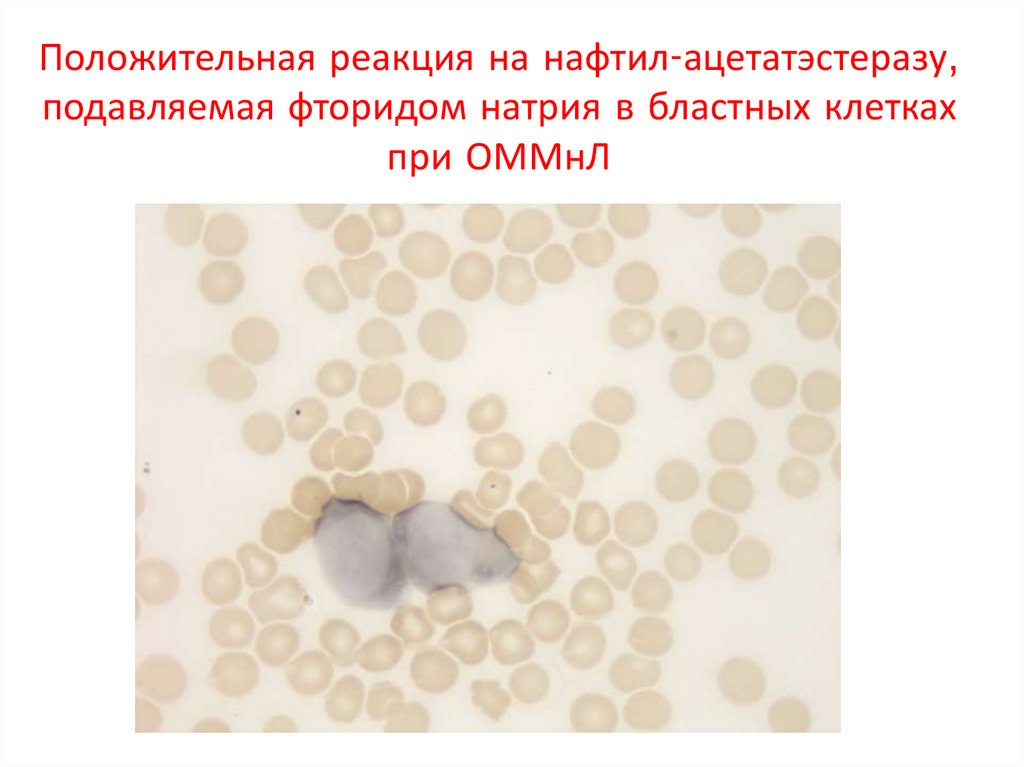
Положительная реакция на нафтил-ацетатэстеразу,подавляемая фторидом натрия в бластных клетках
при ОММнЛ
32.
ШИК-реакция бластных клеток нагликоген при ОЛЛ
33.
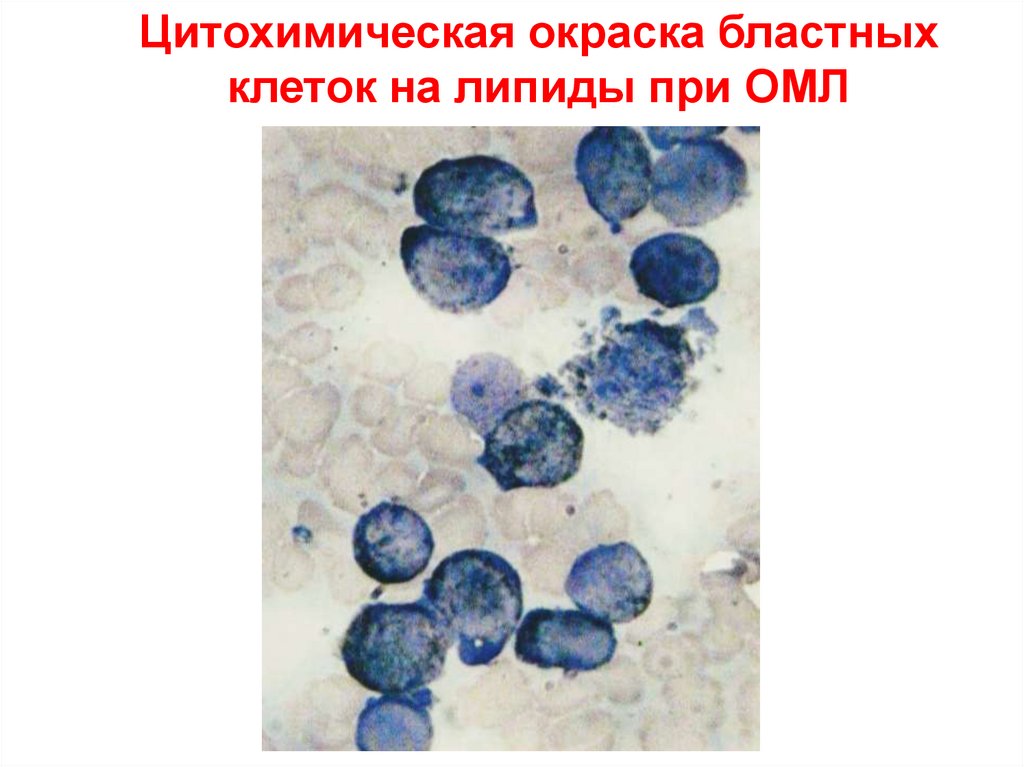
Цитохимическая окраска бластныхклеток на липиды при ОМЛ
34.
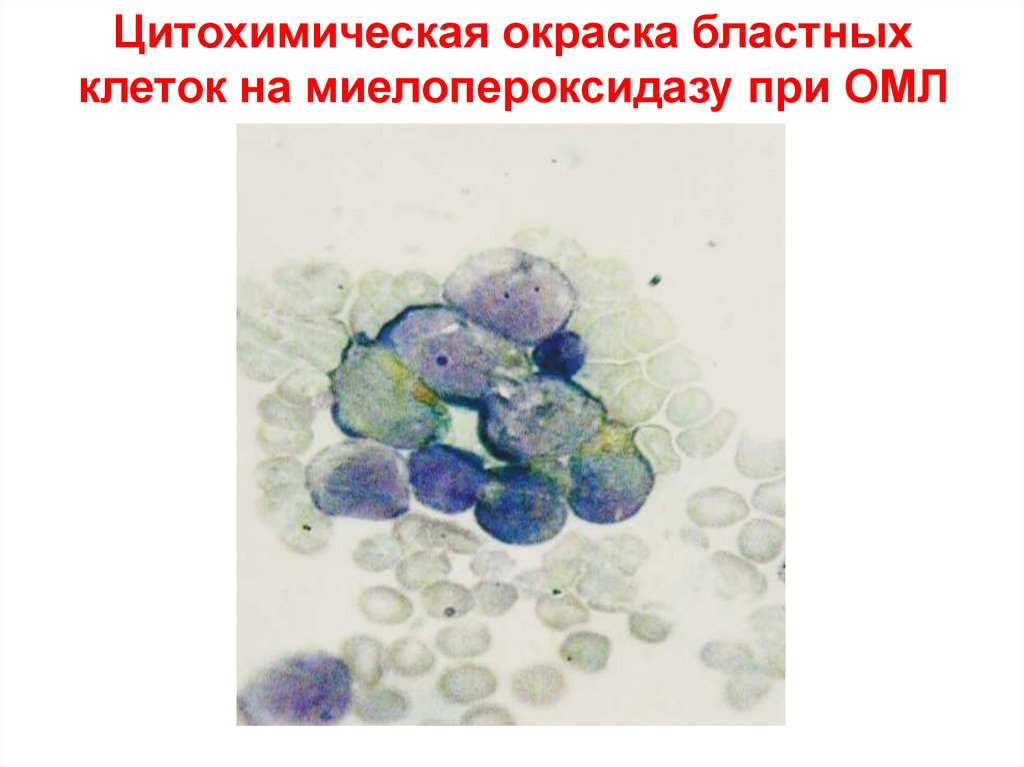
Цитохимическая окраска бластныхклеток на миелопероксидазу при ОМЛ
35.
Цитогенетическое исследование аспиратакостного мозга
• Стандартное цитогенетическое исследование является
необходимым компонентом диагностических процедур у
пациента с острым лейкозом;
• Для определения кариотипа достоверным считается
исследование как минимум 20 метафаз, в которых
производится подсчёт хромосом и оценка их структуры;
• Стандартное цитогенетическое исследование является
единственным методом, позволяющим анализировать весь
хромосомный набор клетки целиком.
• Около 50% пациентов имеют те или иные цитогенетические
аномалии.
36.
Кариограмма. Несбалансированная реципрокная транслокация междухромосомами 15 и 17 (указаны стрелками) в бластных клетках при остром
промиелоцитарном лейкозе
37.
Изменения кариотипа бластных клеток костного мозга при ОМЛБ., З. (26.12.17)
Кариотип: 41~45, XY, -4, -5, add(9)(q34), -10, add(11)(q?21), -16, -17, -18, 20, +6 mar [9] / 46, XY [11]
Заключение: Проанализировано 20 клеток. В 45 % количество
хромосом от 41 до 45, обнаружены множественные хромосомный
аномалии, затрагивающие 4, 5, 9, 10, 11, 16, 17, 18 и 20 хромосомы.
38.
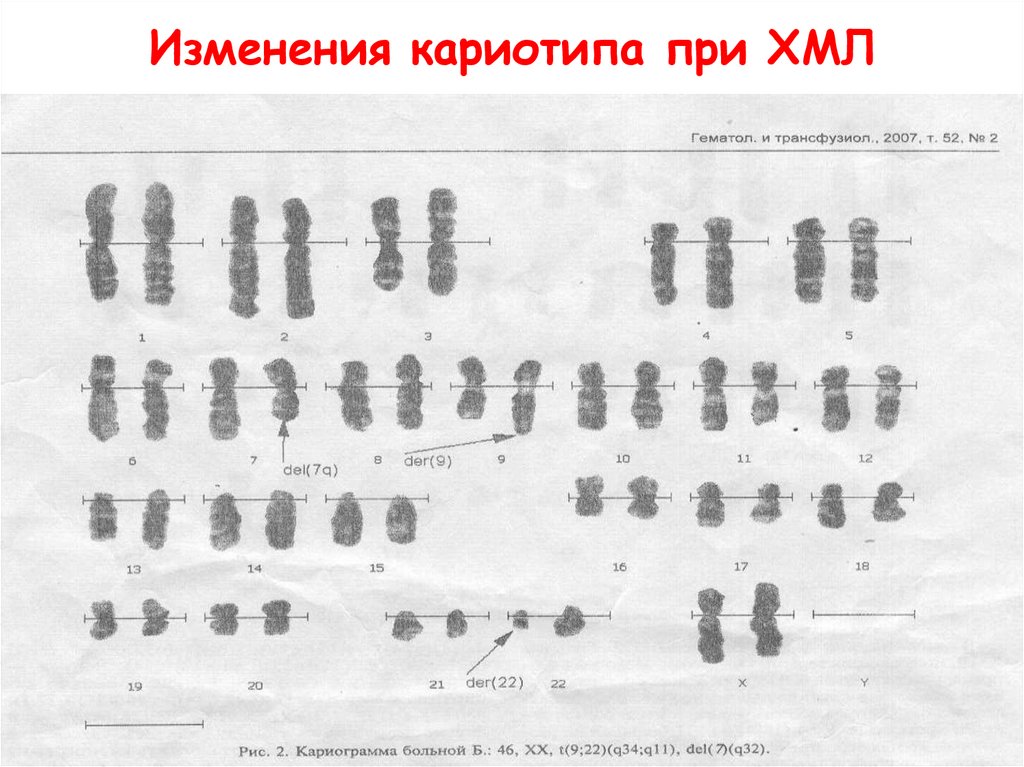
Изменения кариотипа при ХМЛ39.
Изменения кариотипа при ХМЛ40.
Молекулярно-генетические исследованияпри острых лейкозах
• Молекулярно-генетические исследования клеток костного
мозга при острых лейкозах на наличие химерных генов
проводятся методами полимеразной цепной реакции
(ПЦР) и флуоресцентной in situ гибридизации (FISH).
Минимальный набор маркёров для диагностики ОМЛ
содержит AML/ETO, CBFβMYH11, PML-RARальфа, MLL/AF4,
МLL/AF9, MLL/ELL, MLL/AF1q, MLL/AF6, MLL/MLL;
• При В-ОЛЛ FISH исследование целесообразно выполнять
на следующие ключевые перестройки: t(9;22) (q34;q11) BCR-ABL и t(4;11) – MLL-AF4
41.
Стадии острого лейкозаПервый острый период ( первая
развернутая
стадия болезни, первая атака)
Полная ремиссия
Выздоровление
Неполная ремиссия
Рецидив (первый или повторный), его
локализация
Терминальная стадия
42.
Критерии полной клиникоморфологической ремиссииВ костном мозге бластных клеток не более 5%,
лимфоцитов – 30%, соотношение прочих ростков – в
норме, мегакариоциты обнаруживаются;
В крови количество нейтрофилов более 1,0х109 л,
тромбоцитов – не менее 100х109 л, бласты не
обнаруживаются;
Отсутствие
внекостномозговых
лейкозных
пролифератов, нормальные размеры лимфоузлов,
печени, селезенки, яичек и др. органов;
Нет клинических признаков нейролейкемии и
нормальный состав ликвора.
Указанные показатели должны сохраняться в
стабильном состоянии в течение 1 месяца и более
43.
Типы полной клинико гематологической ремиссиицитогенетическая полная ремиссия (ПРц) – кариотип
нормальный, методами стандартной цитогенетики не
выявляются исходные аномалии кариотипа;
молекулярная полная ремиссия (ПРм) – отсутствуют
исходно определявшиеся методом ПЦР молекулярные
маркеры ОЛ (дважды проведенный анализ);
неполная ремиссия - морфологическая ремиссия с
неполным восстановлением показателей периферической
крови (число нейтрофилов менее 1,0х109 л, тромбоцитов
менее 100х109 л) (ПРн).
Выздоровлением от острого лейкоза считается стойкая
полная ремиссия на протяжении 5 лет и более.
44.
Рецидивы острого лейкозаКостномозговой рецидив (в костном мозге более 5%
бластных
клеток)
Внекостно – мозговой рецидив (нейролейкемия,поражение
яичек, селезенки, печени и т.д.)
Цитогенетический рецидив –в пунктате костного мозга
митозы с хромосомными аберрациями, обнаруживаемые в
дебюте заболевания на фоне сохраняющейся полной клиникогематологической ремиссии
Молекулярный рецидив –появление исходно определявшихся
молекулярных маркеров ОЛ в двух повторных, проведенных с
коротким интервалом времени, анализах на фоне сохраняющейся
клинико-гематологической ремиссии
Ранний рецидив – регистрируется раньше, чем 1 год от
момента достижения полной ремиссии
Поздний рецидив –возникает через 1 год и более от момента
достижения полной ремиссии
45.
Острый лейкоз: течение заболевания ипрогноз (1)
При естественном течении и отсутствии лечения летальный исход в течение нескольких недель (2-3 мес.).
Острый миелобластный лейкоз:
• средний возраст больных 50-55 лет;
• ремиссии удается достичь у 60-70% больных. Прогноз
ухудшается с возрастом: ремиссии достигают у 55-70% в
возрасте до 60 лет, а старше 60 лет – только в 33-65%.
Средняя продолжительность ремиссии – 1 год, средняя
ожидаемая продолжительность жизни около 2 лет;
• 15-20% больных удается вылечить химиотерапией. ОПЛ
излечивают у 60% пациентов при быстрой правильной
диагностике и своевременном лечении.
46.
Острый лейкоз: течение заболевания ипрогноз (2)
Острый лимфобластный лейкоз:
• средний возраст больных моложе, чем при ОМЛ
(40-45 лет);
• ремиссии удается получить у 75-80% больных,
средняя продолжительность ремиссии – 18-24 мес.;
• выздоровление при химиотерапии отмечается у
20-25% больных;
• прогноз значительно лучше при проведении
аллогенной и аутологичной трансплантации
костного мозга у больных во время второй и более
ремиссии.
47.
Программное лечение острыхлейкозов
Установление
диагноза
острого
лейкоза
с
идентификацией его варианта требует немедленной
активной программной терапии (за исключением
малопроцентного лейкоза и эритромиелоза).
Цель
терапии
–
излечение
или
достижение
длительной безрецидивной выживаемости больных.
Задачи:
1. Поэтапная полная эрадикация лейкозного клона и
восстановление
нормального
поликлонального
гемопоэза;
2. Предупреждение и активное лечение проявлений и
осложнений цитостатической болезни (желудочнокишечных, кожных, гематологических).
48.
Лечение острых лейкозовОсновные этапы лечения:
1. Индукция ремиссии;
2. Консолидация
(закрепление)
ремиссии;
3. Профилактика нейролейкемии;
4.Терапия поддерживания
ремиссии.
49.
Лечение острых лейкозовПервый этап лечения – индукция ремиссии –
начинается сразу же после установления диагноза по
программам, соответствующим форме лейкоза, и
заканчивается подтверждением ремиссии с помощью
пункции костного мозга и спинальной пункции. В этот
период
происходит
максимально
быстрое
и
существенное сокращение на 2-3 порядка опухолевой
массы (на 99,0-99,9%)
Цитостатическое
лечение
в
стадии
ремиссии,
включающее
курсы
консолидации
и
терапии
поддерживания,
проводится
с
целью
полного
уничтожения остаточных бластных клеток и достижения
выздоровления.
Режим: Индукционная химиотерапия осуществляется в
стационаре, лечение в стадии ремиссии, как правило,
амбулаторное. Для проведения люмбальной пункции –
обязательная госпитализация на сутки.
50.
Принципы леченияострого лейкоза
Применение
цитостатических
препаратов
в
адекватной дозе и за определенный промежуток
времени для более полного уничтожения лейкозного
клона;
Терапия
вспомогательная,
сопроводительная
(«выхаживания») больных в период аплазии
кроветворения , цитостатической болезни.
Наиболее важные препараты для лечения ОМЛ цитарабин, антрациклины, вепезид, аналоги пуринов
(6-меркаптопурин, тиогуанин и др.). ОПЛ лечат
ретиноидом ATRA и антрациклинами с цитозаром.
Для
лечения
ОЛЛ
используют
алкалоиды,
выделенные из растения Vinca rosea L. (винкристин,
онковин) и преднизолон, а также циклофосфамид,
аспарагиназа, антрациклины.
51.
Индукция «7+3» - «ЗОЛОТОЙСТАНДАРТ» для лечения ОМЛ
•Цитарабин - 100 мг/м2 длительная 24 часовая
внутривенная инфузия на 500мл физиологического
раствора. День 1-7.
•Даунорубицин -
60 мг/м2 болюсная в/в инфузия
на 100мл физиологического раствора в течение 1530 минут. День 1-3.
или Идарубицин 12мг/м2
или Митоксантрон 12мг/м2
2017 ELN AML Recommendations
CR 60-80% < 60 лет
40-60% > 60 лет
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ по ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ОСТРЫХ МИЕЛОИДНЫХ ЛЕЙКОЗОВ ВЗРОСЛЫХ.
НАЦИОНАЛЬНОЕ ГЕМАТОЛОГИЧЕСКОЕ ОБЩЕСТВО
Рекомендации утверждены на II Конгрессе гематологов России (апрель 2014г)
52.
Профилактика нейролейкемии (1)Профилактика нейролейкемии распределяется на все
этапы лечения – индукцию ремиссии, консолидацию
и поддерживающее лечение.
Первая диагностическая
люмбальная пункция с
интратекальным введением метотрексата в дозе 12,5
мг м2 (не более 15 мг) осуществляется до
индукционного курса или в первые дни его
проведения до развития цитопении.
При нормальном цитозе ликвора (не более 10 клеток
в 1 мкл, бласты отсутствуют) последующие
люмбальные пункции производятся с введением трех
цитостатических препаратов:
Метотрексат в дозе 12,5 мг м2 (не более 15 мг из
расчета 1,5 мг на 1 мл дист. воды);
Цитозар в дозе 20 мг м2 (из расчета 5 мг препарата
на 1 мл дист. воды);
Преднизолон (30 мг) или дексаметазон (4 мг).
53.
Профилактика нейролейкемии (2)Основной этап профилактики нейролейкемии (5
интратекальных введений с интервалов в 1 нед.)
при
ОЛЛ
осуществляется
во
время
индукционного
лечения.
Следующие
люмбальные
пункции
(второй
этап
профилактики) производятся перед каждым
курсом консолидации, реиндукции, а затем 1 раз в
2-3 мес. на протяжении всего периода
поддерживающего лечения (2,5-3 года)
При ОНЛЛ основной этап осуществляется за
период
первых
2-3
курсов
индукции консолидации,
все
последующие
профилактические пункции – 1 раз в 3 мес. в
течение 1 года терапии
54.
Профилактика нейролейкемии (3)Альтернативным вариантом профилактики
нейролейкемии является облучение головы
в дозе 24 Гр за 15-18 сеансов по 1,5 Гр
каждый (у больных старше 50 лет и в случае
осложнений или тяжелой непереносимости
люмбальных
пункций).
Параллельно
краниальному облучению вводится 4 дозы
метотрексата по 15 мг интралюмбально.
При
ОНЛЛ
облучение
головы
не
сопровождается
профилактическими
люмбальными пункциями
В
ряде
программ
химиотерапии
профилактика
нейролейкемии
осуществляется за счет высоких доз
метотрексата (в в от 500 мг до 5 г м2) и
цитозин-арабинозида (в в от 1 до 3 г м2)
55.
Лечение нейролейкемииОсуществляется по следующей программе:
совместное
интралюмбальное
введение
метотрексата, цитозара и преднизолона с кратностью
2 раза в нед.;
метотрексат, цитозар и преднизолон интратекально в
сочетании с облучением головы в дозе 2,4 Гр (если
больной не получал лучевой профилактики по выше
указанной методике);
метотрексат в в в высоких дозах (300-500 мг м2 или
300-500 мг кг).
Интралюмбальное введение метотрексата, цитозара и
преднизолона прекращают после нормализации
ликвора в трех последовательных пункциях. В
дальнейшем показано профилактическое введение
этих препаратов интралюмбально каждые 1,5-2 мес.
(в дозе 15,30 и 30 мг соответственно) в течение года,
а затем 1 раз в 3 мес. до окончания всей терапии.
56.
Сопроводительная терапия1. Обеспечение адекватного сосудистого доступа;
2. Профилактика синдрома массивного лизиса опухолевых
клеток – водная нагрузка, форсированный диурез,
аллопуринол, гидроксимочевина;
3. Профилактика тошноты и рвоты – противорвотные
препараты;
4. Профилактика и лечение геморрагических осложнений –
трансфузии тромбоцитов, свежезамороженной плазмы,
криопреципитата;
5. Профилактика и лечение анемического синдрома;
6. Профилактика и купирование электролитных нарушений;
7. Профилактика и лечение коагуляционных нарушений;
8. Профилактика и лечение инфекционных осложнений.
57.
Компонентная гемотерапияПри падении уровня тромбоцитов (самая
уязвимая часть цитостатической терапии) ниже
20х109 л до и после лечения цитостатиками
необходимо сопровождать цитостатическую
терапию повторными (1-2 раза в нед.)
переливаниями тромбоцитарной массы в
объеме не менее 4 доз (2-4х1011 клеток),
полученных от одного донора.
Переливание
эритроцитов
по
общим
показаниям (падение их уровня ниже 2,5х1012 л
или гемоглобина ниже 80 г л), появление
гемодинамических нарушений – одышки,
тахикардии, обморочного состояния.
Лейкоциты
при
агранулоцитозе
не
переливаются.
Все переливаемые компоненты крови подлежат
предварительному облучению в дозе 1500 рад
для предупреждения реакции «трансплантат
против хозяина».
58.
Лечение и профилактикаинфекционных осложнений (1)
Изоляция больного в отдельную палату и бокс, обработка
полости рта, санитарно-гигиенические мероприятия;
Антибиотики широкого спектра действия;
Противовирусные
препараты
фамцикловир и др.)
(ацикловир,
валацикловир,
Противогрибковые препараты (флуконазол 200-400 мг сут,
итраконазол 100-200 мг сут, позаконазол, амфоглюкамин 200
мг сут, амфотерицин В, нистатин);
Иммуноглобулины при доказанной генерализованной вирусной
инфекции – ЦМВ, герпесвирус 6-го типа (октагам, биавен,
интраглобин);
Ростовые гемопоэтические факторы (молграмостим – лейкомакс,
филграстим – нейпоген, ленограстим – граноцит).
59.
Лечение геморрагического синдрома(включая ДВС-синдром)
Свежезамороженная плазма 400-600 мл и более
струйно 1-2 раза в день (при ее отсутствии
применяют антигемофильную или нативную
плазму);
Тромбоконцентрат в дозе 2-4х1011 клеток от
одного донора 2-3 раза в нед.;
Контрикал в большой дозе – 400-500 тыс. ЕД в
сут. в в капельно.
Санаторно-курортное лечение –
в привычном для больного климате или в
средней полосе, без инсоляции вне периода
цитопении не противопоказано.
60.
Трансплантация костного мозгаАллогенная – от здорового донора (чаще от
близких родственников) больному;
Аутологичная
- пересадка больному его
собственных миелокариоцитов, заготовленных в
период
полной
клинико-гематологической
ремиссии и сохраняющихся при ультранизких
температурах ( в жидком азоте);
Основной
метод,
позволяющий
преодолеть
токсичность химиотерапии на кроветворение;
Стволовые клетки, полученные от донора или у
самого больного, вводятся после окончания
химиотерапии,
когда
препараты
полностью
вывелись из организма или разрушились, что
позволяет быстро восстановить кроветворение.
61.
Трансплантация костного мозга• При пересадке аллогенного костного мозга возможно
длительное приживление трансплантата только при совпадении
донора и реципиента по антигенам главного комплекса
гистосовместимости (иммунологической совместимости);
• При иммунологической несовместимости развивается
выраженная иммунологическая реакция "трансплантат против
хозяина" (РТПХ), способная привести к гибели больного;
• даже полная совместимость не дает абсолютной гарантии
отсутствия развития РТПХ, и до 25% больных погибает от
осложнений, связанных с трансплантацией;
• Наименьшее количество осложнений встречается у совместимых
сибсов (родных братьев и сестер);
• РТПХ способна оказывать и лечебное действие, когда иммунная
система донора начинает распознавать опухолевые клетки
хозяина и бороться с ними, т.е. проявляется реакция
трансплантат против опухоли (РТПО).
62.
Профилактика острых лейкозовне разработана
Забота государства о гражданах
своей страны
Здоровый образ жизни
Гигиена труда





















































 Медицина
Медицина








