Похожие презентации:
Острые и хронические лейкозы
1.
2.
3.
4.
5.
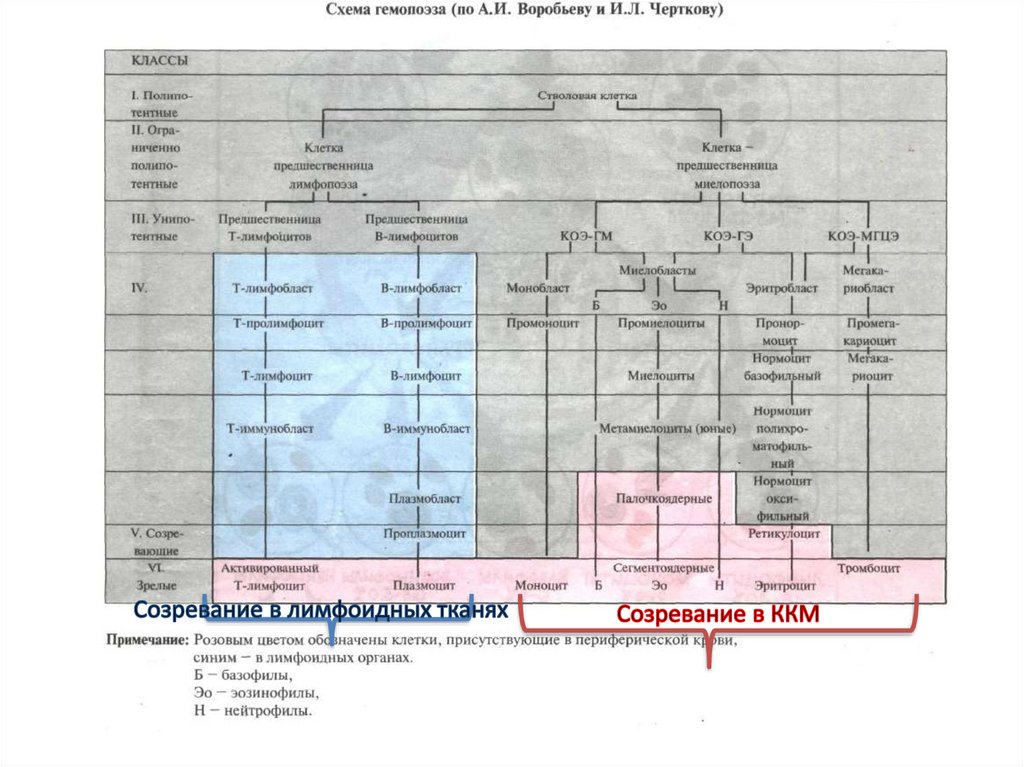
Лейкемические гемобластозы• Миелодиспластический синдром
• Острые и хронические лейкозы миелоидного
ряда
• Острые и хронические лейкозы лимфотичской
природы
• Парапротеинемические гемобластозы
• Макрофагальные и тучноклеточные лейкозы.
6.
Классификация лейкозов по составупериферической крови
острые
1) наличие большого количества бластных форм >50%,
2) отсутствие промежуточных форм лейкоцитов
(лейкемический провал - hiatus leucaemicus)
хронические
1) мало бластных форм до 10%,
2) имеются все промежуточные формы лейкоцитов.
7.
8.
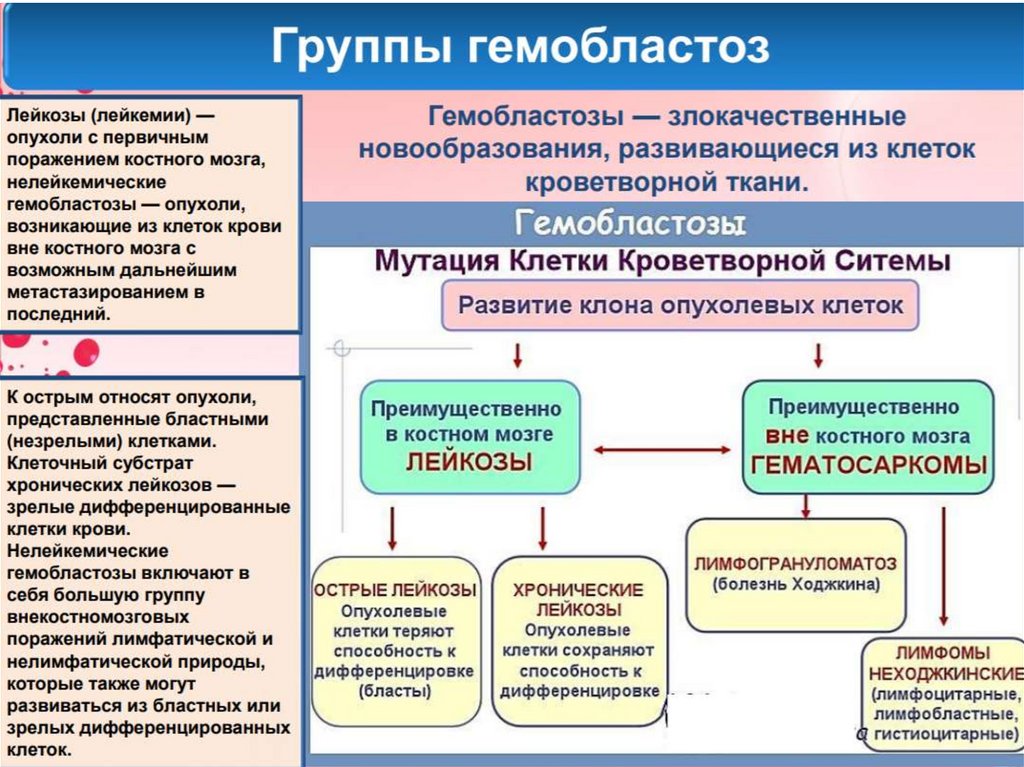
Острые лейкозыЗаболевания,
характеризующиеся
пролиферацией незрелых бластных клеток в
ККМ с угнетение нормального гемопоэза и
вовлечение в процесс различных органов
(ЦНС, печень, селезенка, л\у)
9.
• ОЛЛ чаще наблюдается у детей до 15 лет, увзрослых на него приходится не более 1520%.
• ОМЛ развивается преимущественно у
взрослых (80%), у детей около 20%.
10.
Клиническая картинаНачальная стадия
Острое начало — наблюдается у 50% больных и характеризуется высокой
температурой тела (иногда с ознобами), выраженной слабостью,
интоксикацией, болями в суставах, болями при глотании, болями в животе.
Такое начало заболевания, как правило, трактуют как грипп, ангину, ревматизм,
острое респираторное заболевание.
Начало заболевания с выраженными геморрагическими явлениями наблюдается у 10% больных и характеризуется профузным кровотечением
различной локализации (носовым, желудочно-кишечным, церебральным и
др.).
Медленное
начало
характеризуется
развитием
неспецифического
симптомокомплекса: нарастающей слабостью, прогрессирующим снижением
работоспособности, выраженной усталостью, болями в костях, мышцах,
суставах, незначительным увеличением лимфатических узлов, умеренными
геморрагическими проявлениями и появлением небольших геморрагии на
коже в виде «синяков».
Бессимптомное (скрытое) начало — наблюдается у 5% пациентов, общее
состояние больных не нарушается, самочувствие вполне удовлетворительное. у
некоторых больных целенаправленное исследование может выявить
незначительное увеличение печени и селезенки. Заболевание выявляется при
случайном исследовании периферической крови (при заполнении
санаторнокурортной карты, прохождении медицинского осмотра при
оформлении на работу и т.д.).
11.
Клиническая картинСтадия развернутой клинической картины
развивается
вследствие
интенсивной
пролиферации, накопления злокачественных
лейкозных
клеток
и
выраженных
внекостномозговых проявлений.
Больные жалуются на резко выраженную
прогрессирующую
слабость,
быструю
утомляемость, боли в костях и суставах, боли
в области печени и селезенки, повышение
температуры тела, головную боль.
12.
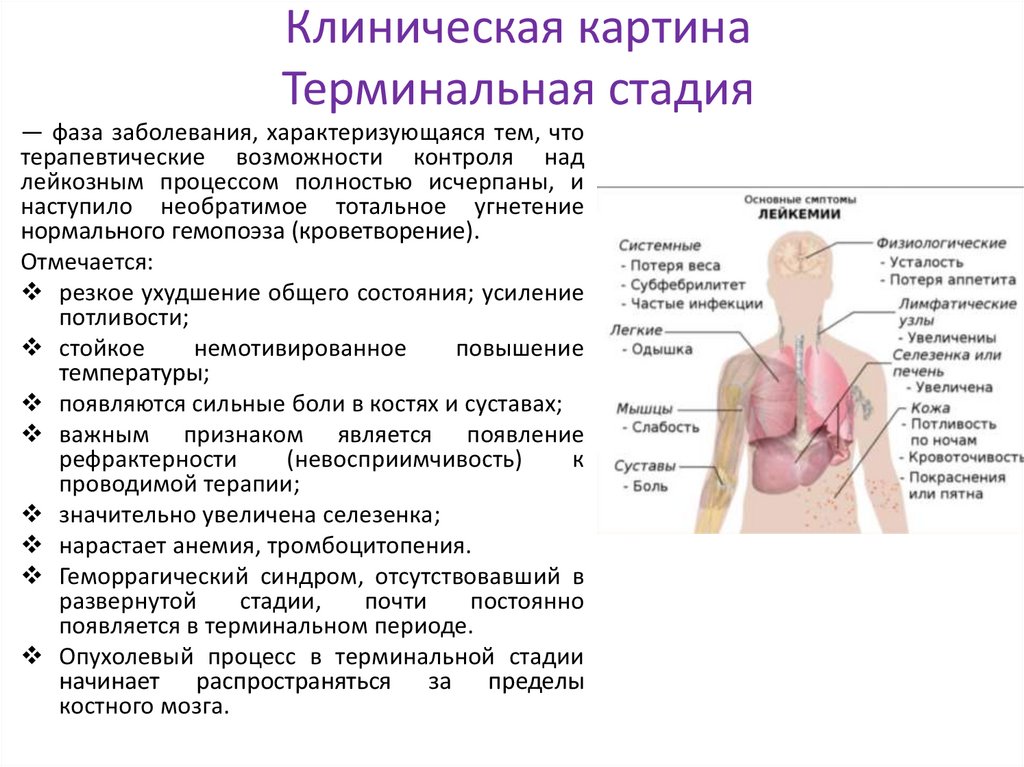
Клиническая картинаТерминальная стадия
— фаза заболевания, характеризующаяся тем, что
терапевтические возможности контроля над
лейкозным процессом полностью исчерпаны, и
наступило необратимое тотальное угнетение
нормального гемопоэза (кроветворение).
Отмечается:
резкое ухудшение общего состояния; усиление
потливости;
стойкое
немотивированное
повышение
температуры;
появляются сильные боли в костях и суставах;
важным признаком является появление
рефрактерности
(невосприимчивость)
к
проводимой терапии;
значительно увеличена селезенка;
нарастает анемия, тромбоцитопения.
Геморрагический синдром, отсутствовавший в
развернутой
стадии,
почти
постоянно
появляется в терминальном периоде.
Опухолевый процесс в терминальной стадии
начинает распространяться за пределы
костного мозга.
13.
Острый миелоидный лейкозОстрый миелоидный лейкоз – это клональное
опухолевое заболевание кроветворной ткани,
связанное
с
мутацией
в
клеткепредшественнице гемопоэза, следствием
которой становится блок дифференцировки и
бесконтрольная пролиферация незрелых
миелоидных клеток.
14.
1. ОМЛ с устойчиво выявляемыми генетическими аномалиями:ОМЛ с t(8;21)(q22;q22); RUNX1-RUNX1T1
ОМЛ с inv(16)(p13.1q22) or t(16;16)(p13.1;q22); CBFB-MYH11
ОПЛ с t(15;17)(q22;q12); PML-RARA
ОМЛ с t(9;11)(p22;q23); MLLT3-MLL
ОМЛ с t(6;9)(p23;q34); DEK-NUP214
ОМЛ с inv(3)(q21q26.2) or t(3;3)(q21;q26.2); RPN1-EVI1
ОМЛ (мегакариобластный) с t(1;22)(p13;q13); RBM15-MKL1 Предварительная подкатегория: ОМЛ с нормальным кариотипом
и мутированным геном NPM1 Предварительная подкатегория: ОМЛ с нормальным кариотипом и мутированным геном
2. ОМЛ с изменениями, связанными с миелодисплазией Миелоидные неоплазии, связанные с предшествующей ХТ
(исключенная категория)
3. ОМЛ, по-другому не специфицированные (NOS)
Острый миелобластный лейкоз с минимальной дифференцировкой
Острый миелобластный лейкоз без созревания
Острый миелобластный лейкоз с созреванием
Острый миеломонобластный лейкоз
Острый монобластный/моноцитарный лейкоз
Острый эритромиелоз
Острый мегакариобластный лейкоз
Острый лейкоз из базофилов
Острый панмиелоз с миелофиброзом (син.: острый миелофиброз; острый миелосклероз)
4. Миелоидная саркома (син.: экстрамедуллярная миелоидная опухоль; гранулоцитарная саркома; хлорома)
5. Миелоидные опухоли, связанные с синдромом Дауна
Транзиторный аномальный миелопоэз (син.: транзиторное МПЗ)
Миелоидный лейкоз, связанный с синдромом Дауна
6. Опухоль из плазмацитоидных дендритных клеток
7.Острые лейкозы неясной линии дифференцировки
Острый недифференцированный лейкоз
Острый лейкоз смешанного фенотипа с t(9;22)(q34;q11.2); BCRABL1
Острый лейкоз смешанного фенотипа с t(v;11q23); реарранжировка гена MLL
Острый лейкоз смешанного фенотипа, B/миелоидный, NOS
Острый лейкоз смешанного фенотипа, T/миелоидный, NOS
Предварительная подкатегория: лимфобластный лейкоз/лимфома из клеток натуральных киллеров?
Классификаци ВОЗ 2008
15.
• Причиной ОМЛ которого являются многоэтапныекооперирующие мутации (точечные, аномалии числа
копий, транслокации) в гемопоэтических клеткахпредшественниках, результатом которых является
прекращение
линейной
гематологической
дифференцировки и неконтролируемая пролиферация
злокачественных
аналогов
миелоидных
предшественников
• У небольшой части пациентов ОМЛ является результатом
эволюции
предлейкемических
врожденных
и
наследственных
синдромов
(транзиторный
миелопролиферативный синдром у 4 пациентов с
синдромом Дауна, анемия Фанкони, нейрофиброматоз
типа II, тяжелая врожденная нейтропения, врожденная
тромбоцитопения/тромбоцитопатия со склонностью к
развитию ОМЛ), приобретенной апластической анемии и
некоторых других синдромов.
16.
Диагностика1. Морфологическое исследование
Для установления диагноза ОМЛ в мазке периферической крови или костного
мозга необходимо наличие 20% или более бластных клеток. Следует
подчеркнуть, что пункцию костного мозга необходимо выполнять во всех
случаях, независимо от процентного содержания бластных клеток в
периферической крови.
2. Иммунофенотипирование.
подтверждение диагноза
установление варианта ОЛ
определение бифенотипических и билинейных вариантов ОЛ;
характеристика аберрантного иммунофенотипа в дебюте заболевания с
целью дальнейшего мониторинга минимальной остаточной популяции
клеток в период ремиссии ОЛ.
3. Цитогенетика
Стандартное цитогенетическое исследование является необходимым
компонентом диагностических процедур у пациента с подозрением на ОЛ.
Хромосомные аномалии детектируются в примерно у половины больных ОМЛ.
Семь транслокаций и инверсий (и их варианты) определяются ВОЗ в категорию
«ОМЛ с устойчиво выявляемыми хромосомными аномалиями». Более того,
обнаружение некоторых генетических аномалий является достаточным для
установления диагноза «ОМЛ с мультилинейной дисплазией» при наличии 20%
и более бластных клеток в костном мозге
17.
4. Молекулярная цитогенетика При неудавшемся цитогенетическомисследовании опциональным вариантом для детекции реаранжировок генов
является флюоресцентная in situ гибридизация (FISH), таких как RUNX1RUNX1T1, CBFB-MYH11, MLL и EVI1 или потеря хромосомы 5q и 7q. FISH зачастую
необходим для идентификации слияний MLL при транслокациях региона 11q23.
5. Молекулярная генетика При ведении больных ОМЛ взятие образцов
костного мозга и периферической крови с целью молекулярного исследования
является рутинной процедурой. В идеале необходимо провести выделение ДНК
и РНК и заморозить клетки, если клеток ограниченное количество, то
выделению РНК должно отдаваться предпочтение, так как РНК подходит для
молекулярного скрининга на предмет слияний генов и мутаций, связанных с
лейкозом.
6. Биобанкинг
И в рамках кооперированных исследований и взаимодействия, а также в
обычной клинической практике рекомендуется выделять и сохранять
первичную ДНК или РНК больных в биобанке, или направлять материал на
хранение в лаборатории Федеральных Центров. Первичный материал должен
17 включать замороженную выделенную ДНК или РНК, хранимую при
температуре -80°C и живые клетки, хранимые при температуре -196°C. Также
для хранения рекомендуется сохранять ДНК, цитогенетических осадков до
лечения и на разных его этапах (время достижения ПР, момент рецидива) для
определения МРБ. Сохранение первичного материала позволит в случае
необходимости оценить прогноз и четко определить терапевтическую тактику.
18.
Диагноз ОМЛ ставится на основании• обнаружения в пунктате костного мозга или в периферической
крови не менее 20% бластных клеток,
• либо не зависимо от процентного содержания бластных клеток
при наличии патогномоничных для ОМЛ хромосомных t(8;21)
(q22; q22) AML/ETO, t(15;17) (q12; q11-12) PML/RAR-α, inv(16) или
t(16;16) (p12; q23) CBF/MYH11, t(1;22).
• Диагноз de novo ОМЛ правомочен, если в анамнезе нет указаний
на
предшествующие
конституциональные
расстройства,
миелодиспластические и миелопролиферативные заболевания, а
также на экспозицию потенциально лейкемогенных факторов –
облучения и химиотерапии
• Нейролейкоз: более 5 клеток в 1 мкл цереброспинальной
жидкости при наичии любого количества бластов и/или
симптомы поражения черепно-мозговых нервов являются
диагностическими критериями инициального нейролейкоза
19.
ЛечениеПериод начального лечения, целью которого является максимально быстрое и
существенное сокращение опухолевой массы и достижение полной ремиссии,
называется периодом индукции ремиссии (обычно 1--2 курса). Именно в этот
период на фоне применения цитостатических средств количество лейкемических
клеток в костном мозге уменьшается примерно в 100 раз, т.е. в момент
констатации полной ремиссии в костном мозге морфологически определяется
менее 5% опухолевых клеток.
Вторым этапом терапии ОЛ является консолидация ремиссии (закрепление
достигнутого противоопухолевого эффекта). В настоящее время в большинстве
случаев консолидация является наиболее агрессивным и высокодозным этапом
при лечении ОЛ. Задачей этого периода является по возможности еще большее
уменьшение числа остающихся после индукции лейкемических клеток
После консолидации (обычно 1--2 курса) следует период противорецидивного
или поддерживающего лечения. При разных вариантах ОЛ длительность и
интенсивность поддерживающей терапии различны, но принцип ее одинаков для
всех видов ОЛ -- продолжение цитостатического воздействия в меньших дозах,
чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Принципиальным этапом при лечении некоторых вариантов ОЛ (лимфобластных,
промиелоцитарных, миеломоно- и монобластных) являются профилактика или при
необходимости лечение нейролейкемии. Этот этап распределяется на все
периоды программного лечения -- индукцию ремиссии, консолидацию и
поддерживающее лечение.
20.
Прогноз• Возраст является одним из универсальных, независимых и
устойчивых факторов прогноза. Долгосрочные результаты лечения
больных ОМЛ в возрасте старше 60 лет значительно хуже в
сравнении с таковыми у больных моложе 60 лет.
• Факторы, связанные с заболеванием и влияющие на результаты
терапии, следует анализировать на всех этапах лечения. Это
обусловлено тем, что лейкозассоциированные факторы прогноза
позволяют оценить объем опухолевой массы, чувствительность
бластных клеток к цитостатическим препаратам, скорость
элиминации лейкемических клеток и объем минимальной
остаточной (резидуальной) болезни (МРБ).
• Прежде всего, необходимо учитывать такие вполне доступные
клинико-гематологические
параметры,
ассоциированные
с
неблагоприятным течением ОМЛ как лейкоцитоз выше 100 х 109
/л, удлинение сроков от момента диагностики заболевания до
начала терапии, персистировании 20 бластных клеток в
периферической крови ко времени завершения индукционного
курса, недостижение полной ремиссии после первого
индукционного курса.
• Одним из важнейших факторов прогноза, сопряженных с ОМЛ,
является кариотип лейкемических клеток.
21.
Прогноз• Современная
химиотерапия
позволяет
достичь ремиссии у большинства больных
(при остром лимфобластном лейкозе — в 95%
случаев у детей и в 75—85% у взрослых, при
остром миелобластном лейкозе — в 85—90% у
детей и в 65-75% у взрослых).
• 5-летняя безрецидивная выживаемость при
остром лимфобластном лейкозе составляет
более 50% у детей и 30-35% у взрослых, при
остром миелобластном лейкозе — 40—50% у
детей и 10—25% у взрослых.
22.
Острый лимфолейкозОстрые лимфобластные лейкозы/лимфомы (ОЛЛ/лф)
представляют
собой
гетерогенную
группу
злокачественных клональных заболеваний системы
крови, происходящих из клеток-предшественниц
гемопоэза
преимущественно
лимфоидной
направленности
дифференцировки
и
характеризующиеся
чаще
всего
исходным
поражением
костного
мозга,
вытеснением
нормального
кроветворения
и
вовлечением
различных органов и систем организма (ЦНС, яички,
лимфатическая ткань любой локализации), а также
возможностью
исходного
поражения
органов
лимфатической ткани без вовлечения костного мозга
ОЛЛ может встречаться у лиц любого возраста, начиная с младенческого возраста и
заканчивая пожилым, однако максимальные значения заболеваемости приходятся на
детский возраст (60% больных ОЛЛ моложе 20 лет).
23.
Классификация ВОЗ 2008в этой ВОЗ классификации острые лимфобластные лейкозы
рассматриваются в разделе опухолей из предшественников Т- и Влимфоцитов:
1) лимфобластный лейкоз/лимфома из В-предшественников
(острый лимфобластный лейкоз из предшественников В-клеток –
синоним);
2) лимфобластный лейкоз/лимфома из Т-предшественников
(острый лимфобластный лейкоз из предшественников Т-клеток –
синоним).
Возможно равноценное использование описанных определений, и
авторы классификации лишь полагают, что при проценте бластных
клеток в костном мозге 25 и более целесообразно говорить об
остром лейкозе, а менее 25% - о лимфобластной лимфоме. Но чаще
всего эти терминологические сложности умозрительны, поскольку
терапия одинакова.
24.
При физикальном обследованиибледность кожных покровов
петехиальные высыпания, синяки, кровоточивость
десен,
повышение температуры тела,
лимфоаденопатия, в том числе увеличение небных
миндалин,
спленомегалия,
гепатомегалия,
увеличение размеров почек,
болезненность при поколачивании костей.
Вовлечение кожи при ОЛЛ бывает редко, и если
диагностируется, то ассоциируется с пре-В
иммунофенотипом.
25.
Диагностика1. выполнение общего анализа периферической крови
с подсчетом лейкоцитарной формулы и определением числа
тромбоцитов. При диагностике ОЛЛ у части больных показатели
крови могут быть нормальными. Число лейкоцитов может
варьировать от 0,5*109 /л до 700*109 /л; увеличение числа
лейкоцитов выше 10,0*109 /л отмечается у 60% больных, выше
100,0*109 /л – у 10%; тромбоцитопения
2. исследование аспирата костного мозга
Диагноз острого лейкоза устанавливают при обнаржуении в костном
мозге 20% и более бластных клеток.
Однако, диагноз ОЛЛ (В клеточного или Т-клеточного) устанавливают
при обнаружении 25% и более бластных клеток в костном мозге.
Если процент бластных клеток в костном мозге менее 25%, или
бластные клетки отсутствуют в костном мозге, но присутствуют в
иных очагах поражения (лимфатические узлы любой локализации,
тимус, кожа, и т.д.), то устаналвивают диагноз Т- или В-лимобластной
лимфомы.
26.
Диагностика3. морфоцитохимическое исследование костного мозга
При цитохимическом исследовании лимфоидные бласты
часто содержат PASположительные гранулы, они
негативны в реакции на миелопероксидазу и другим
миелоидным цитохимическим реакциям. Нередко при
выполнении цитохимического исследования бластные
клетки определяют, как недифференцируемые, поэтому
ключевым методом диагностики ОЛЛ является
иммунофентипирование.
4. иммунофенотипическое исследование бластных
клеток аспирата костного мозга Его используют для
более четкого определения принадлежности бластных
клеток
к
той
или
иной
линии
клеточной
дифференцировки
после
установления
морфологического диагноза ОЛЛ.
27.
Диагностика5. цитогенетическое исследование аспирата костного мозга. Стандартное
цитогенетическое исследование является необходимым компонентом диагностических
процедур у пациента с подозрением на ОЛ. Для определения кариотипа достоверным
считается только исследование как минимум 20 метафаз.
Стандартное цитогенетическое исследование является единственным методом,
позволяющим анализировать весь хромосомный набор клетки целиком. Однако его
выполнение требует достаточно длительного времен, а также в ряде случаев
констатируется отсутствие делящихся клеток (митозов). В этих случаях целесообразно
выполнять FISH исследование на ключевые перестройки t(9;22) (q34;q11) - BCR-ABL и
t(4;11) – MLL-AF4 при В-ОЛЛ
6. молекулярное исследование аспирата костного мозга на наличие химерных генов
BCR-ABL, c-MYC-IgH, MLL-AF4 и других, в зависимости от выявленных цитогенетических
поломок с целью дальнейшего мониторирования эффективности химиотерапии и
оценки МРБ в рамках клинических исследований.
7. молекулярное исследование аспирата костного мозга на Т- или В-клеточную
клональность. С молекулярной точки зрения все случаи ОЛЛ развиваются из клетокпредшественников B- или T-лимфоцитов, поэтому все они демонстрируют клональные
перестройки генов тяжелых цепей Ig и/или генов TCR. Этот феномен позволяет
определять пациент специфичекие перестройки и использовать их в 18 качестве
молекулярного маркера заболевания при мониторинге МРБ
28.
Диагностика8. люмбальная пункция с исследованием ликвора.
При ряде вариантов ОЛЛ высока вероятность
вовлечения оболочек головного мозга.
9. Биобанкинг Выделять и сохранять первичную
ДНК и/или РНК из клеток костного мозга больных в
биобанке, или направлять материал на хранение в
лаборатории Федеральных Центров. Сохранение
первичного биологического материала (ДНК, РНК
выделенная из клеток костного мозга, или
замороженные клетки) для выполнения в будущем
молекулярных исследований, позволяющих четко
определить группы риска
10. Общеклинические анализы крови для
выявления осложений
29.
Диагностика• выполнить
биопсию
очага
поражения
(кожы,
лимфатического узла, образования средостения) у
больных без поражения костного мозга с целью точной
верификации диагноза. Не рекомендуется выполнять
пункционную биопсию очага поражения
• выполнение компьютерной томографии (КТ) головного
мозга, ОБП, ОГК, органов средостения
• Другие методы общеклинического обследования
• выполнение определения статуса больного (по шкалам
ECOG/WHO), оценки коморбидности.
• выполнение женщинам репродуктивного возраста теста
на беременность.
• выполнение HLA-типирования больного и сиблингов с
целью поиска потенциального донора костного мозга.
• консультация невропатолога, окулиста, отоларинголога,
гинеколога (для женщин).
30.
ПрогнозПоследние десять лет ключевым фактором
прогноза для всех ОЛЛ стал показатель,
оценивающий
минимальную
резидуальную
популяцию опухолевых клеток (МРБ): при ее
обнаружении с чувствительностью метода 10-4 в
течение 6 месяцев лечения прогноз определяется
как негативный.
Совершенно очевидно, что выделение тех или
иных факторов прогноза напрямую связано с
выбором
терапевтической
тактики
и
необходимостью использовать в период первой
полной ремиссии трансплантацию аллогенного
костного мозга (аллогенную ТГСК).
31.
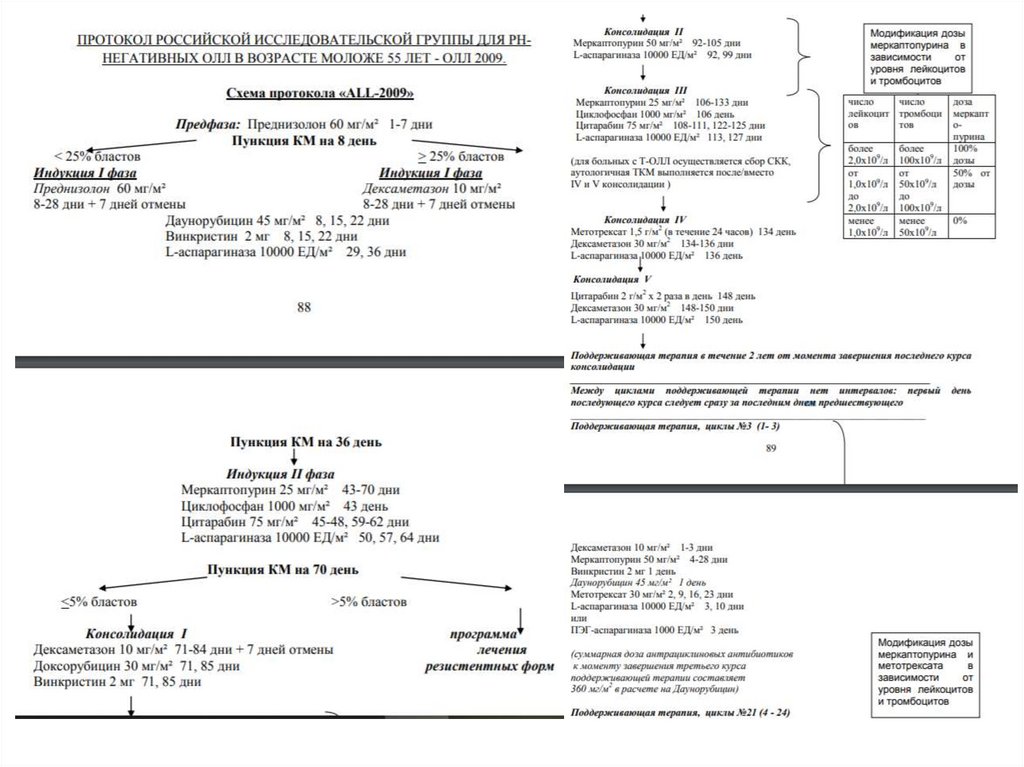
ЛечениеПериод начального лечения, целью которого является максимально быстрое и
существенное сокращение опухолевой массы и достижение полной ремиссии,
называется периодом индукции ремиссии (обычно 1--2 курса). Именно в этот
период на фоне применения цитостатических средств количество лейкемических
клеток в костном мозге уменьшается примерно в 100 раз, т.е. в момент
констатации полной ремиссии в костном мозге морфологически определяется
менее 5% опухолевых клеток.
Вторым этапом терапии ОЛ является консолидация ремиссии (закрепление
достигнутого противоопухолевого эффекта). В настоящее время в большинстве
случаев консолидация является наиболее агрессивным и высокодозным этапом
при лечении ОЛ. Задачей этого периода является по возможности еще большее
уменьшение числа остающихся после индукции лейкемических клеток
После консолидации (обычно 1--2 курса) следует период противорецидивного
или поддерживающего лечения. При разных вариантах ОЛ длительность и
интенсивность поддерживающей терапии различны, но принцип ее одинаков для
всех видов ОЛ -- продолжение цитостатического воздействия в меньших дозах,
чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Принципиальным этапом при лечении некоторых вариантов ОЛ (лимфобластных,
промиелоцитарных, миеломоно- и монобластных) являются профилактика или при
необходимости лечение нейролейкемии. Этот этап распределяется на все
периоды программного лечения -- индукцию ремиссии, консолидацию и
поддерживающее лечение.




























 Медицина
Медицина