Похожие презентации:
Свойства атомов. Типы связей
1.
Свойстваатомов
2.
1.Ряд чисел 2,8,5 соответствуетраспределению электронов в
атоме элемента:
1)азота
2)фтора
3)фосфора
4)хлора
3.
2. Ряд чисел, соответствующийраспределению электронов по
уровням в атоме хлора:
1) 2,8,5
2) 7,8,2
3) 2,8,7
4)2,8,18,7
4.
3. Сокращённая электронная2
5
формула 2S 2P соответствует
атомам :
1)фтора
2)хлора
3)азота
4)фосфора
5.
23
2S 2Р
4.
.Укажите знак
химического элемента.
1) Р
2) N
3) As
4) В
6.
5. Химический элементэлектронная формула
2
2
6
2
4
которого 1S 2S 2P 3S 3P
1)C
2)О
3)Si
4)S
7.
6. Количество валентныхэлектронов у атома элемента с
порядковым номером 16:
1)16
2)6
3)8
4)2
8.
7. Заряд ядра атомакальция:
1)+2
2)+20
3)+40
4)+4
9.
8. Количество нейтронов ватоме железа-56:
1)30
2)26
3)56
4)55
10.
9. Количествоэнергетических уровней в
атоме элемента хлор:
1)35
2)17
3)7
4)3
11.
10. У элементов азот ифосфор одинаковое
количество:
1)электронов
2)валентных электронов
3)протонов
4)энергетических
уровней
12.
11. У элементов алюминийи фосфор одинаковое
количество:
1)электронов
2)валентных электронов
3)протонов
4)энергетических
уровней
13.
14.
Свойстваатомов
15.
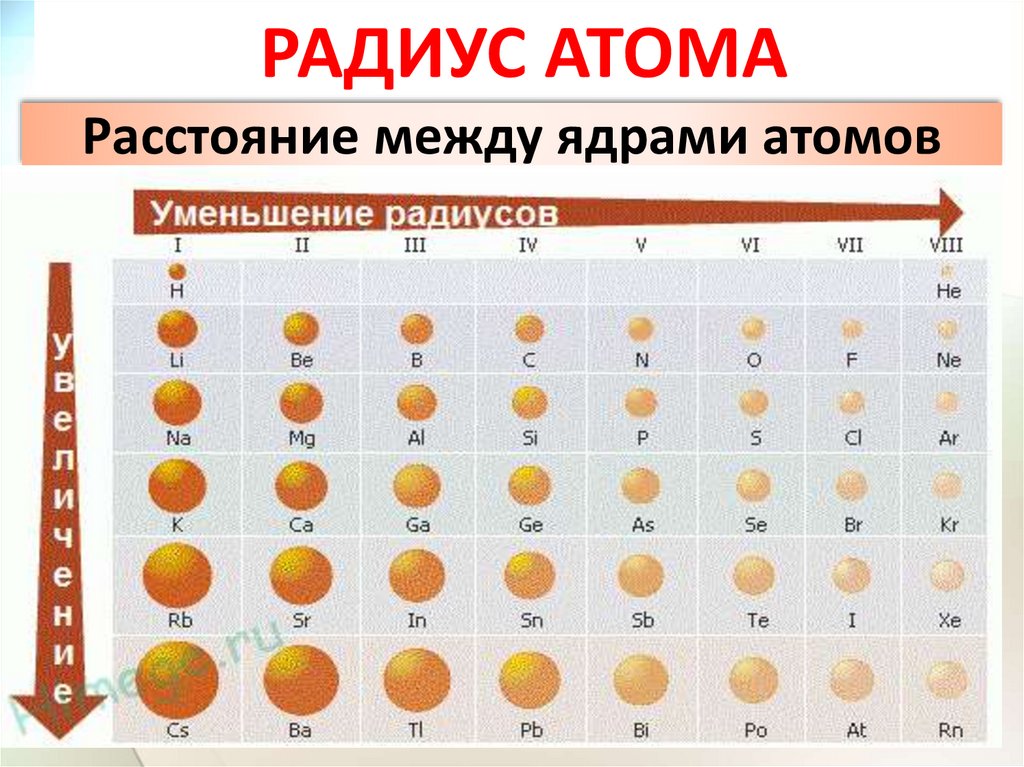
РАДИУС АТОМАРасстояние между ядрами атомов
16.
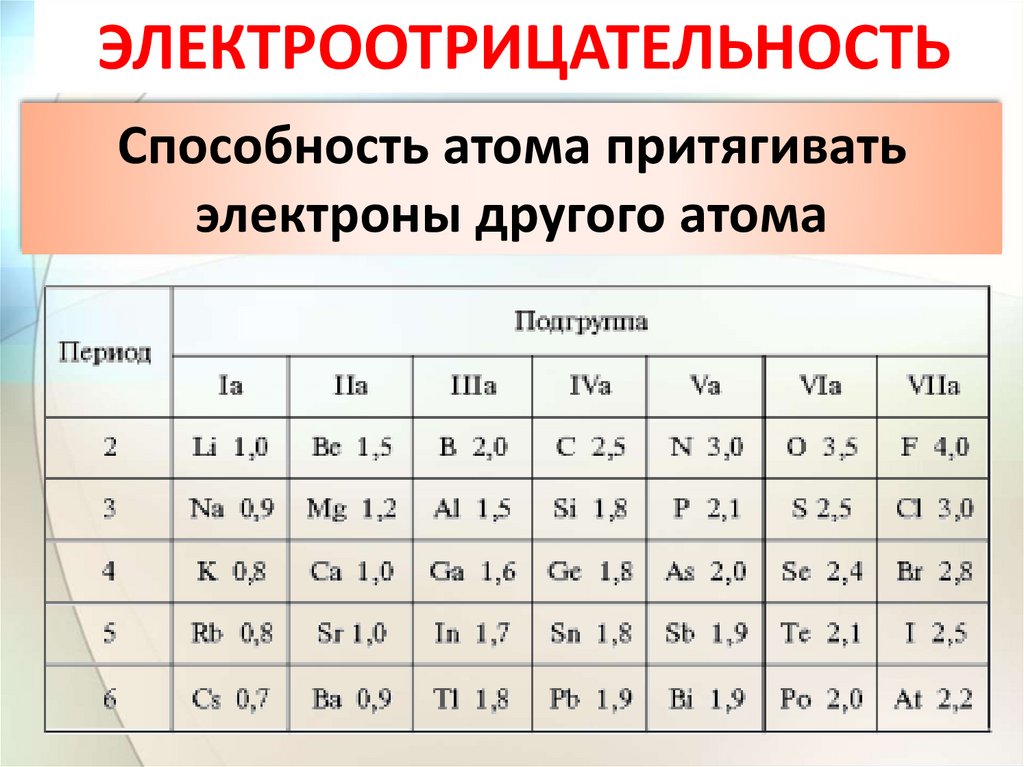
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬСпособность атома притягивать
электроны другого атома
17.
Металлические свойстваСпособность атома отдавать
электроны
18.
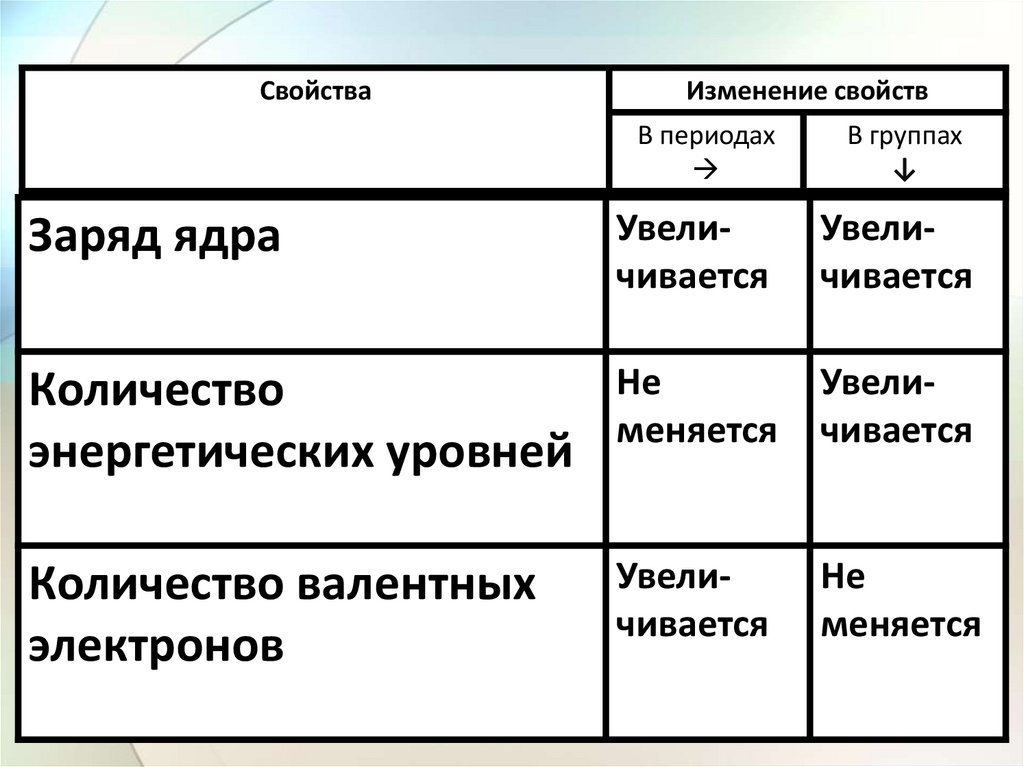
СвойстваИзменение свойств
В периодах
В группах
↓
Заряд ядра
Увеличивается
Увеличивается
Количество
энергетических уровней
Не
меняется
Увеличивается
Количество валентных
электронов
Увеличивается
Не
меняется
19.
20.
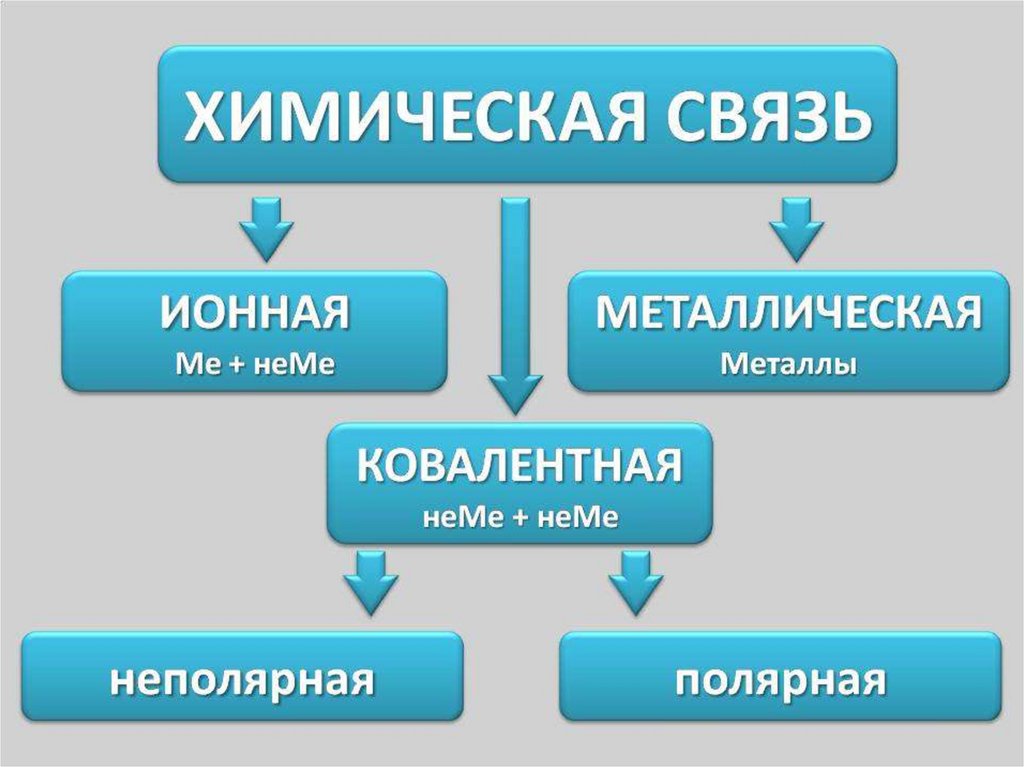
Связь атомов21.
22.
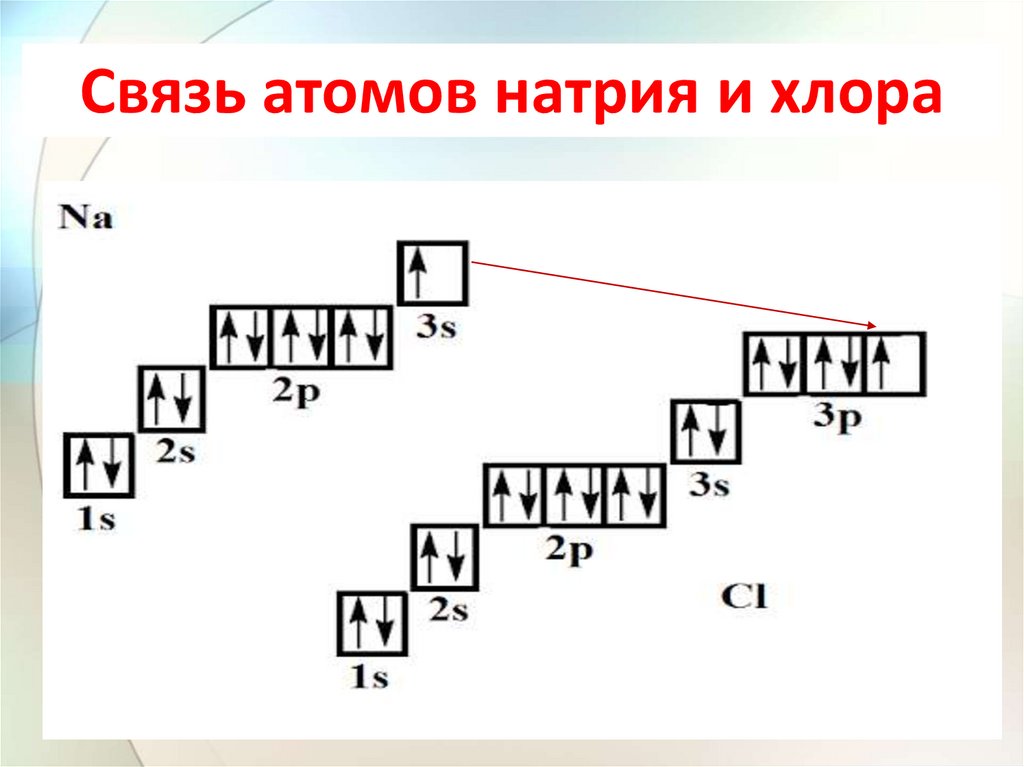
Связь атомов натрия и хлора23.
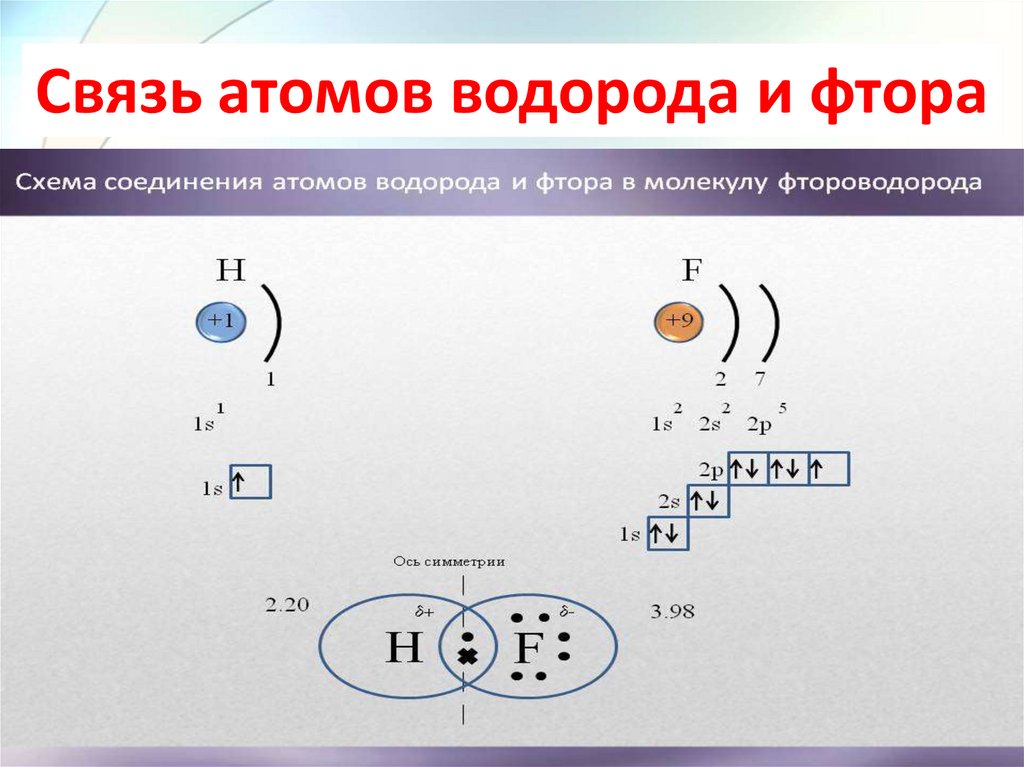
Связь атомов водорода и фтора24.
Связь атомов хлора и хлора25.
26.
27.
28.
29.
Ковалентной неполярной связью(КНПС) называется связь, которая
возникает между одинаковыми
элементами-неметаллами, т.е.
элементами с одинаковыми эо.
При этом образуется общая
электронная пара, которая
располагается посередине между
атомами неметаллов, т.е. в равной
степени принадлежат обоим атомам.
30.
Ковалентной полярной связью(КПС) называется связь, которая
возникает
между
разными
элементами-неметаллами,
т.е.
элементами с отличающимися ЭО.
При этом образуется общая
электронная
пара,
которая
смещается к атому с большей ЭО.
Атомы приобретают частичные
заряды: δ+ или δ- (дельта плюс,
дельта минус).
31.
32.
33.
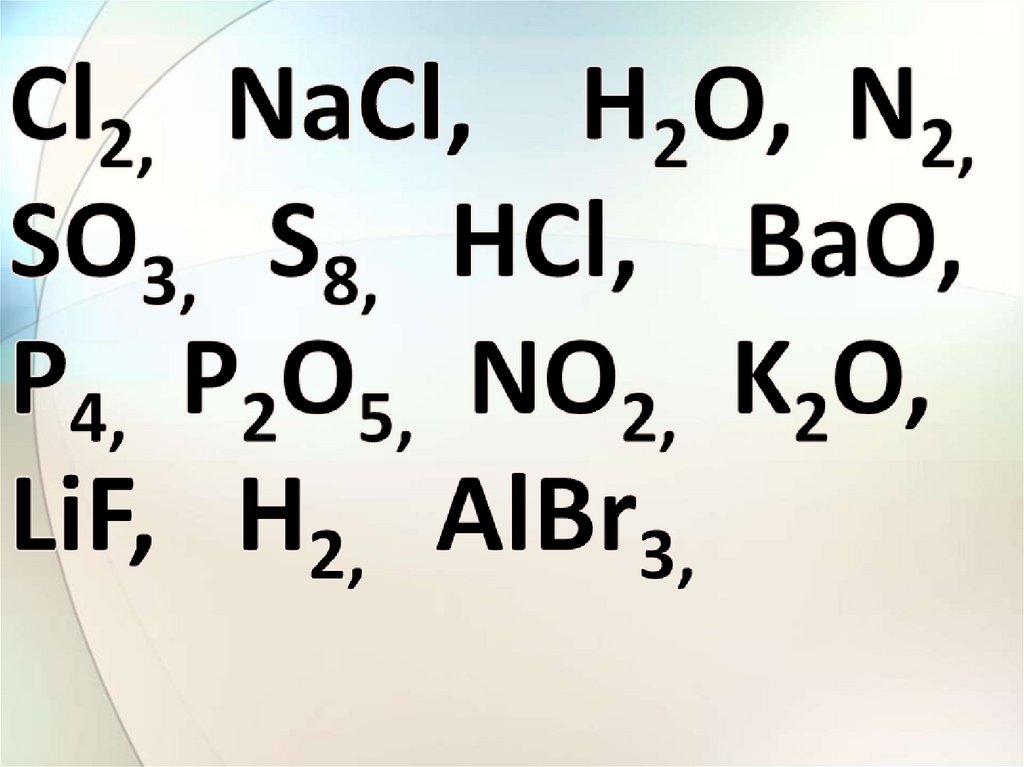
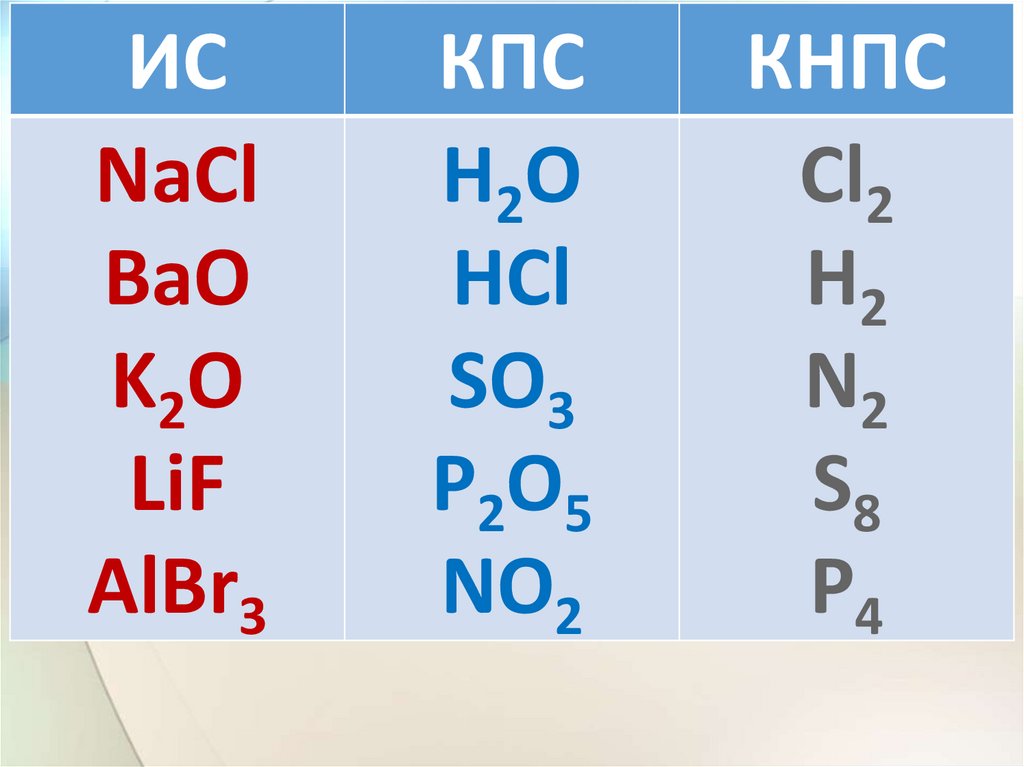
ИСNaCl
BaO
K2O
LiF
AlBr3
КПС
H2O
HCl
SO3
P2O5
NO2
КНПС
Cl2
H2
N2
S8
P4

























 Химия
Химия








