Похожие презентации:
Стронций
1.
Стронций. Общие сведения обэлементе. История открытия и
область применения.
Стро́нций — элемент главной
подгруппы второй группы, пятого
периода периодической системы
химических элементов Д. И.
Менделеева, с атомным номером 38.
Обозначается символом Sr (лат.
Strontium).
Простое
вещество
стронций — мягкий, ковкий и
пластичный
щёлочноземельный
металл серебристо-белого цвета.
2.
Новый элемент обнаружили в минералестронцианите, найденном в 1764 году в
свинцовом руднике близ шотландской деревни
Строншиан, давшей впоследствии название
новому элементу. Присутствие в этом
минерале оксида нового металла было
установлено
в
1787
году
Уильямом
Крюйкшенком
и
Адером
Кроуфордом.
Выделен в чистом виде сэром Хемфри Дэви в
1808 году.
3.
Стронций. Основные сведения обэлементе. Основные физические
характеристики.
Относительная электроотрицательность : 1.0
Температура плавления:
768°C
Атомная масса: 81,62 а.е.м.
Электродный потенциал: -2,89
Теплопроводность: 0,737
Плотность: 2,6 г/см3
Цвет в твёрдом состоянии: Серебристо-белый
Тип: Щелочно-земельный металл
Орбитали: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2
1ый потенциал ионизации: 5,569 В
Ковалентный радиус: 1,91 Å
4.
Прикомнатной
температуре
решетка
Стронция
кубическая
гранецентрированная (α-Sr) с периодом а = 6,0848Å; при температуре выше
248 °С превращается в гексагональную модификацию (β-Sr) с периодами
решетки а = 4,32Å и с = 7,06 Å; при 614 °C переходит в кубическую
объемноцентрированную модификацию (γ-Sr) с периодом а = 4,85Å. Атомный
радиус 2,15Å, ионный радиус Sr2+ 1,20Å. Плотность α-формы 2,63 г/см3 (20
°C); tпл 770 °С, tкип 1383 °C; удельная теплоемкость 737,4 кдж/(кг·К) [0,176
кал/(г·°С)]; удельное электросопротивление 22,76·10-6 ом·см-1. Стронций
парамагнитен, атомная магнитная восприимчивость при комнатной
температуре 91,2·10-6. Стронций - мягкий пластичный металл, легко режется
ножом. Изотоп - стронций 90
5.
Стронций. Основные сведенияоб элементе. Химические
свойства.
Стронций в своих соединениях всегда проявляет валентность
+2. По свойствам стронций близок к кальцию и барию, занимая
промежуточное положение между ними.
В электрохимическом ряду напряжений стронций
находится среди наиболее активных металлов (его нормальный
электродный потенциал равен −2,89 В). Энергично реагирует с
водой, образуя гидроксид:
Sr+2H2O
Sr(OH)2+H2
Взаимодействует с кислотами, вытесняет тяжёлые
металлы из их солей. С концентрированными кислотами
(H2SO4, HNO3) реагирует слабо.
6.
Металлический стронций быстро окисляется на воздухе, образуяжелтоватую плёнку, в которой помимо оксида SrO всегда присутствуют
пероксид SrO2 и нитрид Sr3N2. При нагревании на воздухе загорается,
порошкообразный стронций на воздухе склонен к самовоспламенению.
Энергично реагирует с неметаллами — серой, фосфором, галогенами.
Взаимодействует с водородом (выше 200оС), азотом (выше 400оС).
Практически не реагирует с щелочами.
7.
Распространённость стронция вприроде.
Среднее содержание Стронция в земной коре (кларк) 3,4·10-2% по массе, в
геохимических процессах он является спутником кальция. Известно около 30
минералов Стронция; важнейшие - целестин SrSO4 и стронцианит SrCO3. В
магматических породах Стронций находится преимущественно в рассеянном
виде и входит в виде изоморфной примеси в кристаллическую решетку
кальциевых, калиевых и бариевых минералов. В биосфере Стронций
накапливается в карбонатных породах и особенно в осадках соленых озер и
лагун (месторождения целестина).
8. Основные минералы носители
SrAl3(AsO4)SO4(OH)6 — кеммлицит;Sr2Al(CO3)F5 — стенонит;
SrAl2(CO3)2(OH)4•Н2О — стронциодрессерит;
SrAl3(PO4)2(OH)5•Н2О — гойясит;
Sr2Al(PO4)2OH — гудкенит;
SrAl3(PO4)SO4(OH)6 — сванбергит;
Sr(AlSiO4)2 — слосонит;
Sr(AlSi3O8)2•5Н2О — брюстерит;
Sr5(AsO4)3F — ферморит;
Sr2(B14O23)•8Н2О — стронциоджинорит;
Sr2(B5O9)Cl•Н2О — стронциохильгардит;
SrFe3(PO4)2(OH)5•Н2О — люсуньит;
SrMn2(VO4)2•4Н2О — сантафеит;
Sr5(PO4)3OH — беловит;
SrV(Si2O7) — харадаит.
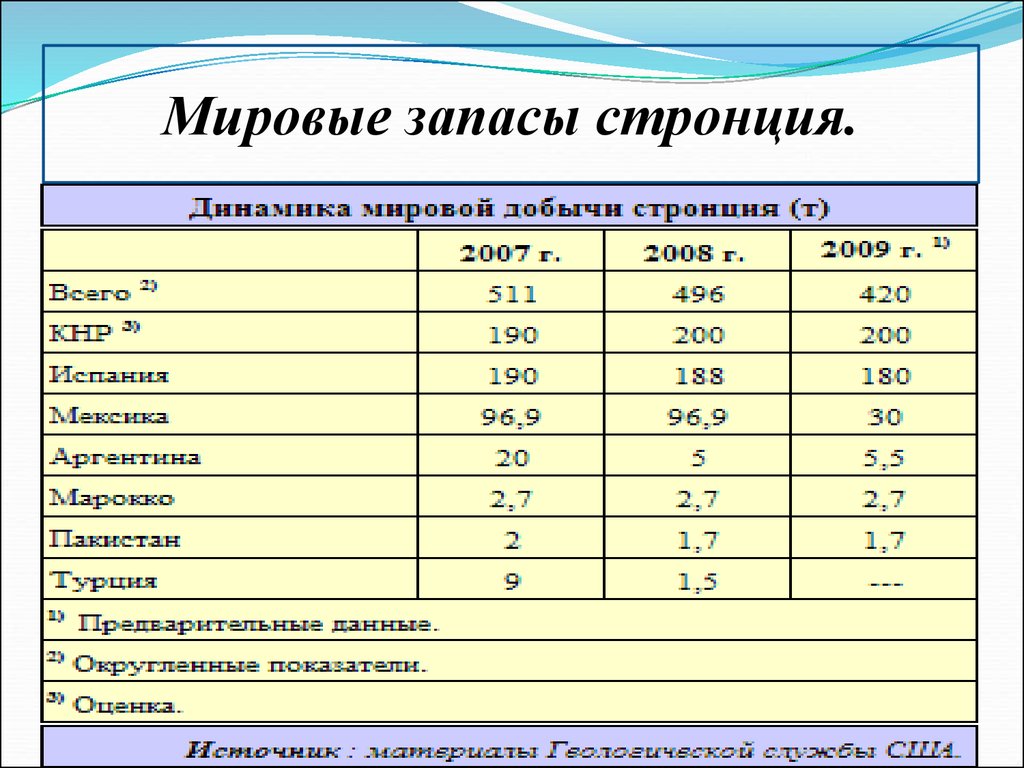
9.
Мировые запасы стронция.10.
Основные месторождения по добычистронция.
Известны месторождения стронция в
Калифорнии, Аризоне (США); России(Пермский
край), Китай и других странах
11. Области применения
МеталлургияМеталлотермия
Магнитные материалы
Пиротехника
Атомноводородная энергетика
Медицина










 Химия
Химия