Похожие презентации:
Металлы II А подгруппы
1.
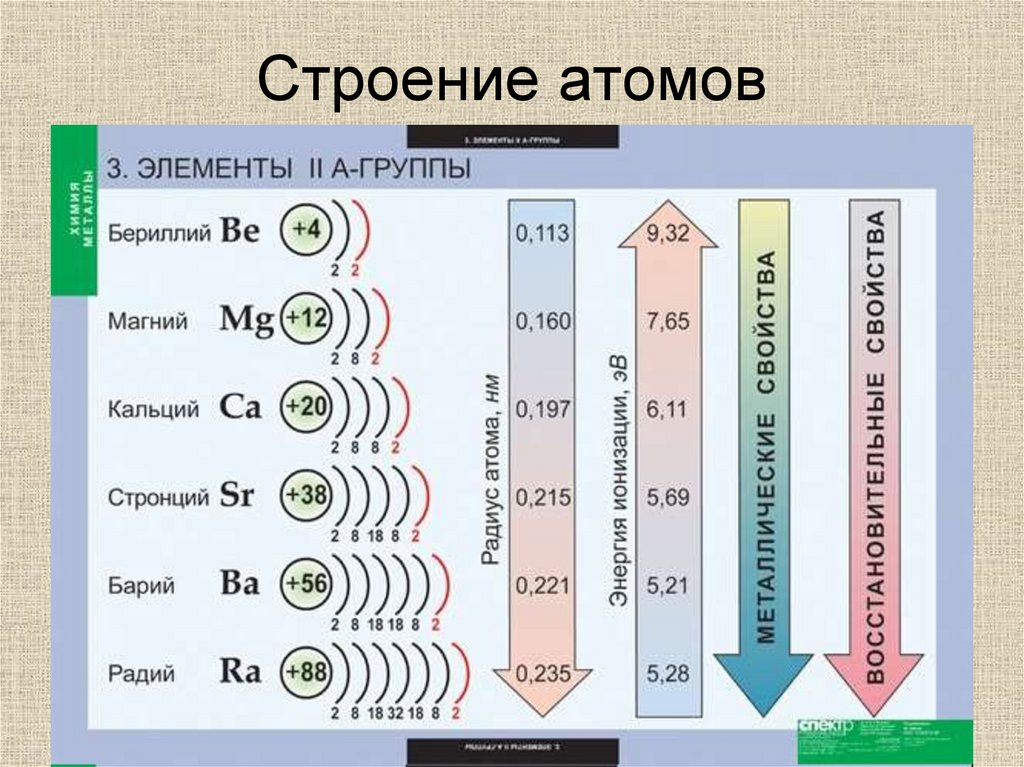
Металлы II А погруппы2. Строение атомов
Бериллий4
Be
9,012
2s2
Магний
12
Строение атомов
• Общая электронная формула ns2
Mg
24,305
3s2
Кальций
20
Ca
• Валентность II
40,078
4s2
Стронци
й
3
8
• Степень окисления +2
Sr
87,62
5s
2
Барий
56
Ba
• Восстановительные свойства
137,327
6s2
Радий
88
Ra
(226)
7s
2
• Менее реакционно-способны, чем
щелочные металлы
3. Строение атомов
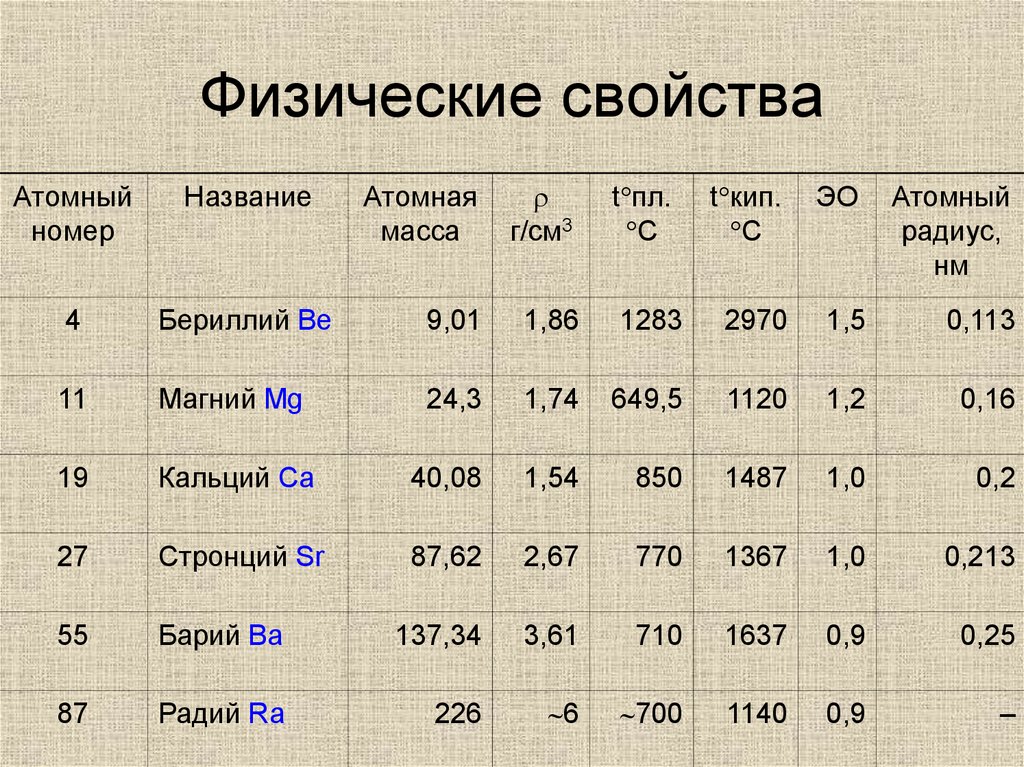
4. Физические свойства
Атомнаямасса
r
г/см3
Бериллий Be
9,01
1,86
11
Магний Mg
24,3
19
Кальций Ca
27
Стронций Sr
55
87
Атомный
номер
Название
t кип.
C
ЭО
Атомный
радиус,
нм
4
1283
2970
1,5
0,113
1,74
649,5
1120
1,2
0,16
40,08
1,54
850
1487
1,0
0,2
87,62
2,67
770
1367
1,0
0,213
Барий Ba
137,34
3,61
710
1637
0,9
0,25
Радий Ra
226
~6
~700
1140
0,9
–
t пл.
C
5. Физические свойства
• серебристо-белые блестящие металлы,твердость значительно выше, чем у
щелочных металлов.
6. Be
• 3BeO • Al2O3 • 6SiO2 –• берилл
7. Mg
MgCO3 – магнезит
CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3H2O – каинит
KCl • MgCl2 • 6H2O – карналлит
8. Ca
CaCO3 – кальцит
(известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат
(флюорит)
9. Sr, Ba и Ra
SrSO4 – целестин
SrCO3 – стронцианит
BaSO4 – барит
BaCO3 – витерит
• во всём мире удалось
добыть всего 1,5 кг
чистого радия
10. Химические свойства
1. Все металлы образуют оксиды RO, барийпероксид – BaO22Me +O2 → 2MeO
2. Бериллий и магний сравнительно медленно
реагируют с неметаллами
Me +H2 → MeH2
Me +Cl2 → MeCl2
Me +S → MeS
11. Химические свойства
3. Растворяются в кислотах:Me +2HCl → MeCl2 + H2
Бериллий растворяется в водных растворах
щелочей
4. В обычных условиях поверхность Be и Mg
покрыта инертной оксидной пленкой,
поэтому они устойчивы по отношению к
воде.
Ca, Sr и Ba растворяются в воде с
образованием гидроксидов Me +2HOH →
Me(OH)2 +Н2
12.
• Качественная реакция на катионыщелочноземельных металлов –
окрашивание пламени в следующие
цвета:
• Ca2+ - темно-оранжевый
• Sr2+- темно-красный
• Ba2+ - светло-зеленый
13.
14. Проверка знаний
Сравните атомы элементов, поставив знаки<, > или = вместо *:
а) заряд ядра: Mg * Ca, Na *Mg, Ca * К;
б) число электронных слоев: Mg * Ca, Na * Mg,
Ca * К;
в) число электронов на внешнем уровне: Mg * Ca,
Na *Mg, Ca * К;
г) радиус атома: Mg * Ca, Na * Mg, Ca * K;
д) восстановительные свойства: Mg * Ca,
Na * Mg, Ca * K.
15.
Допишите уравнения реакций:а) Са + H2O→ ……………………….
б) Mg + НСl→……………………….
в) Ва + О2→………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН)2 → МеSО4
16. Домашнее задание:
§ 12. упр. № 5, 8Применение соединений
щелочноземельных металлов













 Химия
Химия








