Похожие презентации:
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
1.
Определение воды по Фишеру.Кислотное число, число омыления.
Определение аминного азота методами
формольного и йодометрического
титрования.
Ассистент кафедры
Фармацевтической и
токсикологической химии им.
А.П.Арзамасцева
Антонов Сергей Александрович
2.
Зачем необходимо определятьвлагу в лекарственных средствах
В фармацевтическом анализе определение летучих веществ и
воды имеет большое значение.
Содержание влаги в лекарственных веществах точно нормируется
ГФ, поскольку нарушение этого показателя может привести к
изменениям качества препаратов: разложению активных
молекул, потере фармакологической активности или появлению
токсических эффектов.
В таких препаратах, как эфир для наркоза, следы влаги не
допускаются вовсе.
3.
Промышленное значениеопределения влаги
Кроме фармацевтических лабораторий определение влаги
широко применяется в сельском хозяйстве для определения
влажности пшеничного зерна (ГОСТ 13586.5-93), в целлюлознобумажной промышленности для определения влажности бумаги
и картона (ГОСТ 13525.19-91), в пищевой промышленности для
определения влаги в пищевых концентратах (ГОСТ 15113.4-77), в
топливной промышленности для определения влаги в воздушносухом топливе (угли, горючие сланцы, ГОСТ 27314-91) и т.д.
Определение воды методом К. Фишера проводят в сырой нефти
(ГОСТ Р 54284-2010), в жареном молотом кофе (ГОСТ Р 527952007), некоторых промышленных реактивах.
4.
Метод титрования реактивомК. Фишера
– классический метод титрования в
аналитической химии - получил наиболее
широкое распространение в
фармацевтическом анализе, в практическом
отношении является наиболее удобным для
субстанций и дозированных препаратов.
Метод основан на взаимодействии реактива
Фишера и воды.
5.
Метод титрования реактивомК. Фишера
Плюсы метода:
1.
Высокая точность определения при малых навесках
субстанций, в отличие от потери в массе при высушивании
2. Селективен по воде и позволяет определить как
гигроскопическую, так и связанную воду
3. Легкая пробоподготовка, малое время анализа
4. Можно анализировать твердые вещества, жидкости и газы
5.
Пригоден для автоматизации.
6.
Метод титрования реактивомК. Фишера
Ограничения метода:
Неприменим для анализа соединений, реагирующих с
одним или несколькими компонентами реактива
Фишера, например, аскорбиновой кислоты,
меркаптанов, сульфидов, гидрокарбонатов и
карбонатов щелочных металлов и др.
Разновидности метода:
Кулонометрическое и объемное титрование (для обоих
разработаны автоматические титраторы).
7.
Метод титрования реактивомК. Фишера
Реактив К. Фишера:
Представляет собой раствор двуокиси серы, йода и пиридина в
метиловом спирте.
Получают его растворением сублимированного I2 в смеси
безводного пиридина и абсолютного метанола, р-р охлаждают
льдом и добавляют жидкий или газообразный SO2 (соотношение
SO2:I2= 1:1,3)
Предложен К. Фишером в 1935 году.
Реактивы и растворы, применяемые в данном методе, очень
гигроскопичны, поэтому должны быть приняты меры
предохранения их от атмосферной влаги.
8.
Метод титрования реактивомК. Фишера
Взаимодействие реактива К. Фишера с водой:
Основано на окислении диоксида серы йодом в
присутствии воды. Продукты реакции (H2SO4 и HI)
связываются пиридином.
Протекает в две стадии стехиометрически по
уравнениям:
I2 + SO2 + H2O + 3C5H5N → 2C5H5N∙HI + C5H5NSO3
C5H5NSO3 + CH3OH → C5H5N∙HSO4CH3
9.
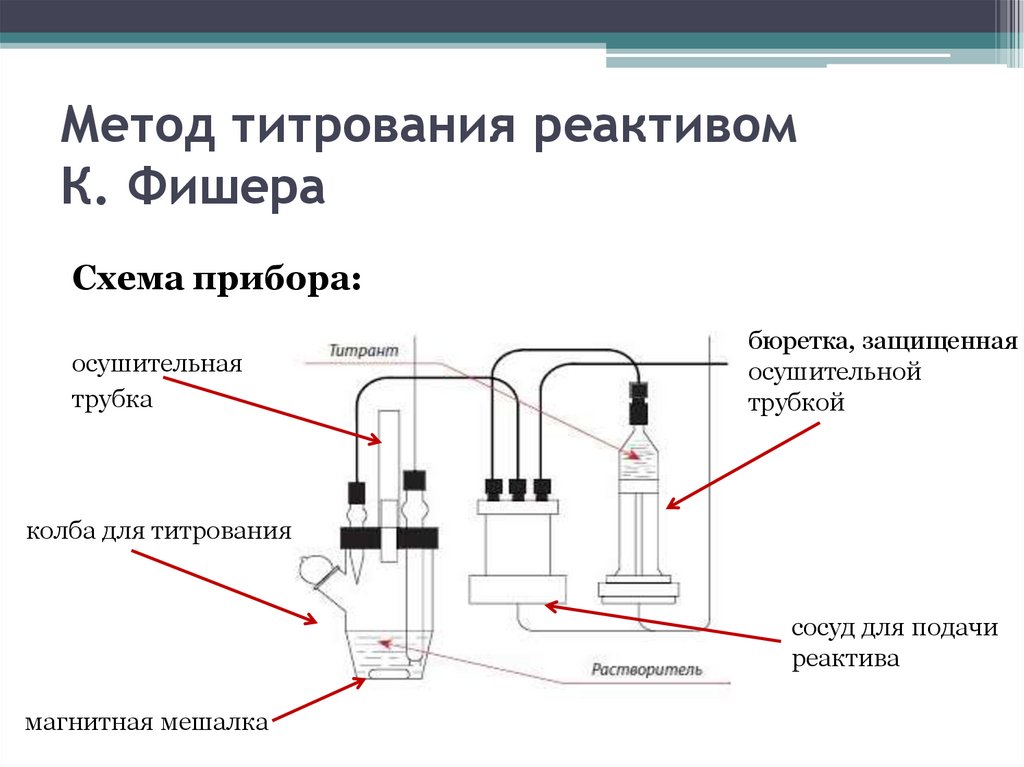
Метод титрования реактивомК. Фишера
Схема прибора:
осушительная
трубка
бюретка, защищенная
осушительной
трубкой
колба для титрования
сосуд для подачи
реактива
магнитная мешалка
10.
Метод титрования реактивомК. Фишера
Фото приборов:
11.
Метод титрования реактивомК. Фишера
Методика определения:
Точную навеску препарата, содержащую
приблизительно от 0,03 до 0,05 г воды, помещают в
сухую колбу вместимостью 100 мл, в которую
предварительно внесено 5 мл метилового спирта.
Перемешивают 1 мин и титруют реактивом К. Фишера,
прибавляя его при приближении к конечной точке по
0,1 - 0,05 мл.
12.
Метод титрования реактивомК. Фишера
Методика определения:
Конец титрования может быть определен как визуально по
изменению окраски от желтой до красновато-коричневой,
так и электрометрическим титрованием «до полного
прекращения тока» (см. «Электрометрические методы
титрования»).
Изменение тока в конечной точке титрования при этом
выражено настолько четко, что для ее определения
построение графиков не обязательно.
Параллельно титруют 5 мл метилового спирта
(контрольный опыт).
13.
Метод титрования реактивомК. Фишера
Расчеты:
Содержание воды в процентах (X) вычисляют по
формуле:
а − б × Т × 100,





























 Химия
Химия








