Похожие презентации:
Реакции замещения
1. Реакции замещения
2. Генри Кавендиш
• Основные труды Кавендиша относятся кхимии газов и различным разделам
экспериментальной физики. В 1766 г.
Кавендиш опубликовал первую важную
работу по химии – «Искусственный
воздух», где сообщалось
об открытии «горючего воздуха»
(водорода). Он разработал методику
собирания, очистки и изучения газов, с
помощью которой в 1766 г. ему удалось
получить в чистом виде водород и
углекислый газ, установить их удельный
вес и другие свойства.
3.
4.
5. Реакции замещения
- реакции между простыми исложными веществами, при
протекании которых атомы простого
вещества замещают атомы одного из
элементов в молекуле сложного
вещества
А + ВС = В + АС
6.
7.
8. Электрохимический ряд напряжений металлов
-последовательность, в которой металлырасположены в порядке увеличения их стандартных
электрохимических потенциалов φ0,отвечающих
полуреакции восстановления катиона металла Men:
Men+ + nē → Me
9. Электрохимический ряд напряжений металлов
10. Правила ряда напряжения:
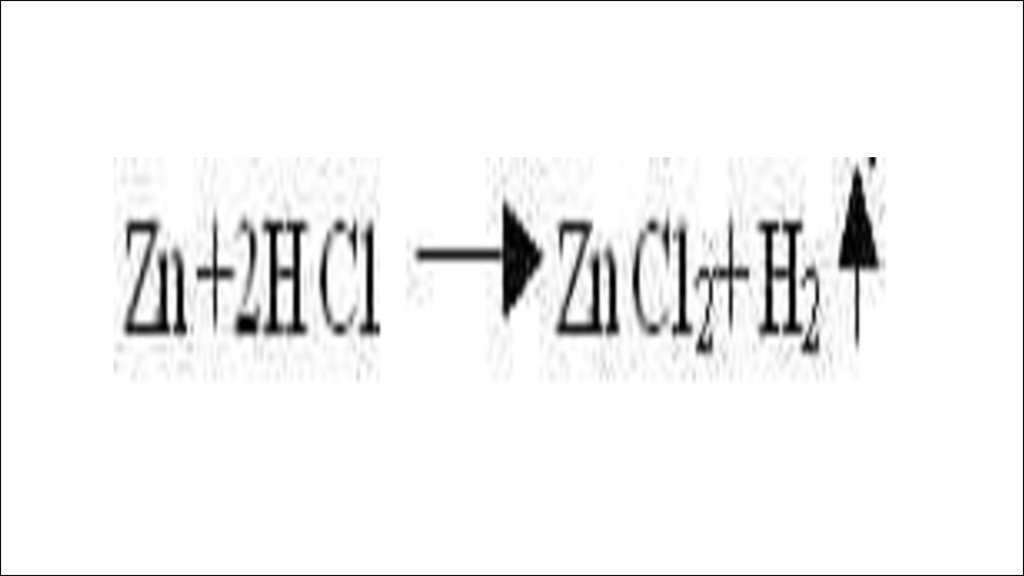
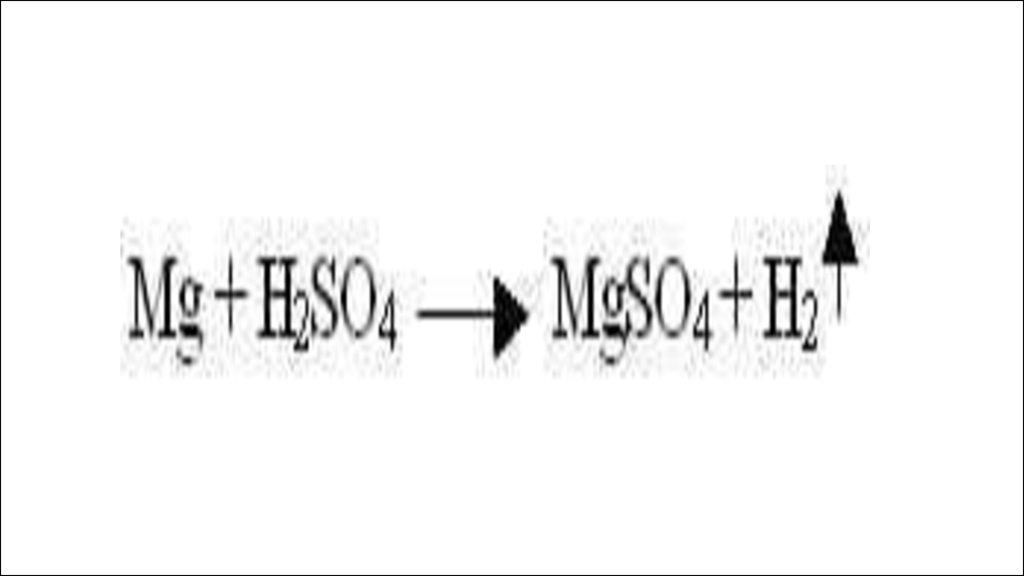
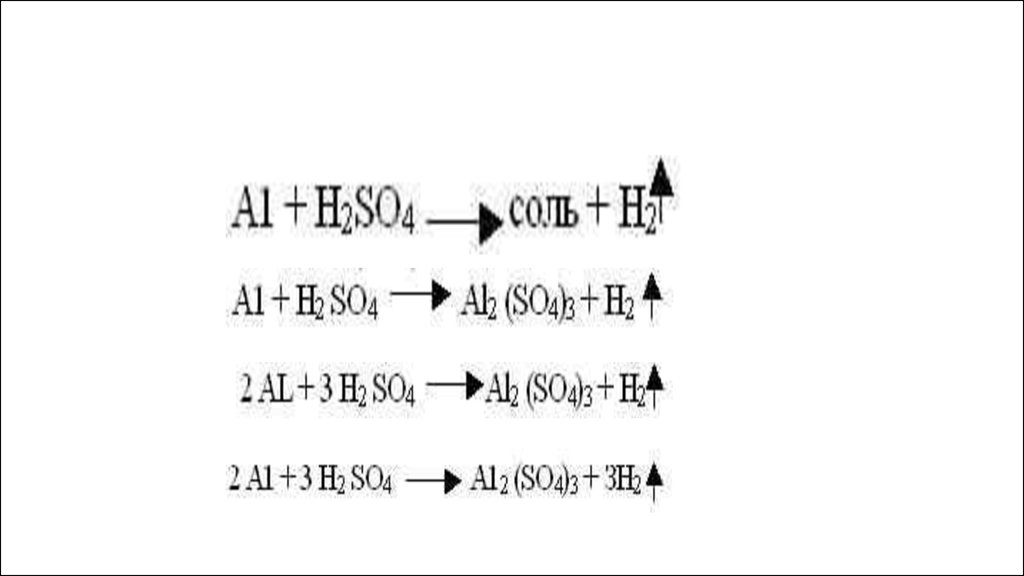
1) если металл стоит в этом ряду доводорода, он способен вытеснять его
из растворов кислот, если после
водорода, то нет.
11.
2) если металл стоит в рядунапряжений до металла соли, то он
способен вытеснить этот металл из
раствора его соли
12.
13.
•2 Al+3CuCl₂=2AlCl₃+ 3Cu14.
•Cu+2AgNO₃=2Ag+Cu(NO₃)₂15.
16.
•2Fe+3CL₂=2FeCl₃ - реакция соединения•Fe+CuCl₂=FeCl₂+Cu – реакция замещения
•CaCo₃=CaO+CO₂ - реакция разложения
•4NO₂+O₂+2H₂O=4НNO₃ - реакция
соединения
•2KBr+Cl₂=2KCl+Br₂ - реакция замещения
•Ca₃(PO₄)₂+3SiO2=3CaSiO₃+P₂O₅ - реакция
замещения
17. Д/З:
•§16 (учебник Рудзитис Г.Е.8кл.)
•Упражнение 5-6 стр.47








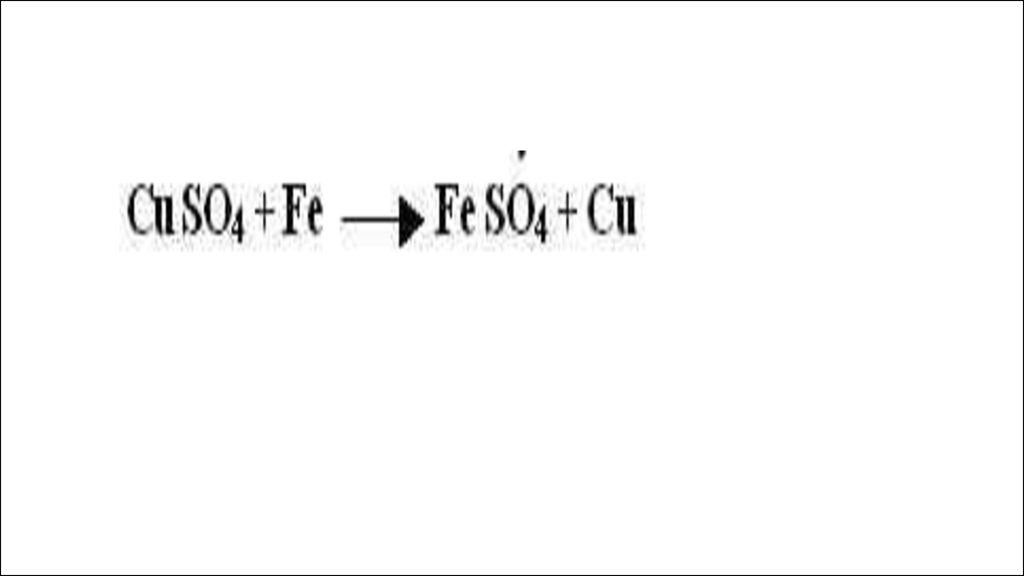
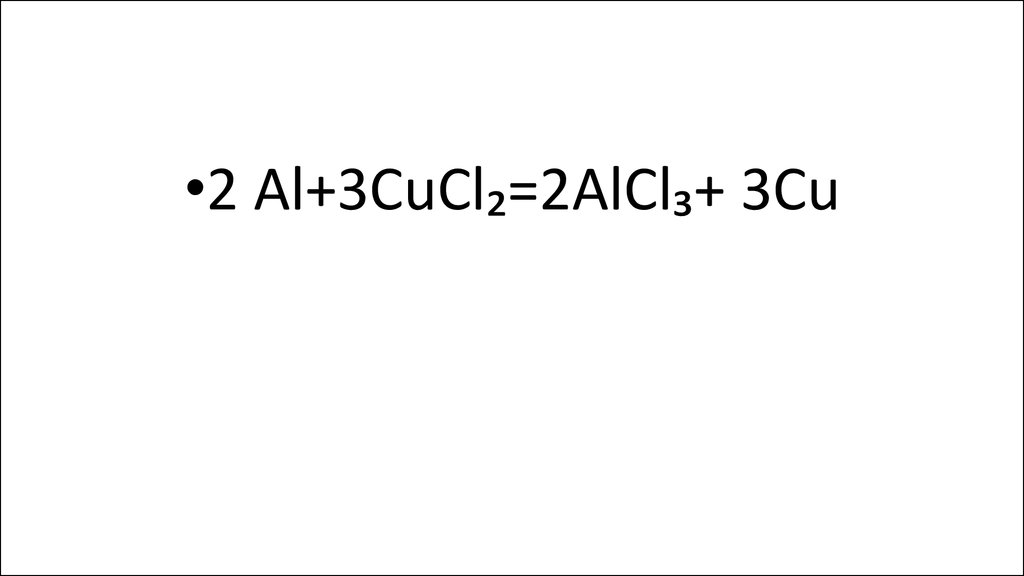
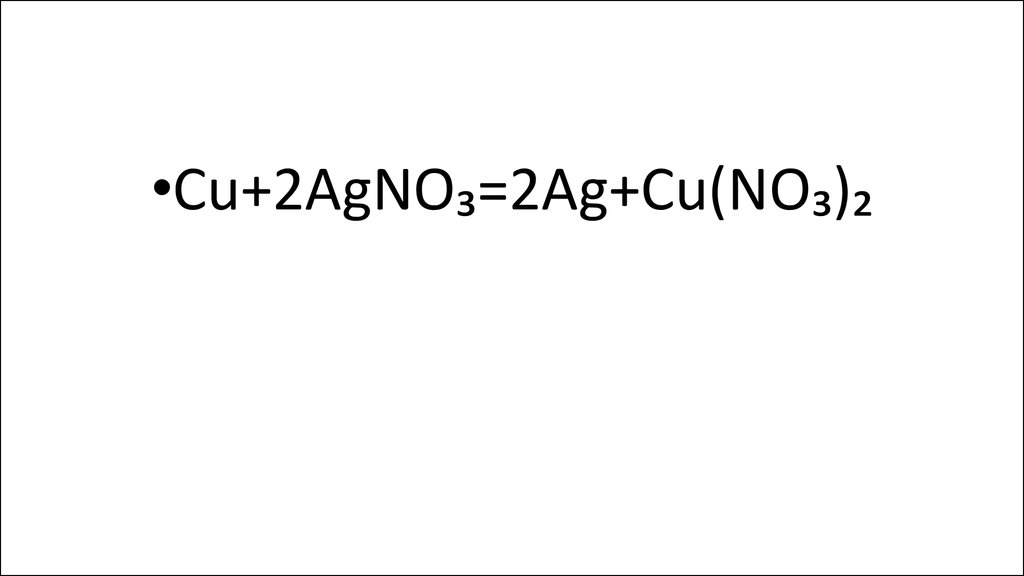
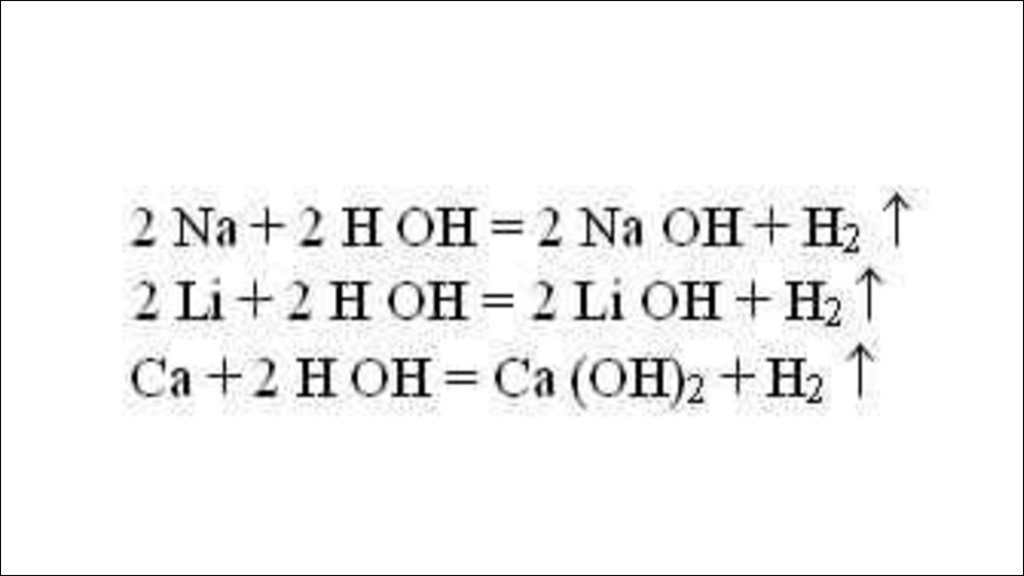


 Химия
Химия








