Похожие презентации:
Реакции замещения
1. Эпиграф: «УДАЧА ПРИХОДИТ ТЕМ, КТО ЕЁ ДОБИВАЕТСЯ!»
Помощники: Внимание,Находчивость и Смекалка.
2. ЗАГАДКА
Эти явления знаете выВ жизни нашей встречаются они,
А отличают эти явления - взаимные
превращения,
И образуются всегда – новые вещества
Что же это за явления?
3. Задание
Из перечисленных явлений выберите толькохимические:
а) плавление парафина;
б) образование инея;
в) ржавление гвоздей;
г) разложение воды электрическим током на
водород и кислород;
д) горение древесины.
Укажите признаки и условия для явлений:
д) и г).
4. Ответьте на вопросы:
По каким признакам можно определить, чтопроизошла химическая реакция?
Какому закону, связанному с массой веществ,
подчиняются все химические реакции? Кем и когда он
был открыт?
В чем сущность этого закона?
Что называют уравнением химической реакции?
Какие типы реакций вам известны?
С каким типом реакций мы познакомились на
прошлом уроке?
Какие реакции называются реакциями соединения?
Какие реакции называются реакциями разложения?
5. ИГРА «НАЙДИ МЕНЯ»
4 Р + 5О2 = P2O –соед.2SO2 + O2 = 2SO3 – соед.
2CH4 = C2H2 + 3H2 - разложение
2KMnO4 = K2MnO4 + MnO2 + O2 - разложение
6. Работа по карточкам
Вариант I1) MgO + CO2 → MgCO3 -соед.
2) 2Al + 3Cl2 = 2AlCl3 –соед.
3) Na2O + H2O →2NaOH – соед.
4) 2KClO3 → 2KCl + 3O2 –разл.
5) 2CO + O2 → 2CO2 –соед.
Вариант II
1) 2KNO3 → 2KNO2 + O2 –разл.
2) 2SO2 + O2 → 2SO3 –соед.
3) SO3 + H2O → H2SO4 –соед.
4) K2O + H2O → 2KOH –соед.
5) 2NO + O2 → 2NO2 – соед.
7. Тема урока: «Реакции замещения»
Задачи урока:познакомиться на практике с данным
типом химических реакций,
научиться прогнозировать и записывать
формулы продуктов реакции
выяснить возможность их протекания.
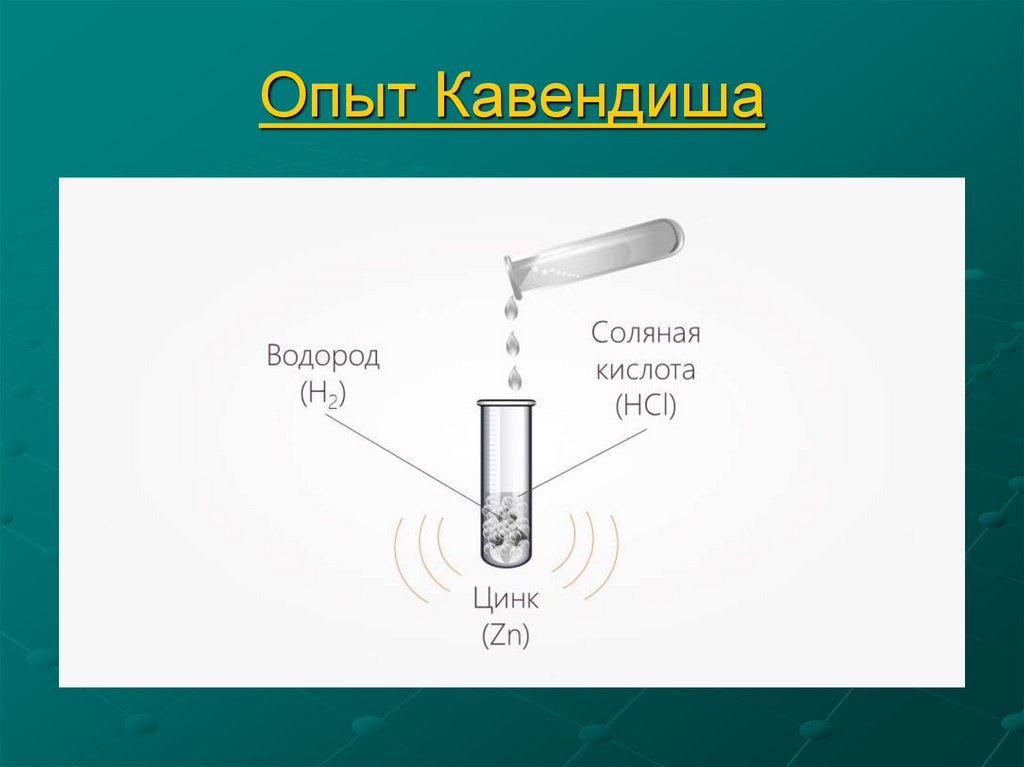
8. Опыт Кавендиша
9. Инструкция по технике безопасности
Перед началом работы приготовьте рабочее место.Запрещается брать вещества руками.
При выполнении лабораторной работы неукоснительно соблюдайте
правила техники безопасности, следите, чтобы вещества не
попадали на кожу лица и рук.
В случае попадании кислоты на кожу промыть проточной водой и
обработать 5% раствором питьевой соды.
Не забывайте о правилах обращения со стеклянной посудой.
Пузырьки с растворами не оставляйте открытыми (закрывайте сразу
после того как набрали раствор в пробирку). Крышки от пузырьков
не путайте.
10. Опыт № 1: Взаимодействие металлов с кислотами
Zn + 2HCl = ZnCl2 +H2 ↑Запишите аналогичную
реакцию для алюминия и серной
кислоты.
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
11.
12. Определение
Реакции замещения – этореакции, при осуществлении
которых атомы простого
вещества замещают атомы
одного из элементов в сложном
веществе.
13. ПРОБЛЕМА:
А ЛЮБОЙ ЛИ МЕТАЛЛ СПОСОБЕНВСТУПИТЬ В РЕАКЦИЮ ЗАМЕЩЕНИЯ
С КИСЛОТОЙ?
14. Эксперимент № 1
Кальций + Соляная кислота =Магний + Соляная кислота =
Цинк + Соляная кислота =
Медь + Соляная кислота =
15. Н.Н.Бекетов
Академик Петербургской АН (, изучая взаимодействие металлов с кислотами,пришел к выводу, как и вы. Он заметил, во-первых, что не все металлы
реагируют с кислотами, во-вторых, скорость химических реакций зависит от
активности металлов. Он составил ряд активности металлов
(электрохимический ряд напряжений металлов).
16.
17. Первое правило ряда напряжений : взаимодействие металлов с растворами кислот
Каждый из металлов,расположенных в ряду активности
металлов до водорода, способен
вытеснять его из растворов
кислот. Металлы, стоящие в ряду
активности после водорода не
вступают в реакцию с растворами
кислот.
( ВС + А = АС + В )
18. Второе правило ряда напряжений: взаимодействие металлов с растворами солей
Металл, стоящий в ряду напряженийлевее, способен вытеснять металлы из
растворов солей, которые стоят в
этом ряду правее его.
( ВС + А = АС + В )
19. Эксперимент №2: «Взаимодействие металлов с растворами солей»
Fe + СuSO4 = FeSO4 + СuСu + Ag NO3 = Ag + Сu (NO 3)2(уравнять) рисунок в учебнике на
стр. 186.
20. Эксперимент № 2
Оформляем результатылабораторного опыта в таблицу.
Вывод 1: железо в ряду напряжений
металлов стоит левее меди, поэтому железо
вытесняет медь из растворов её солей.
Вывод 2: медь в ряду напряжений металлов
стоит левее серебра, поэтому медь
вытесняет серебро из раствора её солей
21. Ответьте на следующие вопросы:
Что мы изучали сегодня на уроке?Какие реакции называются реакциями
замещения?
Назовите два правила ряда активности
металлов.
22. ЗАКРЕПЛЕНИЕ
Допишите уравнения возможныхреакций, если не идёт реакция,
объясните почему?
Zn+H 2 SO 4 →
Cu+HCl→
Mg+CuCl2→
Ag+MgSO4 →
Al+HCl→
23. Домашнее задание
П.32,- №2 (стр.187) -на «3»
№ 3 (стр.187) - (на «4»)
№2, №3(стр.187), (на «5»)























 Химия
Химия








