Похожие презентации:
Кислоты. К уроку по химии для 8 класса
1. Презентация к уроку по химии для 8 класса «Кислоты»
Автор: учитель МБОУ СШ №16 г. ПавловоНижегородской области Краснова Н.Ю.
2.
• Лимонная кислота• Яблочная кислота
• Муравьиная кислота
3.
• Уксусная кислота• Молочная кислота
• Винная кислота
4.
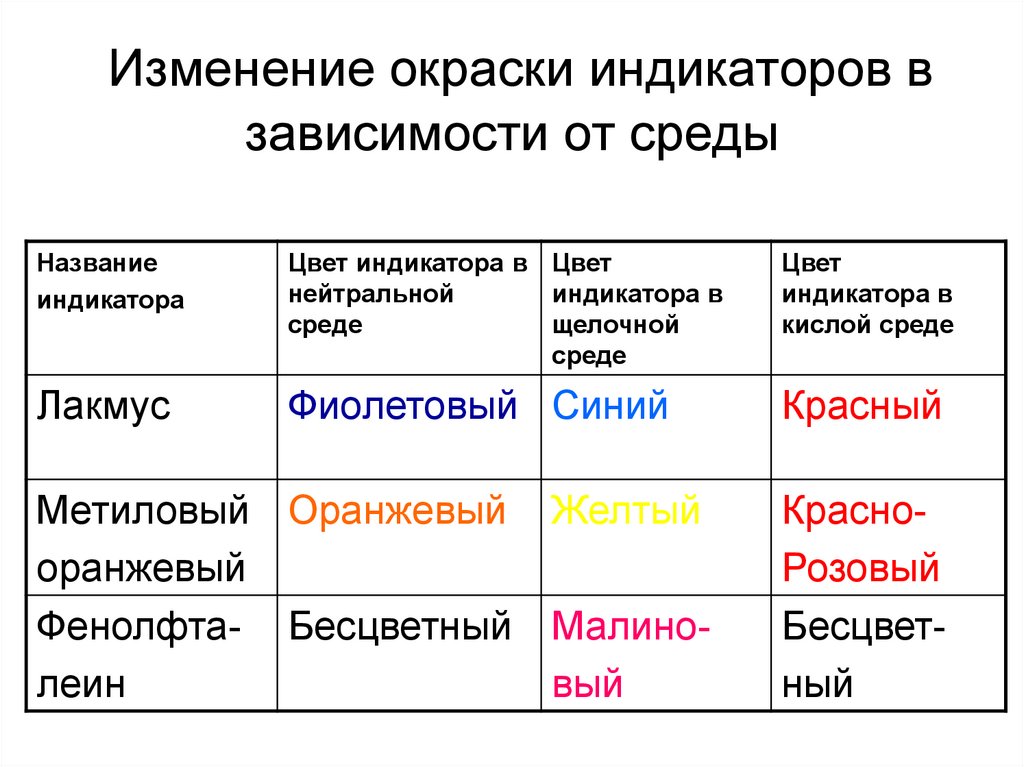
Пищевые кислоты5. Изменение окраски индикаторов в зависимости от среды
Названиеиндикатора
Цвет индикатора в Цвет
нейтральной
индикатора в
среде
щелочной
среде
Цвет
индикатора в
кислой среде
Лакмус
Фиолетовый Синий
Красный
Метиловый Оранжевый Желтый
оранжевый
Фенолфта- Бесцветный Малинолеин
вый
КрасноРозовый
Бесцветный
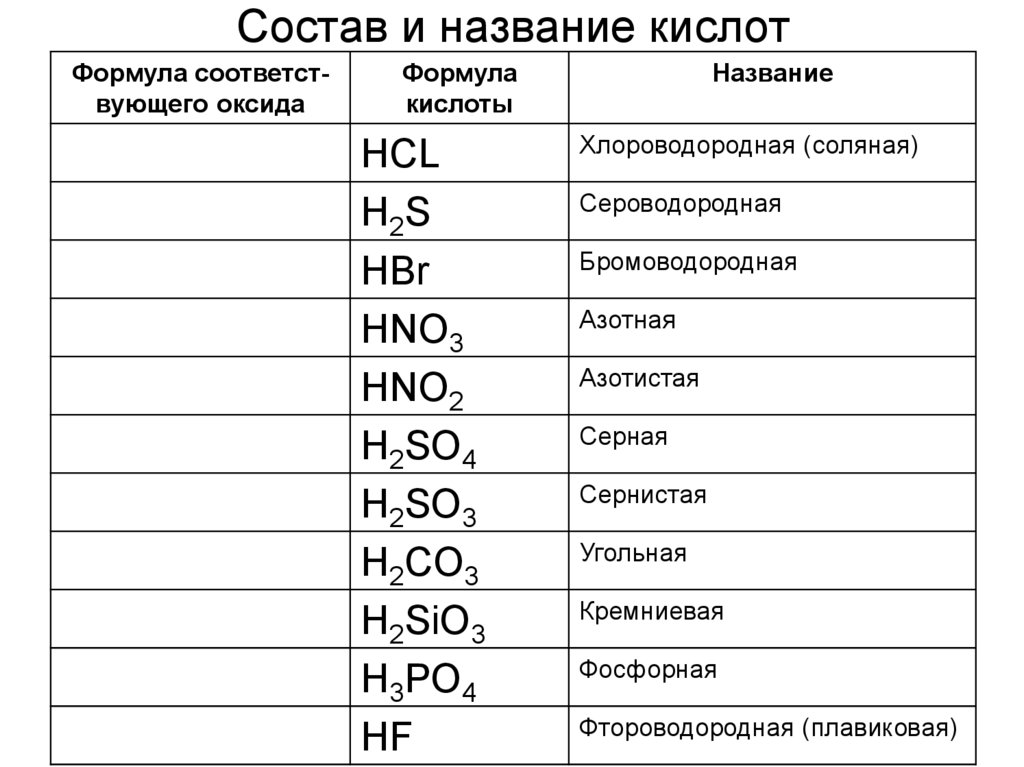
6. Состав и название кислот
Формула соответствующего оксидаФормула
кислоты
HCL
H2S
HBr
HNO3
HNO2
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
HF
Название
Хлороводородная (соляная)
Сероводородная
Бромоводородная
Азотная
Азотистая
Серная
Сернистая
Угольная
Кремниевая
Фосфорная
Фтороводородная (плавиковая)
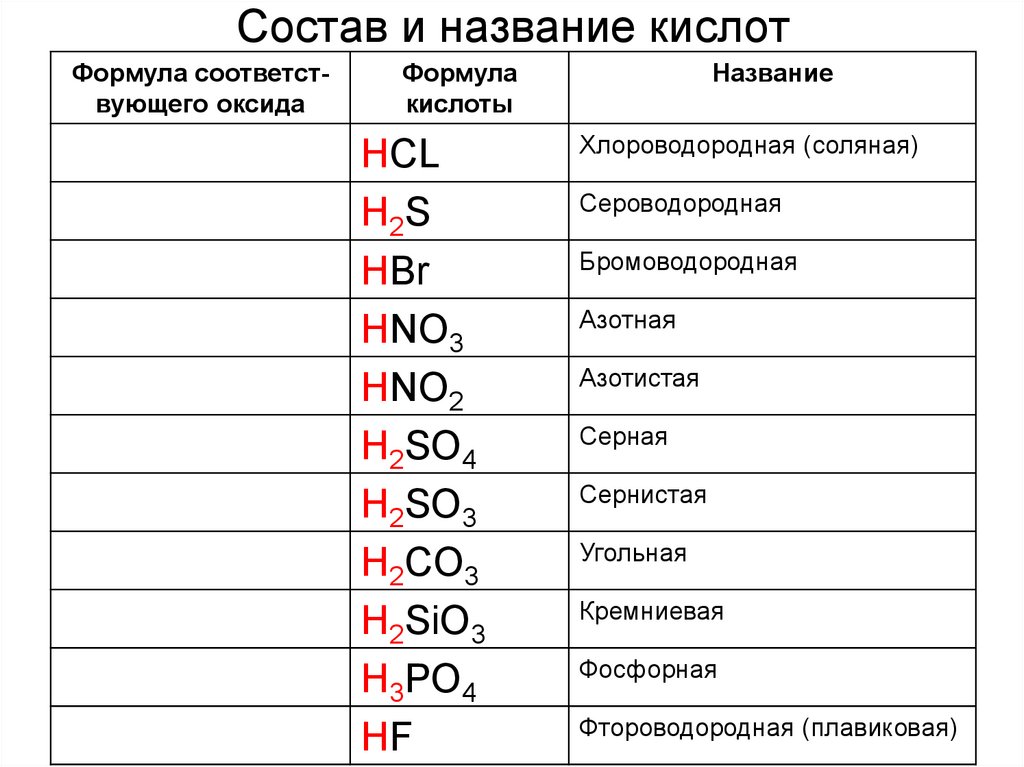
7. Состав и название кислот
Формула соответствующего оксидаФормула
кислоты
HCL
H2S
HBr
HNO3
HNO2
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
HF
Название
Хлороводородная (соляная)
Сероводородная
Бромоводородная
Азотная
Азотистая
Серная
Сернистая
Угольная
Кремниевая
Фосфорная
Фтороводородная (плавиковая)
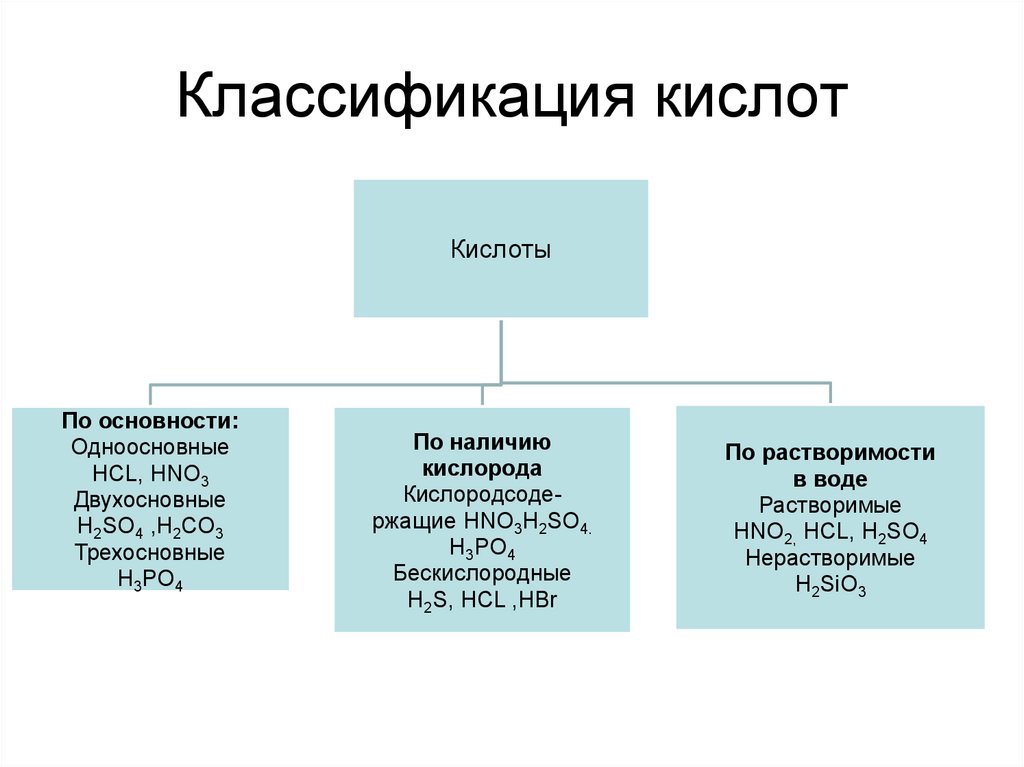
8. Классификация кислот
КислотыПо основности:
Одноосновные
HCL, HNO3
Двухосновные
H2SO4 ,H2CO3
Трехосновные
H3PO4
По наличию
кислорода
Кислородсодержащие HNO3H2SO4.
H3PO4
Бескислородные
H2S, HCL ,HBr
По растворимости
в воде
Растворимые
HNO2, HCL, H2SO4
Нерастворимые
H2SiO3
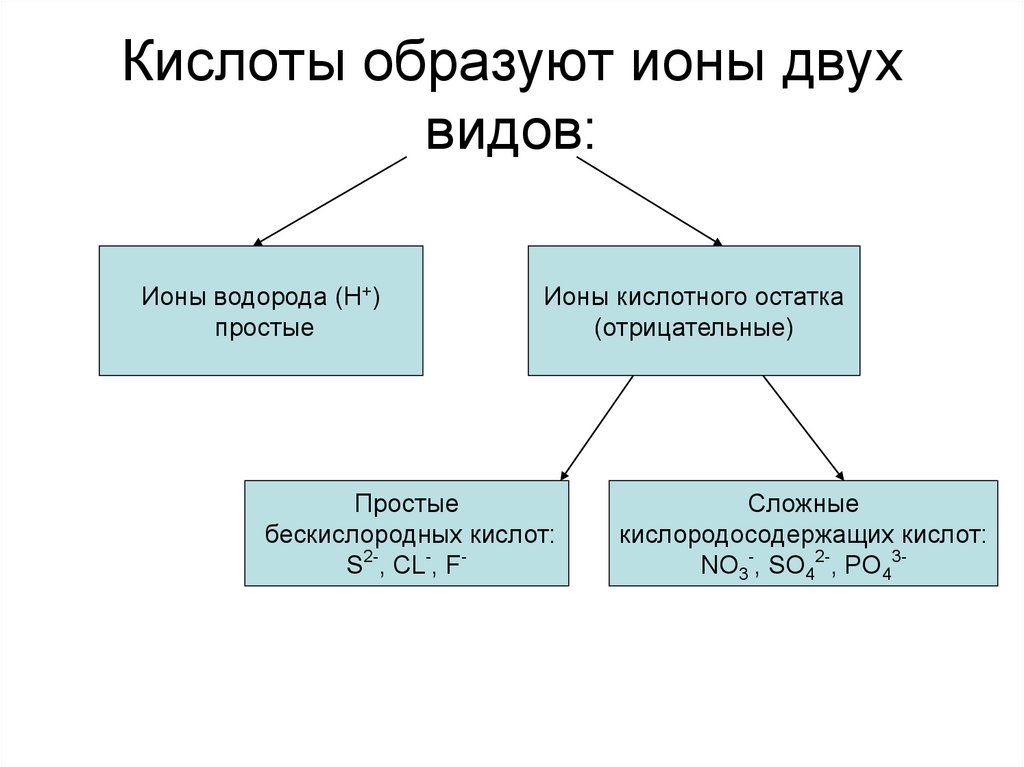
9. Кислоты образуют ионы двух видов:
Ионы водорода (Н+)простые
Ионы кислотного остатка
(отрицательные)
Простые
бескислородных кислот:
S2-, CL-, F-
Сложные
кислородосодержащих кислот:
NO3-, SO42-, PO43-
10. Степень окисления атомов в кислотах
+1-1
H CL
+1 x -2
H 2S O 4
H+12S-2
+1 x
H N
-2
O 3
(+1) * 2 + x + (-2) * 4 = 0
2+x-8=0
X-6=0
X=6
+1 x -2
H 2C O 3
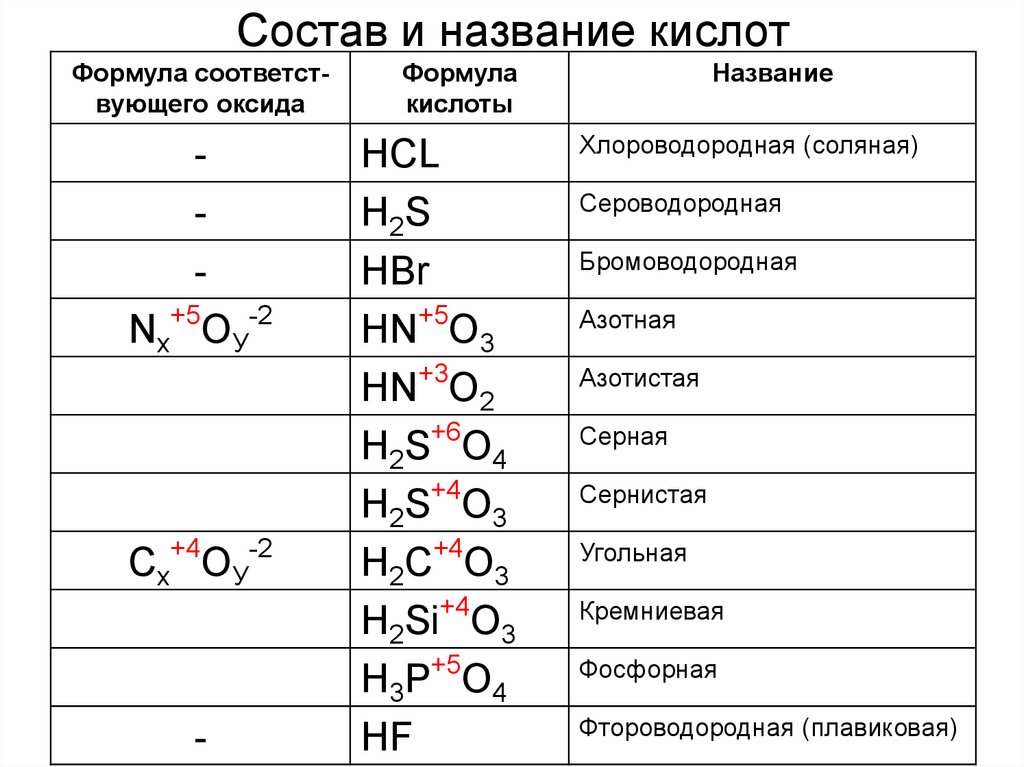
11. Состав и название кислот
Формула соответствующего оксидаNх+5OУ-2
+4
-2
Сх OУ
-
Формула
кислоты
HCL
H2S
HBr
HN+5O3
HN+3O2
H2S+6O4
H2S+4O3
+4
H2C O3
H2Si+4O3
H3P+5O4
HF
Название
Хлороводородная (соляная)
Сероводородная
Бромоводородная
Азотная
Азотистая
Серная
Сернистая
Угольная
Кремниевая
Фосфорная
Фтороводородная (плавиковая)
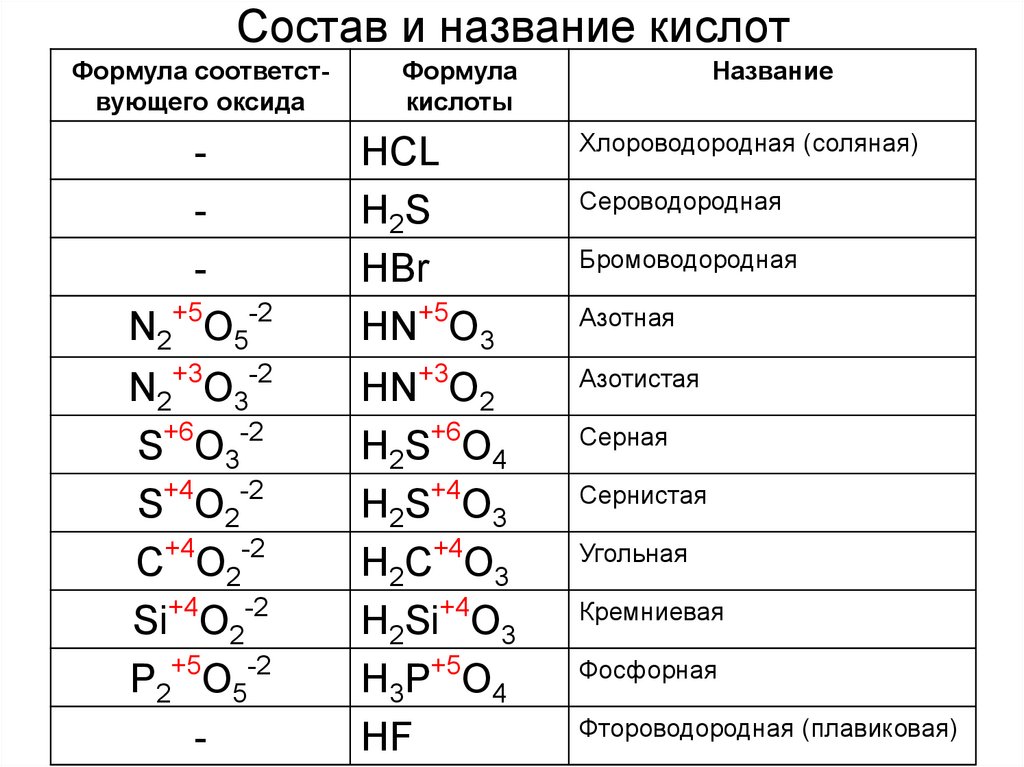
12. Состав и название кислот
Формула соответствующего оксидаФормула
кислоты
Название
N2+5O5-2
HCL
H2S
HBr
HN+5O3
Хлороводородная (соляная)
N2+3O3-2
S+6O3-2
S+4O2-2
+4
-2
С O2
Si+4O2-2
P2+5O5-2
-
HN+3O2
H2S+6O4
H2S+4O3
+4
H2C O3
H2Si+4O3
H3P+5O4
HF
Азотистая
Сероводородная
Бромоводородная
Азотная
Серная
Сернистая
Угольная
Кремниевая
Фосфорная
Фтороводородная (плавиковая)
13. Характеристика кислоты
1.2.
3.
4.
5.
6.
7.
Формула
Наличие кислорода
Основность
Растворимость
Степень окисления элементов,
образующих кислоту
Заряд иона кислотного остатка
Соответствующий оксид, название






 Химия
Химия








