Похожие презентации:
Химическое равновесие. 11 класс
1.
Урок по химии для 11 классаМБОУ «Гимназия 127»
Гладышева Н.К.
2014-15 уч. год.
2.
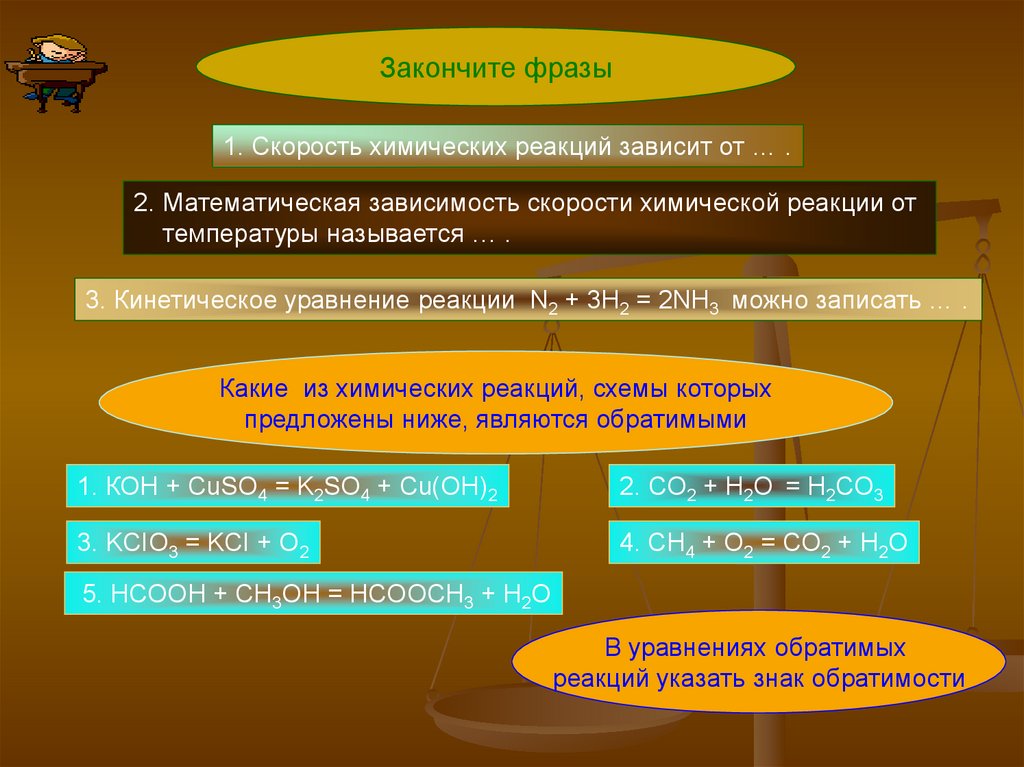
Закончите фразы1. Скорость химических реакций зависит от … .
2. Математическая зависимость скорости химической реакции от
температуры называется … .
3. Кинетическое уравнение реакции N2 + 3H2 = 2NH3 можно записать … .
Какие из химических реакций, схемы которых
предложены ниже, являются обратимыми
1. КОН + CuSO4 = K2SO4 + Cu(OH)2
2. СO2 + H2O = H2CO3
3. KCIO3 = KCI + O2
4. CH4 + O2 = CO2 + H2O
5. HCOOH + CH3OH = HCOOCH3 + H2O
В уравнениях обратимых
реакций указать знак обратимости
3.
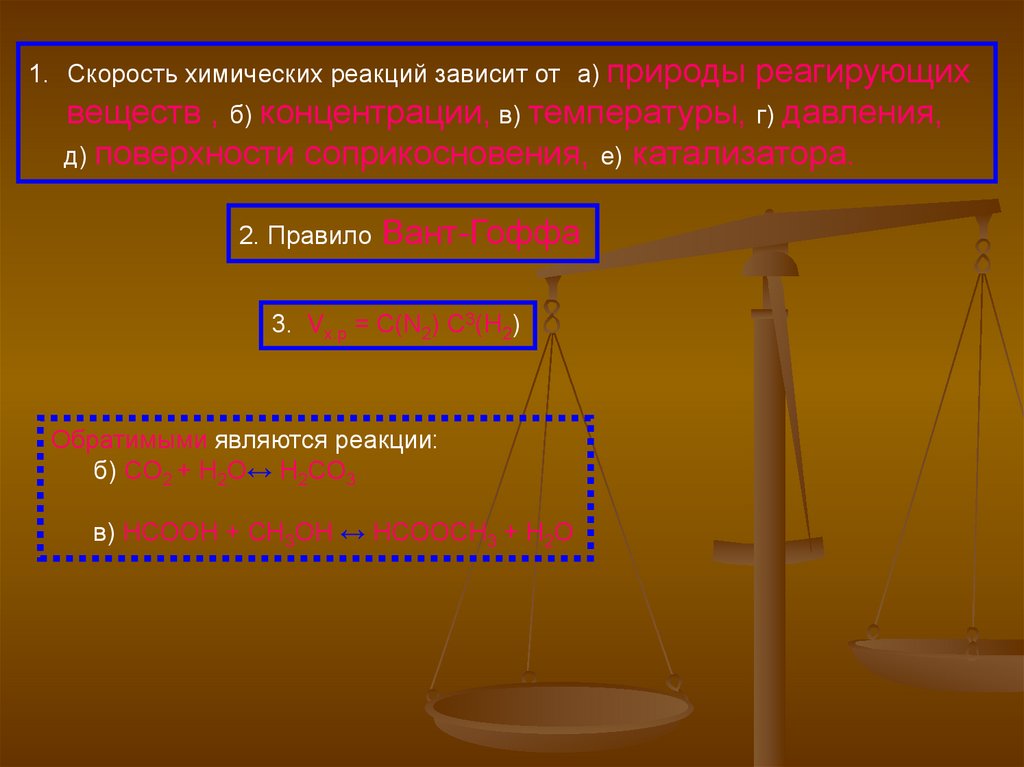
1. Скорость химических реакций зависит от а) природыреагирующих
веществ , б) концентрации, в) температуры, г) давления,
д) поверхности соприкосновения, е) катализатора.
2. Правило
Вант-Гоффа
3. Vx.p = C(N2) C3(H2)
Обратимыми являются реакции:
б) CO2 + H2O↔ H2CO3
в) HCOOH + CH3OH ↔ HCOOCH3 + H2O
4.
А+ВА, В
исходные
вещества
С+В
А, В, С, Д
равновесное
состояние
С, Д
исходное
состояние
5.
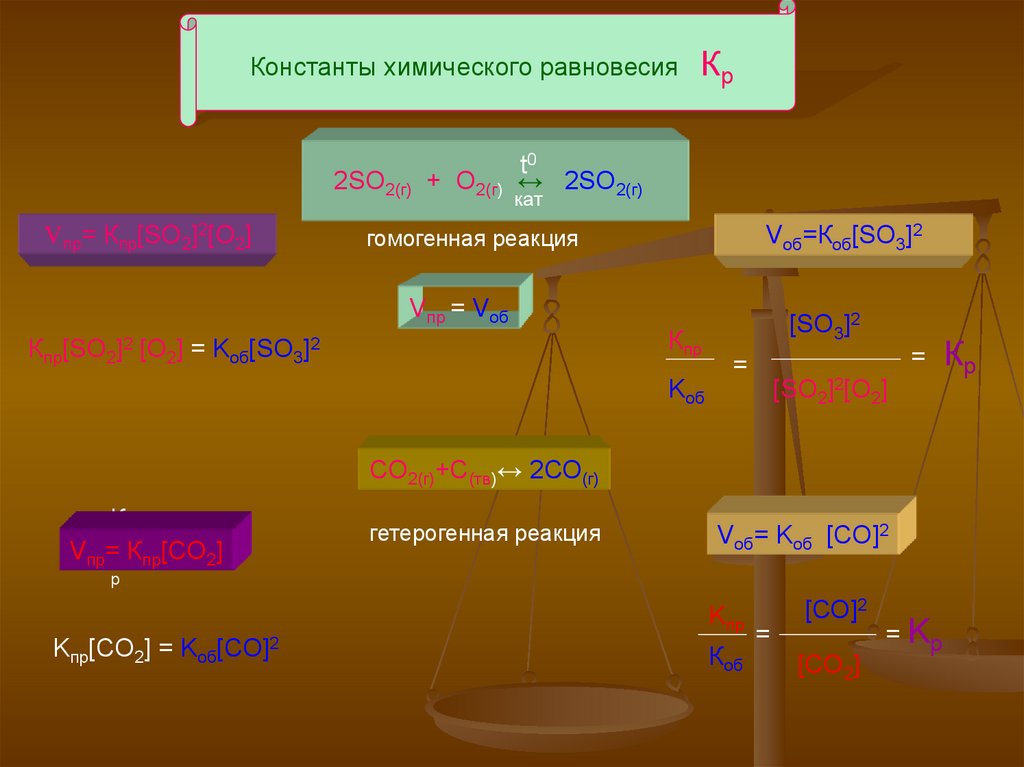
Константы химического равновесия2SO2(г) + O2(г)
Vпр= Кпр[SO2]2[O2]
Кр
t0
↔ 2SO2(г)
кат
Vоб=Коб[SO3]2
гомогенная реакция
Vпр = Vоб
Кпр[SO2]2 [O2] = Kоб[SO3]2
Кпр
[SO3]2
=
=
[SO2]2[O2]
Kоб
СО2(г)+С(тв)↔ 2СО(г)
К
Vпр=п Кпр[CO2]
гетерогенная реакция
Vоб= Kоб [CO]2
р
Kпр
Kпр[CO2] = Kоб[CO]2
Коб
[СО]2
=
[CO2]
= Kр
Кр
6.
Французский физикохимик , занимался процессамигорения, взрывов. Самое известное, но далеко не
единственное научное достижение – принцип
смещения равновесия. Он еще изобрел способы
приготовления разных видов цемента, способ получения аммиака из водорода и азота. Ле Шателье
был действительным членом многих академий
наук.
Анри Луи Ле Шателье
1850-1936
Лауреаты Нобелевской премии
Планк Макс
И.П.Пригожин
Г.Ч.Браун
В.Ф. Оствальд
М.Молина
7.
Равновесные процессы в бутылке с газированной водойиспарение
H2O(ж)
CO2(г)
конденсация
растворение
выделение из
раствора
СО2(вод)+Н2О
диссоциация
моляризация
Н2О(Г)
СО2(вод)
обратимые
физические
процессы
НСО3- +Н+
8.
№п/п
Уравнения реакций
Кр
при 298К
(25ºС)
при 1000К
(727ºС)
9,2∙10-13
2∙10-4
1
2CH4 ↔ C2H6 + H2
2
C2H6 ↔ C2H4+ H2
2∙10-18
0,34
3
3C2H2 ↔ C6H6
1,7∙108
1∙1013
4
C6H12 ↔ 3C2H4
5,5∙10-31
1,9∙104
5
C6H6 + 3H2 ↔ C6H12
1,4∙ 1017
6,5∙10-10
6
2H2O + 3CO ↔ CH3OH + 2CO2
1,6∙1014
6∙10-8
7
2SO3 ↔ 2SO2 + O2
4,9∙10-13
0,68
8
3H2 + N2 ↔ 2NH3
6,8∙102
5,7∙10-4
9.
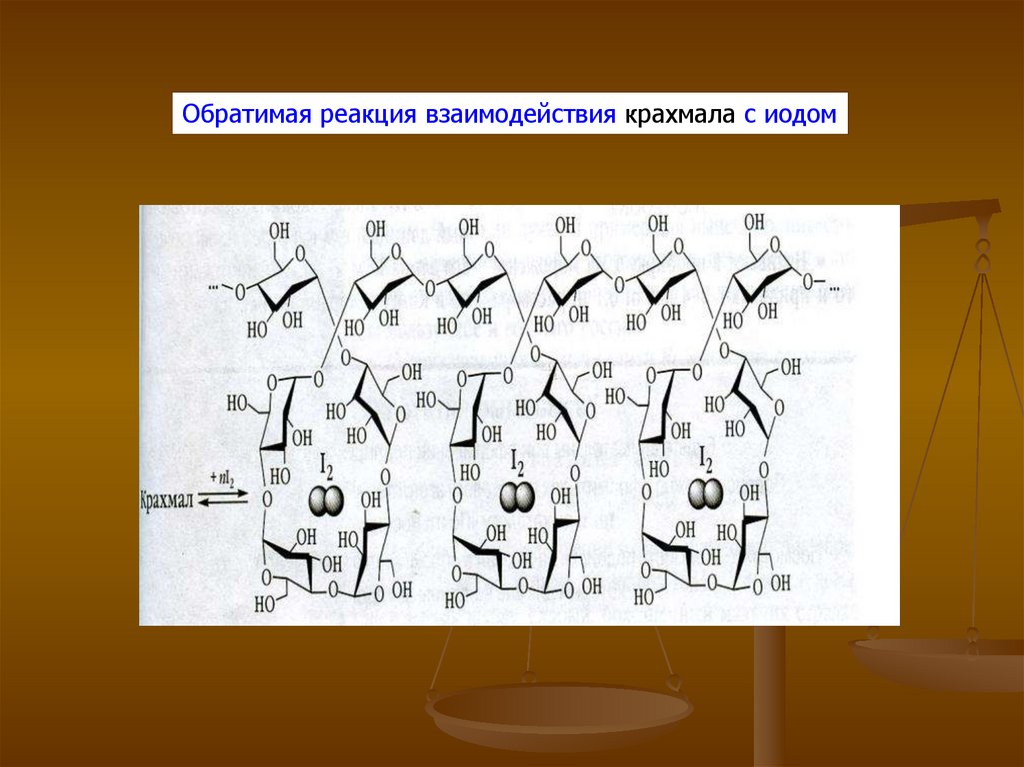
Обратимая реакция взаимодействия крахмала с иодом10.
Даны схемы химических реакций1) Н2(г) + О2 ↔ Н2О + Q
2) СаСО3(тв) ↔ СаО(тв) + СО2(г)- Q
3) СО(г) + Н2О ↔ СО2 + Н2 + Q
Задание
№1
Укажите, в какую сторону сместится
равновесие при:
а) при ↑ t0
б) при ↓ Р
в) при ↑ С исходных веществ
Задание
№2
Запишите выражение константы
равновесия для данных схем
химических реакций, укажите ее
размерность.
11.
Задание к уроку по теме:Химик толкает реакцию в спину:
"Давай-ка тебя я немного подвину"
Она отвечает: "Ты знаешь меня:
Ни часа, ни дня не могу без огня!
И чтобы улучшить мое настроение,
Прошу, даже требую: выше давление!
К тому же учти: я - такая реакция,
Что мне реагентов важна концентрация".
И химик подумал: "Теперь мне все ясно.
Тепло поглощаешь - и это прекрасно!
Как только под колбой зажгутся горелки,
Ступай-ка, реакция, прямо по стрелке.
Вот это цветочки, но будут и фрукты Повысит давление выход продукта!
Еще концентрация… Да, ты права:
Побольше я выдам тебе вещества".
Реакция стала работать послушно,
Продукт образую полезный и нужный.
Такой вот привиделся сон.
Какие же выводы сделает он?
(Реакция: а) эндотермическая, б) протекала с уменьшением объема реагирующих газов).






 Химия
Химия








