Похожие презентации:
Классификация неорганических веществ
1.
21.09.20212.
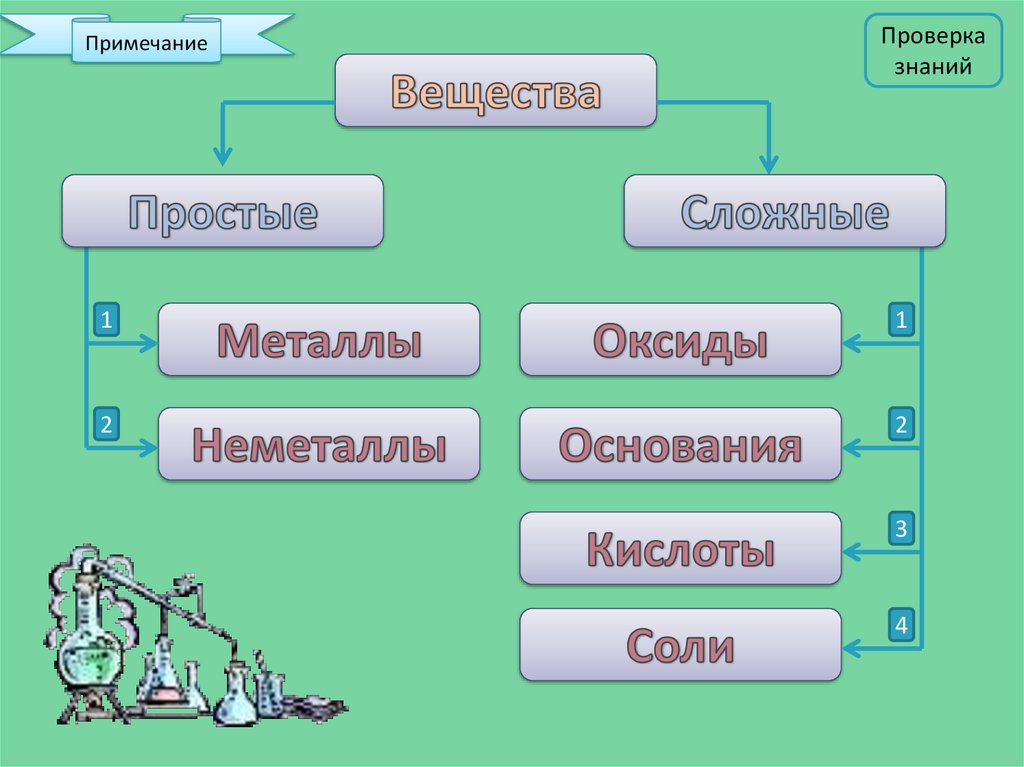
ПримечаниеПроверка
знаний
1
1
2
2
3
4
3.
СхемаВещества – это то, из чего состоят физические
тела.
Свойства веществ – это признаки, по которым
одни вещества отличаются от других.
Свойства
Физические
Агрегатное состояние
Плотность
Электропроводность
Теплопроводность
и др.
Химические
Превращение одних
веществ в другие
4.
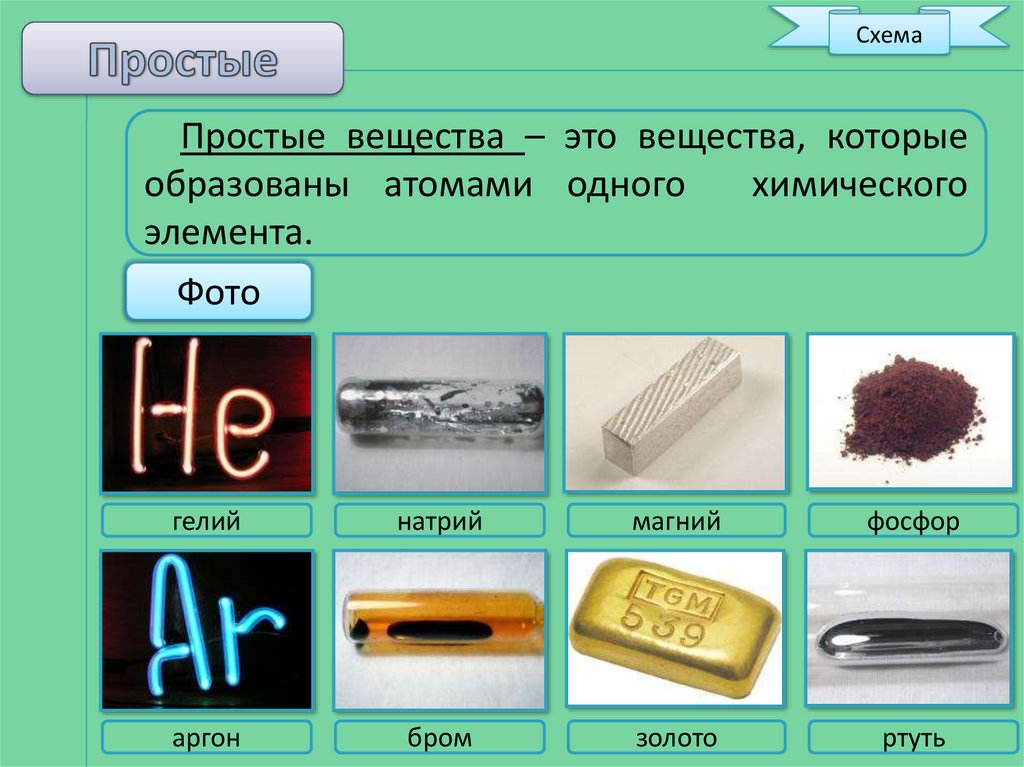
СхемаПростые вещества – это вещества, которые
образованы атомами одного
химического
элемента.
Фото
гелий
натрий
магний
фосфор
аргон
бром
золото
ртуть
5.
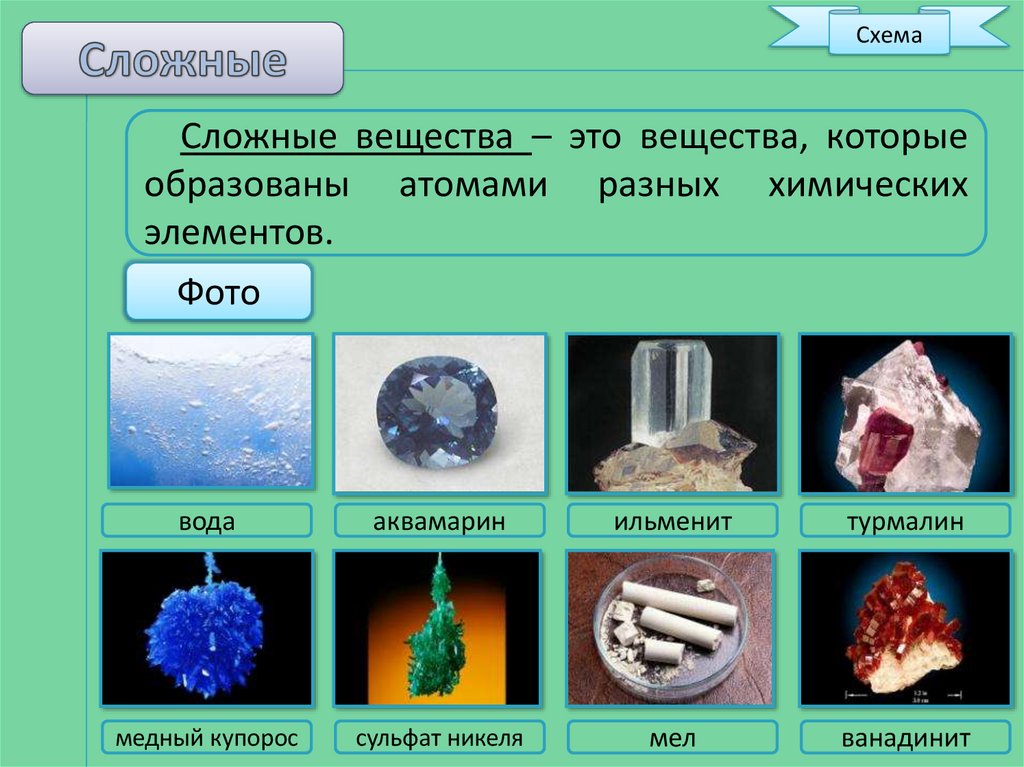
СхемаСложные вещества – это вещества, которые
образованы атомами разных химических
элементов.
Фото
вода
аквамарин
ильменит
турмалин
медный купорос
сульфат никеля
мел
ванадинит
6.
СхемаМеталлы – это ковкие, пластичные, тягучие
вещества, которые имеют металлический блеск
тепло- и электропроводны.
Физ. свойства
Фото
Хим. свойства
Взаимодействие
Пластичностьс кислородом.
Теплопроводность
Электропроводность
Взаимодействие
с неметаллами.
марганец
натрий
магний
Металлический блеск
По твердости: мягкие и твердые
Взаимодействие с кислотами.
По плотности: легкие и тяжелые
По tплавления: легкоплавкие и тугоплавкие
медь
вольфрам
золото
осмий
ртуть
7.
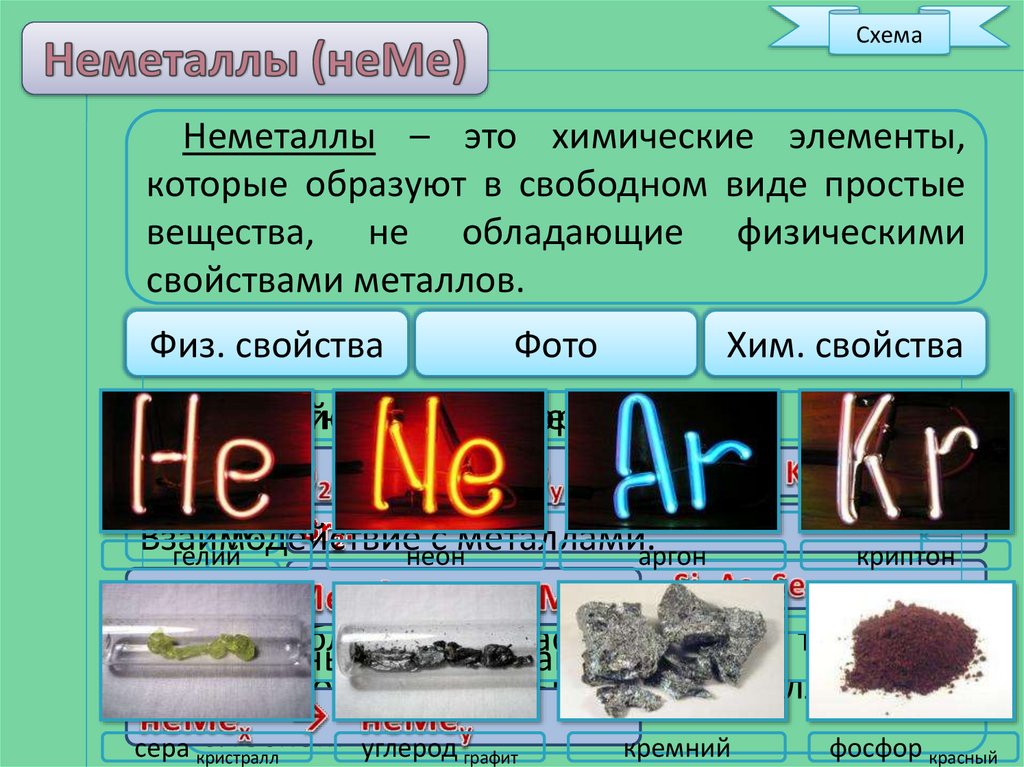
СхемаНеметаллы – это химические элементы,
которые образуют в свободном виде простые
вещества, не обладающие физическими
свойствами металлов.
Физ. свойства
Фото
Хим. свойства
Взаимодействие
Агрегатное состояние
с кислородом.
Г.
Ж.
Взаимодействие
с металлами.аргон
гелий
неон
криптон
Тв.
Не обладают
пластичностью, тепло- и
Аллотропные
модификации.
электропроводностью,
металлическим
блеском углерод графит
сера кристралл
кремний
фосфор красный
8.
СхемаОксиды – это сложные вещества, состоящие из
двух элементов, один из которых кислород
(степень окисления кислорода -2).
Классификация
Номенклатура
Фото Хим. свойства
1. Записать слово «оксид»
1. Взаимодействие с водой.
2.
3.
кислотами.
кислотными оксидами.
2. Записать название химического элемента
химического
элемента
Н2О3.(г)Указать валентность
Н2О (ж)
Н2О (тв)
Al2O3 (глинозём)
- если это неметалл
1.- Взаимодействие
2.
3.
-оксиды,
если это
металл
с водой.
основаниями.
основными
побочной
оксидами.
подгруппы
это
этооксиды,
которые
которые
неизвзаимодействуют
взаимодействуют
ни с
кислотами,
-кислотами
это оксиды,
или
ни
которым
ссооснованиями
щелочами
соответствует
и образуют
не
основание.
кислота.
образуют
при
солей.
этом
соль и воду.
CaO
Fe2O3
CuO
MgO
(негашеная изв.)
9.
СхемаОснования – это сложные вещества,
состоящие из ионов металлов и связанных с
ними гидроксид-ионов.
Классификация
Номенклатура
Фото
Хим. свойства
Взаимодействие
с кислотами.
1. Записать слово
«гидроксид»
2. Записать название металла
Взаимодействие
3. Указать
валентность
с кислотными
металла
оксидами.
NaOH,
KOH
CuOH
- если это металл из побочной подгруппы
Ba(OH)2
Cu(OH)2, Fe(OH)2
Взаимодействие с солями.
Na(OH)
Fe(OH)3, Al(OH)3
Cu(OH)2
10.
СхемаКислоты – это сложные вещества, молекулы
которых
состоят из атомов водорода и
кислотного остатка.
Классификация
Номенклатура
Фото
Хим. свойства
1. Взаимодействие с солями.
4.
металлами.
HCl – соляная к-та
HNО2 – азотистая к-та
HNO3 – азотная к-та
H2S – сероводородная
HCl,
HBr,
H2SO
серная к-та
4 –HF
HNO3, HNOк-та
H2SО3 – сернистая
2
2. НВзаимодействие
HCl с основными
HNO3оксидами.Н3ВО3
2SО4
H2СO3 H–2Sугольная к-та
H2SO4, H2CO
H2SiО3–кремневая
к-та
3
H3РO4 – фосфорная к-та
H3PO4, H
H3ВО3 – борная
к-та
3BO3
3. Взаимодействие с основаниями.
уксусная к-та
лимонная к-та
лимонная к-та
муравьиная
11.
СхемаСоли – это сложные вещества, состоящие из
ионов металлов и кислотных остатков.
Классификация
Номенклатура
Фото
Хим. свойства
1.
4. Взаимодействие с кислотами.
металлами.
1. –Записать
остатка»
-Cl
хлорид название «кислотного
-NО2 – нитрит
остатков
-NO3 таблица
– нитрат названия кислотных
-S – сульфид
2. Взаимодействие
с основаниями.
2. Записать название
металла
-SO4 4 – сульфатMgSO4
-SО3(мел)
CuSO
CaCO
3 – сульфит KNO3
3. Указать
валентность
металла
Средние,
Кислые
Основные
или
соли
соли
нормальные,
–
–
это
это
продукты
продукты
соли
этонеполного
продукты
-СO3 – карбонат
-SiО3– –силикат
- если
это
металл
из побочной
подгруппы
3.замещения
Взаимодействие
с другими
солями.
полного
замещения
атомов
гидроксогрупп
атомов
водорода
водорода
в основании
в кислоте
в кислоте
на
-ВО3 – борат
4 – фосфат
на-РO
металл.
кислотный
металл.
остаток.
2Cu(OH)
Cu(OH)
Cu(OH)
H+2H
SO
(CuОН)
Cu(НSO
CuSO24SO
++ 2H
O 22OO
22 ++22H
2SO
2SO
44
4
4+)242H
22H
KCl (сильвин)
FeTiO3(ильменит)
KMnO4
FeCl3
12.
СхемаNaCl
Ba(ОH)2
H3BО3
BaSO4
Оксиды
СaО
Cl2О7
Mg3(PO4)2
CО2
H2SО4
HCl
Fe(ОH)3
HNO3
Сa(ОH)2
K2SiO3
SО3
CuО
Кислоты
P2О5
Сu(ОH)2
CuBr2
CaCO3
Соли
Na2SO4
Ag2О
HNO2
LiОH
NaОH
H3PО4
Fe2О3
H2SО3
NaNO2
Mg(NO3)2
KОH
Fe(ОH)2
H2S
Li2О
K2CO3
H2SiО3
Основания
Ошибки







 Химия
Химия








