Похожие презентации:
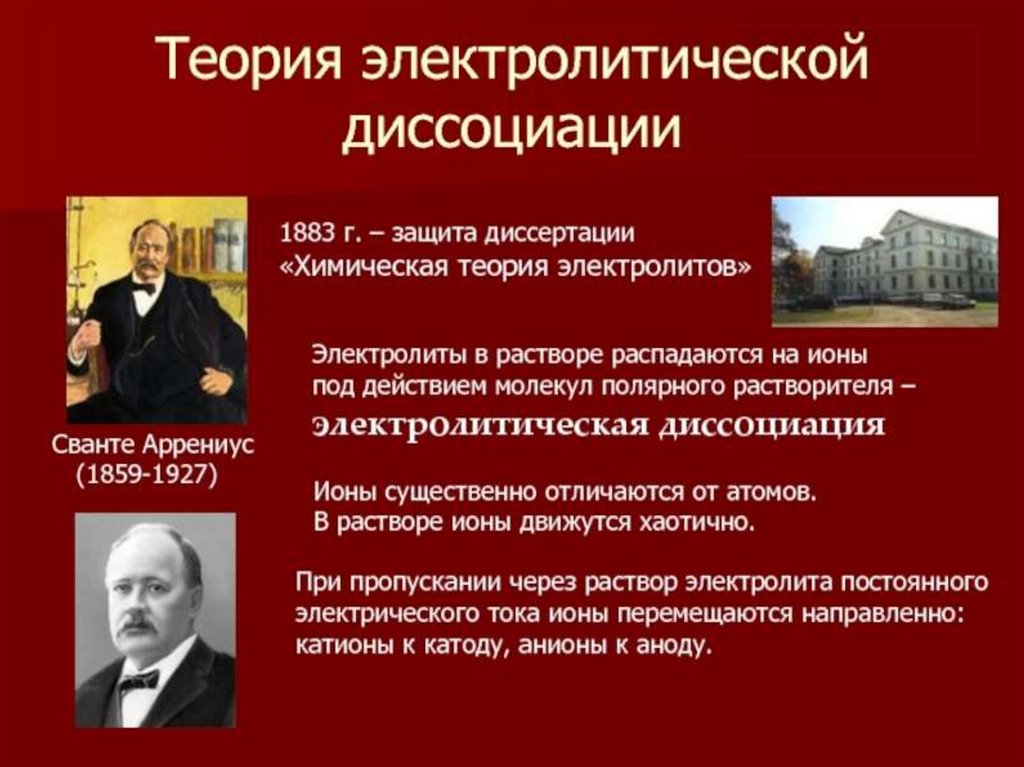
Теория электролитической диссоциации
1.
2.
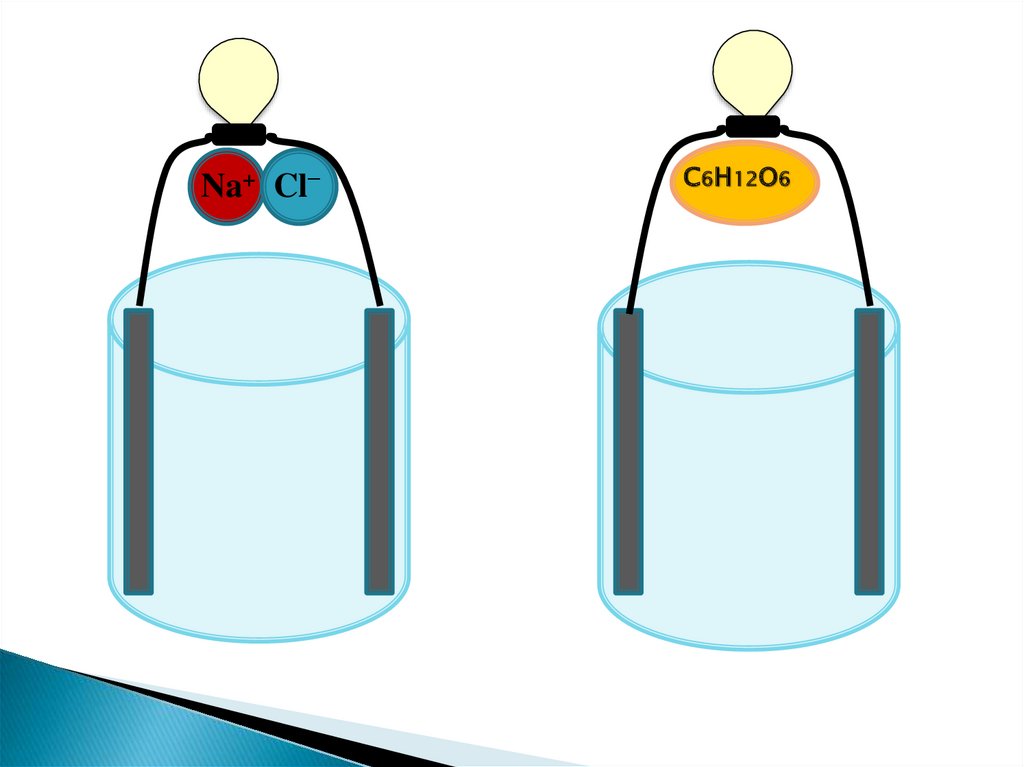
Na+ Cl−С6H12O6
3.
- направленное движение заряженных частиц- ионы
- диссоциация
-вещество, которое диссоциирует на ионы,
при растворении или расплавлении
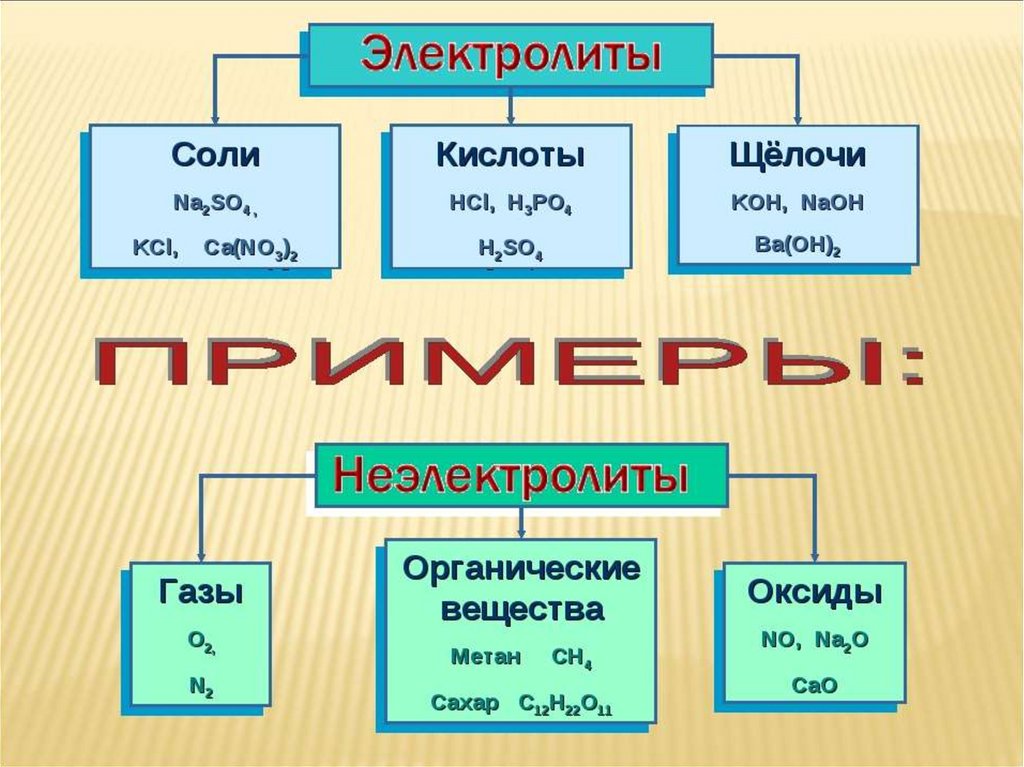
Сильные кислоты, гидроксиды и соли.
4.
5.
6.
Процесс диссоциации – обратимый процесс!!!NaCl ⇄ Na⁺+Cl⁻
1.Ориентация молекул воды вокруг растворяемого вещества
2.Гидратация (соединение) молекул воды с противоположно
заряженными ионами
3,4.Диссоциация (распад) электролита на гидратированные ионы.
7.
1.Основания (щелочи) – диссоциируют в растворе накатионы металлов и анионы гидроксогрупп.
NaOH ⇄ Na⁺+ OH⁻
2.Кислоты (сильные) – диссоциируют в растворе на катионы
водорода и анионы кислотного остатка.
HCl⇄ H⁺+ Cl⁻
3.Соли (растворимые в воде) – диссоциируют в растворе на
катионы металлов и анионы кислотного остатка.
KCl⇄ K⁺+ Cl⁻
8.
Запишите диссоциацию водныхрастворов: HNO3, K2S, Cr2(SO4)3, LiOH,
BaSO4, FeCl3, Ca(OH)2, Cu(OH)2






 Химия
Химия








