Похожие презентации:
Современная аналитическая химия.Учебная литература
1.
СОВРЕМЕННАЯ АНАЛИТИЧЕСКАЯХИМИЯ
для студентов II курса факультета
ФФХИ /отд. Физики/
к.х.н., доцент Нина Борисовна Рожманова
1
2. Учебная литература
1. Основы аналитической химии. В 2-х тт. Под ред. Ю.А.Золотова. М.:Высшая школа, 2004 (2010, 2014). Т.1. 360 с. Т.2.
504 с.
2. Основы аналитической химии. Практическое руководство. Под
ред. Ю.А. Золотова. М.: Высшая школа. 2001 (2017). 463 с.
3. Основы аналитической химии. Задачи и вопросы. Под ред.
Ю.А. Золотова. М.: Высшая школа. 2002. 412 с.
4. Дорохова Е.Н., Прохорова Г.В. Задачи и вопросы по
аналитической химии. М.: Мир, 2001. 267 с.
4. Васильев В.П. Аналитическая химия. В 2-х ч. М.: Дрофа.2002.
320, 384 с.
5. Кристиан Г. Аналитическая химия. М.: Изд-во Бином. 2009. В
2-х томах. 623 с. 504 с.
2
3. Лекция 1 (вводная)
4.
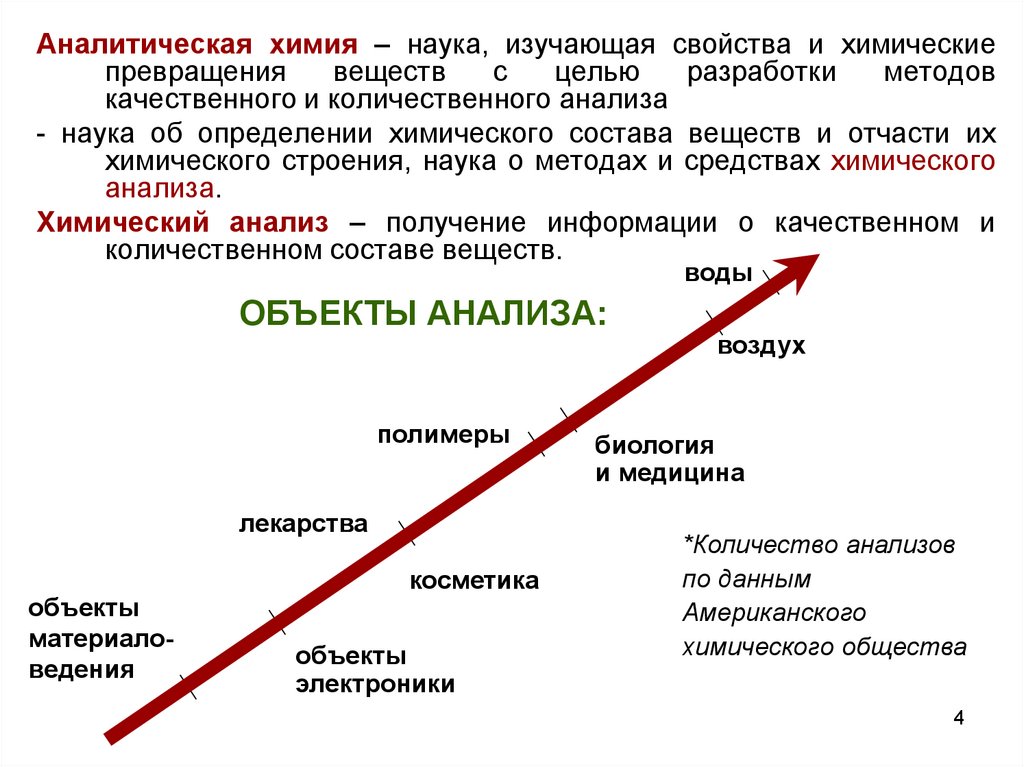
Аналитическая химия – наука, изучающая свойства и химическиепревращения
веществ
с
целью
разработки
методов
качественного и количественного анализа
- наука об определении химического состава веществ и отчасти их
химического строения, наука о методах и средствах химического
анализа.
Химический анализ – получение информации о качественном и
количественном составе веществ.
воды
ОБЪЕКТЫ АНАЛИЗА:
полимеры
лекарства
объекты
материаловедения
косметика
объекты
электроники
воздух
биология
и медицина
*Количество анализов
по данным
Американского
химического общества
4
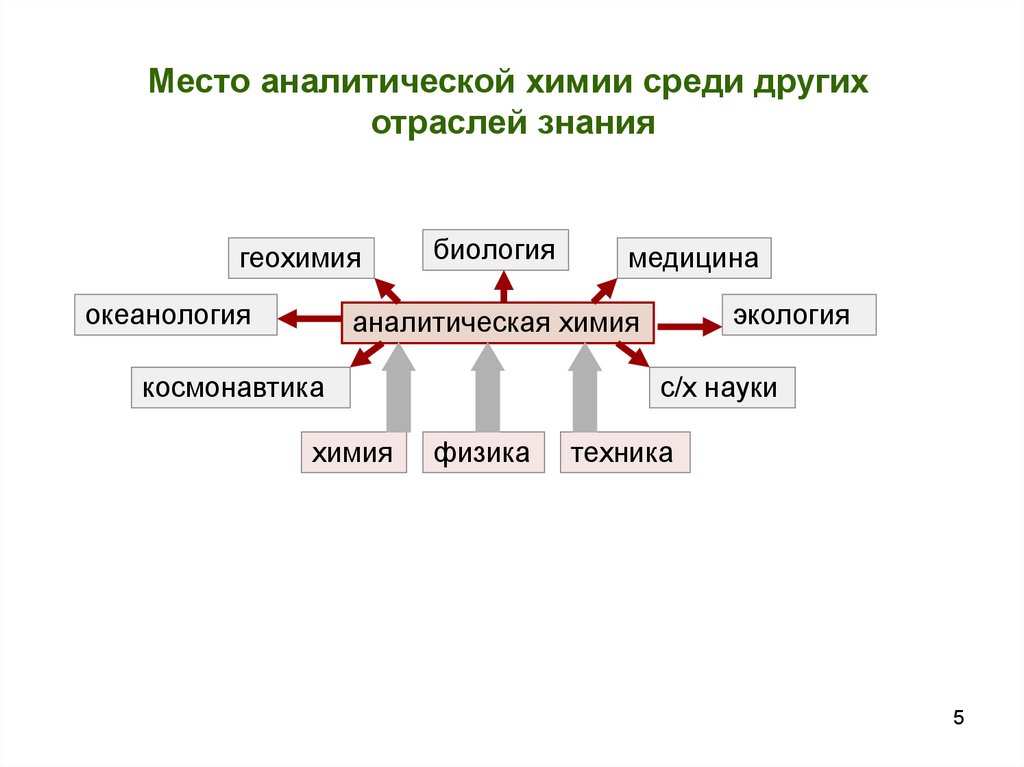
5.
Место аналитической химии среди другихотраслей знания
геохимия
океанология
биология
медицина
экология
аналитическая химия
космонавтика
химия
с/х науки
физика
техника
5
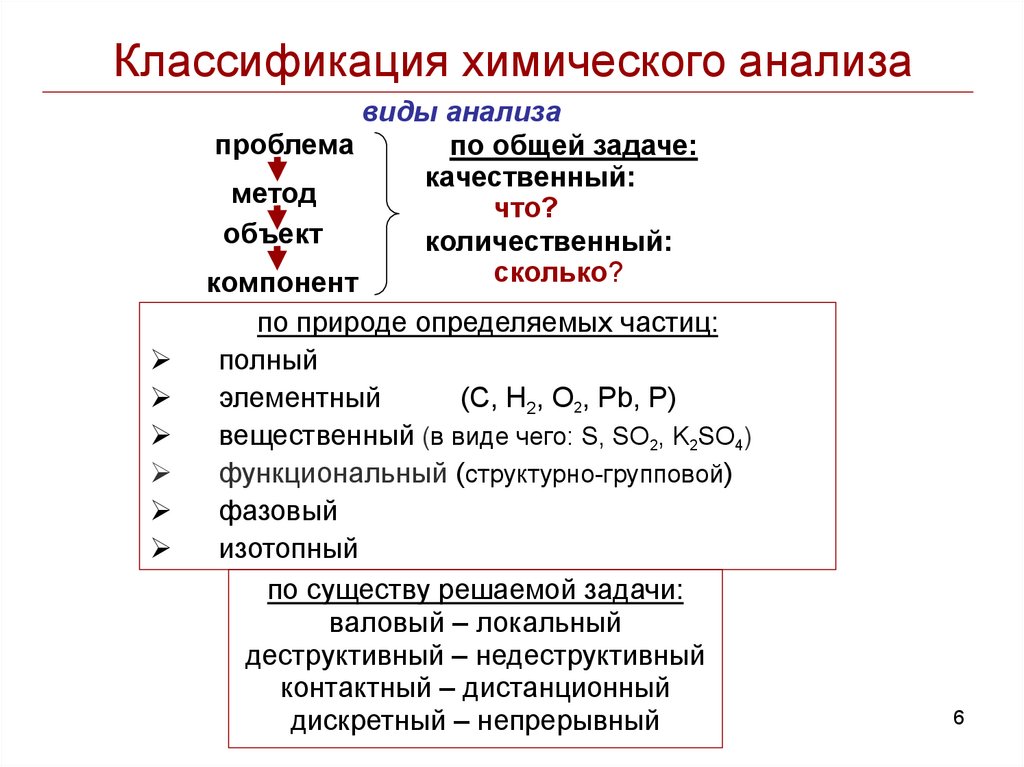
6.
Классификация химического анализавиды анализа
проблема
по общей задаче:
качественный:
метод
что?
объект
количественный:
сколько?
компонент
по природе определяемых частиц:
полный
элементный
(C, Н2, О2, Pb, P)
вещественный (в виде чего: S, SO2, K2SO4)
функциональный (структурно-групповой)
фазовый
изотопный
по существу решаемой задачи:
валовый – локальный
деструктивный – недеструктивный
контактный – дистанционный
дискретный – непрерывный
6
7.
Примеры массовых анализовАвтомобильные выхлопы на СО.
Контроль состава сырья и готовой
продукции во всех отраслях промышленности
Кровь на сахар.
Молоко на содержание жира.
Почвы на азот, фосфор, калий; рН.
Выдыхаемый воздух водителей на С2Н5ОН.
Воздух помещений на пары ртути.
Воды плавательных бассейнов на хлор.
7
8. Методы аналитической химии (методики) сопровождаются аналитическим сигналом Химическое или физическое свойство, функционально
связанной с содержанием компонента,- аналитический сигнал
A.C. = f(C)
Природа А.С.:
•химические и физико-химические методы /масса осадка,
объем раствора , потенциал, сила тока/
•физические методы
•гибридные методы (сочетание разделения и определения)
Химические методы
основаны
на измерении массы вещества – ГРАВИМЕТРИЯ
на измерении объемов – ТИТРИМЕТРИЯ
8
9. Этапы анализа:
1.2.
3.
4.
5.
Выбор метода анализа
Отбор пробы (“Основы аналитической химии”, Т.1, гл.3)
Подготовка пробы к анализу
Проведение измерений
Обработка результатов анализа
y
(А.С.)
1
Характеристики методов анализа:
1. Чувствительность: А.С. = f(c),
А.С. – масса, объем, потенциал, сила тока…
Коэффициент чувствительности – s
s = tg α = Δy/Δx
s1 > s 2
2. Предел обнаружения Сmin
(диапазон определяемых содержаний)
2
α
α
x (с)
Концентрация измеряется в г/л, мг/мл, мкг/мл,
моль/л (М) и т.д.
9
10.
Характеристики методов анализа(продолжение):
3. Точность
правильность
отклонение результатов
от истинного содержания
воспроизводимость
рассеяние результатов относ.
среднего, принимаемого за
истинное
4. Избирательность (селективность)
5. Экспрессность
6. Простота анализа
7. Возможность автоматизации
8. Стоимость
10
11. Химические методы растворы
cA – общая (аналитическая) концентрация компонента А[A] – равновесная концентрация, т.е. концентрация
конкретной формы компонента А
aA – активность компонента А
С=Σ[ ]
Na2CO3 ↔ 2Na+ + CO32основная реакция
0,1 М р-р → СNa2CO3
В кислой среде протекают конкурирующие реакции по
аниону:
CO32- + H+ = HCO3-; константа Ка2=[H+][CO32-]/[HCO3-]
HCO3- + H+ = H2CO3 ; константа Ка1=[H+][HCO3-]/[H2CO3]
Уравнение материального
баланса:
с = [CO32-] + [HCO3-] + [H2CO3]
11
12.
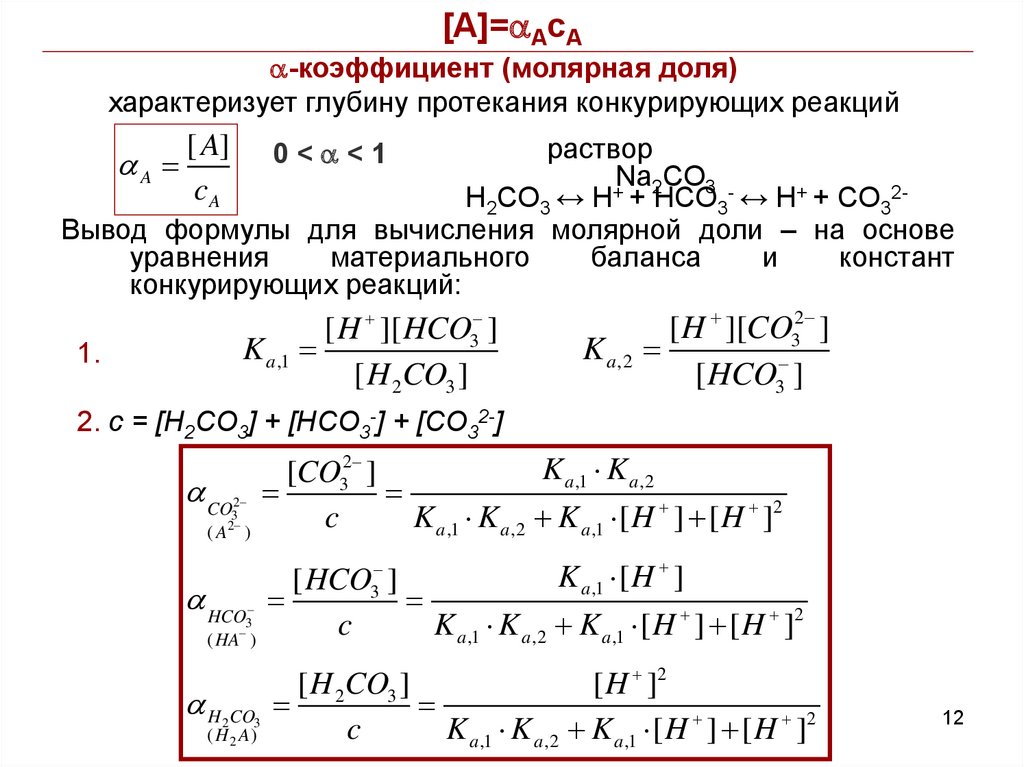
[A]=aAcAa-коэффициент (молярная доля)
характеризует глубину протекания конкурирующих реакций
раствор
Na2CO3 +
H2CO3 ↔ H + HCO3 ↔ H+ + CO32Вывод формулы для вычисления молярной доли – на основе
уравнения
материального
баланса
и
констант
конкурирующих реакций:
aA
[ A]
cA
0<a<1
[ H ][ HCO3 ]
K a ,1
[ H 2CO3 ]
1.
K a ,2
[ H ][CO32 ]
[ HCO3 ]
2. c = [H2CO3] + [HCO3-] + [CO32-]
K a ,1 K a ,2
[CO32 ]
c
K a ,1 K a ,2 K a ,1 [ H ] [ H ]2
a CO
2
3
2
(A )
a HCO
3
( HA )
a H CO
2
3
( H 2 A)
K a ,1 [ H ]
[ HCO3 ]
c
K a ,1 K a ,2 K a ,1 [ H ] [ H ]2
[ H 2CO3 ]
[ H ]2
c
K a ,1 K a ,2 K a ,1 [ H ] [ H ]2
12
13.
Если конкурирующие реакции в системе не протекают:cA= [A]; α = 1.
13
14.
аА – активность (эффективная, действующая концентрациякомпонента А), моль/л
аА ≤ [A] ≤ cA
Мера напряженности электростатического поля
в растворе электролита – ионная сила:
Идеальные и реальные
системы
1 n
2
I ci zi
2 i 1
Идеальная система – отсутствуют электростатические и
химические взаимодействия:
EAA = EBB = EAB
I~0
aA = [A] = сА
14
15.
В реальной системеа) Электростатические взаимодействия – I > 0
EAA ≠ EBB ≠ EAB
[A] ≠ aA
приводят к отклонениям свойств растворов от идеальных
(особенно для растворов электролитов)
Но: сА = [A] , т.к. не протекают конкурирующие реакции.
аА = γА[A]
gA – коэффициент активности,
мера
электростатических
электролитов; γ = f(I)
взаимодействий
Для бинарного электролита:
в
растворах
g g g
Если γ <1, то аА < [А]
15
16.
Коэффициенты активности индивидуальных ионоввычисляют по формулам Дебая-Хюккеля
1.
lg g i Azi2 I
2
Az
I
i
2. lg g
i
1 aB I
(I ≤ 0,01 М)
A~0,5
B~0,33
a~3 Å
(I = 0,01 – 0,1 M)
А и В – константы, зависящие от Т и ε растворителя,
а – минимальное расстояние между двумя взаимодействующими
ионами (константа, учитывающая размеры ионы)
В разбавленных растворах - при I → 0 величина gi → 1
При I < 1•10-4 раствор можно считать идеальным
Экспериментально можно определить только средний
коэффициент активности g±
Для электролита AmBn
g
m n
g g
m
A
n
B
16
17.
б) Химические взаимодействияI > 0, α < 1, поэтому aA ≠ [A] ≠ сА
Компоненты системы могут одновременно участвовать в
нескольких равновесиях. Одна из реакций главная, остальные –
побочные (конкурирующие).
α = f(K, c)
Итак, в реальной системе:
[ A]
aA
cA
aA = γA[A] = γAαACA
В каком интервале лежат значения коэффициента активности и
молярной доли?
γ ~1 – 0,3
α ~ 1 – 10-30
В концентрированных растворах I > 1 M
g >1! (в 12 М HCl : g± =58)
17
18. Химическое равновесие в гомогенной системе
При равновесии в химической системе DG =0aA + bB = cC + dD
термодинамическая
константа
равновесия
c
C
a
A
a a
K
aa
0
d
D
b
B
свободная
энергия
Гиббса
K = f (T, P, р-ль)
Закон действующих масс
Для идеальных систем в состоянии химического равновесия
отношение произведения концентраций продуктов реакции в
степенях, равных стехиометрическим
коэффициентам, и
произведению концентраций исходных веществ, есть величина
постоянная при данной температуре, давлении и в данном
растворителе
K > 1 – реакция протекает → (в прямом направлении)
K < 1 – реакция протекает ← (в обратном направлении)
Значение
константы
равновесия
позволяет
оценить
направление и глубину протекания химической реакции
18
19.
Концентрационные константы равновесий в гомогенной системереальная
условная
[C ]c [ D]d
K
[ A]a [ B]b
c d
c
c
'
C D
K a b
c A cB
K = f (T, P, I)
K’ = f (T, P, I, a)
т.к. ai =gi ai ci
a b
a b
cCc cDd
a Aaa Bb
g
g
a
0 A B
Aa B
K' a b K c d K c d c d
cAcB
a Ca D
g C g D a Ca D
Для выполнения расчетов:
1. Если можно пренебречь влиянием конкурирующих реакций, a 1, K’=K.
Необходимо учитывать только электростатические взаимодействия (g ≠ 1).
2. Если g = 1 (очень разбавленные растворы), a 1, то K’ = K = K0
3. Если влияние электростатических взаимодействий << химических, то
полагаем K ≈ K0, рассчитываем только a-коэффициент.
19
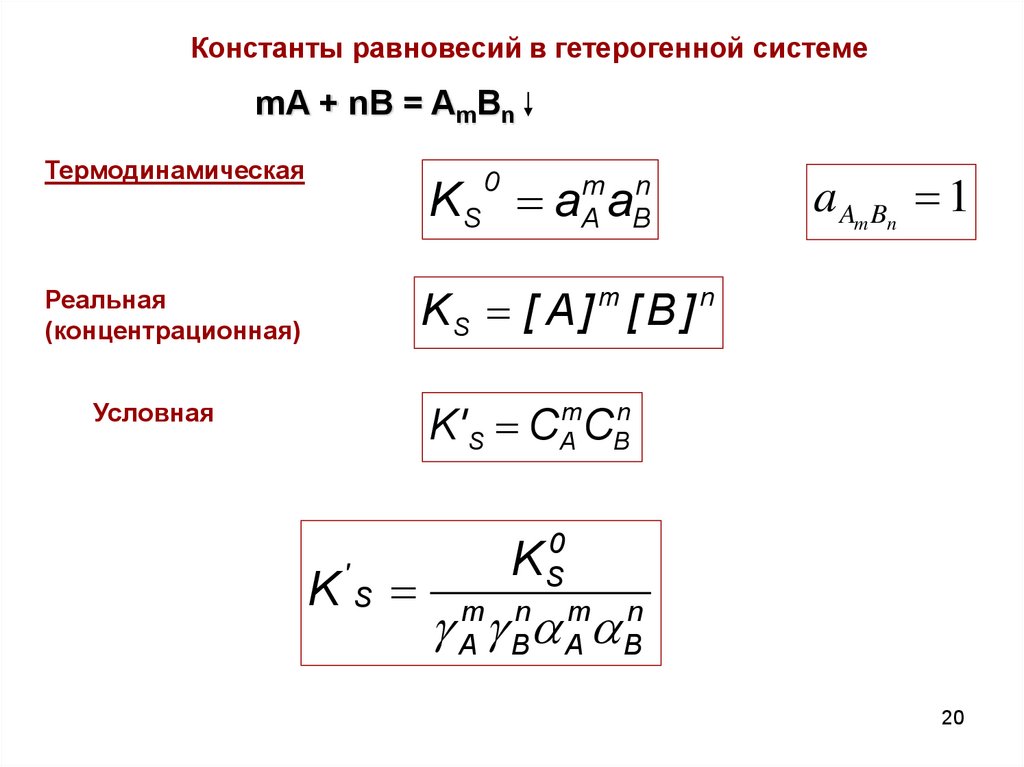
20.
Константы равновесий в гетерогенной системеmA + nB = AmBn
Термодинамическая
0
a Am Bn 1
KS a a
m n
A B
KS [ A ] [ B ]
m
Реальная
(концентрационная)
n
K' S C C
m
A
Условная
KS
'
n
B
K S0
g Amg Bna Ama Bn
20
21.
Задача: вычислить реальную константу диссоциации Ка,1 дляянтарной кислоты НООС-(СН2)2-СООН (НА) в присутствии
0,0164 М раствора K2SO4, если К0а,1 = 6,5 х 10-5 .
K2 SO4 2 K SO42
Ионная
сила:
2
I 1 ([K ]zK2 [SO42 ]zSO
2 )
2
4
1 ( 0,0328 12 0,0164 22 ) 0,05M
2
Диссоциация кислоты:
HA H A
K
0
a,1
aH a A
aHA
При I = 0,05: γHA=1, γH+= γA- = 0,84 (справочные данные)
Ka,1 Ka0,1
g HA
1
5
6,5 10 5
9
,
1
10
gH gA
(0,84)2
Если γ<1, то K0a < Ka (диссоциирует сильнее)
21
22.
Титриметрические методы анализаДостоинства: быстрота; универсальность; высокая
точность (sr<0,2 – 0,5%); низкая стоимость; простота.
Недостатки: низкая чувствительность.
Классические титриметрические методы пригодны при
определении >0,5%.
Вещества
взаимодействуют
в
эквивалентных
количествах:
С1V1=C2V2
Конец реакции – точка эквивалентности (Т.Э.)
(определяют К.Т.Т.)
Реагент – титрант (первичный стандарт, вторичный
стандарт)
Процесс – титрование
Индикатор (вспомогательное вещество)
22
23.
А + T ↔ продуктыСущность метода титриметрии
– о содержании определяемого компонента A
судят по объему раствора реагента T с точно
известной концентрацией, в эквивалентных
количествах прореагировавшего
с определяемым компонентом.
Измеряют объемы реагирующих веществ.
23
24.
Процесс добавления реагента Tк определяемому компоненту A до тех пор,
пока они не прореагируют в эквивалентных
количествах, называют титрованием →
титриметрический метод.
Раствор реагента с точно известной
концентрацией – титрант.
Определение к.т.т.:
Визуальное (индикаторы, без индикаторов – KMnO4)
Физико-химическое (E, I, A, …) – резкое изменение
физического свойства раствора в т.э.
24
25.
Требования к реакциям в титриметрии• Строгая стехиометричность (только «по одному
уравнению»)
• Отсутствие конкурирующих реакций
• Практически необратимая реакция
• Высокая скорость
• Возможность надежного фиксирования точки
эквивалентности (к.т.т.)
• Доступные и дешевые реагенты (титранты,
стандарты)
25
26. Классификация титриметрических методов
По типу реакций, положенных в основу1.
1.
2.
3.
4.
Кислотно-основное титрование
HA + B- ↔ HB + AОкислительно-восстановительное титрование
Ox1 + Red2 ↔ Red1 + Ox2
Комплексометрическое титрование
M + L ↔ ML
Осадительное титрование
M + X ↔ MX↓(тв)
По способу выполнения
2.
1.
2.
3.
Прямое А + Т
Обратное А + В(изб) + Т
Заместительное А + В С + D
+
T
(A – аналит, Т – титрант)
По способу проведения
3.
Метод пипетирования (титрования равных порций раствора (т.е.
аликвот)
26
Метод отдельных навесок
27. Стандартные растворы
Раствор с известной концентрацией называют стандартным растворомПервичные стандартные растворы готовят растворением точного
количества химического вещества в определенном объеме
Вторничные стандарты – растворы, концентрацию которых определяют
(стандартизуют) по первичному стандартному раствору
Первичные
стандарты
Вторичные
стандарты
Na2CO3
HCl
H2C2O4·2H2O
NaOH
Na2B4O7
KMnO4
ЭДТА
Na2S2O3
K2Cr2O7
AgNO3
и др.
и др.
Требования к первичному стандарту:
1.
Строго установленный
химический состав
2.
Получение в химически чистом
виде (и наличие метода
контроля чистоты)
3.
Устойчивость к воздействию
компонентов атмосферы (H2O,
CO2, и др.)
4.
Большая молекулярная масса
эквивалента
5.
Доступность и дешевизна 27
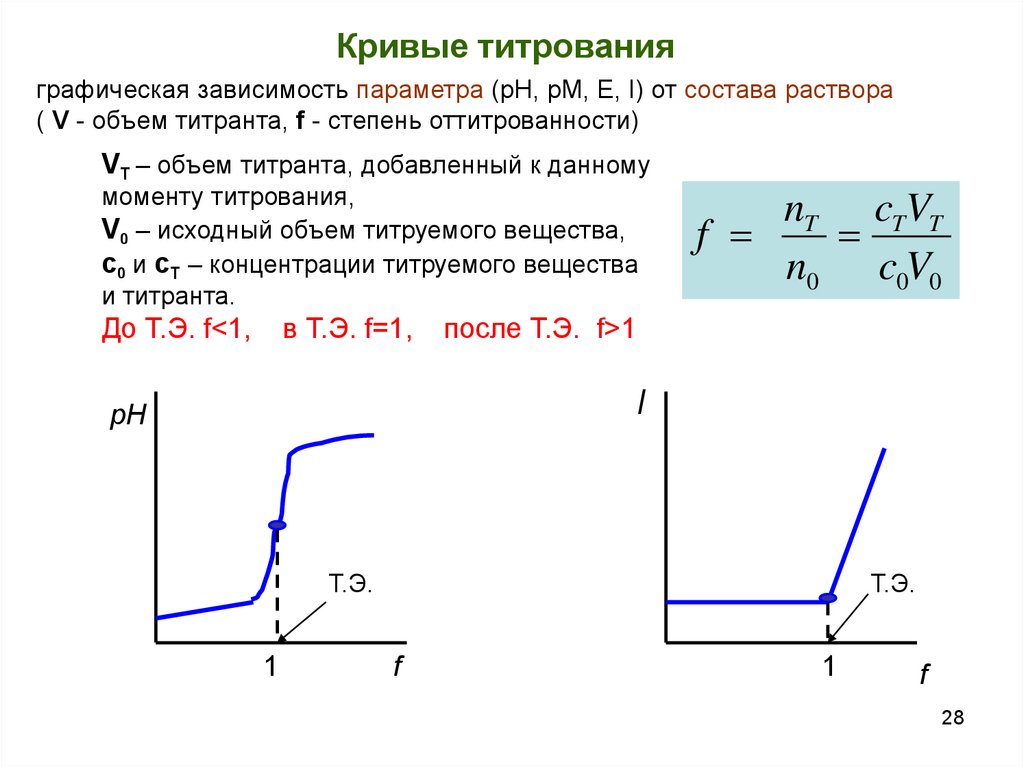
28.
Кривые титрованияграфическая зависимость параметра (рН, pM, E, I) от состава раствора
( V - объем титранта, f - степень оттитрованности)
VT – объем титранта, добавленный к данному
моменту титрования,
V0 – исходный объем титруемого вещества,
c0 и cT – концентрации титруемого вещества
и титранта.
До Т.Э. f<1,
в Т.Э. f=1,
nT cTVT
f
n0 c0V0
после Т.Э. f>1
I
рН
Т.Э.
1
Т.Э.
f
1
f
28
29.
Закон кратных отношенийвещества реагируют между собой в эквивалентных количествах:
n1 = n 2
aA + bB → продукты
A + (b/a)B → продукты (a > b)
(b/a) = fB – фактор эквивалентности вещества В в данной
реакции
fA = 1 - фактор эквивалентности вещества А в данной реакции
Эквивалент – молекула, атом, ион ( f = 1) или часть молекулы (f ≠ 1,
a ≠ b) - условная частица, равноценная одному иону
водорода или одному электрону в данной реакции
(кислотно-основной или окислительно-восстановительной).
29
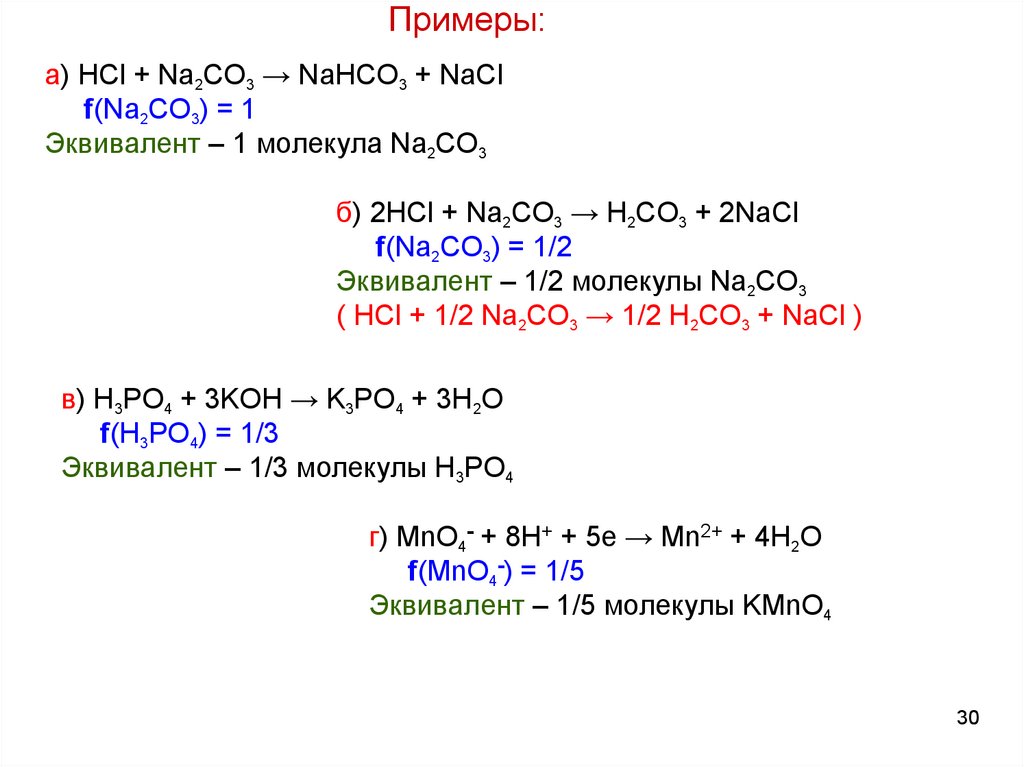
30.
Примеры:а) HCl + Na2CO3 → NaHCO3 + NaCl
f(Na2CO3) = 1
Эквивалент – 1 молекула Na2CO3
б) 2HCl + Na2CO3 → H2CO3 + 2NaCl
f(Na2CO3) = 1/2
Эквивалент – 1/2 молекулы Na2CO3
( HCl + 1/2 Na2CO3 → 1/2 H2CO3 + NaCl )
в) H3PO4 + 3KOH → K3PO4 + 3H2O
f(H3PO4) = 1/3
Эквивалент – 1/3 молекулы H3PO4
г) MnO4- + 8H+ + 5e → Mn2+ + 4H2O
f(MnO4-) = 1/5
Эквивалент – 1/5 молекулы KMnO4
30
31.
Единица измерения количества вещества (количества частиц) – моль1 Моль – количество вещества, которое содержит столько частиц,
сколько атомов углерода содержится в 0,012 кг изотопа 12С,
т.е. NA = 6,02∙1023 моль-1
Масса одного моля – молярная масса (кг/моль, г/моль)
Масса одного моля эквивалентов (эквивалентная масса)
= молярная масса х f
Молярная концентрация – количество вещества в 1 л, выраженное
в молях (эквивалента)
Например, 0,1 М HCl;
C(Na2CO3) = 0,1 M
C(1/2 Na2CO3) = 0,1 M
0,01 M HCl
(a)
(б)
31
32.
Точка эквивалентности:n1 = n2
n1 = C1V1
n2 = C2V2
C1V1 C2V2
C1V1
C2
V2
(где С выражена в молях эквивалента на литр)
32

























 Химия
Химия








